Большая Энциклопедия Нефти и Газа. Плотность аргона
| Газы | Формула | Плотность при нормальных условиях ρ, кг/м3 |
| Азот | N2 | 1,2505 |
| Аммиак | Nh4 | 0,7714 |
| Аргон | Ar | 1,7839 |
| Ацетилен | C2h3 | 1,1709 |
| Ацетон | C3H6O | 2,595 |
| Бор фтористый | BF3 | 2,99 |
| Бромистый водород | HBr | 3,664 |
| Н-бутан | C4h20 | 2,703 |
| Изо-бутан | C4h20 | 2,668 |
| Н-бутиловый спирт | C4h20O | 3,244 |
| Вода | h3O | 0,768 |
| Водород | h3 | 0,08987 |
| Воздух (сухой) | — | 1,2928 |
| Н-гексан | C6h24 | 3,845 |
| Гелий | He | 0,1785 |
| Н-гептан | C7h26 | 4,459 |
| Германия тетрагидрид | Geh5 | 3,42 |
| Двуокись углерода | CO2 | 1,9768 |
| Н-декан | C10h32 | 6,35 |
| Диметиламин | (Ch4)2NH | 1,966* |
| Дифтордихлорметан | CF2Cl2 | 5,51 |
| Дифенил | C12h20 | 6,89 |
| Дифениловый эфир | C12h20O | 7,54 |
| Дихлорметан | Ch3Cl2 | 3,79 |
| Диэтиловый эфир | C4h20O | 3,30 |
| Закись азота | N2O | 1,978 |
| Йодистый водород | HI | 5,789 |
| Кислород | O2 | 1,42895 |
| Кремний фтористый | SiF4 | 4,9605 |
| Кремний гексагидрид | Si2H5 | 2,85 |
| Кремний тетрагидрид | Sih5 | 1,44 |
| Криптон | Kr | 3,74 |
| Ксенон | Xe | 5,89 |
| Метан | Ch5 | 0,7168 |
| Метиламин | CH5N | 1,388 |
| Метиловый спирт | Ch5O | 1,426 |
| Мышьяк фтористый | AsF5 | 7,71 |
| Неон | Ne | 0,8999 |
| Нитрозилфторид | NOF | 2,176* |
| Нитрозилхлорид | NOCl | 2,9919 |
| Озон | O3 | 2,22 |
| Окись азота | NO | 1,3402 |
| Окись углерода | CO | 1,25 |
| Н-октан | C8h28 | 5,03 |
| Н-пентан | C5h22 (Ch4(Ch3)3СН3) | 3,457 |
| Изо-пентан | C5h22 (СН3)2СНСН2СН3 | 3,22 |
| Пропан | C3H8 | 2,0037 |
| Пропилен | C3H6 | 1,915 |
| Радон | Rn | 9,73 |
| Силан диметил | Sih3(Ch4)2 | 2,73 |
| Силан метил | Sih4Ch4 | 2,08 |
| Силан хлористый | Sih4Cl | 3,03 |
| Cилан трифтористый | SiHF3 | 3,89 |
| Стибин (15°С, 754 мм.рт.ст.) | Sbh4 | 5,30 |
| Селеновая кислота | h3Se | 3,6643 |
| Сернистый газ | SO2 | 2,9263 |
| Сернистый ангидрид | SO3 | 3,575 |
| Сероводород | h3S | 1,5392 |
| Сероокись углерода | COS | 2,72 |
| Сульфурил фтористый | SO2F2 | 3,72* |
| Триметиламин | (Ch4)3N | 2,58* |
| Триметилбор | (Ch4)3B | 2,52 |
| Фосфористый водород | Ph4 | 1,53 |
| Фосфор фтористый | PF3 | 3,907* |
Фосфор оксифторид | POF3 | 4,8 |
| Фосфор пентафторид | PF5 | 5,81 |
| Фреон-11 | CF3CI | 6,13 |
| Фреон-12 (дифтордихлорметан) | CF2CI2 | 5,51 |
| Фреон-13 | CFCI3 | 5,11 |
| Фтор | F2 | 1,695 |
| Фтористый кремний | SiF4 | 4,6905 |
| Фтористый метил | Ch4F | 1,545 |
| Фторокись азота | NO2F | 2,9 |
| Хлор | Cl2 | 3,22 |
| Хлор двуокись | ClO2 | 3,09* |
| Хлор окись | Cl2O | 3,89* |
| Хлористый водород | HCl | 1,6391 |
| Хлористый метил (метилхлорид) | Ch4Cl | 2,307 |
| Хлористый этил | C2H5Cl | 2,88 |
| Хлороформ | CHCl3 | 5,283 |
| Хлорокись азота | NO2Cl | 2,57 |
| Циан, дициан | C2N2 | 2,765 (2,335*) |
| Цианистая кислота | HCN | 1,205 |
| Этан | C2H6 | 1,356 |
| Этиламин | C2H7N | 2,0141 |
| Этилен | C2h5 | 1,2605 |
| Этиловый спирт | C2H6O | 2,043 |
infotables.ru
| Агатплотность агата | 2600 | 2,6 |
| Азотплотность азота | 1250 | 1,25 |
| Азот сжиженный (-195°C)плотность сжиженного азота | 850 | 0,850 |
| Азота закись N2Oплотность закиси азота | 1,98 | 0,00198 |
| Азота окись NOплотность окиси азота | 1,3402 | 0,00134 |
| Азота фторокись NO2Fплотность фторокиси азота | 2,9 | 0,0029 |
| Азота хлорокись NO2Clплотность хлорокись азота | 2,57 | 0,00257 |
| Азотная кислота, HNO3 водный раствор 91%плотность азотной кислоты | 1505 | 1,505 |
| Актинийплотность актиния | 10070 | 10,07 |
| Алебастрплотность алебастра | 1800-2500 | 1,8-2,5 |
| Алмазплотность алмаза | 3510 | 3,51 |
| Алюминиевая бронза (3-10% Al)плотность алюминиевой бронзы | 7700-8700 | 7,7-8,7 |
| Алюминиевая фольгаплотность алюминиевой фольги | 2700 -2750 | 7,7-2,75 |
| Алюминийплотность алюминия | 2710 | 2,71 |
| Алюминий крупнокусковойплотность крупнокускового алюминия | 880 | 0,88 |
| Алюминий порошкообразныйплотность порошкообразного алюминия | 750 | 0,75 |
| Алюминий фтористый (криолит)плотность фтористого алюминия | 1600 | 1,6 |
| Алюминия оксид Al2O3 (чистый сухой)плотность оксида алюминия | 1520 | 1,52 |
| Америций чистыйплотность амерция | 13670 | 13,67 |
| Аммиакплотность аммиака | 770 | 0,77 |
| Аммиачная селитра (нитрат аммония)плотность аммиачной селитры | 730 | 0,73 |
| Аммония сульфат; сернокислый аммоний (мокрый)плотность сульфата аммония | 1290 | 1,29 |
| Аммония сульфат; сернокислый аммоний (сухой)плотность сульфата аммония | 1130 | 1,13 |
| Андезит цельныйплотность андезита | 2770 | 2,77 |
| Анилинплотность анилина | 1020 | 1,02 |
| Апатитплотность апатита | 3190 | 3,19 |
| Арахис нечищенный (земляной орех)плотность арахиса | 270 | 0,27 |
| Арахис чищенный (земляной орех)плотность арахиса | 650 | 0,65 |
| Аргонплотность аргона | 1784 | 1,784 |
| Асбест кускамиплотность асбеста | 1600 | 1,6 |
| Асбест цельныйплотность асбеста | 2350-2600 | 2,35-2,6 |
| Асфальтобетонплотность асфальтобетона | 2250 | 2,25 |
| Асфальтовая крошкаплотность асфальтовой крошки | 720 | 0,72 |
| Ацетилен C2h3плотность ацетилена | 1,17 | |
| Ацетонплотность ацетона | 800 | 0,8 |
| Ацетонитрилплотность ацетонитрила | 780 | 0,78 |
| Баббитплотность баббита | 7270 | 7,27 |
| Базальт дробленыйплотность базальта дробленного | 1950 | 1,95 |
| Базальт цельныйплотность базальта цельного | 3000 | 3 |
| Бакелит цельныйплотность бакелита цельного | 1360 | 1,36 |
| Барий чистыйплотность бария чистого | 3590 | 3,59 |
| Бариллиево-медный сплав, бериллиевая бронзаплотность сплава | 8100 - 8250 | 8,1 - 8,25 |
| Бария сульфат (барит), дробленыйплотность сульфата бария | 2880 | 2,88 |
| Бензинплотность бензина | 750 | 0,75 |
| Бензолплотность бензола | 0,88 | |
| Бериллийплотность бериллия | 1848 | 1,848 |
| Берклий чистыйплотность берклий чистый | 14780 | 14,78 |
| Бетонплотность бетона | 2300 | 2,3 |
| Бетонит сухойплотность бетонита сухого | 600 | 0,6 |
| Бобы какаоплотность какое бобов | 600 | 0,6 |
| Бобы касторовыеплотность бобов касторовых | 580 | 0,58 |
| Бобы соевыеплотность соевых бобов | 720 | 0,72 |
| Бокситы дробленыеплотность дробленых боксидов | 1282 | 1,282 |
| Борплотность бора | 2460 | 2,46 |
| Бор фтористыйплотность фтористого бора | 2,99 | |
| Бром чистыйплотность блома | 3120 | 3,12 |
| Бронзаплотность бронзы | 8700-8900 | 8,7-8,9 |
| Бронза свинцовистаяплотность свинцовой бронзы | 7700 - 8700 | 7,7-8,7 |
| Бронза фосфористаяплотность бронзы фосфористной | 8780 - 8920 | 8,78-8,92 |
| Бумага обычнаяплотность бумаги | 1201 | 1,201 |
| Бура (пироборнокислый натрий)плотность буры | 850 | 0,85 |
| Буровой раствор глинистый жидкийплотность раствора | 1730 | 1,73 |
| Бутан (i-Бутан) C4h20плотность бутана | 2,67 | |
| Бутан (n-Бутан) C4h20плотность бутана | 2,7 | |
| Бытовые отходы, бытовой мусорплотность мусора | 480 | 0,48 |
| Ванадий чистыйплотность ванадия | 6020 | 6,02 |
| Винипластплотность винипласта | 1380 | 1,38 |
| Висмут чистыйплотность висмута | 9750 | 9,75 |
| Вода дистиллированнаяплотность воды дистиллированной | 998 | 0,998 |
| Вода морскаяплотность морской воды | 1020 | 1,02 |
| Водородплотность водорода | 90 | 0,09 |
| Водород сжиженныйплотность сжиженного водорода | 72 | 0,072 |
| Водород бромистый HBrплотность бромистого водорода | 3,66 | |
| Водород иодистый Hlплотность иодистого водорода | 5,79 | |
| Водород мышьяковистый h4Asплотность мышьяковистого водорода | 3,48 | |
| Водород селенистый h3Seплотность селенистого водорода | 3,66 | |
| Водород сернистый h3Sплотность сернистого водорода | 1,54 | |
| Водород теллуристый h3Teплотность теллуристного водорода | 5,81 | |
| Водород фосфористый h4Pплотность фосфористого водорода | 1,53 | |
| Водород хлористый HClплотность хлористого водорода | 1,64 | |
| Водяной пар (100°C)плотность водяного пара | 880 | 0,88 |
| Воздухплотность воздуха | 1290 | 1,29 |
| Воздух сжиженныйплотность воздуха | 861 | 0,861 |
| Вольфрамплотность вольфрама | 19100 | 19,1 |
| Гадолиний чистый Gadolinium Gdплотность гадолиния | 7895 | 7,895 |
| Галлий чистыйплотность галлия | 5900 | 5,9 |
| Гафний чистый Hafnium Hfплотность гафния | 13310 | 13,31 |
| Гелийплотность гелия | 0,18 | |
| Гелий сжиженныйплотность гелия | 147 | |
| Гематит (красный железняк) дробленыйплотность гематита | 2100-2900 | 2,1-2,9 |
| Гематит (красный железняк) цельныйплотность гематита | 5095 - 5205 | 5,095 - 5,205 |
| Германий чистыйплотность германия | 5300 | 5,3 |
| Глицеринплотность глицерина | 1260 | 1,26 |
| Гранитплотность гранита | 2800 | 2,8 |
| Двуокись углеродаплотность углекислого газа | 1980 | 1,98 |
| Дедеронплотность дедерона | 1100 | 1,1 |
| Дизельное топливо (солярка)плотность дизельного топлива | 850 | 0,85 |
| Дубплотность дуба | 800 | 0,8 |
| Дюралюминийплотность дюралюминия | 2790 | 2,79 |
| Дюралюминийплотность дюралюминия | 2790 | 2,79 |
| Железоплотность железа | 7800 | 7,8 |
| Золотоплотность золота | 19300 | 19,3 |
| Инварплотность инвара | 8700 | 8,7 |
| Иридийплотность иридия | 22400 | 22,4 |
| Каменный угольплотность каменного угля | 1400 | 1,4 |
| Керосинплотность керосина | 800 | 0,8 |
| Кислородплотность кислорода | 1470 | 1,47 |
| Коксплотность кокса | 600 | 0,6 |
| Криптонплотность криптона | 3743 | 3,743 |
| Ксенонплотность ксенона | 5851 | 5,851 |
| Латуньплотность латуни | 8600 | 8,6 |
| Лед (вода ниже 0°С)плотность льда | 900 | 0,9 |
| Литийплотность лития | 535 | 0,535 |
| Магнийплотность магния | 1738 | 1,738 |
| Медьплотность меди | 8900 | 8,9 |
| Метанплотность метана | 717 | 0,717 |
| Молокоплотность молока | 1030 | 1,03 |
| Натрийплотность натрия | 968 | 0,986 |
| Неонплотность неона | 900 | 0,9 |
| Окись углеродаплотность угарного газа | 1250 | 1,25 |
| Пертинаксплотность пертинакса | 1350 | 1,35 |
| Песчаникплотность песчаника | 2400 | 2,4 |
| Платинаплотность платины | 21500 | 21,5 |
| Пропанплотность пропана | 2200 | 2,2 |
| Органическое стеклоплотность органического стекла | 1180 | 1,18 |
| Пробковая кораплотность пробковой коры | 150 | 0,15 |
| Ртутьплотность ртути | 13500 | 13,5 |
| Свинецплотность свинца | 11340 | 11,34 |
| Сереброплотность серебра | 10500 | 10,5 |
| Серная кислота (концентрированная)плотность серной кислоты | 1830 | 1,83 |
| Соснаплотность сосны | 500 | 0,5 |
| Спирт (ректификат)плотность спирта | 830 | 0,83 |
| Стекло оконноеплотность оконного стекла | 2500 | 2,5 |
| Титанплотность титана | 4500 | 4,5 |
| Углеродплотность углерода | 2260 | 2,26 |
| Фторплотность фтора | 1696 | 1,696 |
| Хлорплотность хлора | 3220 | 3,22 |
| Цинкплотность цинка | 7100 | 7,1 |
| Электронплотность электрона | 1800 | 1,8 |
| Этиленплотность этилена | 1260 | 1,26 |
| Этиловый спиртплотность этилового спирта | 790 | 0,79 |
| Эфирплотность эфира | 720 | 0,72 |
mozgan.ru
Плотность газов и паров: таблица при различных температурах
Плотность газов и паров при нормальных условиях
В таблице приведена плотность газов и паров при нормальных условиях – температуре 0°С и нормальном атмосферном давлении (760 мм. рт. ст.). Для некоторых газов, например газа стибина, плотность дана при температуре 15°С и давлении 754 мм. рт. ст.
Значение плотности газов в таблице указано в размерности кг/м3 для следующих газов и паров: азот N2, аммиак Nh4, аргон Ar, ацетилен C2h3, бор фтористый BF3, бутан C4h20, водород: бромистый HBr, йодистый HI, мышьяковистый h4As, селенистый h3Se, сернистый h3S, теллуристый h3Te, фосфористый h4P, хлористый HCl, воздух, гелий He, германия тетрагидрид Geh5, диметиламин (Ch4)2NH, дифтордихлорметан CF2Cl2, дициан C2N2, закись азота N2O, кислород O2, кремний фтористый SiF4, гексагидрид Si2H6, тетрагидрид Sih5, криптон Kr, ксенон Xe, метан Ch5, метиленхлорид Ch4Cl, метиламин CH5N, метиловый эфир C2H6O, метилфторид Ch4F, метилхлорид Ch4Cl, мышьяк фтористый AsF5, неон Ne, нитрозил фтористый NOF и хлористый NOCl, озон O3, окись азота NO, пропан C3H8, пропилен C3H6, радон Rn, двуокись серы SO2 и гексафторид серы SF2, силан диметил Sih3(Ch4)2, метил Sih4Ch4, хлористый SIh4Cl, трифтористый SiHF3, стибин Sbh4, сульфурил фтористый SO2F2, триметиламин (Ch4)3N, триметилбор (Ch4)3B, двуокись углерода CO2, окись углерода CO, сероокись COS, фосфор фтористый PF2, оксифторид POF3, пентафторид PF5, фтор F2, фторокись азота NO2, двуокись хлора ClO2, окись хлора Cl2O, хлорокись азота NO2Cl, этан C2H6, этилен C2h5, окись азота NO.
Плотность газов вычисляется, как отношение молярной массы газа к его молярному объему, который при 0°С и давлении 1 атм. равен 22,4 л/моль.
Следует отметить, что самым легким газом является водород — плотность этого газа при нормальных условиях равна 0,0899 кг/м3. Для удобства восприятия плотность газов приводят именно к плотности водорода, используя при этом относительную плотность по водороду. Например, относительная плотность газа азота N2 по водороду равна 13,9.
Наибольшую плотность имеет газ радон. Этот радиоактивный газ имеет плотность при нормальных условиях 9,73 кг/м3, а его относительная плотность по водороду составляет величину 108,2.
Необходимо отметить, что при увеличении давления газов и паров, их плотность увеличивается пропорционально.
Примечание: Для газов и паров, рядом со значением плотности которых, присутствует символ *, ее величина в таблице приведена при температуре 20°С.
Из анализа данных, представленных в таблице, видно, что плотность рассмотренных газов находится в диапазоне от 0,089 до 9,73 кг/м3.
Плотность газов в жидком и твердом состояниях при различных температурах
Значения плотности газов и паров в жидком и твердом состояниях приведены в таблице в зависимости от температуры при нормальном атмосферном давлении. Величина плотности газов указана в основном при низких температурах (в интервале от -268 до 20°С), при которых они находятся в жидком, или твердом состояниях.
При низких температурах плотность некоторых газов сравнима с плотностью металлов. К плотным (тяжелым) газам в жидком состоянии можно отнести такие газы, как этилен, криптон (плотность 2371 кг/м3) и ксенон (плотность 3060 кг/м3). Например, плотность газа этилена при температуре -102°С имеет значение 5566 кг/м3, что почти в полтора раза больше плотности алюминия. При этом этилен находится в жидком состоянии.
Газы в твердом состоянии имеют плотность немногим больше, чем в жидком. Твердое состояние газа достигается при более низкой температуре.Например, углекислый газ находится в виде жидкости при температуре -60°С (при атмосферном давлении), но уже при -79°С становиться твердым и имеет плотность 1530 кг/м3.
Плотность газов в таблице дана в т/м3и приведена для следующих газов: азот N2, окись азота NO, аммиак Nh4, аргон Ar, ацетилен C2h3, водород: сернистый h3S, фосфористый h4P, фтористый HF, хлористый HCl, воздух, гелий He, криптон Kr, ксенон Xe, кислород O2, метан Ch5, метилхлорид Ch4Cl, неон Ne, озон O3, сера двуокись SO2, углерод: двуокись CO2, окись CO, фтор F2, хлор Cl2, этан C2H6, этилен C2h5.
Источник:Таблицы физических величин. Справочник. Под ред. акад. И.К. Кикоина. М.: Атомиздат, 1976. — 1008 с.
thermalinfo.ru
Плотность - аргон - Большая Энциклопедия Нефти и Газа, статья, страница 1
Плотность - аргон
Cтраница 1
Плотность аргона указываете на в съ атома 39 9, но, судя по тому, что ii-ь-съ атома аргоновыхъ элементовъ бол - te Ч ЕМЪ для га-лоидовъ, а мен - fee чЪяъ для шелочныхъ ме-талловъ, должно думать, что атомный в съ Аг бо. [2]
Плотность аргона указывает на вес атома 39 9, но, судя по тому, что щелочных металлов, должно думать, что атомный вес Аг более, чем С1, но щены не только перед началом периодов, но и после их конца, чтобы ясно VIU-ой группы. [3]
Значения плотности аргона на кривой затвердевания, рассчитанные по уравнению состояния, хорошо согласуются с опорными данными, полученными экстраполяцией изобар до температур затвердевания. [4]
Методом гидростатического взвешивания измерена плотность аргона в пределах температур от - 117 до - 180 С и давлений от 10 до 500 кг. [5]
Нами были проведены измерения плотности аргона в интервале температур от - 117 до - 180 С при давлениях от 10 до 500 кг с. [6]
Гелий защищает металл хуже аргона ( его плотность меньше плотности аргона), что приводит к необходимости увеличения расхода для надежной защиты. [8]
В последнее время одновременно с нашей работой были проведены измерения плотности аргона Витценбургом и Стриландом. В работе приведены данные по плотности на кривой: плавления как для жидкого, так и для твердого аргона. В монографии Дина приведены таблицы термодинамических свойств аргона ( включающие область жидкого состояния), составленные графоаналитическим методом на основании ограниченных данных Михельса и Вийкера, охватывающих область температур от 0 до 150 С. [9]
В результате графоаналитической обработки всех имеющихся экспериментальных PVT-данных составлена таблица наивероятных значений плотности аргона в пределах температур от - 188 до - 115 С и давлений от 2 до 500 атм, а также на линиях насыщения и плавления. [10]
Речь идет о величинах, усредненных по времени. Например, плотность аргона в малом элементе объема в какой-либо момент времени может отличаться от средней плотности. [12]
С уменьшением плотности аргона при постоянной его температуре положение максимумов функции 4nR4p ( R) - р1 несколько смещается в сторону больших R. Одновременно уменьшается среднее число ближайших соседей. [14]
Страницы: 1 2
www.ngpedia.ru
Аргон, плотность - Справочник химика 21
Газы с большей плотностью—аргон (плотность [c.31]
У последнего элемента 3-го периода — аргона Аг (как и у Ые) завершается заполнение х- и р-орбиталей. Его внешний слой (слой М) представляет собой совокупность четырех двухэлектронных облаков (одного в форме шара, трех других — в форме гантели). У атомов элементов 3-го периода в двух первых квантовых слоях (К и ) повторяется электронная конфигурация атома неона (I я 2я 2р"). На рисунке II по максимумам распределения электронной плотности в атоме аргона можно различить К-, L- и Л1-слои. [c.28]
Пример 2, Подсчитать плотность р и приведенный молекулярный вес (М) воздуха, если состав его (по объему) 21% О2, 78% N2 и 1% Аг, а плотность кислорода 1,429 г/уг, азота 1,251 г/л и аргона 1,781 г/л. [c.53]
Физические свойства. В соответствии с характером изменения структуры и типа химической связи закономерно изменяются и свойства простых веществ — их плотность, температура плавления и кипения, электрическая проводимость и др. Так, аргон, хлор р,г/см и сера в твердом состоянии являются диэлектриками, [c.235]
У последнего элемента 3-го периода — аргона Аг (как и у Ые) завершается заполнение 5- и р-орбита-лей, т. е. внешний слой представляет собой совокупность четырех двухэлектронных облаков (одного в форме шара, трех других — в форме гантели). По максимумам распределения электронной плотности (рис. 10) можно различить К-, - и М-слон. [c.25]
Вблизи тройной точки аргона плотность р = 1,416 г/мл скорость звука а = 875 м/с теплоемкость Ср = 1,100 кДж/(кг-К) объемный коэффициент расширения (вычисленный по зависимости р от Г) ая = =3,8- 10 Подставляя эти значения в уравнение (УИ.б), получим 1,7-10 Па" . Зная по уравнению (УП.9) найдем бЛ о = = 0,084. Таким образом, микрофлуктуации плотности в модели жидкого аргона при 84 К, исследованный Берналом и Кингом, почти в 1,7 раза больше, чем можно было бы ожидать на основе термодинамической теории. Эта разница не столь уж велика. При радиусе области у, равном 2 0, отношение величины б Л о , рассчитанной по данным Бернала и Кинга, к для аргона тоже близко к 1,7. Для воды около тем- [c.136]
На рис. 2. 5 показаны плотности сосуществующих фаз для аргона. Плотности сосуществующих фаз для криптона и ксенона приведены в табл. 2. 43 и 2. 44. [c.60]
I lio. Из скольких атомов состоит молекула аргона, если плотность его по воздуху равна 1,38 [c.251]
Первое допущение, кроме очевидной области низких давлений, достаточно корректно для полимерных материалов большой плотности с значительной долей упорядоченной фазы и малой подвижностью структурных элементов матрицы, например, полиэтилена высокого давления. Второе и третье допущения выполняются при давлениях до 5—6 МПа для газов с малой молекулярной массой в области состояний, значительно удаленных от линии равновесия жидкость — пар (7 7 с), например, гелия, аргона, азота, кислорода, что подтверждается экспериментально (6, 8, 10, 15]. [c.99]
Видно существенное различие между значениями предельных объемов адсорбционного пространства для различных газов. Вывод здесь, по нашему мнению, может быть только один изменяется не объем адсорбционного пространства, а плотность адсорбированной фазы. Если считать истинное значение предельного объема адсорбционного пространства по бензолу — = 0,40 см /г постоянным для всех адсорбируемых газов, то можно отметить, что степень заполнения адсорбционного пространства зависит от размера молекул, свойств криогенных газов и температуры опыта. Например, азот и аргон адсорбируются при температуре, близкой к их точке кипения, и плотность адсорбата (в расчете на 1 о = 0,40 см г) почти в полтора раза выше плотности нормальной жидкости при этой же температуре. По-видимому, в силу малости линейных размеров молекул это свойство должно наблюдаться у всех исследуемых газов при температурах, близких к температуре кипения. Низкое значение Ц7о для гелия и неона объясняется высокой температурой адсорбции, значительно превышающей критическую для указанных газов. [c.27]
Значения pv RT для аргона при 25° С, вычисленные из рядов по плотности и по давлению [42] [c.16]
В работе [27] описан абсолютный метод определения плотности газа. Точные аналитические весы помещают в газовую камеру. На одно коромысло подвешивают поплавок, на другое — уравновешивающие его грузы, вес которых зависит от параметров газа. Предварительные результаты для н-гексана и аргона хорошо согласуются с данными других авторов, однако проведение опытов с сильно полярными веществами сопряжено с трудностями. [c.82]
Измерение поглощательной способности. Отбирают микро-пипеткой аликвотную часть полученного раствора, равную 0,01 или 0,02 мл (в соответствии с областью прямолинейной зависимости поглощательной способности от концентрации алюминия), и вводят ее в графитовую печь. Высушивают каплю в течение 30 с при 400 К, проводят термическое разрушение сухого остатка в течение 20 с при 1700 К и атомизируют пробу в течение 8 с при 3000 К. В качестве экранирующего газа используют аргон. Поглощение фиксируют с помощью регистрирующего устройства. Для измерения отбирают не менее трех аликвотных частей раствора. Печь промывают, вводя 0,01—0,02 мл воды и осуществляя все стадии нагревания по указанной программе. Из значения оптической плотности анализируемого раствора вычитают значение оптической плотности, полученной в холостом опыте. Массу алюминия находят по градуировочному графику с учетом поправки холостого опыта, [c.168]
Чувствительность детектора зависит от разности плотностей газа-носителя и анализируемого вещества. Поэтому рекомендуется в качестве газа-носителя использовать воздух, азот, аргон, двуокись углерода. Водород и гелий не рекомендуется использовать в сочетании с детектором по плотности, так как может происходить диффузия компонентов пробы к чувствительным элементам. [c.252]Найдите плотность аргона а) по водороду б) по воздуху. [c.30]
| Рис. 7-7. Влияние сопержаиия кремния на плотность (а), размер кристаллитов Ьс (б) л содержание графитовой фазы (в). Смесь метан-аргон (1 1), 81 Си от 0,02 до 1,2% ( ъем.). Общее да вленне 13,3 хПа. Время осаждения 130 с [7-23]. | ![Рис. 7-7. Влияние сопержаиия кремния на плотность (а), размер кристаллитов Ьс (б) л содержание графитовой фазы (в). <a href="/info/40037">Смесь метан</a>-аргон (1 1), 81 Си от 0,02 до 1,2% ( ъем.). Общее да вленне 13,3 хПа. Время осаждения 130 с [7-23].](/800/600/http/chem21.info/pic2/051228211021103102231253210054121087066160157205.png) |
Соединение Р,.Н , содержит 6,11% (по массе) водорода. Плотность пара этого соединения по аргону равна 1,652. Установите его истинную формулу. [c.238]
Вычисленные с помощью метода Хартри —Фока электронные ПЛОТНОСТИ атомов являются достаточно точными и хорошо совпадают с экспериментальными величинами. Например, на рис. 11 приводится сравнение радиальной электронной плотности, вычисленной по методу Хартри — Фока для атома аргон,а, с экспериментальными данными, полученными с помощью метода дифракции электронов. [c.61]
Газы с большей плотностью—аргон (плотность 1,783 мг/см ), двуокись углерода и азот более удобны, чем водород или гелий (плотность гелия 0,177. нг1см .) Менее плотные газы все-таки применяются вследствие их некоторых преимуществ, связанных с детектированием. Теплопроводность их значительно отличается от всех других газов, что позволяет определять даже микропри- [c.31]
В 1894 г. Рамзай повторил эксперимент Кавендиша, выделил оставшийся пузырек газа и провел его анализ новым методом, во времена Кавендиша еще неизвестным. Рамзай нагрел этот газ, изучил его спектр. В результате выяснилось, что оставшийся пузырек представляет собой новый газ, плотность которого несколько выше, чем у азота. Содержание его в атмосфере равно примерно 1 % (по объему). Он химически инертен, не реагирует ни с одним другим элементом. По этой причине газ получил название аргон (от греческого ариое — инертный). [c.106]
Прежде чем приступить к детальному изучению вопроса, рассмотрим некоторые числовые величины, входящие в вириальное уравнение состояния, и отметим некоторые из этих общих характеристик. В качестве примера возьмем аргон при температуре 25° С. Пользуясь табл. 1.1, определим вклад в ру НТ от первых нескольких членов как для ряда по плотности (1.2), так и для ряда по давлению (1.3) при различных значениях давления. Вклады от оставшихся членов, взятые из экспериментальных значений ри1ЯТ, указаны в скобках. Другие газы ведут себя подобным образом, хотя значения температур и давлений будут иными. Очевидно, что при низких давлениях сходимость обоих рядов одинаково хорошая, однако при высоких давлениях оба ряда плохо сходятся, если вообще сходимость существует. Обычно из интуитивных соображений следует, что вириальное уравнение состояния в действительности расходится при высоких плотностях, но природа расходимости и область сходимости окончательно еще не установлены ни теоретически, ни экспериментально. (Весьма обстоятельно этот вопрос рассмотрен в разд. 16 работы [24]). Упомянутые ранее простые случаи указывают на то, что сходимость вириальных рядов в любом случае является асимптотической и что все члены, которыми можно пренебрегать при низких плотностях, становятся существенными при высоких плотностях (очевидным примером могли бы служить члены, изменяющиеся как е ). Лишь недавно было дано математическое доказательство того, что вириальный ряд абсолютно сходится в области ограниченных размеров в соответствии с определенными условиями, налагаемыми на межмолекулярные силы [29]. Хотя точная область сходимости с математической точки зрения до сих пор не установлена, можно считать доказанным существование таких областей. Экспериментально установлено, что при температурах ниже критической вириальный ряд сходится вплоть до плотностей насыщенного пара [c.15]
Если необходимо разделить вириальные коэффициенты и В, то в этом случае нужны прямые измерения плотности. Такая процедура была выполнена Оркатом и Коулом [138], но они измеряли не показатель преломления, а диэлектрическую проницаемость аргона, двуокиси углерода и этилена. К преимуществам оптического метода можно отнести то, что он дает иную информацию о межмолекулярных силах по сравнению с информацией, получаемой из измерений плотности. [c.107]
Аналогичные расчеты для воды и аргона, демонстрируемые в /66-69/, позволяют утверждать, что уравнение (111.2.3) хорошо описывает не только метастабильную область и непосредственно прилегающие к ней стабильные состояния, но и всю область плотной жидкости вплоть до кривой плавления. Так, для воды /66, 69/ в метастабильной области расчеты согласуются с экспериментом в пределах 0,01%, а результаты расчетов плотности стабильной жидкости согласуются со скелетными таблицами /75/ в пределах нормативных допусков. Специфика воды как ассоциированной жидкости при этом пегко учитывается введением вместо постоянного значения параметра В в [c.40]
Принципиальная схема газового хроматографа представлена на рис. 57. Газ-носитель из баллона / поступает в блок подготовки газов 2, где происходит его очистка, устанавливаются объемная скорость и давление. В качестве газа-гюсителя используют гелий, азот, аргон, углекислый газ. В обогреваемый до температуры выше кипения исследуемой смеси испаритель 5, через который протекает поток газа-носителя, микрошприцем 3 через резиновую мембрану вводят пробу вещества. Захватив пары анализируемой пробы, газ-носитель поступает в хроматографическую колонку 6 — металлическую или стеклянную трубку длиной обычно от 0,5 до 4 м и диаметром 2—8 мм, заполненную гранулированной насадкой. Во избе-жение конденсации паров пробы колонка помещена в термостат 7. Выходящий из колонки газовый поток содержит зоны отдельных компонентов, разделенные зонами чистого газа-носителя и отличающиеся от них по электрической проводимости, плотности или другим параметрам. Измерение этих параметров на выходе из колонки позволяет определить относительное содержание компонента в смеси. Устройство, непрерывно регистрирующее значение того или иного параметра газового потока, называется детектором 8. [c.49]
Пример. При растворении аргона в воде скорость растворения в расчете на единицу поверхности первое время (3—5 мин) постоянна и равна 1 раскорость растворения возрастает из-за естественного конвективного леремешивания вследствие более высокой плотности слоя воды с растворенным аргоном. Это наблюдается при Ра > 3- 10- . [c.304]
Окисление газообразного полифосфора избытком дикислорода приводит к получению 1,25 моль декаоксида тетрафосфора. Установите число атомов в молекуле полифосфора, а также значения формульного количества этого вещества (моль) и его массы (г), вступивших в реакцию, если относительная плотность газообразного фосфора по аргону равна 3,1. [c.45]
При сжигании 8,71 г некоторого газообразного силана Si H,, на воздухе образовалось 16,82 г Si02. Найдите химическую формулу этого силана, если его плотность по аргону равна 1,558. [c.243]
chem21.info
Аргон - Физическая энциклопедия
АРГОН (Argon), Ar,- хим. элемент VIII группы периодич. системы элементов, инертный бесцветный газ, ат. номер 18, ат. масса 39,948. А. содержится в атм. воздухе (0,93%) и состоит из трёх стабильных изотопов: 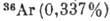 ,
, 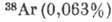 и
и 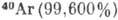 . Конфигурация внеш. электронной оболочки
. Конфигурация внеш. электронной оболочки 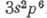 . Энергии последовательных ионизации соответственно равны 15,759; 27,63 и 40,91 эВ. Ван-дер-ваальсов радиус А. 0,192 нм.
. Энергии последовательных ионизации соответственно равны 15,759; 27,63 и 40,91 эВ. Ван-дер-ваальсов радиус А. 0,192 нм.
Плотность А. при нормальных условиях 1,7839 кг/м3, 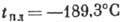 ,
, 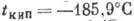 (при нормальном давлении). Теплота плавления 1,176 кДж/моль, теплота испарения
(при нормальном давлении). Теплота плавления 1,176 кДж/моль, теплота испарения 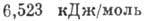 , плотность жидкого А. 1,401 кг/дм3, твёрдого (-2330C) -1,65 кг/дм3,
, плотность жидкого А. 1,401 кг/дм3, твёрдого (-2330C) -1,65 кг/дм3,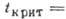 =
=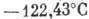 ,
, 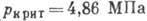 , критич. плотность 0,5308 кг/дм3. Тройная точка: 83,78 К, 68,9 кПа.
, критич. плотность 0,5308 кг/дм3. Тройная точка: 83,78 К, 68,9 кПа.
Хим. соединения А. неизвестны. А. образует соединения включения (клатраты) с веществами, размеры полостей в кристаллич. решётках к-рых примерно равны размерам атома А. Атомы А. могут образовывать т. н. ван-дер-ваалъсовы молекулы. А. наполняют разрядные трубки (сине-голубое свечение), на определении отношения концентраций 40Ar и 40K основан один из методов определения возраста минералов, А. применяют в активных средах лазеров.
Лит.: Фастовский В. Г., Ровинский A. E., Петровский Ю. В., Инертные газы, M., 1964; Бердоносов С. С., Инертные газы вчера и сегодня, M., 1966.
С. С. Бердоносов.
Предметный указатель >>
www.femto.com.ua
Плотность аргон—кислород - Справочник химика 21
Первое допущение, кроме очевидной области низких давлений, достаточно корректно для полимерных материалов большой плотности с значительной долей упорядоченной фазы и малой подвижностью структурных элементов матрицы, например, полиэтилена высокого давления. Второе и третье допущения выполняются при давлениях до 5—6 МПа для газов с малой молекулярной массой в области состояний, значительно удаленных от линии равновесия жидкость — пар (7 7 с), например, гелия, аргона, азота, кислорода, что подтверждается экспериментально (6, 8, 10, 15]. [c.99]
Поэтому потенциальная энергия межмолекулярного взаимодействия атома адсорбата (например, благородного газа) с цеолитом сильно зависит от направления радиуса-вектора от центра полости к ее стенкам (ребрам каркаса цеолита) или к окну. На рис. 11.3 представлены некоторые потенциальные кривые для межмолекулярного взаимодействия атома аргона с цеолитом NaX. Из рисунка видно, что глубины потенциальных ям для разных направлений изменяются более чем в два раза, причем наибольшие глубины потенциальной ямы получаются прп направлении на места наибольшей плотности расположения ионов кислорода. [c.211]Литий — легкий мягкий металл. Плотность его 530 кг/м , температура плавления 180° С. Только 0,26 г, или 0,49 см , лития требуется для элемента емкостью 1 А-ч. Литий бурно реагирует с водой и кислотами, выделяя из них водород, на воздухе быстро окисляется, взаимодействует с кислородом и азотом. Все работы с литием проводят в сухих боксах, заполненных инертным газом — аргоном. Потенциал литиевого электрода около 3 В и зависит от природы и состава электролита. [c.276]
ВОДЫ занимают места, недоступные для таких газов, как аргон, криптон или кислород. Однако азот, по-видимому, или заполняет полости, недоступные для других молекул, или же должен иметь повышенную среднюю адсорбционную плотность. Дополнительное пространство, занимаемое водой, должно состоять из малых объемов в 8-ячейках, образующих стенки каналов. Рассчитанный свободный объем главных каналов в структуре цеолита составляет 614 А на элементарную ячейку, что вполне сопоставимо с объемом пор, определенным по адсорбции постоянных газов Аг и Оа и равным 619—642 А . [c.443]
Открытие в составе воздуха первого из инертных газов — аргона, вошедшее в историю химии под образным названием торжество третьего десятичного знака , состоялось лишь примерно сто лет спустя при следующих обстоятельствах. В конце XIX, в. предметом ожесточенных споров сделалась гипотеза Проута, Согласно этой гипотезе, атомы всех элементов представляют собой сочетания атомов водорода, так как по крайней мере большинство атомных весов элементов оказываются кратными от единицы. Для решения споров потребовалось повторное определение атомных весов, в частности через точное измерение удельных весов таких газов, как азот, кислород и водород. Зтой задачей и был занят английский экспериментатор Релей, когда он натолкнулся на непонятный факт азог, выделенный из воздуха путем уда-, ления из него кислорода (и СОг), имел одну плотность, а азот, выделенный из азотистых соединений, — другую, несколько меньшую (1,257 и 1251 г/л). [c.176]
Три полученных образца были тщательно высушены их плотности, которые были определены при 25 °С и давлении 1 атм, составляли для образца I 1,2572 г/л, для образца II 1,2505 г/л и для образца III 1,2564 г/л. Последняя величина колебалась при изменении относительных количеств аммиака и кислорода, и многие экспериментаторы пренебрегли бы этими колебаниями, отнеся их за счет погрешности эксперимента. Однако Рэлей и Рамзай повторили и выполнили в измененном виде эксперимент Кавендиша и получили инертный газ, который назвали аргоном. Данные спектрального анализа убедили их, однако, что этот газ не является индивидуальным элементом, и последующие исследования, продолжавшиеся несколько лет и включавшие тщательную дистилляцию сжиженного газа, привели к получению относительно чистых образцов аргона, неона, криптона и ксенона. Спектральные данные подтвердили, что это новые элементы, а измерение их теплоемкости показало, что они моно-атомны. Таким образом в периодической таблице Менделеева появилась новая группа элементов. Затем Рамзай нашел гелий (элемент, который Локьер обнаружил в солнечной атмосфере) в урановых рудах, где он образуется из альфа-частиц в процессе геологического развития Земли. В 1900 г. с открытием радона в радиевых рудах эта группа элементов была заполнена. Об открытии радона первым заявил Дорн, однако Рамзай и другие исследователи почти одновременно пришли к такому же результату. [c.333]
Признать аргон сложным веществом нет ныне оснований, хотя при открытии аргона (1894) у меня самого (что высказано в 6 издании. Основ химии") были поводы считать его за прочный полимер азота N (относится к азоту N-, как озон О к кислороду О ), образованный с выделением тепла (а озон—с поглощением). Если же считать аргон и его спутников (гелий и пр.) за самостоятельные химические элементы, то их — вследствие их неспособности образовать солеобразные соединения типа RX" (гл. 15) — должно поместить в особую группу, так сказать нулевую, предшествующую группе 1, элементы которой дают RX, и составляющую переход от галоидов (группа VII, дающая с водородом соединения типа RX, а с кислородом типа RX ). Такое соображение, отвечающее тому, что мне лично было высказано Рамзаем (19 марта 1900 г.), находится в согласии с тем, что аргон и его аналоги содержат по одному атому в частице, что дает возможность, судя по плотности газа [c.488]
До конца XIX века полагали, что воздух состоит только из кислорода и азота. Но в 1894 г, английский физик Дж. Рэлей установил, что плотность азота, полученного из воздуха (1,2572 г/л), несколько больше, чем плотность азота, полученного из его соединений (1,2505 г/л). Профессор химии У. Рамзай предположил, что разница в плотности вызвана присутствием в атмосферном азоте примеси какого-то более тяжелого газа. Связывая азот с раскаленным магнием (Рамзай) или вызывая действием электрического разряда его соединение с кислородом (Рэлей), оба ученых выделили из атмосферного азота небольшие количества химически инертного газа. Так был открыт неизвестный до того времени элемент, названный аргоном. Вслед за аргоном были выделены гелий, неон, криптон и ксенон, содержащиеся в воздухе в ничтожных количествах. Последний элемент подгруппы — радон — был открыт при изучении радиоактивных превращений. [c.660]
К. В [38] было найдено, что газы, входящие в состав воздуха, по-разному влияют на плотность. Азот плотность понижает, а кислород, аргон и углерода диоксид повышает плотность. Коррекция значений плотности при отклонении ее изотопного состава от изотопного состава ССОВ нами уже рассматривалась. [c.22]
Тодос и его сотрудники установили, что предложенная Абас-Заде [53] зависимость X — Х = ар , справедливая для теплопроводности, может быть расширена аналогичная зависимость разности вязкостей ц — 1° от плотности дает в рассматриваемых ими случаях хорошее совпадение с опытными данными для сжатых и сжиженных газов. Для азота, аргона, кислорода, двуокиси углерода, двуокиси серы, метана, этана, пропана, м-бутана, изобутана и пентана найдена общая кривая зависимостп (р — от приведенной плотности рлр = р/р1ф. Эта кривая описывается уравнением [c.255]
Применение атмосферы аргона и кислорода дает хорошие результаты также в сочетании с дугой переменного тока. Сравнивались результаты определения ряда элементов в графите при испарении в атмосфере воздуха и смеси 75% аргона с 25% кислорода. Использовали дугу переменного тока силой 8—16 А. Пределы обнаружения бора, бериллия, германия, кальция, магния, титана и цинка в графитовой основе и бериллия, кадмия, железа, германия, марганца, ниобия и титана в основе графит-Ь -Ькарбонат лития в 2—10 раз ниже в атмосфере аргона с кислородом, чем в воздухе. В основе графит + фторид лития (3 1) пределы обнаружения бора, бериллия, германия, кадмия, марганца, ниобия и цинка в 2—5 раз ниже в атмосфере аргона с кислородом, чем в воздухе. Зато предел обнаружения олова во всех матрицах при анализе в воздухе в 5 раз ниже, чем в смеси аргона с кислородом. Точность анализа в атмосфере аргона и кислорода несколько лучше, чем в воздухе. Но не для всех элементов оптимальное соотношение аргон кислород было 75 25. Так, максимальное значение /л//ф при определении магния и хрома в графите получено в атмосфере 40% аргон-ЬбО% кислорода, а при определении хрома и железа в основе графит + -[-карбокат лития — в атмосфере чистого аргона. Таким образом, состав 75% аргона-f 25% кислорода является компромиссным. Авторами исследованы также смеси гелия с кислородом (70—100% Не+ЗО—0% Ог). При этом столкнулись со следую-шими трудностями. Большое различие в плотности гелия и кислорода затрудняет смешение их в контролируемых условиях. Кроме того, при содержании, в смеси 30% кислорода электроды горели очень интенсивно, как будто кислорода было гораздо больше. Поэтому от гелия отказались, хотя характеристики у гелия и аргона близкие [236]. [c.128]
Гэмпсон любезно предоставил в наше распоряжение один из своих образчиков жидкого воздуха — около 100 мл. После того как его свойства были продемонстрированы студентам в моей лаборатории, осталось еще несколько кубиков. Тогда я вздумал рассмотреть его спектр предварительно освободив его от деятельных газов, ему дали испариться в газометре и при помощи указанных реактивов отняли кислород и азот. Остаток обнаружил спектр аргона, но одновременно мы наблюдали две яркие линии одну — в желтой части спектра, другую — в зеленой. В тот же вечер мы определили плотность газа, она на две единицы превышала плотность аргона, [c.46]
Выделены и изучены смолистые вещества после трехлетнего хранения топлив (табл. 39). На силикагеле АСК была отделена углеводородная часть, а смолистые вещества десорбировали последовательно бензолом и спиртоацетоновой (1 1) смесью. Растворы смол тщательно сушили и фильтровали, после чего растворитель отгоняли в тоне сухого аргона. Средняя молекулярная масса фракции смол превышает молекулярную массу соответствующих исходных топлив на 30—50 единиц для ТС-1, Т-1 и бензинов, на 80—130 единиц для ДЗ. Плотность смолистых веществ приближается к 1000 кг/м . Высокие значения коэффициента рефракции и эмпирические формулы указывают на циклическую структуру смол. Выделенные смолистые вещества являлись сложной смесью сернистых, азотистых и кислородных соединений. В смолах присутствуют также соединения, в состав которых входят сера, кислород и азот одновременно. [c.93]
ТО есть на поляризацию индикаторного электрода расходуется только часть налагаемого напряжения. Но при условии, что площадь поверхности анода во много раз больше, чем у катода, поляризацией анода можно пренебречь, потому что из-за малой плотности тока его потенциал будет оставаться нрактически постоянным. Если сопротивление раствора уменьшить, то слагаемым Ш можно пренебречь, потому что в полярографической ячейке редко возникают токи, сила которых выше нескольких десятков микроампер. Для снижения сопротивления в анализируемый раствор вводят избыток индифферентного электролита, или просто фона. В качестве фона пригодны различные соли щелочных и щелочноземельньк металлов, растворы кислот, щелочей, а также разнообразные буферные смеси. Нри этих условиях можно полагать, что практически все налагаемое на ячейку внешнее напряжение расходуется на изменение нотенциала индикаторного электрода, то есть в и Е . Перед регистрацией нолярограммы необходимо удалить из раствора растворенный кислород, который восстанавливается на ртутном электроде. Растворимость кислорода в разбавленньк растворах электролитов довольно высокая, около 10 " моль/л, поэтому он мешает полярографическому определению большинства веществ. Из раствора кислород можно удалить, барботируя через него какой-либо электрохимически инертный газ (азот, гелий, аргон). В этом случае ячейка должна быть достаточно герметичной, а избыток газа следует отводить через гидрозатвор. Во время регистрации нолярограммы, для того чтобы кислород воздуха не попадал в ячейку, над поверхностью раствора рекомендуется пропускать ток инертного газа. Для удаления растворенного кислорода необходимо 15-20 минут барботировать инертный газ, а при работе с низкими концентрациями вещества и в случае очень точньк измерений требуется увели- [c.165]
Открытие элементов нулевой группы. Тщательные и весьма точные опыты, предпринятые Рэлеем и Рамзаем, столкнувшимися с проблемой различия в плотностях азота, полученного из. воздуха после удаления кислорода, и азота, полученного разложением азотсодержащих соединений (в первом случае плотность оказалась выше на 0,1%), привели к открытию 5 редких газов, что знаменовало собой выдающийся успех классической экспериментальной химии. К моменту открытия аргона, 8Аг (1894 г.) и гелия 2Не (1895 г.) не было точно известно, какое место они должны занять в периодической системе. Однако Рамзай решил, что оба эти элемента принадлежат к одному семейству, и для Не определил место в таблице Менделеева между Н и зЫ, а для Аг (который в то время обозначали символом А) —между 1 С1 и эК. В 1896 г. были предсказаны свойства трех еще не обнаруженных газов, относящихся к тому же семейству, и в течение мая — июля 1898 г. были открыты криптон збКг, неон юЫе и ксенон 54Хе, принадлежность которых к так называемой нулевой группе была доказана исследованием их свойств. Действительно, было бы неестественным такое расположение элементов в периодической таблице, когда непосредственно за галогенами следовали бы щелочные металлы, диаметрально отличающиеся от них по свойствам включение между ними нулевой группы оказалось посновапным и придало периодической системе законченный [c.29]
Хотя дисперсионная составляющая для катионов должна быть значительно меньше соответствующего вклада атомов кислорода решетки, даже для молекул с симметричным распределением электронной плотности наблюдается некоторое снижение адсорбции и теплот адсорбции с уменьшением плотности, как показано для адсорбции аргона на декатионированных морденитах [4]. Декатионирование представляет собой другой путь получения изоструктурных цеолитов с различной катионной плотностью. При декатиониравании путем кислотной обработки следует принимать во внимание возможность деалюминирования образцов [5, 6]. Снижение адсорбции СО2 с уменьшением содержания катионов в элементарной ячейке наблюдается и для синтетических эрионитов, отличающихся степенью декатионирования и деалюминирования (рис. 2, а). [c.192]
Газ, выделяющийся во всех этих стадиях, а также вследствие электронной бомбардировки различных частей трубки, был подвергнут исследованию [15881. Выделение газов из металлов [5681, слюды и геттеров [2099] также исследовалось с использованием омегатрона при давлениях порядка 10 мм рт. с/й. Описано применение омегатрона [1788] для изучения количества кислорода, окиси углерода и азота, адсорбирующихся на вольфрамовом катоде при 300° К, которые выделяются холодной нитью . Омегатрон может быть использован в качестве манометра для измерения давления ионизационный манометр неудовлетворителен для измерения давления кислорода. В работах, связанных с исследованиями верхних слоев атмосферы, радиочастотный масс-спектрометр особенно удобен благодаря своим малым размерам и весу (18421. Несколько таких приборов может быть установлено на одной ракете 1963], и специальные условия, при которых проводилась работа, обеспечили возможность создания очень простых конструкций. Например, при работе на большой высоте можно было устранить вакуумный кожух, системы напуска и с(качную систему, а для изучения ионов, присутствующих в атмосфере, иет необходимости в ионизационной камере. Разрешающая способность прибора была очень мала, поскольку нужно было различать только такие ионы, как N , NO и Oi, поэтому необходимо было иметь три прибора для анализа положительных и отрицательных ионов, а также нейтральных осколков. Описан метод для калибровки по массам [10531 и опубликованы результаты различных измерений арктической ионосферы [1052, 1054, 1188, 1371, 2041]. Было показано, например, что происходит диффузионное разделение аргона и азота на высоте выше 110 км, что при 220 км основными газами являются N2, О, NO и О2 в примерных соотношениях 2,8 2,9 1,4 1. Ионы О не появляются ниже 130 км, но представляют собой основные положительные ионы в спектре на высоте больше 200 км. В Арктике на высоте 200 км плотность атмосферы днем в летний период в 20 раз больше плотности ночью в зимнее время, равной 5-10" г/л . На высоте 100наблюдались ионы О , N0", NO (преимущественно ионы N0 и 0J). Преобладание ионов N0" можно объяснить низким потенциалом ионизации NO (9,5 эе). Ионизационные потен циалы О2 и N2 составляют 12,5 и 15,5 эв соответственно. [c.497]
Свойства. Азот — бесцветный, не имеющий запаха и вкуса газ, более легкий, чем воздух. Вес 1 л чистого азота нри 0° и 1QQ мм ртст равен 1,2505 г, а вес воздушного азота , содержащего 1,185 об. % аргона, составляет 1,2567 г вес 1 л воздуха при тех же условиях равен 1,2928 г. Азот сжижается с трудом (критическая температура — 147,1°, критическое давление 33,5 атм, критическая плотность 0,3110). Температура кипения жидкого азота равна —195,8°, температура плавления твердого азота — 210,5°. В воде азот менее растворим, чем кислород 1 л воды при 0° растворяет 23,6 мл воздушного азота или 23,2 мл чистого азота. [c.634]
Как э,то следует из приведенного списка, атомные веса, принятые Менделеевым для церия (140), эрбжя (178) и лантана (180), заметно отличаются от современных. Для атомного веса дидима Менделеев принял значение 138. Довольно близок к современному значению атомный вес (88), принятый для иттрия Однако изучение редких земель с помощью спектрального анализа, исследования Пера Теодора Клеве (1840—1905), профессора Упсальского университета, привело его к от-крытию в 1879 г. самария, эрбия, тулия и иттербия Наряду с этим исследования Ауэра фон Вельсбаха (1858—1929) открывшего празеодим и неодим в 1885 г., и Эжена Анатоля Демар-с э (1852—1904), открывшего в 1896 г. европий, и особенно аналитическое изучение группы редких земель, столь трудной для экспериментирования, сделали необходимым пересмотр таблицы Менделеева. К этому добавляется одно из самых сенсационных открытий химии второй половины XIX в. и притом в неожиданной области — открытие Рамзаем благородных газов в 1894—1898 гг. Это открытие имело в своей основе одно из наблюдений лорда Роберта Джона Рэлея, сына знаменитого физика Джона Уильяма Рэлея. Определяя плотность азота, нолученного химическим путем, и азота, полученного перегонкой жидкого воздуха, Рэлей заметил, что плотность последнего всегда несколько выше, чем первого. Так как Рэлей не мог предложить никакого объяснения этому факту, он сообщил о своем наблюдении в журнале Природа приглашая химиков дать необходимое объяснение. Это сообщение тотчас же привлекло внимание Рамзая, и он объединился с Рэлеем для того, чтобы отыскать истинную причину наблюдавшегося явления. Переработав значительное количество жидкого воздуха, лорд Рэлей и Рамзай объявили в 1894 г. об открытии нового элемента, который они назвали аргоном вследствие его химической инертности В этом отношении не следует забывать, что еще в 1785 г. Кавендиш, пропуская электрическую искру через смесь воздуха с кислородом в присутствии едкого кали, заметил, что после образования азотной кислоты, поглощенной едким кали, и удаления избытка кислорода получается незначительный остаток — /i2 полного [c.276]
При электролитическом рафинировании гафния применяют хлоридные и хлоридно-фторидные электролиты. В случае хлоридных электролитов в состав первичного электролита вводят Hf li, в случае фто-ридно-хлоридных — КгНГРв. В отличие от титана при рафинировании которого сравнительно легко получают устойчивый электролит, содержащий низшие хлориды, при рафинировании гафния стабильный электролит получить трудно. Низшие хлориды гафния неустойчивы и легко диспропор-ционируют на тетрахлорид и металлический гафний. Давление пара тетрахлорида гафния невелико только при низкой концентрации его Б расплаве, поэтому используют электролиты, содержащие 3,0—8,0% гафния. Электролиз проводят при низкой плотности тока (до 20 а дм ) в герметичных электролизерах в атмосфере аргона или гелия (рис. 129). Содержание примесей в рафинированном металле значительно ниже, чем в исходном материале. Количество кислорода уменьшается с 0,175 до 0,037% [8]. [c.469]
Ке5 — черный рентгеноаморфный порошок с плотностью 7,11 г см и магнитной восприимчивостью = 0,2 10 . При нагревании выше 680° С в токе аргона Ке5 необратимо диспропорционирует на КеЗа и Не. Выше температуры 300° С КеЗ присоединяет серу, образуя КеЗг- В присутствии влаги КеЗ легко окисляется кислородом при обычной температуре по реакции [c.166]
Стояки газовых весов изготовлены из медных трубок длиной 8— 10 л и внутренним диаметром 5—8 ми трубки проложены параллельно, вплотную одна к другой. Это позволяет обеспечить в них одинаковые температурные условия. Концы трубок защищены колпаком с отверстием для выхода газов. Дифманометр обычно заполняют керосином плотностью 0,83, вязкость и упругость пара которого ниже, чем воды. Газовые весы для анализа аргона тарируют обычно по 98%-ному кислороду и воздуху. Для этого в стояк анализируемого газа пускают кислород и установочными винтами 12, 13 и 14 ставят трубку дифмано1метра в такое положение, чтобы мениск жидкости установился на цифре 50 (всего на [c.356]
chem21.info