Электронный учебник по химии. Аргон металл или неметалл
Билет 5 НЕМЕТАЛЛЫ
Билет № 5
Неметаллы, положение этих химических элементов в периодической системе, строение их атомов (на примере атомов хлора, кислорода, азота). Отличие физических свойств неметаллов от металлов. Реакции неметаллов с простыми веществами: металлами, водородом и кислородом.
Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Рассмотрим схемы строения атомов некоторых неметаллов:
N: 2е, 5е, 1s2 2s22p3 высшая степень окисления равна +5, а низшая степень окисления -3.
О: 2е, 6е, 1s22s22p4 высшая степень окисления равна +2, а низшая степень окисления -2.
Cl: 2е, 8e, 7е, 1s22s22p63s23p5 высшая степень окисления равна +7, а низшая степень окисления -1.
С увеличение порядкового номера по периоду неметаллические свойства элементов усиливаются, а в группах – ослабевают: в VIA подгруппе О типичный неметалл, а полоний - металл.
Неметаллы при обычных условиях могут быть газами, жидкостями и твердыми веществами. Газами являются гелий, неон, аргон, криптон, хсенон, радон. Их называют инертными газами. Каждая молекула инертного газа состоит из одного атома; атомы этих элементов не объединяются в молекулы, т.к. внешние слои их атомов завершены (имеют по 8, кроме гелия, электронов).
Другие газы: водород, кислород, азот, фтор, хлор образуют двухатомные молекулы и имеют формулы: h3, O2, N2, F2, Cl2.
Единственное жидкое вещество, образованное неметаллом – это бром – Br2.
Остальные неметаллы твердые. Большинство неметаллов не электропроводны (графит и кремний проводят ток), имеют низкую теплопроводность, непластичны.
Чтобы выяснить свойства, характерные для всех неметаллов, надо обратить внимание на положение неметаллов в периодической системе элементов Д.И.Менделеева. Если провести диагональ от Be до At, то над этой диагональю в главных подгруппах окажутся элементы – неметаллы. К неметаллам относятся также водород и инертные газы. Таким образом, в VIIIA и VIIA – подгруппе все элементы – неметаллы, в VIA подгруппе – только полоний металл, в VA подгруппе неметаллы: N, P, As, в IVA - кремний и углерод, а в IIIA подгруппе - бор.
Неметаллы в основном располагаются в конце малых и больших периодов, а число внешних электронов у их атомов равно номеру группы. Исключение составляет гелий: на внешнем слое его находится 2 электрона, а сам он – в VIII группе.
Для завершения внешних электронных уровней атомы неметаллов присоединяют электроны и являются окислителями. Активнее всех присоединяет электрон атом фтора. Эта способность у остальных элементов-неметаллов уменьшается в следующем ряду: O N Cl Br S C I P H
У атомов этих элементов уменьшение способности присоединять электроны находится в соответствии с их электроотрицательностью.
Химические свойства неметаллов:
взаимодействуя с металлами, типичные неметаллы образуют соединения с ионной связью, например, хлорид натрия NaCl, оксид кальция CaO, сульфид калия K2S.
Приведем уравнения реакций:
2Na + Cl2 = 2NaCl 2Ca + O2 = 2CaO 2K + S = K2S
Итак, неметаллы могут реагировать с металлами, проявляя при этом свойства окислителей.
В определенных условиях неметаллы могут взаимодействовать друг с другом:
h3+S→h3S
S+O2→SO2 В этих двух реакциях сера проявляет свой
Неметаллы могут взаимодействовать со сложными веществами
А) с водой:Cl2+2h3O4HCl+2O2(на свету, или темп.)
Б) с солями: Cl2+2KBr2KCl+Br2 (комн. to)
В) со щелочами, при этом сера выступает в роли окислителя и восстановителя: 3S+6NaOH→2Na2S+Na2SO3+3h3O (кипячение)
Г) с кислотами – окислителями при нагревании: С + 2h3SO4(конц)→ СO2+ 2SO2+ 2h3O
С + 4HNO3 (конц)→ СO2 + 4NO2 + 2h3O
Следует отметить, что для неметаллов скорее характерно различие, чем общность свойств.
studfiles.net
Аргон свойства - Справочник химика 21
В первом способе плазма образуется при пропускании рабочего плазмообразующего вещества через электрическую дугу. Используемое в дуге напряжение невелико (40—100 В), плотность тока достаточно велика (>1 А). В качестве плазмообразующих газов используются обычно азот, водород, гелий, аргон. Изменяя газ, можно изменять химические свойства среды плазмы (окислительные, нейтральные, восстановительные). Плазма может иметь разную температуру (от 5000 до 50000° С). Соответственно степень ионизации может изменяться от 1 до 100%. Дуговые плазменные струи всегда в некоторой степени загрязнены материалом электродов. Поэтому наряду с дуговыми плазмотронами развивается разработка высокачастотных и сверхвысокочастотных плазмотронов, в которых источником плазмы является высокочастотный индукционный нагрев. [c.538]
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА — естественная система химических элементов, созданная гениальным русским химиком Д. И. Менделеевым. Расположив элементы в последовательности возрастания атомных масс и сгруппировав элементы с аналогичными свойствами, Д. И. Менделеев составил таблицу элементов, закономерности которой теоретически вытекают из сформулированного им периодического закона Физические и химические свойства элементов, проявляющиеся в свойствах простых и сложных тел, ими образуемых, находятся в периодической зависимости от их атомного веса (1869—1871 гг.). Периодический закон и периодическая система элементов Д. И. Менделеева позволяют установить свя ь между всеми химическими элементами, предсказать существование ранее неизвестных элементов и описать их свойства. Как впоследствии стало известно, периодичность в изменении свойств элементов обусловлена числом электронов в атоме, электронной структурой атома, периодически изменяющейся по мере возрастания числа электронов. Число электронов равно положительному заряду атомного ядра это число равно порядковому (атомному) номеру элемента в периодической системе элементов Д. И. Менделеева. Отсюда современная формулировка периодического закона Свойства элементов, а также свойства образованных ими простых и сложных соединений находятся в периодической зависимости от величины зарядов их атомных ядер (2) . Поскольку атомные массы элементов, как правило, возрастают в той же последовательности, что и заряды атомных ядер, современная форма таблицы периодической системы элементов полностью совпадает с менделеевской, где аргон, кобальт, теллур расположены не в порядке возрастания атомной массы, а на основе их химических свойств. Это несоответствие рассматривалось противниками Д. И. Менделеева как недостаток его системы, но, как позже было доказано, закономерность нарушается в связи с изотопным составом элементов, что также предвидел Д. И. Менделеев. Периодический закон и периодическая система элементов [c.188]
Термодинамические свойства некоторых промышленных газов весьма подробно представлены в двух недавних публикациях. В первой из них [1] приводятся физические и термодинамические свойства воздуха, аргона, двуокиси и окиси углерода, водорода, азота, кислорода и водяного пара. В книге Дина [2] рассматриваются аммиак, двуокись и окись углерода, воздух, ацетилен, этилен, пропан и аргон. Свойства гелия подробно изложены Кеезомом [3]. [c.306]
Физические свойства. В соответствии с характером изменения структуры и типа химической связи закономерно изменяются и свойства простых веществ — их плотность, температура плавления и кипения, электрическая проводимость и др. Так, аргон, хлор р,г/см и сера в твердом состоянии являются диэлектриками, [c.235]
| Таблица 52. Свойства аргона | 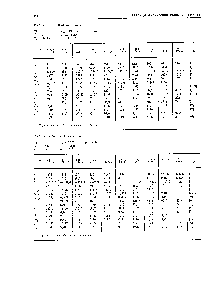 |
Если проследить изменение свойств всех остальных элементов, то окажется, что в общем оно происходит в таком же порядке, как и у первых шестнадцати (не считая водорода и гелия) элементов за аргоном опять идет одновалентный щелочной металл калий, затем двухвалентный металл кальций, сходный с магнием, и т. д. [c.49]
Какие же вещества являются элементами Первыми правильно установленными элементами были металлы-золото, серебро, медь, олово, железо, платина, свинец, цинк, ртуть, никель, вольфрам, кобальт, И вообще из 105 известных к настоящему времени элементов только 22 не обладают металлическими свойствами. Пять неметаллов (гелий, неон, аргон, криптон и ксенон) были обнаружены в смеси газов, остающейся после удаления из воздуха всего имеющегося в нем азота и кислорода. Химики считали эти благородные газы инертными до 1962 г., когда было показано, что ксенон дает соединения со фтором, наиболее активным в химическом отнощении неметаллом. Другие химически активные неметаллы представляют собой либо газы (например, водород, азот, кислород и хлор), либо хрупкие кристаллические вещества (например, углерод, сера, фосфор, мыщьяк и иод). При обычных условиях лишь один неметаллический элемент-бром-находится в жидком состоянии, [c.271]
Видно существенное различие между значениями предельных объемов адсорбционного пространства для различных газов. Вывод здесь, по нашему мнению, может быть только один изменяется не объем адсорбционного пространства, а плотность адсорбированной фазы. Если считать истинное значение предельного объема адсорбционного пространства по бензолу — = 0,40 см /г постоянным для всех адсорбируемых газов, то можно отметить, что степень заполнения адсорбционного пространства зависит от размера молекул, свойств криогенных газов и температуры опыта. Например, азот и аргон адсорбируются при температуре, близкой к их точке кипения, и плотность адсорбата (в расчете на 1 о = 0,40 см г) почти в полтора раза выше плотности нормальной жидкости при этой же температуре. По-видимому, в силу малости линейных размеров молекул это свойство должно наблюдаться у всех исследуемых газов при температурах, близких к температуре кипения. Низкое значение Ц7о для гелия и неона объясняется высокой температурой адсорбции, значительно превышающей критическую для указанных газов. [c.27]
В этом ряду сделано исключение только для калия, который должен был бы стоять впереди аргона. Как следует из разд. 2.2.1, это исключение находит полное оправдание в современной теории строения атома. Не останавливаясь на водороде и гелии, посмотрим, какова последовательность в изменении свойств остальных элементов. [c.72]
За неоном идет натрий — одновалентный металл, похожий на литий. С ним как бы вновь возвращаемся к уже рассмотренному ряду. Действительно, за натрием следует магний — аналог бериллия потом алюминий, хотя и металл, а не неметалл, как бор, но тоже трехвалентный, обнаруживающий некоторые неметаллические свойства. После него идут кремний — четырехвалентный неметалл, во многих отношениях сходный с углеродом пятивалентный фосфор, по химическим свойствам похожий на азот, сера — элемент с резко выраженными неметаллическими свойствами хлор — очень энергичный неметалл, принадлежащий к той же группе галогенов, что и фтор, благородный газ аргон. [c.73]
Ряды элементов, в пределах которых свойства изменяются последовательно, как, например, ряд из восьми элементов от лития до неона или от натрия до аргона, называются периодами. Если напишем эти два периода один под другим так, чтобы под литием находился натрий, а под неоном — аргон, то получим следующее расположение элементов [c.73]
Примеси кислорода, азота, углерода резко ухудшают механические свойства титана, а при большом содержании превращают его в хрупкий материал, непригодный для практического использования. Поскольку при высоких температурах титан реагирует с названными неметаллами, его восстановление проводят в герметичной аппаратуре в атмосфере аргона, а очистку и переплавку — в высоком вакууме. [c.505]
Таким образом, электроны Аг целиком заполняют Зр-состоя-ния. Далее, казалось, должна была заполняться З -оболочка. Кроме того, наличие -оболочки должно было вызвать -валент-ность у аргона, который, следовательно, не должен был обладать свойствами инертного газа. [c.460]
Если располагать элементы в порядке возрастания их атомных масс с учетом изменения химических свойств, то от предложенной Д. И. Менделеевым формулировки периодического закона будут заметны некоторые отклонения. Например, по химическим свойствам иод располагается после теллура, хотя атомная масса иода меньше. Аналогичное явление наблюдается при переходе от аргона к калию и от кобальта к никелю. Такие исключения Д. И. Менделееву были известны, но объяснить их он не мог. [c.55]
Если теперь рассмотреть элементы от натрия до аргона, то нетрудно заметить, что они в значительной степени повторяют свойства элементов от лития до неона. Причем повторение проявляется в определенной последовательности натрий повторяет свойства лития, магний — бериллия, алюминий—бора, кремний — углерода, фосфор — азота, сера — кислорода, хлор —фтора, аргон —неона, т. е. каждый восьмой элемент повторяет свойства первого. Следующий за аргоном калий повторяет свойства натрия и лития, кальций—магния и бериллия и т. д., иначе говоря, свойства элементов периодической системы повторяются. [c.56]
Установлено, что наилучший уровень механических свойств псевдосплавов обеспечивается пропиткой в среде аргона. Свойства псевдосплавов Fe- u в значительной мере зависят от степени дефектности структуры. Материалы из взаиморавновесных фаз обладают более совершенным строением межфазных фаниц и, соответственно, более высокими показателями прочности и пластичности. Наряду с применением только двух компонентов для получения псевдосплавов Fe- u в качестве составляющих используют сплавы железа и меди с другими элементами. Так, тугоплавкий каркас изготовляют из смеси порошков железа и фафита, железа и марганца. Железную основу легируют также Мо, Ni, Zn, Со, Al и др. Для пропитки применяют сплавы меди с Мп, Zn, Sn, Al, Со. [c.125]
Описан также аппарат, в котором образование покрытия происходит на изогнутой новерхности стального барабана, закрепленного в тефлоновом дер кателе. Мономер испаряют из лодочки под барабаном при давлении 10 мм рт. ст. и после осаждения подвергают ионной бомбардировке, инициируемой и поддерживаемой тлеющ1им разрядом в атмосфере аргона. Свойства получаемых в данном случае покрытий регулируются силой тока разряда и скоростью испарения. В этом случае удается получить пленку толщиной до 10 мкм. [c.95]
Франк [306] обнаружил, что зависимость фактора Эйкена от температуры для ряда простых газов имеет максимум. Вайнс и Беннетт [307] объясняют это изменением удельной теплоемкости с температурой. Шефер и Рейтер [308] показали, что отношение теплопроводности аргона к его вязкости постоянно в широком диапазоне температур. Кейс приводит две кривые зависимости фактора / от температуры для аргона. Свойства паров органических жидкостей были изучены Вайнсом [309, 310] при температурах 310—423°К. Эйкен [311] показал, что для полярных молекул величина [ будет меньше, чем для неполярных. Шефер [312] для характеристики фактора f полярных молекул использовал комплекс 1]2М/31(г7 (Г + 35/4). [c.281]
V VBe VBei2 Бериллиды ванадия образуются сплавлением компонентов в кварцевых контейнерах в аргоне. Свойства соединений не изучены [1731 [c.186]
С рением алюминий начинает взаимодействовать при 770°С. Соединеиия по-лучануг синтезом из элементов в дуговой аечи в среде аргона. Свойства соединений рения не изучены [c.203]
Твердые вещества, состоящие из неполярных молекул. Это такие вещества, как твердый аргон или твердая СО2, молекулы которых связаны между собой относительно слабыми ван-дер-ваальсовыми или слабыми полярными силами. Не следует ожидать, что они будут в сколько-нибудь значительной стенени притягивать молекулы реагирующих веществ как в жидкой, так и в газовой фазах они, сл>едовательно, не будут обладать важными каталитическими свойствами. [c.531]
Четвертый ряд также начинается со щелочного металла — калия. Судя по тому, как изменялись свойства в двух предыдущих рядах, можно было бы ожидать, что н здесь они будут изменяться в той же последовательности и седьмым элементом в ряду будет опять галоген, а восьмым — благородный газ. Однако этого ие наблюдается. Вместо галогена на седьмом месте находится марганец— металл, образующий как основные, так и кислотные оксиды, из которых лишь высший МпгОт аналогичен соответствующему оксиду хлора С12О7). После марганца в том же ряду стоят еще три металла — железо, кобальт и никель, очень сходные друг с другом. И только следующий, пятый ряд, начинающийся с меди, заканчивается благородным газом криптоном. Шестой ряд снова начинается со щелочного металла рубидия и т. д. Таким образом, у элементов, следующих за аргоном, более или менее полное поч вторение свойств наблюдается только через восемнадцать элементов, а не через восемь, как было во втором и третьем рядах. Эти восемнадчать элементов образуют четвертый — так называемый большой период, состоящий из двух рядов. [c.50]
Для выяснения воздействия этих соединений на резину были поставлены следующие опыты. Образцы резин испытывали в окисленном топливе Т-6 в присутствии акцептора свободных радикалов — ионола [0,1% (масс.)] и без него в среде аргона при 140°С. За время опыта (4 ч) концентрация гидропероксидов в результате распада (в том числе с образованием свободных радикалов) уменьшилась с 10 до 5-10 моль/л. В присутствии ионола физико-механическнс свойства резины не изменились, а в его отсутствие она полностью теряла эластичность. Аналогичные результаты получены в индивидуальных углеводородах (табл. 7.4) [335]. Из этих данных следует, что гидропероксиды сами по себе, по-видимому, не влияют на физико-механнческие свойства резины. Ухудшение ее свойств происходит под воздействием свободных (пероксидных и алкильных) радикалов. [c.232]
Исследованы каталитические свойства трех карбонилов железа Ре(СО)б, Ре2(СО)9 и Рез(СО)12 [42]. Додекакарбонил желёйа переводил гексен-1 при 60 °С в смесь изомеров, близкую по составу к термодинамически равновесной, а нона- и пентакарбонил про-. являли аналогичную активность лишь при более высоких температурах. Как и в более ранних работах, увеличение давления СО уменьшало или даже полностью подавляло изомеризацию. Ее скорость снижалась и при повышении давления водорода, а в атмосфере аргона подавлялись лишь побочные реакции. [c.107]
Свойства. Т1, 2г, Н — серебристо-белые ковкие металлы. П1П1 загрязгенни О, N. Н, С, В и другими примесями теряют иластичиость, становятся твердыми и хрупкими. При нагревании сильно поглощают водород и азот, образуя гидриды и нитриды, поэтому сваривать их можно только аргоно-дуговой сваркой. Некоторые свойства Т1, Ъх и НГ указаны в табл. 3.7. [c.504]
Азот получают разделением воздуха или же совместно с водородом в виде азотоводородной смеси. Воздух состоит в основном из азота — 78,03, кислорода — 20,95 и аргона — 0,94% (об.). В незначительных количествах в воздухе содержатся СО2, Нг, Ые, Не, Кг, Хе. Физические свойства основных составляющих воздуха приведены в табл. 7. [c.84]
Сплавы алюминия с марганцем и магнием (типа АМЦ, АМГ) хорошо деформируются и свариваются дуговой сваркой в среде аргона или автоматической сваркой по флюсу. Алюминиевые сплавы, обладающие большей прочностью, такие, как АМГ5В и АМГ6, обрабатываются несколько труднее, но могут использоваться при изготовлении аппаратов, работающих под давлением, вместо дефицитных меди и латуни, при этом значительно уменьшаются вес изделий и их стоимость. Свойства некоторых алюминиевых сплавов при низких температурах приведены в табл. 21. [c.142]
В Институте проблем материаловедения им. И.Н. Францевича НАН Украины проводятся работы, направленные на создание углеродных тканей с заданными электрофизическими свойствами для использования в медицинской технике. В рамках этих работ выполнены исследования по влиянию химико-тфмической обработки и электротермоудара на сопротивление углеродных тканей. Показано, что при термоударе снижение сопротивления ткани происходит как при обработке в защитной среде (аргоне), так и на воздухе. Конечная величина удельного сопротивления определяется параметрами термообработки, а при электротермоударе приложенным напряжением и временем процесса (до 1 минуты). [c.73]
chem21.info
МЕТАЛЛЫ И НЕМЕТАЛЛЫ. МЕТАЛЛОИДЫ И ВОДОРОД
Только совокупность химических и физических признаков позволяет безошибочно решить вопрос о принадлежности любого простого вещества к группе металлов или металлоидов. К числу наиболее распространенных металлов относятся натрий, калий, кальций, магний, алюминий, железо, олово, свинец, медь, серебро, золото, ртуть и др. К группе неметаллов относятся все простые газы азот, водород, кислород, хлор, аргон, неон и др., кроме того, к неметаллам относятся такие элементы, как углерод, кремний, фосфор, сера, мышьяк, иод, бром и др. [c.62]
Из 92 элементов, встречающихся в природе, подавляющее большинство составляют металлы. К неметаллам (металлоидам) относятся водород, бор, углерод, азот, кислород, кремний, фосфор, сера, инертные газы (гелий, неон, аргон, криптон, ксенон), галогены (фтор, хло бром,иод). [c.80]
МЕТАЛЛЫ И НЕМЕТАЛЛЫ. МЕТАЛЛОИДЫ И ВОДОРОД [c.71]
Процесс, изображенный схемой 1, имеет более общее применение, чем процесс, представленный схемой 2. Первый включает улетучивание газа и дистилляцию, второй —- возгонку. Все элементы-неметаллы можно превратить в соединения, отделяемые в виде газа или пара. Многие металлы и металлоиды, включая германий, мышьяк, селен, олово, сурьму, рутений, осмий и рений, можно выделить из водного раствора отгонкой после превращения их в соответствующие соединения (табл. 13) В случае металлов методы выделения в виде газа или пара применяют реже (например, выделение мышьяка в виде мышьяковистого водорода). Ртуть как в виде металла, так и в виде соединения можно, конечно, легко возгонять нагреванием, и этот метод был применен для выделения чрезвычайно малых количеств ртути, встречающихся в горных породах. [c.67]
В одних случаях растворенный компонент располагается в решетке между атомами растворителя, не нарушая существенно ее параметры. При этом образуется решетка внедрения,, условно показанная на рис. 13, а. Решетку внедрения обычно образуют системы металл — металлоид. Такие неметаллы, как водород, кислород, азот, углерод, имеют гораздо меньший атомный радиус по сравнению с радиусом металла-растворителя, что и является условием существования решетки такого типа. [c.22]
Элементы разделяются на две большие группы. Одни нз них в виде простых веществ, т. е. не в соединении с другими элементами, хорошо проводят тепло и электричество й имеют своеобразный металлический блеск такие элементы называются металлами. К металлам относятся, например, железо, медь, серебро, золото, платина, алюминий, свинец, олово, цинк, ртуть. Другие элементы этими свойствами не обладают они называются неметаллами или металлоидами. В качестве примеров металлоидов можно указать на кислород, водород, углерод, известный нам в виде угля, фосфор, серу. [c.22]
По химическим свойствам сера — типичный неметалл. Энергично реагирует со многими металлами и металлоидами соединяется с железом, цинком, водородом, кислородом, фосфором, хлором и т. д. В реакциях с металлами и водородом сера играет роль окислителя (электроноакцентора), проявляя при этом валентность, рав- [c.502]
Уже почти десять лет известно, что все элементы, кроме переходных металлов и инертных газов, образуют простые гидриды МН , где п — общая валентность элемента М. Сильно электроположительные элементы дают чрезвычайно реакционноспособные солеобразные гидриды, например НаН, где водород находится в виде аниона. Электроотрицательные неметаллы и металлоиды дают летучие ковалентные гидриды, например Н2О. Между этими крайними случаями находятся твердые полимерные гидриды, причем некоторые из них чрезвычайно реакционноспособны, например А1Нз, и в этом отношении они подобны солеобразным гидридам. В эту схему не укладываются переходные металлы, образующие твердые нестехиометрические гидриды типа сплавов, а также ряд неустойчивых и часто неясно определяемых комплексных гидридов. Подобно тому как переходные металлы не дают устойчивых алкилов типа МКп, они не дают также соответствующих гидридов. Состояние вопроса к 1952 г., суммированное Вибергом [1], дано на рис. 1. Между различными типами гидридов имеется непрерывная, но ясная градация. [c.192]
Таковы были системы, в основе которых лежала. пибо разбивка элементов на две резко противоположные группы — металлы, дающие основные окислы, и металлоиды (неметаллы), дающие кислотные окислы, либо расположение элементов в порядке их электрохимической полярности, либо разбивка их по противоположному отношению к водороду и кислороду, либо, наконец, деление их па обособленные группы по значению валентности. [c.188]
Элементы - окислители (неметаллы или металлоиды). Атомы их легко принимают некоторое число новых электронов, переходя в отрицательные ионы различной зарядности по схеме Э° п. ё Э". Отсюда еще одно их название — электроотри- цательные элементы. Это акцепторы электронов. К ним в основном относятся элементы, имеющие во внешнем квантовом слое (4)—5—6—7 электронов, то есть элементы главных подгрупп IV—V—VI—VII групп (плюс И и В). Эти элементы стремятся пополнить свой внешний слой до 8. электронов (водород — до 2). Это их основная функция. Однако их атомы могут и от давать полностью или частично свои внешние электроны, проявляя восстановительную способность, типичную для элементов — металлов. С этой точки зрения можно называть их металлоидами (метал-иоиодобными). Лишь кислороду и особенно фтору восстановительная способность практически не свойственна. Это —- два настоящих неметалла. [c.138]
chem21.info
Как отличить металл от неметалла? — журнал "Рутвет"
Оглавление:
- Как отличить металл от неметалла?
- Металлические сплавы
- Как отличить шлак от металла?
- Как отличить чугун от металла?
Каждое простое вещество по его физическим свойствам делится на металлы и неметаллы. Как отличить металлы от неметаллов? Некоторые из них легко определяются визуально: водород — неметалл, а железо — металл. Но, для того чтобы избежать возможной ошибки в классификации, большинство элементов лучше определять по признакам.
- Все металлы, если они находятся в обычном температурном режиме, представляют собой твердые вещества. Исключение из этого правила — ртуть. Для всех металлов характерен металлический блеск, они хорошие тепло-и электро-проводники. Почти все металлы обладают пластичностью, если на них оказывается физическое воздействие.
- Неметаллы характеризуются гораздо большими различиями по сравнению с металлами. Так, они могут быть жидкими (бром), твёрдыми (сера), или газообразными (водород). Также они плохие тепло- и электро- проводники.
- Металлы и неметаллы имеют разное строение. Неметаллы характеризуются большим количеством свободных атомов на внешнем уровне по сравнению с металлами. Последним характерно немолекулярное строение — кристаллическая решетка.
- Неметаллы обладают большим окислительно-восстановительным потенциалом и электроотрицательностью.
- Как отличить металл от неметалла, не изучая их физических и химических свойств? Для этого можно воспользоваться таблицей Менделеева: следует мысленно провести линию от бора до астата. Левая часть нижней таблицы показывает металлы. Также их можно найти в побочных подгруппах, расположенных в верхней части лесенки. Оставшиеся части главных подгрупп содержат неметаллы.
- Кроме того, многие таблицы делают цветными. Красным цветом в таких таблицах обозначены неметаллы, а зеленым и черным — металлы.
- Не стоит забывать также и о существовании амфотерных элементов, которые в разных химических реакциях проявляют свойства металлов или неметаллов. В таблице Менделеева они выделены штриховкой. Их называют полуметаллами. Такие вещества обладают металлическим блеском и являются слабыми электро-проводниками.
Кроме того, в промышленности существуют также металлические сплавы, которые были получены в результате сплавления металла с неметаллами или другими металлами, например, чугун, сталь, бронза, латунь.
Сплавы можно получать из двух или нескольких компонентов. Однако не все компоненты обладают хорошим взаимодействием между собой, поэтому не всегда можно получить желаемый сплав. Так, например, железо и свинец, свинец и цинк не сплавляются между собой, поскольку в жидком состоянии они не образуют раствор.
Обязательным условием для получения сплавов является образование жидкого однородного раствора. Полученные сплавы обладают свойствами, отличными от свойств компонентов, из которых они были образованы.
Чистые металлы в промышленности используются крайне редко, поскольку они не всегда обладают требуемыми свойствами и экономичностью.
Существует еще один способ, как можно отличить металлы от неметаллов: магнит. Однако следует отметить, что магнит является ограниченным средством в определении металлов, поскольку свойствами притягивания к нему обладают только недрагоценные металлы. Так, например, к магниту притянутся чугун, сталь, железо, а вот алюминий, серебро, медь — не притянутся. Этим же способом вы не сможете и проверить золото в домашних условиях на подлинность.
Видео о том, как отличить металлы
Как отличить шлак от металла?
Шлаки — это побочные продукты, которые получаются в результате следующих процессов:
- Плавка цветных и черных металлов.
- Сжигание твердого топлива.
- Электротермическая возгонка фосфора.
Металлургические шлаки — расплавы, которые покрывают жидкий металл при металлургическом процессе. После застывания шлаки представляют собой камневидные или стекловидные вещества.
Минеральный и химический состав шлаков зависит от таких факторов:
- Состав пустой рудной породы.
- Топливо.
- Вид выплавляемого металла.
- Особенности металлургических процессов.
- Условия сжигания топлива.
- Условия охлаждения шлаков.
Шлак по своим физическим свойствам характеризуется:
- Температурой плавления.
- Температурным интервалом затвердевания.
- Теплоёмкостью.
- Вязкостью.
- Способностью растворять сульфиды, оксиды и др.
- Определённой плотностью.
- Определённой газопроницаемостью.
Оптимальной температурой плавления шлаков является 1100-1200 °C. Если сталь плавится при температуре 1400-1500 °C, то шлак должен иметь небольшую вязкость, высокую подвижность и текучесть — эти условия обеспечивают в сварочных работах правильное формирование сварного шва. Очень большую роль играет то, как затвердевает расплавленный шлак. Шлаки не обладают строго определённым режимом температурного плавления. Если температура повышается, шлак становится менее вязким, а если понижается — то вязкость возрастает.
Состав и свойства шлаков зависят от исходных флюсов. Температура металла под флюсом должна быть не менее 1500-1550 °C, а температура шлаков при этом — 1750 °C.Часто возникает вопрос, как отличить шлак от металла. Основными отличиями являются:
- Металл обладает большей жидкостью и подвижностью.
- При расплавлении можно увидеть, как металл кипит, чего нельзя сказать о шлаках.
- Шлаки обладают большей тягучестью и имеют более тёмный цвет по сравнению с металлом.
- Шлаки всегда имеют меньший вес по сравнению с металлами.
Как отличить чугун от металла?
Чугун — это металл, образовавшийся в результате сплава железа и углерода. Этот материал имеет хорошие литейные качества и отличается дешевизной. Как правило, чугун используется в машиностроительной промышленности. Кроме того, чугун — основное сырьё для выплавки стали. Для производства этого материала используется железная руда, флюсы и топливо.
Часто в металлических конструкциях или деталях можно обнаружить трещину, разлом или скол. В таком случае возникает необходимость в ремонтных сварочных работах. Для того чтобы правильно провести такой ремонт, необходимо знать, с какими именно металлами вы имеете дело — сталь это или чугун. Как отличить чугун от металла?
Перед тем как приступить к изучению поверхности, которая нуждается в ремонте, следует подготовить:
- Дрель.
- Шлифовальную машину.
- Мелкий напильник или надфиль.
Вдео о том, как различать металлы
Порядок определения
- В первую очередь необходимо найти на поверхности детали такое место, которое не бросается в глаза и несколько раз пройтись по нему мелким напильником или надфилем. В результате этого на поверхности металла (или чугуна) образуются мелкие опилки. Их следует взять и растереть между пальцами. Если вы имеете дело с чугуном, то пальцы окрасятся в характерный черный графитовый цвет. Для большей наглядности можно взять немного опилок и поместить их между двумя листами бумаги белого цвета и слегка потереть листы друг о друга. Если вы имеете дело со сталью, то бумага останется чистой.
- Также можно определить, сталь перед вами или чугун при помощи шлифовальной машины. Для этого следует заранее подготовить две детали, состав которых вам точно известен, из стали и чугуна. Теперь нужно включить шлифмашину и пустить с них поочерёдно искры. Сравнив форму и цвет образовавшихся искорок, требуется проделать то же самое и с деталью, состав которой необходимо определить. Вывод можно сделать, опираясь на наибольшую аналогию с образцами.
- Искры, которые возникают в процессе шлифования стали, будут лететь по касательной вдоль окружности шлифовального круга. Если в металле содержится углерод, то есть вы имеете дело с чугуном, то, частицы, раскалившиеся в процессе шлифования, отлетая в воздух и соприкасаясь с ним, будут окисляться – таким образом, углерод переходит в углекислоту. Следует также обратить внимание, что при контакте шлифовального круга с чугунной поверхностью всегда образуется очень много довольно коротких по длине искорок. Кроме того, искры, образующиеся при шлифовании чугуна, имеют яркий соломенный цвет.
- Для определения следующим способом нужно взять дрель и вставить в неё сверло с маленьким диаметром. Следует найти на детали незаметное место, включить дрель и немного засверлить. Поскольку в сверлении деталей из чугуна есть значительные отличия от сверления стальных деталей, то рекомендуется взять две детали из стали и чугуна и попробовать их посверлить. В процессе сверления чугуна практически не образуются стружки. А если они и образовались, то будут иметь очень маленькие размеры, а при растирании их между пальцами чугунные стружки легко превращаются в труху. Стружки же из стали отличаются завитой формой и напоминают проволоку. Кроме того, стальную стружку довольно сложно сломать пальцами.
- Таким же способом можно использовать и токарный станок — чугунные стружки будут иметь вид грубой пыли.
А Вы умеете отличать металл от неметалла? Расскажите, как Вы это делаете в комментариях.
www.rutvet.ru
Учебник по химии - Неметаллы
Неметаллы– это химические элементы, которые образуют в свободном состоянии простые вещества, не обладающие физическими и химическими свойствам металлов. Это 22 элемента Переодической системы: бор B, углерод C, кремний Si, азот N, фосфор P, мышьяк As, кислород O, сера S, селен Se, теллур Te, водород H, фтор F, хлор Cl, бром Br, йод I, астат At; а так же благородные газы: гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn. Физические свойства Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: газы (благородные газы:He, Ne, Ar, Kr, Xe, Rn;водород h3, кислород O2, азот N2, фтор F2, хлор Cl2.), жидкость (бром Br2) , твердые вещества( йод I2, углерод C, кремний Si, сера S, фосфор P и др.). Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью. Химические свойства 1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3
2. Неметаллы играют роль окислителя при взаимодействии с водородом
h3 + F2 = 2HF
3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО
2P + 5S = P2S5
4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
Ch5 + 2O2 = CO2 + 2h3O
5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3 6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5
7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
8. Наиболее сильные восстановительные свойства имеют углерод и водород
ZnO + C = Zn + CO;
CuO + h3 = Cu + h3O 9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования)
Cl2 + h3O =HCl + HClO
chemica-book.ucoz.ru


















