Формула гидроксида. Формула гидроксида аргона
Формула гидроксида в химии
Определение и формула гидроксида
Основная классификация гидроксидов основывается на их природе. Различают основные, амфотерные и кислотные гидроксиды.
Основные гидроксиды (основания, щелочи)
К ним относятся соединения металлов общей формулы 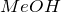 или
или 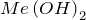 , а также раствор аммиака в воде (гидроксид аммония
, а также раствор аммиака в воде (гидроксид аммония 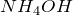 ). В данных веществах металл принимает степень окисления или
). В данных веществах металл принимает степень окисления или 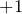
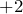 .
. Примеры: 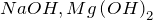
Щелочами называют гидроксиды щелочных и щелочно-земельных металлов, которые в воде они диссоциируют нацело, т.е. являются сильными электролитами.
Они проявляют типичные основные свойства реагируя с кислотными оксидами, кислотами, амфотерными соединениями (при сплавлении fus. и в растворе sol.), растворимыми солями:
![Rendered by QuickLaTeX.com \[ 2CsOH + CO_2 = Cs_2CO_3 + H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-cc0221b3349a01516e6072897687d0a6_l3.png)
![Rendered by QuickLaTeX.com \[ 2NaOH + H_2SO_4 = Na_2SO_4 + 2H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-847d8c70200605d974adee04d43eed5b_l3.png)
![Rendered by QuickLaTeX.com \[ 2KOH + ZnO \overset{fus.}{\rightarrow} K_2ZnO_2 + H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7c34fa40be3753078af4663cd3363442_l3.png)
![Rendered by QuickLaTeX.com \[ 2KOH + ZnO + H_2O \overset{sol.}{\rightarrow} K_2[Zn(OH)_4] \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d29fad1c231b9fa1e9afd347301d857a_l3.png)
![Rendered by QuickLaTeX.com \[ 3NaOH + FeCl_3 = Fe(OH)_3 + 3NaCl \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0cab876fca1dc6d93094e89351ce85e7_l3.png)
Остальные основные гидроксиды обладают практически такими же химическими свойствами, но они как правило нерастворимы в воде и не взаимодействуют с амфотерными соединениями.
Амфотерные гидроксиды
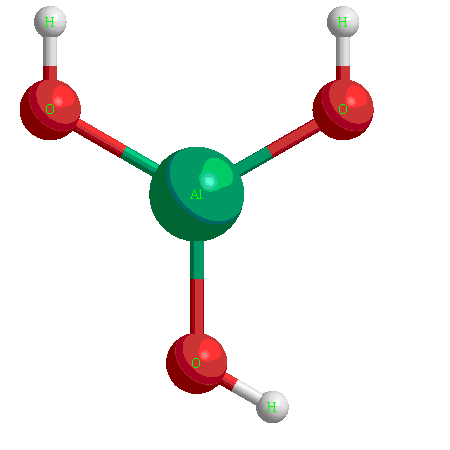
Это гидроксиды металлов со степенью окисления 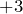
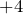 . Есть исключения (например,
. Есть исключения (например, 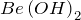 ), в которых металл проявляет степень окисления
), в которых металл проявляет степень окисления 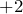 .
. Примеры: 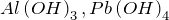 .
.
В зависимости от условий амфотерные вещества могут проявлять или основные или кислотные свойства.
Они представляют собой твёрдые вещества, которые не растворяются в воде, и так правило являются слабыми электролитами.
При воздействии температуры происходит разложение соединения с образованием амфотерного оксида, например:
![Rendered by QuickLaTeX.com \[ Fe\left(OH\right)_2\overset{t}{\rightarrow}FeO+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a38c6f8198772c7d3e873894f4b9012a_l3.png)
При взаимодействии с кислотами образуются соли:
![Rendered by QuickLaTeX.com \[ 2Al\left(OH\right)_3+6HCl\rightarrow 2AlCl_3+3H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a1ffbafbe1c0a23a28b315731a4810d8_l3.png)
Пример реакции с сильным основанием в зависимости от условий проведения реакции рассмотрен выше.
Кислотные гидроксиды (кислородсодержащие кислоты)
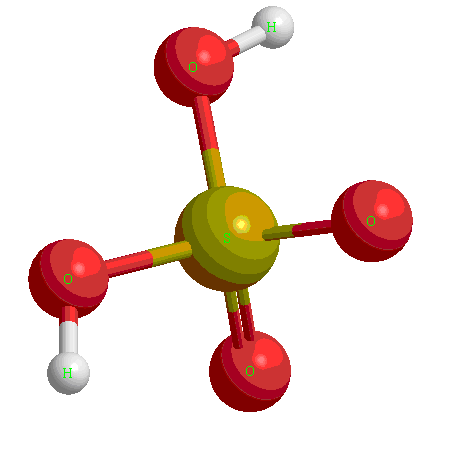
Это как правило гидроксиды неметаллов, имеющих степень окисления 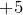 ,
, 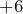
Примеры: 
Большая часть неорганических кислот при обычных условиях находятся в жидком состоянии, некоторые – в твёрдом состоянии (ортофосфорная), а некоторые нельзя выделить в виде индивидуальных соединений.
Кислоты реагируют с основаниями, основными оксидами и металлами с образованием солей:
![Rendered by QuickLaTeX.com \[ H_2SO_4+2RbOH\rightarrow Rb_2SO_4+2H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-be2a894cf0391f6b06b76294bdee630a_l3.png)
![Rendered by QuickLaTeX.com \[ 2HCl+MgO\rightarrow MgCl_2+H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1bef462ecaa1ffef1961a47c2266bfa3_l3.png)
![Rendered by QuickLaTeX.com \[ 6HCl+2Al\rightarrow 2AlCl_3+3H_2\uparrow \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a4472def4cc52b90164c2c239262567c_l3.png)
Примеры решения задач
ru.solverbook.com
ответы2
2. Исходя из положения германия, молибдена и рения в периодической системе составьте формулы следующих соединений: водородного соединения германия, рениевой кислоты и оксида молибдена, отвечающего его высшей степени окисления. Изобразите графически формулы этих соединений.
3. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающие их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия. Na2O - NaOH - оксид и гидроксид натрия MgO - Mg(OH)2 - оксид и гидроксид магния Al2O3 - Al(OH)3 - оксид и гидроксид алюминия (амфотерные) SiO2 - h3SiO3 - оксид кремния (4) и метакремниевая кислота P2O5 - h4PO4 - оксид фосфора (5) и ортофосфорная кислота SO3 - h3SO4 - оксид серы (6) и серная кислота Cl2O7 - HClO4 - оксид хлора (7) и хлорная кислота При переходе от натрия к хлору основные свойства этих соединений ослабляются, а кислотные - усиливаются: гидроксид натрия - щелочь, гидроксид магния - слабое основание, гидроксид алюминия - амфотерен, гидроксид кремния (4) - слабая кислота, гидроксид фосфора (5) - кислота средней силы, гидроксиды серы (6) и хлора (7) - сильные кислоты. Доказательство амфотерности гидроксида алюминия: 1. Взаимодействие с кислотами (основные свойства) Al(OH)3 + 3HNO3 = Al(NO3)3 + 3h3O 2. Взаимодействие со щелочами (кислотные свойства) Al(OH)3 + NaOH + 2h3O = Na[Al(OH)4(Н2О)2] Al(OH)3 + 3KOH = K3[Al(OH)6] (в растворе)
оксиды и гидроксиды: Na2O, NaOH, MgO,Mg(OH)2, Al2O3, Al(OH)3, SiO2, h3SiO3, P2O5, h4PO4, SO3, h3SO4, Cl2O7, HClO4. уравнения реакций, доказывающиe амфотерность гидроксида алюминия: Al(OH)3 + NaOH = NaAlO2 + 2h3O кислотный характер Al(OH)3+3HCl=AlCL3+3h3O основный характер
4. Какой из элементов четвертого периода – ванадий или мышьяк – обладает более выраженными металлическими свойствами? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте, исходя из строения атомов данных элементов?
Ванадий расположен в побочной подгр. (в поб. подгр. располагаются только металлы),на внешнем, четвертом уровне 2 электрона - т.е. это металл. У мышьяка (элемент главной подгруппы) на внешнем, четвертом уровне 5 электронов => это неметалл.
Марганец образует соединения, в которых он проявляет степень окисления +2,+3,+4,+6,+7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида марганца (IV).
Марганец образует соединения, в которых он проявляет степень окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидрооксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидрооксида марганца (IV).
Оксид марганца (II) MnO , Ему соответствует гидроксид марганца (II), Mn(ОН)2
Оксид марганца (III) Mn2O3 , Mn(ОН)3 - гидроксид марганца (III),
MnO2 – оксид марганца(IV)
Гидроксид марганца (IV) неустойчив, его формула может быть представлена в двух видах: Mn(ОН)4 и Н4MnO4 ортомарганцоватистая и Н2MnO3 метамарганцоватистая кислота. Также, как и оксид марганца (IV), гидроксид марганца (IV) амфотерен.
h5MnO4 + 4KOH = K4MnO4 + 4h3O Вз-вие с щелочами
Mn(ОН)4 + 4HCl = MnCl4 + 4h3O Вз-вие с кислотами
MnO3 – оксид марганца(VI), ему соответствует h3MnO4 – марганцоватая кислота
Mn2O7 – оксид марганца(VII), ему соответствует HMnO4 – марганцовая кислота
6 . У какого элемента четвертого периода – хрома или селена – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Ответ мотивируйте строением атомов хрома и селена
На внешнем энергетическом уровне у атома хрома один электрон (3d54s1), а у селена – шесть (4s24p4). Атомы типичных металлов характеризуются наличием небольшого числа электронов на внешнем энергетическом уровне, а следовательно, тенденцией терять эти электроны. Они обладают только восстановительными свойствами и не образуют элементарных отрицательных ионов. Элементы, атомы которых на внешнем уровне содержат более трех электронов, обладают определенным сродством к электрону, а следовательно, приобретают отрицательную степень окисления и даже образуют отрицательные ионы. Таким образом, хром, как и все металлы, обладает только восстановительными свойствами, тогда как для селена, проявляющего слабые восстановительные свойства, более свойственны окислительные. Общей закономерностью для всех групп, содержащих p- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у хрома выражены сильнее, чем у селена. Селен относится к p-элементам поэтому с водородом он образует соединение с ковалентно-полярной связью (h5Se) такая связь практически всегда образует молекулярную кристаллическую решетку (связи в молекулах прочные, но между молекулами связи очень слабые), поэтому селен способен образовывать газообразное соединение с водородом.
. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
Неметаллы (грубо говоря) проявляют низшую степень оксиления в соединениях с металлами. Чтобы узнать, какая низшая степень окисления у этих атомов, нужно вычесть номер их группы из 8 (8 - х). Это происходит по теории квантовых чисел и внутриатомных энергий, но просче говоря потому, что неметалл, при соединение с металлом, всегда остается в обычном состоянии - не возбужденном - и принимает электроны металлов, т.к. они - металлы - могут только отдавать электроны (все типичные металлы - только востановители). Тогда, исходя из этого: Cl: -1 (это вообще галоген), S: -2, N: -3, C: -2 (вот тут нужно знать, т.к. правило 8 - х, на самом деле, глупо, и далеко не всегда работает). Вот почему у углерода -2: 6C: 1s2 2s2 2p2 У него на внешнем элк. уровне всего 2 неспаренных электрона. 1) AlCl3 - хлорид алюминия 2) Al2S3 - сульфид алюминия 3) AlN - нитрид алюминия 4) Al2C3 - карбид алюминия
. У какого из p-элементов пятой группы периодической системы – фосфора или сурьмы – сильнее выражены неметаллические свойства? Какое из водородных соединений данных элементов более сильный восстановитель? Ответ мотивируйте строением атома этих элементов.
Неметаллические свойства сильнее всего выражены у фосфора по сравнению с сурьмой, потому что радиус атома фосфора намного меньше радиуса атома сурьмы (у фосфора валентные электроны находятся на 3-м энергетическом уровне, а у сурьмы на 5-ом), поэтому атому фосфора легче притянуть нужные ему электроны, чем атому сурьмы. Так, у фосфора есть водородное соединение фосфин Ph4 - очень сильный восстановитель (фосфор в фосфине может отдать 8 электронов). У сурьмы тоже есть газообразное водородное соединение - сурьмянистый водород Sbh4, которое очень слабо проявляет восстановительные свойства (степень окисления сурьмы +3, и сурьма в этом соединении может отдать только 2 электрона). Оба химических элемента имеют максимальную степень окисления +5. Если посмотреть на таблицу относительных электроотрицательностей элементов, то мы увидим, что у P она 2,11, у H она 2,1, а у Sb она 1,82. Это доказывает, что Sb в Sbh4 имеет положительную степень окисления.
10. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: Fe(OH)2 или Fe(OH)3; Sn(OH)2 или Sn(OH)4? Напишите уравнения реакций, доказывающих амфотерность гидроксида олова (II).
Чем ниже степень окисления металла, тем более сильные основные свойства проявляет его гидроксид. Связано это с тем, что чем больше гидроксогрупп присоединено к металлу, тем менее полярной оказывается связь металл-кислород, а значит более полярной связь кислород-водород.
11, Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
ответ
Атом водорода имеет единственный валентный электрон. Поэтому низшая степень окисления водорода будет равна -1. Cah3 - гидрид кальция. Атом фтора имеет семь валентных электронов, до завершения энергетического уровня недостает одного электрона. Поэтому низшая (и единственная) степень окисления фтора -1. CaF2 - фторид кальция. Атом серы имеет шесть валентных электронов, до завершения энергетического уровня не достает двух электронов. Поэтому низшая степень окисления серы равна -2. CaS - сульфид кальция. Атом азота имеет пять валентных электронов, до завершения энергетического уроня не достает трех электронов. Поэтому низшая степень окисления азота равна -3. CaN2 - нитрид кальция.
12, Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Высшую степень окисления элемента определяет номер группы периодической системы Д.М. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6). Элемент Степень окисления Примеры соединений высшая низшая Si +4 -4 Na2SiO3, Sih5 As +5 -3 h4AsO4, h4As Se +6 -2 SeO3, Na2Se Cl +7 -1 KClO4, KBr
13, хром образует соединения, в которых он проявляет степени окисления +2,+3,+6. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. Напишите уравнения реакций, доказывающих амфотерность гидроксида хрома (III). Очень просто: оксид хрома (II) - CrO, (III) - Cr2O3, (VI) - CrO3. Гидроксиды - Cr(OH)2 (основные свойства), Cr(OH)3 (амфотерные свойства), Cr(OH)6 (кислотные свойства). Свойства, так же, как и окислительно-восстановительные, обусловлены степенью окисления. Все гидроксиды нерастворимые. Амфотерность: Cr(OH)3 + 3HCl -> CrCl3 + 3h3O Cr(OH)3 + 3NaOH -> Na3[Cr(OH)6]
14, Какова современная формулировка периодического закона. Объясните, почему в периодической системе элементов аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием, хотя и имеют большую атомную массу?
Современная формулировка периодического закона такова: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер атомов элементов». Аргон, кобальт, теллур и торий помещены соответственно перед калием, никелем, йодом и протактинием потому, что положение в таблице не зависит от атомной массы, а определяется количеством протонов в ядре и электронов в оболочке
15, Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления.
Высшую степень окисления элемента определяет номер группы периодической системы Д.М. Менделеева, в которой он находится. Низшая степень окисления определяется тем условным зарядом, который приобретает атом при присоединении того количества электронов, которое необходимо для образования устойчивой восьмиэлектронной оболочки (ns2np6).
| Элемент | Степень окисления | Примеры соединений | |||
| высшая | низшая | ||||
| C | +4 | -4 | Na2CO3, Ch5 | ||
| P | +5 | -3 | h4PO4, h4P | ||
| S | +6 | -2 | SO3, Na2S | ||
| I | +7 | -1 | KIO4, KI | ||
| 16, Атомы каких элементов четвертого периода периодической системы образуют оксид, отвечающий их высшей степени окисления Э2О5 ? Какой из них образует газообразное соединение с водородом? Составьте формулы кислот, отвечающих их оксидам, и изобразите их графически.
| |||||
studfiles.net
Цены и новости на рынке химии
Новости и события
получать высшее образование, буду подавать заявления в казанские и, возможно, московские вузы», – рассказал студент пятого курса направления «Автоматизация технологических процессов и производств» Ильяс Хамраев. Казанский нефтехимический...
можно было обойтись двадцатью формулами, то сегодня этих формул более трехсот», — говорит директор завода Total Питер ван Йонге. Выше уже говорилось о том, что в лабораториях ANAC не просто анализируется состояние смазочных...
время предприятием «Пигмент» будут представлены новые продукты, которые востребованы в сегменте ЛКМ. В этом году тамбовская компания планирует вывести на рынок стиролакриловую дисперсию для покрытий по металлу. Это новая формула ранее...
Высший административный суд немецкого Грайфсвальда отклонил иск Союза защиты природы, требующий запретить строительство газопровода «Северный поток – 2» в территориальных водах ФРГ. Соответствующее распоряжение распространила в пятницу...
Инвестиции в комплекс оцениваются на уровне $725 млн. Это лишь один из проектов компании в Ла Порте. Также LBI работает над проектом по производству оксида пропилена, который в частности применяется для получения полиуретанов. На...
определяет меры по предотвращению загрязнения воздушной среды, в частности оксидами серы, азота, органическими соединениями. Для постепенного снижения выбросов организацией были выбраны зоны контроля (Emission Control...
Информация
За ними – будущее нефтехимииЛаборатория масел Total ANAC: как сохранить или увеличить ресурс двигателей и трансмиссийТамбовский «Пигмент» расширил ассортимент производства акриловых дисперсий
За ними – будущее нефтехимииЛаборатория масел Total ANAC: как сохранить или увеличить ресурс двигателей и трансмиссийТамбовский «Пигмент» расширил ассортимент производства акриловых дисперсий
Каталог организаций и предприятий
Производство и реализация технических газов. Аргон жидкий. Высший сорт ГОСТ 10157-79. Аргон газообразный. Высший сорт ГОСТ 10157-79. Аргон ОЧ не менее по ТУ. Смесь газов Ацетилен. Гелий. Углекислота. Водород. Реализация криогенного...
...
...
...
оказываем помощь на Кустанайской бирже, обеспечим Вас различными видами удобрений...
Производство, реализация оксид железа, оксид кремния, оксид магния, оксид алюминия, окись магния, окись железа, окись кремния, окись алюминия, оксид хрома, окись хрома модифицированная оксидом железа, диоксид кремния, двуокись кремния, диоксид марганца...
Предложения на покупку и продажу продукции
Трансформаторные масла ГК (РосНефть) и ВГ (Лукойл) в Рязани ООО ТФК «Комтекс» Рязань т. +7 (915) 612-37-79, www.aksioma55.ru Масло трансформаторное РосНефть ГК (175кг) Масло трансформаторное Лукойл В...
DEF Blue / AdBlue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www.aksioma55.ru AUS 32 (Aqueous Urea Solution, 32.5%) - водный раствор мочевины, 32.5%. Продукт представляет собой раствор моче...
DEF Blue / AdBlue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www.aksioma55.ru AUS 32 (Aqueous Urea Solution, 32.5%) - водный раствор мочевины, 32.5%. Продукт представляет собой раствор моче...
AdBlue/DEF Blue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www. aksioma55. ru AUS 32 (Aqueous Urea Solution, 32. 5%) - водный раствор мочевины, 32. 5%. Продукт представляет собой раствор...
DEF Blue / AdBlue жидкость для системы SCR 20л т. +7 (915) 612-37-79, www.aksioma55.ru AUS 32 (Aqueous Urea Solution, 32.5%) - водный раствор мочевины, 32.5%. Продукт представляет собой раствор моче...
В продаже имеется хим.сырье: Серебряная жидкость ртути 99.999 %, Диметиламино хлорпропан, Красная ртуть rm-20 20, Многофункциональный катализатор, compound-20 20, sb2o7hg2, Оксид ртути ii красная и же...
www.himonline.ru



















