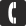Электронная конфигурация атома. Конфигурация аргона
Аргон и его характеристики
Общая характеристика аргона
Самый распространенный в природе элемент VIIIA-группы. Содержание аргона в воздухе 0,932% (об.), 1,28% (масс).
Представляет собой бесцветный газ. Плохо растворяется в воде (растворимость понижается в присутствии сильных электролитов), лучше — в органических растворителях. Образует клатрат состава 8Ar×46Н2О. Не реагирует со всеми другими веществами (простыми и сложными).
Атомная и молекулярная масса аргона
Поскольку в свободном состоянии аргон существует в виде одноатомных молекул Ar, значения его атомной и молекулярной масс совпадают. Они равны 39,948.
Изотопы аргона
Известно, что в природе аргон может находиться в виде трех стабильных изотопов 36Ar (0,337%), 38Ar (0,063%) и 40Ar (99,6%). Их массовые числа равны 36, 38 и 40 соответственно. Ядро атома изотопа аргона 36Ar содержит восемнадцать протонов и восемнадцать нейтронов, а изотопов 38Ar и 40Ar– такое же количество протонов, двадцать и двадцать два нейтронов/а соответственно.
Существуют искусственные изотопы аргона с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 39Ar с периодом полураспада равным 269 лет.
Ионы аргона
Как гелий и неон при сильном возбуждении атомов аргон образует молекулярные ионы типа Ar2+.
Молекула и атом аргона
В свободном состоянии аргон существует в виде одноатомных молекул Ar.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Электронная конфигурация атома - Электронный учебник K-tree
Электронная конфигурация атома - это формула, показывающая расположение электронов в атоме по уровням и подуровням. После изучения статьи Вы узнаете, где и как располагаются электроны, познакомитесь с квантовыми числами и сможете построить электронную конфигурацию атома по его номеру, в конце статьи приведена таблица элементов.
Сколько электронов в атоме?
Атом состоит из ядра и вращающихся вокруг него электронов, ядро состоит из протонов и нейтронов. В нейтральном состоянии у каждого атома количество электронов равно количеству протонов в его ядре. Количество протонов обозначили порядковым номером элемента, например, сера, имеет 16 протонов - 16й элемент периодической системы. Золото имеет 79 протонов - 79й элемент таблицы Менделеева. Соответственно, в сере в нейтральном состоянии 16 электронов, а в золоте 79 электронов.
Где искать электрон?
Наблюдая поведение электрона были выведены определённые закономерности, они описываются квантовыми числами, всего их четыре:
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Далее, вместо слова орбита, мы будем использовать термин "орбиталь", орбиталь - это волновая функция электрона, грубо - это область, в которой электрон проводит 90% времени. N - уровень L - оболочка Ml - номер орбитали Ms - первый или второй электрон на орбитали
Орбитальное квантовое число l
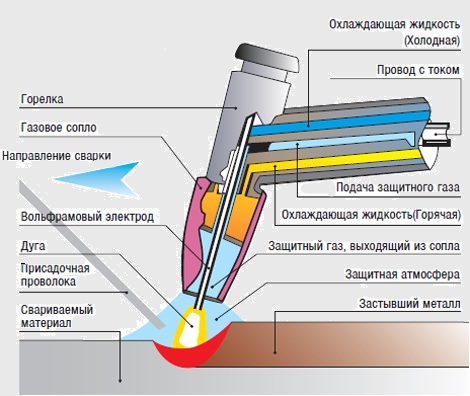
В результате исследования электронного облака, обнаружили, что в зависимости от уровня энергии, облако принимает четыре основных формы: шар, гантели и другие две, более сложные. В порядке возрастания энергии, эти формы называются s-,p-,d- и f-оболочкой. На каждой из таких оболочек может располагаться 1 (на s), 3 (на p), 5 (на d) и 7 (на f) орбиталей. Орбитальное квантовое число - это оболочка, на которой находятся орбитали. Орбитальное квантовое число для s,p,d и f-орбиталей соответственно принимает значения 0,1,2 или 3.
 На s-оболочке одна орбиталь (L=0) - два электрона На p-оболочке три орбитали (L=1) - шесть электронов На d-оболочке пять орбиталей (L=2) - десять электронов На f-оболочке семь орбиталей (L=3) - четырнадцать электронов
На s-оболочке одна орбиталь (L=0) - два электрона На p-оболочке три орбитали (L=1) - шесть электронов На d-оболочке пять орбиталей (L=2) - десять электронов На f-оболочке семь орбиталей (L=3) - четырнадцать электронов Магнитное квантовое число ml
На p-оболочке находится три орбитали, они обозначаются цифрами от -L, до +L, то есть, для p-оболочки (L=1) существуют орбитали "-1", "0" и "1". Магнитное квантовое число обозначается буквой ml.
Внутри оболочки электронам легче располагаться на разных орбиталях, поэтому первые электроны заполняют по одному на каждую орбиталь, а затем уже к каждому присоединяется его пара.
Рассмотрим d-оболочку: d-оболочке соответствует значение L=2, то есть пять орбиталей (-2,-1,0,1 и 2), первые пять электронов заполняют оболочку принимая значения Ml=-2,Ml=-1,Ml=0, Ml=1,Ml=2.Спиновое квантовое число ms
Спин - это направление вращения электрона вокруг своей оси, направлений два, поэтому спиновое квантовое число имеет два значения: +1/2 и -1/2. На одном энергетическом подуровне могут находиться два электрона только с противоположными спинами. Спиновое квантовое число обозначается ms
Главное квантовое число n
Главное квантовое число - это уровень энергии, на данный момент известны семь энергетических уровней, каждый обозначается арабской цифрой: 1,2,3,...7. Количество оболочек на каждом уровне равно номеру уровня: на первом уровне одна оболочка, на втором две и т.д.
Номер электрона
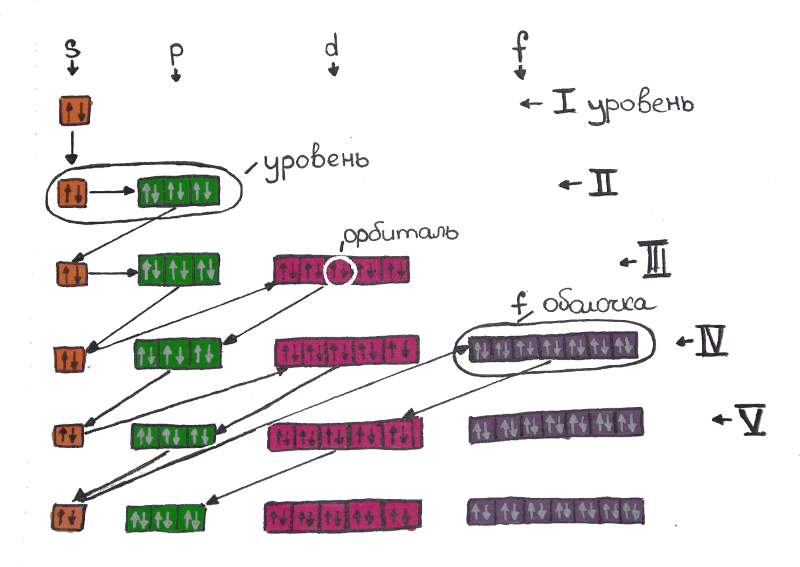
Итак, любой электрон можно описать четырьмя квантовыми числами, комбинация из этих чисел уникальна для каждой позиции электрона, возьмём первый электрон, самый низкий энергетический уровень это N=1, на первом уровне распологается одна оболочка, первая оболочка на любом уровне имеет форму шара (s-оболочка), т.е. L=0, магнитное квантовое число может принять только одно значение, Ml=0 и спин будет равен +1/2. Если мы возьмём пятый электрон (в каком бы атоме он не был), то главные квантовые числа для него будут: N=2, L=1, M=-1, спин 1/2.
Энергетические уровни с подуровнями для наглядности изображены ниже, сверху вниз расположены уровни и цветом разделены подуровни:
| Таблица 1. Распределение электронов по энергетическим уровням | |||||||||||||||||||
Здесь, сверху-вниз показаны энергетические уровни (1-7), слева-направо разделены по группам электронные подуровни (s,p,d,f), в каждой ячейке располагаются по два электрона в противоположных направлениях. Общий принцип распределения электронов такой, что энергетические подуровни заполняются в порядке суммы главного и орбитального квантовых чисел, то есть: 1S, 2S, 2P, 3S, 3P, 4S, 3D и так далее, если сумма одинакова, то сначала заполняется уровень с меньшим главным квантовым числом N.
У некоторых элементов имеются отклонения в формировании электронной конфигурации, а именно у 24Cr, 29Cu, 41Nb, 42Mo, 44Ru, 45Rh, 46Pd, 47Ag, 78Pt, 79Au
Проверьте себя, составьте электронную конфигурацию для элементов #3, #9 и #16, затем проверьте себя по таблице ниже.
| 1 | H | водород | 1s 1 | 1 |
| 2 | He | гелий | 1s 2 | 1 |
| 3 | Li | литий | 1s 22s 1 | 2 |
| 4 | Be | бериллий | 1s 22s 2 | 2 |
| 5 | B | бор | 1s 22s 22p 1 | 2 |
| 6 | C | углерод | 1s 22s 22p 2 | 2 |
| 7 | N | азот | 1s 22s 22p 3 | 2 |
| 8 | O | кислород | 1s 22s 22p 4 | 2 |
| 9 | F | фтор | 1s 22s 22p 5 | 2 |
| 10 | Ne | неон | 1s 22s 22p 6 | 2 |
| 11 | Na | натрий | 1s 22s 22p 63s 1 | 3 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 | 3 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 | 3 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 | 3 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 | 3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 | 3 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 | 3 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 | 3 |
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 | 4 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 | 4 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 | 4 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 | 4 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 | 4 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 | 4 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 | 4 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 | 4 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 | 4 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 | 4 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 | 4 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 | 4 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 | 4 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 | 4 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 | 4 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 | 4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 | 4 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 | 4 |
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 | 5 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 | 5 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 | 5 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 | 5 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 | 5 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 | 5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 | 5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 | 5 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 | 5 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p64d10 | 5 |
| 47 | Ag | 1s 22s 22p 63s 23p64s 23d104p65s14d10 | 5 | |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 | 5 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 | 5 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 | 5 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s24d105p3 | 5 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 | 5 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 | 5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 | 5 |
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 | 6 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 | 6 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 | 6 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 | 6 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 | 6 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 | 6 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 | 6 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 | 6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 | 6 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 | 6 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 | 6 |
| 66 | Dy | диспрозий | 6 | |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 | 6 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 | 6 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 | 6 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 | 6 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 | 6 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 | 6 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 | 6 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 | 6 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 | 6 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 | 6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 | 6 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 | 6 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 | 6 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 | 6 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 | 6 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 | 6 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 | 6 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 | 6 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 | 6 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 | 6 |
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 | 7 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 | 7 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 | 7 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 | 7 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 | 7 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 | 7 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 | 7 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 | 7 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 | 7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 | 7 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 | 7 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 | 7 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 | 7 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 | 7 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 | 7 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 | 7 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 | 7 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 | 7 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 | 7 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 | 7 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 | 7 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 | 7 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 | 7 |
| 110 | Ds | дармштадтий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d8 | 7 |
| 111 | Rg | рентгений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d9 | 7 |
| 112 | Cn | коперниций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d10 | 7 |
| 113 | Nh | нихоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p1 | 7 |
| 114 | Fl | флеровий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p2 | 7 |
| 115 | Mс | московий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p3 | 7 |
| 116 | Lv | ливерморий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p4 | 7 |
| 117 | Ts | теннесcин | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p5 | 7 |
| 118 | Og | оганесон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d107p6 | 7 |
| Таблица 2. Электронная конфигурация атомов | ||||
Если Вы хотите узнать, как составить электронную конфигурацию, обратитесь к статье «как написать электронную конфигурацию»
Квантовые числа электронов в атомах- Электронная конфигурация атомов
- Построение электронной конфигурации
→ Тесты по химии 8 класс
k-tree.ru
Аргон - Госстандарт
Аргон (лат. Argon), Ar, химический элемент VIII группы периодической системы, атомный номер 18, атомная масса 39,948, относится к инертным, или благородным, газам. Природный аргон состоит из трех стабильных нуклидов: 36Ar (0,337%), 38Ar (0,063%) и 40Ar (99,600%).
Радиус нейтрального атома аргона 0,192 нм. Электронная конфигурация нейтрального невозбужденного атома 1s22s2p63s2p6. Энергии последовательной ионизации нейтрального атома равны, соответственно, 15,759; 27,63; 40,91; 59,8 и 75 эВ. Простое вещество аргон — газ без запаха, цвета и вкуса. От греческого "argos" (недеятельный).
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) –185,9°C (немного ниже, чем у кислорода, но немного выше, чем у азота), температура плавления –189,3°C. Критическая температура –122,43°C, критическое давление 4,86 МПа. Плотность при нормальных условиях 1,7839 кг/м3.
В 100 мл воды при 20°C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Как уже говорилось, химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристалической решетке молекулами вещества-хозяина.
История открытия
К открытию аргона привело обнаруженное в 1892 году английским физиком Дж. Рэлеем небольшое (всего на 0,13%) превышение плотности азота (N), выделяемого из воздуха, над плотностью «химического» азота, возникающего при термическом разложении нитрита аммония Nh5NO2.
Вместе с другим английским физиком У. Рамзаем Дж. Рэлей в 1894 году выделил из воздуха примесь более тяжелого (по сравнению с азотом) газа, который отличался одноатомным составом молекул и практически полной химической недеятельностью (аргон не вступает ни в какие химические реакции). Именно из-за своей удивительной химической инертности новый газ и получил свое название (греч. аrgos — неактивный).
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот.
Нахождение в природе
Аргон распространен в природе только в свободном виде. В земной коре его содержание составляет 1,2·10–4 %, в морской воде — 0,45·10–4 %. В атмосферном воздухе содержится 0,93% аргона по объему (9,34 л в 1м3). Это значительно больше, чем содержание в воздухе всех остальных инертных газов вместе взятых. Воздух служит неиссякаемым источником для получения аргона.
Обращает на себя внимание преобладание в смеси природных нуклидов аргона самого тяжелого — аргона-40. Это связано с тем, что 40Ar постоянно образуется за счет распада радиоактивного калия-40. В 1 т калия (K) за год при радиоактивном распаде калия-40 путем захвата орбитального электрона (так называемый электронный захват, или К-захват; на этот тип радиоактивного распада калия-40 приходится 12% от всех актов распада этого природного радионуклида) образуется всего около 3100 атомов аргона-40. Но калий (K) — один из самых распространенных на Земле элементов, да и время, прошедшее за долгую историю Земли, исчисляется миллиардами лет. Поэтому 40Ar накопился в земной атмосфере в значительных количествах.
Преобладание тяжелого аргона-40 в природной смеси изотопов этого элемента приводит к тому, что атомная масса элемента аргона оказывается немного выше, чем следующего за ним в периодической системе элемента калия (K). Однако, когда Менделеев создавал свою знаменитую таблицу, проблема, как разместить калий (K)и аргон, у него не возникала, так как аргон был открыт спустя почти 30 лет после открытия периодического закона, и в таблицу (в группу, которой тогда присвоили номер ноль) попал только в начале 20-го века. В настоящее время аргон, как и другие инертные газы, включают в восьмую группу периодической системы элементов.
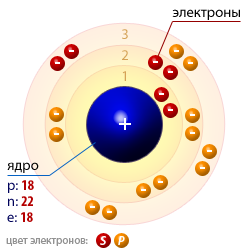
Применение
Аргон широко используют для создания инертной и защитной атмосферы, прежде всего при термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка и другие). В атмосфере аргона получают кристаллы полупроводников и многие другие сверхчистые материалы. Аргоном часто заполняют электрические лампочки (для замедления испарения вольфрама (W) со спирали). При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение, что широко используется, например, в светящейся рекламе. В геохронологии по оределению соотношения изотопов 40Ar/40К устанавливают возраст минераллов.
himiya.gosstandart.info
Аргон
| Атомный номер | 18 |
| Внешний вид простого вещества | инертный газ без цвета, вкуса и запаха |
| Атомная масса(молярная масса) | 39,948 а. е. м. (г/моль) |
| Радиус атома | ? (71)[1]пм |
| Энергия ионизации(первый электрон) | 1519,6(15,75) кДж/моль (эВ) |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Ковалентный радиус | 106[1]пм |
| Радиус иона | 154[1]пм |
| Электроотрицательность(по Полингу) | 0,0 |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Плотность | (при -186 °C) 1,40 г/см³ |
| Молярная теплоёмкость | 20,79[2]Дж/(K·моль) |
| Теплопроводность | 0,0177 Вт/(м·K) |
| Температура плавления | 83,8 K |
| Теплота плавления | n/a кДж/моль |
| Температура кипения | 87,3 K |
| Теплота испарения | 6,52 кДж/моль |
| Молярный объём | 24,2 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 Å |
| Отношение c/a | — |
| Температура Дебая | 85 K |
| Ar | 18 |
| 39,948 | |
| [Ne]3s23p6 | |
| Аргон | |
Арго́н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440–37–1) — инертный одноатомный газ без цвета, вкуса и запаха.
История
Схема атома аргонаИстория открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. С помощью электрофорной машины в течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространнённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от греч. αργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность.
Распространённость
Во Вселенной
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе.
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе[4][7], его запасы в атмосфере оцениваются в 4·1014 т[2][4]. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере — 4·10-6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10-5 — 9,7·10-5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т.
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, h3, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы
Аргон представлен в земной атмосфере тремя стабильными изотопами: 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %). Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9°C аргон конденсируется, при −189,4°С — кристаллизуется.
Применение
Заполненная аргоном и парами ртути газоразрядная трубкаНиже перечислены области применения аргона:
в аргоновых лазерахв лампах накаливания и при заполнении внутреннего пространства стеклопакетовв качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметалловв качестве плазмаобразователя в плазматронах при сварке и резкев пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газав качестве огнетушащего вещества в газовых установках пожаротушения
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа..
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
www.himsnab-spb.ru
Свойства атома Аргона | |
| Название | Аргон / Argon |
| Символ | Ar |
| Номер | 18 |
| Атомная масса (молярная масса) | 39,948 (1) а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p6 |
| Радиус атома | ? (71) пм |
Химические свойства Аргона | |
| Ковалентный радиус | 106 пм |
| Радиус иона | 154 пм |
| Электроотрицательность | 4,3 (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 0 |
| Энергия ионизации (первый электрон) | 1519,6 (15,76) кДж/моль (эВ) |
Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 1,784·10−3 г/см3 |
| Плотность при т. п. | 1,40 г/см3 |
| Температура плавления | 83,8 К (-189,35 °C) |
| Температура кипения | 87,3 К (-185,85 °C) |
| Уд. теплота плавления | 7,05 ккал/кг кДж/моль |
| Уд. теплота испарения | 6,45 кДж/моль кДж/моль |
| Молярная теплоёмкость | 20,79 Дж/(K·моль) |
| Молярный объём | 24,2 см3/моль |
Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 5,260 Å |
| Температура Дебая | 85 K |
Прочие характеристики Аргона | |
| Теплопроводность | (300 K) 0,0164 вт/м×град Вт/(м·К) |
infotables.ru
Конфигурация - благородный газ - Большая Энциклопедия Нефти и Газа, статья, страница 1
Конфигурация - благородный газ
Cтраница 1
Конфигурация благородного газа у аргона получается потому, что состояние Зр, с одной стороны, и состояния 3d и 4s, с другой стороны, сильно разнятся энергетически. Можно сказать, что у аргона сравниваются влияния главного и азимутального квантовых чисел на энергию уровня: они влияют примерно одинаково и еще достаточно сильно, чтобы этот элемент имел устойчивую электронную оболочку благородного газа. Но в отличие от гелия аргон все же способен вступать в химические соединения. [1]
Конфигурации благородных газов давно считались устойчивыми. Помимо того, что это правило Сиджвика неудачно, так как имеет дело с различными числами электронов для разных благородных газов, оно еще и часто не выполняется - соединения имеют другую стехиометрию. Правило 18 электронов очень часто используют для предсказания состава различных металлорганических соединений, особенно карбонильных и нитрозильных. [2]
Обычно комплексы ионов с конфигурацией благородного газа дают лабильные комплексы, а ионы переходных металлов чаще образуют инертные комплексы. [3]
Для достройки наружного электронного слоя до конфигурации благородного газа гелия ( Is2) атому водорода не хватает одного электрона. [4]
Внешняя электронная оболочка простых карбонилат-ионов имеет конфигурацию благородного газа. Большинство из них легко окисляется кислородом воздуха. [5]
Рассмотрим заряженный или нейтральный атом с конфигурацией благородного газа Is22s22p6, например С4 -, N3 -, О2 -, F - или Ne. Предположим, что восемь электронов на валентной оболочке занимают четыре тетраэдрических орбитали. При этом протон поляризует связывающую пару электронов тем же способом, каким протон или небольшой положительный ион поляризует анион ( правила Фаянса, см. разд. Электронная плотность уменьшится у ядра первого атома и частично перейдет к ядру водорода. В результате оставшиеся несвязывающие электроны смогут расширить свое пространство за счет связывающей пары. [7]
В такой записи [ Аг ] означает конфигурацию благородного газа аргона, а подробно указывается только конфигурация валентных электронов. [9]
Таким образом появление хромофорных групп связано с нарушением конфигурации благородного газа, при этом появляются лабильные ( слабо связанные) электроны, поглощающие энергию волн определенного периода и тем обусловливающие появление определенной окраски вещества. [10]
В комплексах, являющихся димерами, для достижения конфигурации благородного газа необходимо образование связи металл-металл. [11]
При одинаковых зарядах и близких радиусах поляризация минимальна у ионов с конфигурацией благородного газа и максимальна у ионов с 18 внешними электронами; промежуточное значение а имеют ионы переходных элементов с незавершенной d - оболочкой. Значительная поляризуемость ионов d - элементов объясняется большим числом внешних электронов у них. [13]
В каждом случае элементы нового периода по строению внутренних энергетических уровней повторяют конфигурацию благородного газа, которым заканчивается предыдущий период. Поэтому часто используется следующая форма записи: натрий - [ Ne ] 3s1, магний - [ Ne ] 3s2, алюминий - [ Ne ] 3s23p и так до конца данного периода. [14]
В каждом случае элементы нового периода по строению внутренних энергетических уровней повторяют конфигурацию благородного газа, которым заканчивается предыдущий период. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
гелий, неон, аргон, криптон, ксенон и радон
Общая характеристика инертных газов
Каждый период Периодической системы заканчивается инертным газом, кроме гелия, все они имеют на внешнем энергетическом уровне по 8 электронов, образующих очень устойчивую систему, в связи с чем эти элементы получили название инертных. Несмотря на то, что электронная оболочка гелия состоит из двух электронов, она также очень устойчива. В связи с этим явлением атомы инертных газов обладают высокими значениями энергий ионизации и, как правило, отрицательными значениями энергии сродства к электрону.
Электронная конфигурация внешнего энергетического уровня инертных газов – 1s2 (He) и ns2np6 для других инертных газов.
Изначально предполагали, что атомы инертных газов не способны к образованию химических связей с другими элементами. Были известны лишь несколько нестойких соединений благородных газов – гидраты аргона, криптона и ксенона (Ar×6h3O, Kr×6h3O, Xe×6h3O), которые получались при действии инертных газов на кристаллизующуюся переохлажденную воду.
Позже, было установлено, что Kr, Xe и Rn вступают в реакции взаимодействия с другими веществами, например, с фтором, при нагревании или электрическом разряде. Для ксенона известны оксид – XeO3 и гидроксид- Xe(OH)6.
Наибольшее практическое применение среди всех благородных газов находят аргон, неон и гелий.
Гелий
По физическим свойствам гелий наиболее близок к молекулярному водороду. В связи с малой поляризуемостью атома гелия, у него самые низкие температуры кипения и плавления, по сравнению с другими элементами VIIIA группы. Однако, он хуже, чем другие инертные газы растворим в воде.
В обычных условиях гелий химически инертен, но в возбужденном состоянии он способен образовывать неустойчивые молекулярные ионы He2+ или ионизированные молекулы HeH+.
Гелий – наиболее распространенный из элементов космоса, после водорода и состоит из двух изотопов — 4He и 3He. Доказано присутствие гелия в атмосфере Солнца, звезд и в метеоритах.
Гелий получают из некоторых природных газов методом глубокого охлаждения, при этом гелий остается в газообразном состоянии, в то время как другие газы конденсируются.
Гелий нашел применение в атомной энергетике, при автогенной сварке металлов, в физических лабораториях в качестве хладоносителя. Изотоп гелия 3 He – единственное вещество, пригодное для измерения температур ниже 1К.
Неон. Аргон
Основное отличие неона от гелия – большая поляризуемость атома, склонность к образованию межмолекулярных связей, несколько большая растворимость и способность адсорбироваться.
Агрон, как и неон, имеет 8 электронов на внешнем энергетическом уровне и, вследствие высокой устойчивости электронной структуры атома неона, он не способен к образованию соединений валентного типа. Аргон образует молекулярные соединения включения – клатраты – с водой, фенолом, толуолом и другими веществами. С сединениями h3S, SO2, CO2, HCl аргон дает двойные гидраты, т.е. смешанные клатраты.
Неон и аргон получают из воздуха путем его разделения при глубоком охлаждении. Аргон, в связи с его сравнительно высоким содержанием в воздухе, получают в значительных количествах, неон – в меньших.
Неон и аргон применяют в качестве наполнителей ламп накаливания, газосветных трубок (для неона характерно красное свечение, для аргона – сине-голубое). Аргон, как наиболее доступный из инертных газов, используют в металлургии, в частности при аргонно-дуговой сварке алюминиевых и алюминиевомагниевых сплавов.
Подгруппа криптона
Энергия ионизации элементов подгруппы криптона (Kr, Xe, Rn) характеризуются меньшими значениями энергии ионизации, чем типические элементы VIIIA группы, поэтому могут образовывать соединения обычного типа. Так, ксенон может проявлять степени окисления «+2», «+4», «+6», «+8».
Криптон применяют в электровакуумной технике, в смеси с ксеноном его используют в качестве наполнителя для различного вида осветительных ламп и трубок. Радиоактивный радон используют в медицине.
Примеры решения задач
ru.solverbook.com