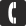№18 Аргон src=new.bmp>. Соединения с аргоном
№18 Аргон
Таблица ^ =>> v
| История открытия:Первый вклад в открытие аргона внес английский физик и химик Генри Кавендиш. Изучая в 1785 году окисление атмосферного азота кислородом под действием электрического разряда, он обнаружил, что остается небольшой объем газа, не подвергающегося окислению. Однако он не нашел объяснения этому факту. В 1892 году английский физик Дж. Рэлей обнаружил небольшое (всего на 0,13%) превышение плотности азота, выделяемого из воздуха, над плотностью азота, получаемого химическим путем. Английский физик У. Рамзаем предположил, что причиной этого может быть примесь еще неизвестного более тяжелого газа и предложил выделить его. Ему и Дж. Рэлею в 1894 году удалось выделить этот газ и спектральным анализом доказать, что это новый химический элемент. Дальнейшие исследования показали полную химическую инертность этого вещества. Благодаря своей химической инертности (а это был первый из открытых инертных газов), новый элемент и получил свое название Аргон (греч. аrgos - неактивный, ленивый). Нахождение в природе и получение:В атмосферном воздухе содержится 0,93% аргона по объему (9,34 л в 1м3), его запасы в атмосфере оцениваются в 4·1014 т. Среди других изотопов преобладает aргон-40, постоянно образующийся в ходе ядерной реакции ("электронный захват") из природного изотопа калия: 40K + e = 40Ar + neВ промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре -185,9°C аргон конденсируется, при -189,4°С - кристаллизуется. Физические свойства:Бесцветный, без запаха газ. Температура кипения аргона (при нормальном давлении) -185,9°C, температура плавления -189,4°C. Плотность при нормальных условиях 1,784 кг/м3. В 100 мл воды при 20°C растворяется около 3,3 мл аргона. в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде. При пропускании электрического разряда через стеклянную трубку, заполненную аргоном, наблюдается сине-голубое свечение. Химические свойства:Аргон химически инертен, при обычных условиях химических соединений не образует. Однако со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода "гость", находится в полости, образованной в кристаллической решетке молекулами вещества-хозяина. При сверхнизких температурах спектральными методами зафиксировано образование некоторых чрезвычайно неустойчивых молекул, содержащих аргон. Установлено существование так называемых эксимерных молекул, содержащих аргон. На переходах этих молекул из метастабильного состояния в несвязанное генерируется лазерное излучение. Важнейшие соединения:Клатрат Ar*6h3O - соединение включения, температура разложения Аr·6Н2О при 101325 Па 42,0°С. Гидрофторид аргона HArF - первое открытое, и пока единственное известное на 2013 г. химическое соединение аргона с электронейтральной молекулой. Получен при УФ-облучении смеси аргона и фтороводорода при 8K. Нестоек и распадается уже при 17 К на фтороводород и аргон. CU(Ar)O - образование такого соединение при 3 К предполагается на основании спектральных данных. В этой молекуле уран должен быть связан с тремя другими атомами - углеродом, аргоном и кислородом. Применение:Аргон широко используют для создания инертной и защитной атмосферы, прежде всего при термической обработке легко окисляющихся металлов (аргоновая плавка, аргоновая сварка и другие). В атмосфере аргона получают кристаллы полупроводников и многие другие сверхчистые материалы. Аргоном часто заполняют электрические лампочки (для замедления испарения вольфрама со спирали). Это же его свойство используется в аргоновой сварке, которая позволяет соединять алюминиевые и дюралевые детали. Аргон (в смеси с неоном, парами ртути) применяют для наполнения газоразрядных трубок (сине-голубое свечение), что используется в светящейся рекламе. Также аргон используется в аргоновых лазерах. В геохронологии по определению соотношения изотопов 40Ar/40К устанавливают возраст минералов. Мавлянова Н.Х., Жудин С.М.ТюмГУ, 501 группа, 2013 г. Источники: Аргон /WebElements.narod.ru/ URL: http://webelements.narod.ru/elements/Ar.htm (дата обращения: 8.07.13). Аргон (элемент) // Википедия. URL: http://ru.wikipedia.org/wiki/Аргон (дата обращения: 8.07.2013). |
www.kontren.narod.ru
Соединение - аргон - Большая Энциклопедия Нефти и Газа, статья, страница 1
Соединение - аргон
Cтраница 1
Соединения аргона были получены при давлениях порядка 200 - 400 атм, соединения криптона - при давлении около 30 атм, соединения ксенона - при атмосферном давлении. [1]
Существуют, невидимому, также соединения аргона с трехфтористым бором. Бут и Вильсон [ ], исследуя эту систему, нашли, что на диаграммах замерзания существует шесть максимумов, отвечающих соединениям одного атома аргона с 1, 2, 3, 6, 8 и 16 молекулами трехфтористого бора. Однако эти максимумы и находящиеся между ними эвтектики лежат в очень узком температурном интервале, от - 129 до - 135 С. Кроме этого, аналогичные молекулярные соединения других веществ с трехфтористым бором не известны, а столь большое колебание координационного числа. [2]
По замечанию авторов, безуспешные попытки получить соединения аргона могут быть связаны с безрезультатностью попыток соединить газообразную ртуть при 800 С с другими элементами. [3]
К числу соединений с ван-дер-ваальсовой связью следует также отнести соединения аргона и криптона со ртутью - ArHg и KrHg, существование которых будто установил Ольденберг [ г ], исследуя спектры флюоресценции в разрядных трубках. [4]
В поисках за каким-нибудь признаком, который бы позволил обнаружить существование какого-нибудь соединения аргона, мне пришлось исследовать газы, которые по мнению Гиллебранда, химика геологического бюро Соединенных Штатов, выделяются из минералов, содержащих уран. [5]
К этому же типу соединений относятся полученные Брэдли координационный продукт аргона с трифторидом бора и Поуэллом и Гутером соединение аргона с хинолом. [6]
Большой интерес вызвало в свое время сообщение [25 ] о выявлении методом термического анализа при повышенном давлении ряда конгруэнтно плавящихся соединений аргона с фтористым бором. [7]
Интересно было получить соединения других инертных газов с фенолом. По методу изоморфного соосаждения с соединениями сероводорода было получено соединение аргона. Устойчивости дифенолятов радона и аргона отличаются больше, чем устойчивости их гексагидратов. [8]
Аргон - газ, не имеет ни запаха, ни цвета, ни вкуса. Соединение аргона с водой было получено ( 1896 г.) при 0 и 150 атм давления в виде прозрачных кристаллов твердого аргон-гидрата, состав которого Аг 5 ( или 6) Н2О был высчитан теоретически. Аргон был сгущен тотчас же после его открытия. [9]
Аргон - газ, не имеет ни запаха, ни цвета, ни вкуса. Соединение аргона с водой было получено ( 1896 г.) - при 0 и 150 атм давления в виде прозрачных кристаллов твердого аргон-гидрата, состав которого Аг-5 ( или 6) Н2О был высчитан теоретически. Аргон был сгущен тотчас же после его открытия. [10]
Впоследствии были получены аналогичные соединения и для других инертных газов. Кстати, гидраты радона, аргона и ксенона были получены в том же Радиевом институте. В 1949 г. были получены соединения аргона, криптона и ксенона с гидрохиноном. [11]
В заключение скажем несколько слов об общих выводах, которые следует сделать из рассмотрения молекулярных кристалло-гидратов. Можно считать установленным, что благородные газы не стоят особняком в смысле образования молекулярных химических соединений, а имеют целый ряд аналогов среди других веществ, в первую очередь среди летучих гидридов. Если аргон и криптон дают такие, либо молекулярные соединения, например, соединения с трехфтористым бором [4], то заранее можно предсказать, что и метан должен давать аналогичные соединения и устойчивость их должна быть средней между устойчивостью соединений аргона и криптона. Наоборот, если известны молекулярные соединения для аналогов благородных газов, то такие соединения должны давать и сами благородные газы и устойчивость их можно приближенно оценить. [12]
Известны непрочные соединения элементов нулевой группы с водой, сероводородом, толуолом, фенолом, например Аг 6Н2О, Кг 6Н2О, Аг 2С6Н5ОН, которые образуются, по-видимому, с помощью вандерваальсовых сил. С увеличением атомной массы инертного газа повышается прочность кристаллогидрата. В последнее время получены соединения аргона и криптона с ртутью, а также гелия с фосфором, иодом, серой. [13]
Страницы: 1
www.ngpedia.ru
Гидрохинон соединение с аргоном - Справочник химика 21
К наиболее важным комплексам этого типа относятся соединения, в которых роль хозяина выполняет гидрохинон. Три молекулы гидрохинона, удерживаемые вместе водородными связями, образуют клетку, в которой помещается одна молекула-гость. Такой молекулой может быть метанол (но не этанол), ЗОг, СОг и аргон (но не неон). В отличие от соединений включения кристаллическая решетка в клатратах может оставаться частично незаполненной. Роль молекулы-хозяина может выполнять также вода. Обычно шесть молекул воды образуют клетку, в которую в качестве молекул-гостей могут войти хлор, метилиодид и многие другие соединения. Образуемые водой клатраты представляют собой твердые вещества, но они сохраняются только при низких температурах, а при комнатной температуре разлагаются [67]. [c.123]
До самого последнего времени не было известно ни одного случая образования связей атомами инертных газов (за исключением молекулы Неа, обнаруженной спектроскопически в разрядных трубках). Твердые гидраты тяжелых инертных газов и кристаллические соединения типа клатрата аргона в гидрохиноне представляют собой просто механические включения атомов инертного газа в кристаллическую решетку льда или гидрохинона (см. стр. 267—268). Поэтому такие газы описывались как инертные , и их инертность использовалась в качестве отправного пункта при построении квантовой теории валентности. [c.87]Гидрохинон имеет очень рыхлую решетку, в которой молекулы удерживаются водородными связями и существуют большие пустоты. Если гидрохинон кристаллизуется из раствора в присутствии растворенной двуокиси серы или в атмосфере аргона под давлением в несколько атмосфер, молекулы газа включаются в кристалл. Они никак не связаны с гидрохиноном, а только расположены в пустотах его структуры. При плавлении или растворении кристалла решетка разрушается и выделяется газ. Такие соединения называются клатратами (клеткообразными) и образуются также при взаимодействии гидрохинона с некоторыми другими газами. Можно получить клатратное соединение с асимметрическим соединением вместо гидрохинона (см. стр. 376). При этом пустоты в решетке также будут асимметричными и могут включать только один из зеркальных изомеров второго асимметрического вещества (с молекулами небольшого размера). Таким путем можно производить разделение оптических изомеров, например три-орто-тимотида [c.267]
Включенное вещество не оказывает влияния на формы колебаний частиц в решетке гидрохинона. Последнее допущение приемлемо, если не возникают нарушения в основном каркасе при размещении молекул, имеющих особые формы. Такие нарушения можно обнаружить путем определения параметров кристаллической структуры они практически отсутствуют в клатратном соединении гидрохинон — аргон. Некоторые особенности спектра ядерного квадрупольного резонанса клатратного соединения с азотом были объяснены небольшими видоизменениями полостей (см. главу десятую, раздел [c.446]
Лар и Уильямс [21] пришли к заключению, что разложение клатратного соединения -гидрохинон — аргон обусловлено диффузией. Они получали свои образцы не путем кристаллизации из раствора в присутствии аргона, а воздействием аргона под высоким давлением на твердый а-гидрохинон. Вследствие этого большая часть твердого вещества могла переходить в -форму. При разложении клатратного соединения -гидрохинона -структура сохраняется. [c.589]
Что касается других перечисленных выше сил, то силы диполь — индуцированный диполь в основном обусловлены полярными связями С—О и О—И и прямо пропорциональны поляризуемости включенных молекул. Силы диполь — диполь отсутствуют в клатратных соединениях гидрохинона с аргоном, кислородом и азотом и, вероятно, незначительны в клатратах гн.чрохинона с хлористым водородом. Величина сил отталкивания быстро растет с увеличением [c.89]
Позднее Пауэлл [207] сообщил, что использование бензола приводит к сравнительно низкому выходу вследствие малой растворимости гидрохинона в бензоле. Чтобы устранить это затруднение, применяли этанол или воду. Применения метанола избегали из-за его склонности к образованию клатратного соединения. Улучшение метода сводилось к использованию 30 мл насыщенного водного раствора гидрохинона и аргона при давлении 40 атм. Образующийся клатрат гидрохинона с аргоном был выделен в виде больших отдельных кристаллов в форме гексагональных призм с ромбоэдрическими поверхностями на концах. Этот клатрат соответствует по составу формуле ЗСбН4(ОН)2 0,8Аг. [c.116]
Экспериментально устойчивость клатратных соединений представляет особую проблему гетерогенного равновесия. В некоторых прямых экспериментах можно и ае достичь истинных давлений разложения, но эта трудность была преодолена Ван-дер-Ваальсом и Платеевым [20], которые добавляли к системе растворитель. Если допустить, что добавляемая жидкость не входит в состав клатратного соединения и обладает малой летучестью, то измеренное давление разложения должно совпадать с истинным. Тогда можно проводить равновесные измерения примерно в течение дня. Было найдено, что изменение давления пара для клатратных соединений аргон — гидрохинон в зависимости от состава подчиняются изотерме Ленгмюра. Теплоты образования при постоянном давлении в расчете на 3 моль гидрохинона можно определить из калориметрических измерений по разности между теплотами растворения клатратного соединения и некоторого эквивалентного количества а-гидро-хинопа [9]. Изменение энтальпии АН) при экзотермической реакции [c.445]
Для клатратного соединения аргон — Р-гидрохинон 0 я=г 0,5 для трехфазной линии. Характер изменения этой величины с температурой можно установить, зная, что при 25° С 0 = 0,34, а при 60° С равно 0,28 в соотБетствии с уравнением (318). [c.448]
Соединения включения, о которых шла речь в этой главе, не являются очень устойчивыми системами. Фактически, некоторые из них пррн обычных условиях находятся в метастабильном состоянии. Детальное теоретическое и экспериментальное изучение термодинамики реакций образования клатратных соединений гидрохинона и гидратов благородных газов было проведено Ван-дер-Ваальсом с сотрудниками [37] (см. главу седьмую, раздел IV). Они показали, например, что равновесное давление аргона над клатратным соединением аргон — Р-гидрохинон при 25° С составляет 3,4 атм. Так как это клатратное соединение устойчиво в течение месяцев, а возможно, и нескольких лет, то процесс разложения, если он протекает, должен характеризоваться значительной энергией активации. [c.588]
При проведении калориметрических измерений с клатратным соединением аргон — гидрохинон Парсонаж и Ставли [31] установили, что потеря аргона имеет место при охлаждении образца от комнатной температуры до температуры жидкого воздуха с последующим нагреванием вновь до комнатной температуры. Однако эту потерю можно значительно снизить, если попытаться удалить из кристаллов даже следы растворителя, из которого кристаллизовали клатратное соединение. Было показано [14], что некоторые из клатратных соединений гидрохинона, например с кислородом и окисью углерода, более склонны к разложению при колебаниях температуры, чем клатратное соединение с аргоном. Другие соединения, например клатратное соединение с метаном, менее склонны к разложению. На клатратных соединениях с кислородом и окисью углерода меньше сказывается влияние изменения температур, если занято около половины доступных полостей. Более богатые гостями клатратные соединения при частичном разложении сохраняют Р-структуру. Напротив, имеются сведения, что клатратное соединение со степенью заполнения полостей 0,2 при разложении склонно к переходу в а-форму. [c.590]
Клатратные соединения впервые открыты Дэви в 1811 г., установившим, что хлор с водой образует твердый газовый гидрат. В XIX в. проведены первые исследования и гидратов углеводородов — метана, этана, этилена, пропана. В 1886 г. Милиус обнаружил, что гидрохинон образует комплексы с инертными газами — азотом, аргоном, ксеноном, криптоном. Поскольку химической связи в этом случае образоваться не могло, Милиус допустил, что комплекс сформировался в результате полного окружения одной молекулы несколькими молекулами другого компонента В 1940 г. Бенген открыл, что мочевина образует твердые аддукты с нормальными алканами и алифатическими спиртами, например с октиловым спиртом. [c.72]
Парсонэйдж и Стэйвли [190] сообщили значение теплоемкости С для ряда клатратных соединений гидрохинона в диапазоне температур от 13 до 273° К. Количество аргона, клатратированного в клетках гидрохинона, изменялось примерно от 20 до 80%. Этот метод исследования движения ионов или молекул в кристаллической решетке заключается в анализах теплоемкости твердого вещества, поскольку вклад в теплоемкость будет, вообще говоря, разным в зависимости от того, вращаются ли частицы свободно или испытывают крутящие колебания. Клатраты гидрохи- [c.98]
Между гидрохиноном и инертным газом нет никакого сильного взаимодействия следовательно, у последнего нет никакой самопроизвольной тенденции быть включенным в кристалл, как это наблюдается для полярных соединений, подобных сероводороду и двуокиси серы. Поэтому необходимо контролировать условия таким образом, чтобы атом инертного газа имелся на поверхности растущего кристалла всякий раз, когда молекулы гидрохинона соединяются, образуя клетку [275]. И так как растворимости газов в воде низки, это можно осуществить только при использовании очень высоких давлений. В работе Пауэлла [209] применялись давления газов 40, 20 и 4 атм соответственно для аргона, криптона, ксенона. Растворимости газов возрастают с увеличением атомных весов. [c.115]
Все эти данные заставляют предположить, что структура клатратного типа образуется в том случае, если размер молекулы газа соответствует размеру полостей, образованных молекулами воды. Этот вывод подтверждается результатами определения устойчивости соединений путем измерения парциального давления пара. Так, давление газа над.гидратами ксенона, криптона и аргона составляют при 0° С соответственно 1,15, 14,5 и 105 атм (см. главу шестую, раздел VIII, Б 1). Как видно, давление пара тем больше, чем меньше диаметр атома благородного газа некоторые вещества, например водород, молекула которого имеет очень небольшие размеры, совсем не образуют гидратов. Б данном случае можно сделать такой же вывод, что и при рассмотрении клатратных соединений гидрохинона. Если размеры захватываемых молекул очень малы по сравнению с размерами возможных дырок в клеточной структуре, то они могут просачиваться и легко удаляться из этой структуры. [c.404]
Р-гидрохинона. Другие размеры полости также должны быть соответственно большими. Чтобы в полость поместились молекулы, перечисленные выше, и молекулы приведенных в таблице веш,еств, полости и должны быть большими, но доказательством того, что они тем не менее размещаются, служит образование соединения включения аргона. Которое прочно удерживает газ при комнатной температуре. Состав можно выразить формулой бС зНаоОг-жМ, где х — число молекул включенного вещества М в одну полость. Так как согласно известным размерам ячеек размеры полостей ограничены и почти одинаковы во всех соединениях, максимальное значение х определяется пространством, необходимым для размещения молекулы М. [c.442]
Клатраты благородных газов с гидрохиноном приобрели практическое значение как наиболее устойчивые из всех молекулярных соединений с неспецифическими силами взаимодействия, открытых до настоящего времени. Устойчивость клатратов благородных газов с гидрохиноном повышается от аргона к ксенону. Клатрат криптона вполне устойчив при комнатной температуре. Утечку криптона из этого клат-рата определяли с применением радиоактивного индикатора Кг. Шлек и Циглер [127] показали, что за сутки препарат выделяет всего пЛО- % содержащейся в нем активности (п[c.82]
chem21.info
Молекулярные соединения BF3 с аргоном
Молекулярные соединения BFg с аргоном [c.56]
Аргон относится к инертным газам и стоит в нулевой группе периодической системы элементов, но, несмотря на это, он активируется в присутствии апротонной кислоты — фтористого бора, и подобно основаниям образует с ним координационные молекулярные соединения по схеме [c.56]
А. И. Шатенштейн [73] сомневается, что в образовании молекулярных соединений фтористого бора с аргоном участвуют химические связи, и [c.56]
Аргон — последний элемент 3-го периода. Его валентный слой содержит восемь электронов и свободные Зс -орбитали. Объяснить химию аргона можно только большим размером атома и, как следствие, большей поляризуемостью. Его соединения со связями валентного типа не получены. Известны, однако, молекулярные соединения включения — клатраты с водой, фенолом, толуолом и другими веществами. Гидрат аргона с шестью молекулами воды Аг-бНгО — кристаллическое вещество, разлагающееся при температуре —42,8° С. Количество молекул воды в гидрате совпадает с максимальным координационным числом для всех элементов рассматриваемого периода. [c.244]
Никитин указал, что, по-видимому, существуют соеди-яения аргона с трехфтористым бором, однако шесть максимумов на диаграммах замерзания и находящиеся между ними эвтектики лежат в очень узком температурном интервале, от —129 до —135°. Кроме этого, аналогичные молекулярные соединения других веществ с трехфтористым бором неизвестны, а столь -большое колебание координационного числа вообще внушает некоторое сомнение. Поэтому существование данных соединений Никитин также не считал окончательно доказанным. [c.301]
По замечанию авторов, безуспешные попытки получить соединения аргона могут быть связаны с безрезультатностью попыток соединить газообразную ртуть при 800° С с другими элементами. В отношении того, что аргон — газ с атомным весом 40, указывалось мы не знаем, почему углерод с его низким атомным весом является твердым вешеством, тогда как азот — газ, за исключением того, что мы приписываем первому молекулярную сложность, а последнему — сравнительную простоту молекулы . [c.30]
До работ Б. А. Никитина, кроме трех кристаллогидратов аргона, криптона и ксенона, состав которых точно аналитически не был определен, никаких химических соединений известно не было. Им был предложен для получения легко диссоциирующих молекулярных соединений (к которым относятся и кристаллогидраты благородных газов) исключительно остроумный способ улавливания их в изоморфную с ними решетку аналогично построенных химических соединений. Метод изоморфного соосаждения, писал Б. А. Никитин, позволяет изучать образование соединений вне зависимости от концентрации изучаемого вещества. При работе с молекулярными соединениями газов отпадает необходимость в применении больших давлений, так как исследуемый газ может при любом парциальном давлении, в любое число раз меньшем упругости диссоциации его соединений, все-таки образовывать это соединение в виде изоморфной смеси с другими молекулярными соединениями . И далее Таким образом можно получать соединения радона, который мы можем иметь только в невесомых количествах никаким другим методом получить соединения радона нельзя . Путем изоморфного соосаждения, как и ожидал Борис Александрович, ему удалось получить впервые кристаллогидраты радона и неона и показать, что благородные газы, неспособные к образованию ионных соединений, сравнительно легко дают комплексные соединения. Далее, пользуясь большей или меньшей устойчивостью некоторых молекулярных соединений благородных газов, он разработал метод их количественного разделения. [c.7]
Существуют, повидимому, также соединения аргона с трехфтористым бором. Бут и Вильсон [ ], исследуя эту систему, нашли, что на диаграммах замерзания существует шесть максимумов, отвечающих соединениям одного атома аргона с 1, 2, 3, 6, 8 и 16 молекулами трехфтористого бора. Однако эти максимумы и находящиеся между ними эвтектики лежат в очень узком температурном интервале, от —129 до —135°С. Кроме этого, аналогичные молекулярные соединения других веществ с трехфтористым бором не известны, а столь большое колебание координационного числа. [c.114]
В заключение скажем несколько слов об общих выводах, которые следует сделать из рассмотрения молекулярных кристалло-гидратов. Можно считать установленным, что благородные газы не стоят особняком в смысле образования молекулярных химических соединений, а имеют целый ряд аналогов среди других веществ, в первую очередь среди летучих гидридов. Если аргон и криптон дают такие, либо молекулярные соединения, например, соединения с трехфтористым бором р], то заранее можно предсказать, что и метан должен давать аналогичные соединения и устойчивость их должна быть средней между устойчивостью соединений аргона и криптона. Наоборот, если известны молекулярные соединения для аналогов благородных газов, то такие соединения должны давать и сами благородные газы и устойчивость их можно приближенно оценить. [c.140]
На основании изложенных данных можно полагать, что взаимодействие аргона с поверхностью твердого тела проходит, вероятно, в два этапа. Сначала образуются молекулярные соединения типа клатратов, которые при благоприятных обстоятельствах, если в окрестности сорбированного атома аргона окажется поверхностный возбужденный атом, переходят в химическое соединение. Детальное рассмотрение механизма взаимодействия инертных газов со свежеобразованными поверхностями твердых тел станет возможным по мере накопления экспериментальных данных об их состоянии. [c.274]
Аргон не образует каких-либо валентных соединений с другими элементами. Однако известны молекулярные соединения аргона, в которых связь атомов осуществляется ван-дер-ваальсовымн силами. Наиболее полно изучен кристаллогидрат Аг-бНгО. [c.539]
Характеристика элемента. Этот элемент занимает особое положение как среди 3-го периода, так и среди своих соседей по нулевой группе. Как член 3-го периода, он должен обладать вакантными Зй-орбиталямн, в то же время разница в энергиях Зр- и З -состоя-ний настолько велика, что использование для химической связи Зй-орбитали не дает сколько-нибудь заметного выигрыша энергии. Поэтому до сих пор не обнаружено ни одного молекулярного соединения аргона. Потенциал ионизации аргона, хотя и меньше, чем у гелня и неона, но все-таки очень высок и равен 15,76 эВ. При возбуждении электронов и переводе их на 45-подуровень требуется 11,5 эВ. Эти величины доказывают, насколько прочно ядро удерживает электроны внешнего октета. О стабильности электронной конфигурации аргона 1з 25 2р 3з 3р ) в сравнении с электронной оболочкой элемента предыдущего периода неона можно судить, сопоставляя с ним изоэлектронных аргону анионов СЬ. Эти ионы легче поляризуются, чем 0 , и из-за больших размеров чаще могут быть восстановителями. Для химии аргона важно учитывать относительно большой размер его атома 1,92 А и способность к поляризации. [c.278]
При образовании молекулярных кристаллов в условиях низких температур, исключающих межатомные взаимодействия, процесс отвердевания наблюдается в чистом виде. Молекулы без сколько-нибудь существенных изменений входят в кристаллическую структуру, связанные между собой только слабыми ненаправленными межмолекулярными связями. Именно поэтому молекулярные кристаллы имеют настолько плотную упаковку, насколько позволяет конфигурация молекул. Заметим, что с химической точки зрения и этот, казалось бы, чисто физический процесс цред-ставляет собой процесс синтеза, так как его продуктом является твердое молекулярное соединение — новое вещество, образующееся из молекул исходных веществ. Чисто межмолекулярные взаимодействия представляет собой кристаллизация неона, аргона, криптона, ксенона и радона. Хотя их кристаллы состоят из атомов, тем не менее это настоящие молекулярные кристаллы образующие их молекулы одноатомны. Понятно, что между такими молекулами не может быть никакого другого взаимодействия, кроме ван-дер-ваальсовского. [c.21]
Нам кажется, что нет оснований приписывать образованию этих соединений иной механизм, чем тот, который описан выше для образования вообш,е всех молекулярных соединений фтористого бора. В данном случае атом бора с секстетной электронной оболочкой соединяется с аргоном, имеющ,им полный октет, и образует координационное соединение. В со- [c.57]
А. И. Шатенштейн [73] сомневается, что в образовании молекулярных соединений фтористого бора с аргоном участвуют химические связи, и считает наиболее вероятным образование подобных соединений путем ван-дер-ваальсова взаимодействия. [c.63]
Нам кажется, что нет оснований приписывать образованию этих соединений иной механизм, чем тот, который описан выше для образования вообще всех молекулярных соединений фтористого бора. В данном случае атом бора с секстетной электронной оболочкой соединяется с аргоном, имеющим полный октет, и образует координационное соединение. В соединениях типа Аг-бВРз и с большим числом молекул ВРз часть молекул связывается непосредственно с аргоном, а часть через атомы фтора, как показано ниже [c.63]
Свойства простого вещества и соединений. Вещество аргон — бесцветный газ, почти в 1,5 раза тяжелее воздуха. Масса I л при норлгальных условиях 1,7809 г. Соединений с валентными связями от аргона ожидать трудно, но молекулярные соединения включения известны клатраты с фенолом, толуолом и др. Установлено, что координационное число аргона соответствует максимальному координационному числу всех элементов 3-го периода и равно шести. [c.278]
Получение и использование. Аргон получают вместе с другими инертными газами из воздуха, где его содержанке составляет 0,934% по объему. Кроме того, аргон образуется в калийсодержащих минералах при -захвате изотопа °К. При фракционировании воздуха возникает проблема отделения неона от аргона. Одним из методов решения такой задачи является использование способности аргона образовывать молекулярные соединения включения — клатраты. Неон ке способен их образовывать из-за малого размера и К 1Чтожной поляризуемости. [c.279]
Первые сведения о молекулярных соединениях благородных газов были получены в 1896 г., когда Вийяр [112] получил кристаллогидрат аргона. Через 27 лет после этого Форкран [112] синтезировал гидраты криптона и ксенона. Эти факты позволяли считать, что радон также должен давать аналогичное соединение. Однако для его обнаружения обычным способом (по измерению упругости пара) потребовались бы практически недоступные количества радона. [c.81]
Клатраты благородных газов с гидрохиноном приобрели практическое значение как наиболее устойчивые из всех молекулярных соединений с неспецифическими силами взаимодействия, открытых до настоящего времени. Устойчивость клатратов благородных газов с гидрохиноном повышается от аргона к ксенону. Клатрат криптона вполне устойчив при комнатной температуре. Утечку криптона из этого клат-рата определяли с применением радиоактивного индикатора Кг. Шлек и Циглер [127] показали, что за сутки препарат выделяет всего пЛО- % содержащейся в нем активности (п[c.82]
Инертные газы. В 1893 г. было обращено внимание на несовпадение плотностей азота из воздуха и азота, получаемого при разложении азотных соединений литр азота из воздуха весил 1,257 г, а полученного химическим путем—1,251 г. Произведенное для выяснения этого загадочного обстоятельства очень точное изучение состава воздуха показало, что после удаления всего кислорода и азота получался небольшой остаток (около %), который ни с чем химически не реагировал. Открытие нового элемента, названного аргоном (по-гречески—недеятельный), представило, таким образом, торжество третьего десятичного знака . Молекулярный вес аргона оказался равным 39,9. Так как молекула его одноатомна, атомный вес аргона равен молекулярному. [c.41]
Со времени первых опытов В. Рамзая, произведенных им еще в конце прошлого столетия, среди химиков крепко утвердилось представление, что элементы нулевой группы периодической системы — благородные газы — в химическом отношении соверщенно недеятельны. Совсем недавно Панет [ ] в большом обзоре Естественная система химических элементов особенно отмечал, что благородные газы не обладают никакими химическими свойствами, что отделить их друг от друга химическим путем нельзя. Однако такое представление не совсем справедливо. Действитель-1Ю, элементы нулевой группы не дают соединений с ионной и атомной связью. Ни солей или окислов, ни обычных молеку.я у благородных газов мы не знаем. Однако существует еще один тип соединений, в котором связь между отдельными частицами обусловлена ван-дер-ваальсовыми силами. Первое соединение одного из благородных газов — аргона, относящееся к этому типу, действительно было получено еще в 1896 г. Атомы благородных газов обладают заметными ван-дер-ваальсовыми силами, их можно получить и Б жидком, и в твердом состоянии, в связи с чем можно ждать, что со временем будет открыто большое число соединений благородных газов, обусловленных ван-дер-ваальсовыми силами сцепления. В химии известны сотни представителей этого класса веществ, которые объединены под обнщм названием молекулярных соединений. Нужно, однако, отметить, что теория молекулярных соединений еще окончательно не разработана и далеко не выяснены закономерности их образования. Поэтому прежде всего необходимо выявить аналогию благородных газов и других веществ в отношении образования молекулярных соединений. В настоян ей работе автор пытается сделать первые шаги для теоретического и экспериментального обоснования химии молекулярных соединений благородных газов. [c.113]
Все же в литературе неоднократно появлялись сведения о получении соединений благородных газов. Многие из этих работ были в дальнейшем опровергнуты, а некоторые соединения еще нельзя считать окончательно доказанными. Те же соединения, существование которых бесспорно доказано, относятся к типу молекулярных соединений с ван-дер-ваальсовой связью. Однако это обстоятельство еще далеко не осознано многими авторами. Так, открытие в 1896 г. гидрата аргона оставалось для многих непонятным и удивительным даже через 30 лет [ ]. Бесспорно доказанным можно считать существование трех соединений благородных газов — гидратов аргона, криптона и ксенона. Об этих соединениях мы неоднократно будем говорить в дальнейшем. [c.114]
Атомы благородных газов можно представить себе соединенными ван-дер-ваальсовыми силами не только с другими атомами благородных газов или близкими к ним ио свойствам молекулам, но и с молекулами, которые сильно от них отличаются. Тогда в кристаллической решетке такого соединения соотношение между числом атомов благородного газа и числом молекул второго вещества должно быть постоянным, так как на место атома благородного газа нельзя поставить не сходную с ним молекулу второго вещества. Мы будем иметь в этом случае химическое соединение постоянного состава с определенной химической формулой, и чем больше ван-дер-ваальсовы силы у компонента, соединяющегося с благородным газом, тем устойчивее будет соединение. Такое соединение может иметь температуру плавления гораздо более высокую, чем кристаллы благородного газа. Действительно, известно несколько соединений благородных газов, которые следует отнести к этому классу веществ это гидраты аргона, криптона и ксенона. Повидимому, молекулярные кристаллогидраты представляют собой одну из наиболее устойчивых групп молекулярных соединений, насчитывающих несколько десятков представителей. Эта группа молекулярных соединений изучена сравнительно лучше, чем другие молекулярные соединения. Все же многое и для нее оставалось до сих пор неясным. Можем ли мы предсказать существование еще неизвестных гидратов, оценить их устойчивость, предсказать их свойства Существуют ли еще неизвестные гидраты других благородных газов — радона, неона и гелия [c.118]
Для трех благородных газов (аргона, криптона и ксенона) известны молекулярные соединения — гидраты, которые по своим свойствам очень близки к молекулярным кристаллогидратам, большой группе соединений, насчитывающей десятки представителей. Из теории Лондона о ван-дер-ваальсовых силах можно сделать вывод об устойчивости молекулярных кристаллогидратов. Чем больше поляризуемость, ионизационный потенциал и дипольный момент молекул гидратобразующего вещества и чем меньше их радиус, тем устойчивее должен быть гидрат, тем меньше должна быть его упругость диссоциации. Если у двух веществ эти свойства близки, то они должны давать аналогичные гидраты, обладающие близкой устойчивостью. Сопоставление молекулярных свойств ряда веществ [c.161]
Новый метод получения диссоциирующих соединений р] основан на соосаждении исследуемого газа при образовании аналогичного изоморфного соединения другого вещества. Если радон (или аргон) образует аналогичное соединение с фенолом, то при образовании Н28-2С( Н50Н из газообразного НзЗ и фенола в присутствии радона последний также должен переходить в осадок. Действительно, поско,льку сами Кп и НаЗ могут образовывать смеиганные кристаллы [ ], то и все их аналогично построенные молекулярные соединения должны быть изоморфны. Как показали В. Г. Хлопин и его сотрудники [ ], доказательством изоморфного соосаждения может служить приложимость закона Бертло— Нернста к распре- [c.187]
Мы видим, что радон соосаждается с кристаллами h3S-2 eH50H, причем константа распределения D действительно остается постоянной в пределах ошибок опыта. Следовательно, радон дает аналогичное молекулярное соединение Rn-2 oH50H, которое значительно устойчивее его гидрата[ ], так как легко получается при комнатной температуре. Устойчивость его, как мы и предполагали, близка к устойчивости соединения HoS, так как константа D имеет значение около 1. Следовательно, его температура плавления тоже должна быть около 50°. В отличие от гидратов, соединения с фенолом плавятся конгруэнтно возможно, что они могут существовать и в жидком состоянии. Мы видим, что для образования соединения с фенолом наличие дипольного. момента не является необходимым условием. Аргон также соосаждается с Н.5-2СвНвОН, причем константа распределения D близка к 0.002. Аналогичные соединения были получены нами также для SO2, НС1 и НВг, причем прямые g P—t для [c.188]
Мы предприняли это исследование для того, чтобы иметь надежный метод определения состава молекулярных соединений благородных газов. Методом изоморфного соосаждения Б. А. Никитину удалось показать, что благородные газы радон[ ] и неонр] образуют гидраты (ранее были известны гидраты аргона, криптона п ксенона). Тем же методом он впервые получил соединения благородных газов с фенолом и толуолом. Террес и Фольмер[ ] изучали методом термического анализа систему сероводород—фенол. Они определяли только линию ликвидуса и не учитывали количества сероводорода, оставшегося в газовой фазе. По максимуму на кривой ликвидуса они вывели заключение, что соединению следует приписать формулу НзЗ 2СаН 50Н. Поскольку при образовании этого соединения из газообразного сероводорода и твердого фенола происходит изоморфный захват находящихся в газообразной фазе благородных газов, Никитин[ ] сделал вывод, что и благородные газы дают аналогичные соединения. В дальнейшем[ ] ои получил соединение ксенона с фенолом и определил упругости диссоциации этого соединения при различных температурах. По аналогии он приписал соединениям благородных газов с фенолом формулу М-2СдН50Н. [c.219]
Г. Фридлендер обнаружил гелий в земной атмосфере. П. Вийяр получил молекулярное соединение ( клатрат ) аргона с водой, [c.574]
Указанная тонкая структура полосы может наблюдаться лишь при поглощении рентгеновых лучей в газах или парах, где возможно наличие неискаженных внешних уровней. И действительно. Костер и Ван-дер-Тюк [ 2 ] наблюдали такую структуру рентгеновой полосы поглощения в газообразном аргоне. На рис. 181 приведена структура А -полосы поглощения Аг, где ясно видны два максимума, соответствующие переходам 15—>-4р и 1 —>-5р. В случае молекулярных соединений на строении края полосы сказывается связь атомов в молекуле. Теория структуры края полос рентгенова погло- [c.323]
В качестве адссфбатов были выбраны очень инертные в химическом отношении газы — аргон и молекулярный азот. Сколько-нибудь значительного взаимодействия этих газов в обычных условиях с твердыми, жидкими пли газообразными материалами ранее не наблюдалось. Известен только факт химического усвоения атмосферного азота почвенными бактериями и другими микроорганизмами. Однако механизм зтого явления, которое все еще не удается воспроизвести в лабораторных условиях, остается неизвестным. Соединения аргона, как и других благородных газов, могут быть получены при некоторых особых условиях. При этом соединения аргона даже с азотом [c.264]
Механизм образования соединений благородных газов, с атомами твердых тел па свежеобразованной поверхности еще мало изучен. Следует отметить, что химия благородных газов получила развитие только в последние годы. До 1и02 г., когда появились работы Бартлетта, Глассепа и Черника [242], химические соединения благородных газов казались очень проб.пематичными. До зтого были известны лишь крайне неустойчивые молекулярные соединения благородных газов, так называемые клатраты. Большой вклад в химию клатратов внес Никитин [248], получивший молекулярные соединения радона и ксенона с фенолом и толуолом. Он нашел, что химическая активность благородных газов растет от аргона к радону. В настоящее время химия благородных газов находится в стадии развития. Синтезированы многие соединения ксенона со фтором, кислородом, металлами. Определена структура [c.273]
chem21.info
Аргон
Арго́н — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440–37–1) — инертный одноатомный газ без цвета, вкуса и запаха.
История
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырек газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша. Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота. Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос. У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы). Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней. Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа. Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество. Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества. Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов. 7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон. Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии. По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl. Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина. Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
Аргон, свойства аргона | Формулы и расчеты онлайн
Аргон, Вступление | |
| Символ | Ar |
| Латинское название | Argon |
| Тип вещества | простой химический элемент |
| Первооткрыватель | У. Рамзай, Дж. Рэлей |
| Год открытия | 1894 |
Основные параметры аргона по таблице Менделеева | |
| Атомный номер Z | 18 |
| Атомная масса | 39.948 |
| Группа | 18 |
| Период | 3 |
| Принадлежность к группе | инертные благородные газы |
Механические свойства аргона | |
| Скорость звука | 319 (Метр / Секунда) |
Термодинамические свойства аргона | |
| Агрегатное состояние при нормальных условиях | газ |
| Точка плавления по Кельвину | 83.85 (Кельвин) |
| Точка плавления по Цельсию | -189.3 (°C) |
| Точка кипения по Кельвину | 87.35 (Кельвин) |
| Точка кипения по Цельсию | -185.8 (°C) |
| Газовая постоянная | 208 (Джоуль / (Килограмм · Кельвин)) |
| Коэффициент объемного расширения газов в интервале температур (0..100°C) при давлении 101.3 кПа | 3.676 · 10 − 3 (1 / Кельвин) |
Магнитные свойства аргона | |
| Тип магнитной проницаемости | диамагнетик |
Свойства атома аргона | |
| Конфигурация электронного облака | 1s2 | 2s22p63s23p6 |
| Радиус атома | 71 · 10 − 12 (Метр) |
| Число протонов p | 18 |
| Число нейтронов n | 22 |
| Число электронов e | 18 |
| Массовое число A | 40 |
| Атомная структура аргона | 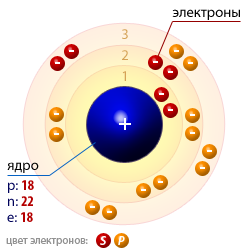 |
Химические свойства аргона | |
| Валентность | 0 |
Распространенность аргона | |
| Вселенная состоит из аргона на | 0.02% |
| Солнце состоит из аргона на | 0.007% |
| Мировой океан состоит из аргона на | 0.000045% |
Вселенная | |
| Вселенная состоит из аргона на | 0.02% |
www.fxyz.ru
Аргон, гидрат - Справочник химика 21
Аргон образует молекулярные соединения включения — клатраты— с водой, фенолом, толуолом и другими веществами. Гидрат аргона примерного состава Аг 6Н гО представляет собой кристаллическое вещество, разлагающееся при атмосферном давлении при —42,8 С. Его можно получить непосредственным взаимодействием аргона с водой при 0°С и давлении порядка 1,5 10 Па. С соединениями НаЗ, 502, СОг, ПС1 аргон дает двойные гидраты, т. е. смешанные клатраты. [c.496]
Аргон — газ, не имеет ни запаха, ни цвета, ни вкуса. Систематические исследования действия аргона на различные металлы, металлоиды и соединения при низких и высоких температурах, в присутствии катализаторов и без них, привели к выводу о невозможности получения устойчивых соединений аргона. Соединение аргона с водой было получено (1896 г.) при 0° и 150 атм давления в виде прозрачных кристаллов твердого аргон-гидрата, состав которого Аг 5 (или 6) Н2О был высчитан теоретически. Аргон был сгущен тотчас же после его открытия. [c.18]В структуре гидратов газов наряду с водородными связями существенную роль играют связи ван-дер-ваальсовского типа, которые возникают между молекулами газов, в том числе одноатомными молекулами аргона, неона и ксенона, и молекулами воды. Гидраты газов имеют кубическую структуру двух типов тип I — элементарная ячейка состоит из 46 молекул воды, 6 больших и 2 малых полостей типа II — в элементарной ячейке находится 136 молекул воды, 8 больших и 16 малых полостей. Таким образом, в структуре тех и других гидратов в образовании полостей принимает участие значительно большее число молекул, чем в структуре льда. Поэтому полости получаются сравнительно большие [c.26]
КЛАТРАТНЫЕ СОЕДИНЕНИЯ. В 1896 г. было сделано открытие, долгое время казавшееся абсурдным. Вайяр сообщил, что им синтезирован гидрат аргона Аг-бНгО. Почти 30 лет не удавалось получить аналогичных соединений других инертных газов. Лишь в 1925 г. Форкан обнаружил, что при взаимодействии ксенона со льдом под давлением образуется гидрат ксенона Хе-бНгО. В 1940 г. известный советский химик Б. А. Никитин при кристаллизации фенола под давлением 40 атм в присутствии ксенона получил соединение Хе-ЗСбНбОН. Все эти соединения — клатратные (или соединения включения). В них нет химической связи. Процесс их образования сводится к внедрению чужих молекул в полости, которые уже существуют или могут возникнуть при определенных условиях в кристаллической решетке того или иного вещества. Нужно только, чтобы совпадали размеры пустот и размеры внедряемых атомов. [c.89]
В ряду Не — Rn возрастает и устойчивость соединений включения. Так, температура, при которой упругость диссоциации клатратов Аг-бНаО, Кг-бНаО и Хе-бНаО достигает одной атмосферы, соответственно равна —43, —28 и —4°С. Наоборот, чтобы получить при 0°С гидрат ксенона, достаточно применить давление чуть больше атмосферного. Для получения гидратов криптона, аргона и неона необходимо давление соответственно в 14,5, 150 и 300 атм. Можно ожидать, что гидрат гелия удастся получить лишь под давлением порядка тысяч атмосфер. [c.613]
Растворы можно различать по агрегатному состоянию — твердые, жидкие и даже говорят о газообразных растворах, имея в виду газовые смеси. Последним, точнее идеально-газовым смесям, было уделено некоторое внимание в гл, V в связи с химическим равновесием. О твердых растворах, являющихся предметом изучения, главным образом физики твердого тела и металловедения, будет более подробно упомянуто в следующей главе. В этой же главе будут обсуждаться лишь жидкие растворы — системы, весьма разнообразные по своей природе и характеру межмолекулярного взаимодействия. Так, при растворении серной кислоты в воде наблюдается выделение большого количества теплоты, отмечается образование ряда гидратов определенного состава. Отчасти на основании этих наблюдений Д. И. Менделеев развивал свою химическую теорию растворов. Несомненно, что силы, действующие в упомянутых гидратах серной кислоты, приближаются по св ему характеру к силам химической связи. В качестве другого крайнего случая можно указать на растворы веществ типа аргона и неона (илн других элементов нулевой группы), когда проявляется действие сил только физической природы — относительно слабых сил Ван-дер-Ваальса. [c.262]
Клатратные соединения впервые открыты Дэви в 1811 г., установившим, что хлор с водой образует твердый газовый гидрат. В XIX в. проведены первые исследования и гидратов углеводородов — метана, этана, этилена, пропана. В 1886 г. Милиус обнаружил, что гидрохинон образует комплексы с инертными газами — азотом, аргоном, ксеноном, криптоном. Поскольку химической связи в этом случае образоваться не могло, Милиус допустил, что комплекс сформировался в результате полного окружения одной молекулы несколькими молекулами другого компонента В 1940 г. Бенген открыл, что мочевина образует твердые аддукты с нормальными алканами и алифатическими спиртами, например с октиловым спиртом. [c.72]
В основе строения атомов Fe, Со и Ni лежит электронная конфигурация аргона 2 8 8. Во внешнем же слое атомы семейства содержат по 2 валентных электрона. Отсюда типичная для этих элементов валентность +2. Это — низшая положительная валентность, которой соответствуют низшие окислы состава ЭО (закиси металлов, например FeO — закись железа). Им отвечают гидраты закиси общей формулы Э (ОН)г, например Fe(0H)2 — гидрат закиси железа. Эти гидраты имеют ясно выраженный основной характер. В образовании высших окислов участвуют электроны второго снаружи слоя. По мере повышения положительной валентности элемента характер окислов и их гидратов изменяется, что особенно ясно выражено у железа Ре(ОН)з— гидроокись, имеющая основной, отчасти амфотерный характер РеОз—кислотный окисел (железный ангидрид). [c.545]
Химическая активность ЩМ не имеет себе равных среди других металлов. Хранят ЩМ обычно в керосине, герметично упакованными в запаянных железных коробках. На воздухе ЩМ быстро покрываются пленкой сложного состава, в которой присутствуют окислы (перекиси), нитриды, гидраты окислов, карбонаты и др. Чтобы ввести ЦМ в реакцию, обычно кусочек металла нужного размера отрезают от монолита скальпелем под слоем органического неполярного растворителя, например керосина или бензола. Тщательно скальпелем убирают с поверхности металла следы коррозии. При необходимости несколько раз меняют растворитель и процедуру очистки проводят в сухой камере, заполненной инертным газом, например аргоном. [c.11]
Одним из клатратных соединений является газированный лед. Опыт показывает, что при охлаждении воды, насыщенный каким-либо газом под давлением, образуется лед, содержащий в своей кристаллической решетке молекулы газа. При этом молекулы Н2О посредством водородных связей образуют многогранники, полости внутри которых достаточно велики, чтобы молекула газа могла в них находиться почти свободно. Выйти из многогранника или войти в уже образовавшийся газо-гидрат молекула не может (рис, 5.21). Поэтому, несмотря на летучесть газов, эти соединения являются относительно устойчивыми. Молекулами-гостьями в гидратах могут быть углекислый газ, аргон, криптон, ксенон, метан, этан, этилен, пропан, циклопропан и др. Гидраты экономичны в смысле хранения газа. В 1 м газового гидрата около 200 м метана. Добыть газ из гидрата очень легко нагреванием. Существует предположение, что большие запасы природного газа хранятся в недрах Земли в форме газогидратов. [c.149]
Как уже отмечалось, химическая активность благородных газов мала. Соединений гелия не получено. Аргон, криптон и ксенон образуют с водой при низких температурах гидраты состава Э-бНаО (Э = Аг, Кг, Хе). Эти соединения получаются в результате включения атомов благородных газов в пустоты, имеющиеся в кристаллической структуре льда. Такие соединения называются соединениями включения, или кла-тратами. Для всех благородных газов, за исключе- [c.106]
Гидраты представляют собой кристаллические соединения — включения (клатраты), которые могут существовать в стабильном состоянии, не являясь химическими соединениями. По существу гидраты — это твердые растворы, где растворителем являются молекулы воды, образующие с помощью водородных связей объемный каркас гидратов. В полостях этого каркаса находятся молекулы газов, способных образовывать гидраты (метан, этан, пропан, изобутан, азот, сероводород, диоксид углерода, аргон). Углеводороды, молекулы которых больше молекулы изобутана, не могут проникать внутрь каркаса, а поэтому не образуют гидратов. Нормальный бутан не образует гидратов, но его молекулы способны проникать через решетку гидратного каркаса вместе с молекулами газов меньших размеров, что приводит к изменению равновесного давления над гидратом. [c.115]
Катализатор готовят, главным образом, из соединений металлов восьмой группы периодической системы, например, осаждают гидрат окиси железа с 3% гидрата окиси алюминия и восстанавливают при температуре ниже 500° (300— 450°), не допуская спекания, в присутствии восстанавливающих газов (водород, окись углерода, метан, этан) и затем подвергают термической обработке при температуре выше 500° (преимущественно при 600—1000°) в присутствии неокисляющих газов (азот, аргон, водород) или в вакууме в продолжение такого времени, которое необходимо для частичного спекания восстановленного катализатора, но в условиях, при которых не происходит плавления [c.51]
До самого последнего времени не было известно ни одного случая образования связей атомами инертных газов (за исключением молекулы Неа, обнаруженной спектроскопически в разрядных трубках). Твердые гидраты тяжелых инертных газов и кристаллические соединения типа клатрата аргона в гидрохиноне представляют собой просто механические включения атомов инертного газа в кристаллическую решетку льда или гидрохинона (см. стр. 267—268). Поэтому такие газы описывались как инертные , и их инертность использовалась в качестве отправного пункта при построении квантовой теории валентности. [c.87]
Детально изучались [126] термодинамические свойства гидратов аргона, криптона, ксенона, метана, четырехфтористого углерода, этана, этилена, кислорода и азота. [c.122]
Долгое время считали, что инертные газы не способны взаимодействовать с другими веществами. Впервые в 1896 г. Р. Вайяр получил кристаллогидрат аргона, сжимая его до 150 атм при 0° С над переохлажденной водой. Позднее были синтезированы кристаллогидраты других инертных газов. Состав их обычно выражается несколько приближенной формулой К -бНгО (реже встречаются кристаллогидраты формулы Я -8Н20). Гидраты эти весьма неустойчивы, что видно из приводимых ниже температур, при которых давления диссоциации достигают одной атмосферы [c.161]
Компенсирующее изменение энтальпии отрицательно и зависит от возможности дисперсионных взаимодействий хозяина и гостя . Энтальпии образования клатратов гидрохинона с аргоном, криптоном, кислородом, азотом, метаном составляют 25,1 26,4 23,0 24,3 30,2 кДж/моль гостя соответственно . Молекулы гости не остаются неподвижными в своих клетках ( lathros — по-гречески клетка) исследования клатратов двухатомных молекул в гидрохиноне привели к заключению, что молекулы НС1, О2, НВг вращаются, а также совершают броуновские колебания в клетках. Несомненно, что в клатратах, содержащих молекулы гостей различных типов (например, молекулы азота и кислорода в гидрохиноне), существует слабое взаимодействие между гостями . Многочисленные клатраты образует вода (клатратные гидраты), причем и в этом случае решетка, типичная для клатратов, отличается от решетки льда. В клатратах гостями заполняются большие и малые полости. Крупные молекулы (этан, этилен, хлороформ) помещаются только в больших полостях, молекулы меньших размеров (метан, аргон) входят в малые и большие полости. Доказано вращательное движение молекул метильной группы ацетона, молекул окиси этилена, гексафторида серы и других в кла-тратных гидратах, где движутся не только молекулы — гости , но и (медленнее) молекулы хозяина , т. е. воды. [c.271]
Многие небольшие молекулы образуют устойчивые кристаллы с водой при низких температурах. Газовые гидраты аргона, криптона и ксенона образуются при соединении инертных газов с водой при высоких давлениях и очень низких температурах. Было показано, что они относятся к клатратным соединениям [278—287]. Все первоначальные способы получения гидратов были изучены много лет назад [78, 98, 303], однако совсем недавно Полингом и Маршем [191] был разработан метод получения клатрата гидрата хлора СЬ 6Н2О. Пирексовую трубку длиной 6 мм вытягивали в капилляр на одном конце и соединяли с баллоном, содержащим хлор. После тщательного промывания капилляр запаивали, а его конец погружали в баню с сухим льдом и ацетоном. Когда некоторое количество хлора конденсировалось в капилляре, в стеклянную трубку впрыскивали каплю воды, после чего широкий конец трубки запаивали. Чередующееся нагревание и охлаждение капилляра способствовало тщательному перемешиванию воды и хлора. Вскоре в капилляре образовывались бледно-желтые кристаллы, которые сохранялись при повышении температуры до 0°. Незначительное количество жидкого хлора также оставалось, показывая тем самым, что хлор был взят в избытке . [c.119]
Клатраты. До сравнительно недавнего времени (60-е годы XX в.) химические свойства гелия, неона, аргона и других благородных газов даже не являлись предметом дискуссии. Эти элементы называли инертными газами, подчеркивая тем самым их полную неспособность к химическому взаимодействию, что объяснялось особой устойчивостью полностью завершенных П5 и пр-орбиталей. Однако уже в конце XIX в. вскоре после открытия инертных газов Вийяр, сжимая аргон под водой при О °С, получил кристаллогидрат примерного состава Аг-бНаО. Затем были получены аналогичные гидраты ксенона и криптона. Оказалось, что эти соедннения неус- [c.391]
Для термоантрацита интенсивное протекание процесса графитации, фиксируемое по изменению периода с (см. рис. 3), начинается при более высокой температуре. У типичного представителя плохо графитиро-ванного материала — гидрата целлюлозного волокна, согласно результатам работь [8, с. 7—10], начало трехмерного упорядочения кристаллической структуры смещено в область еще более высоких температур. В то же время при использовании вместо кокса природного графита кристаллическая структура такого материала в процессе термической обработки не изменяется, поскольку определяется структурой природного графита. Существенное влияние на скорость процесса графитации оказывает газс вая среда. Например, замена аргона при термообработке хлором ускоряет графитацию материа ла [8, с. 7-10]. [c.16]
Структура гидрата сенона и гидратов аргона, криптона, метана, хлора, брома, сероводорода и некоторых других веществ показана на рис. 9.10. Кубическая ячейка данной структуры имеет ребро около [c.257]
Аргон 1/363, 399 2/963 3/164 5/937. См. также Благор(н)ные газы жидкий 4/300 гидраты 1/911 клатраты 1/569 2/1043 определение 1/363, 885 получение 1/363, 796, 904, 929, 930 [c.550]
Аргон, криптон и ксенон обладают способностью образовывать гидраты , в которых одна молекула газа связана с несколькими молекулами воды. При 0° аргон дает гидрат при давлении около 100 ат криптон уже при О и 14 5 ат, а ксенон соответственно при 1,4° и 1 45 ат. [c.261]
Рассмотрим определение растворимости воды в бензоле и тО лурле с применением в качестве радиоактивного индикатора трития [356, 357]. Бензол насыщается тритированной водой и замораживается жидким воздухом твердый раствор помещается в прибор для удаления паров воды в вакууме. Затем система размораживается и раствор переводится в ловушку, содержащую безводную окись кальция, для поглощения воды, растворенной в бензоле. Бензол удаляется отгонкой и в ловушку добавляется этиловый спирт. В результате изотопного обмена водорода между гидроксильными группами спирта и гидрата окиси кальция практически весь тритий оказывается в составе спирта. Пары спирта в токе аргона переводятся в счетчик Гейгера — Мюллера, где и измеряется их активность. Зная активность определенной массы паров спирта, легко пересчитать ее на общее содержание воды, растворенной в бензоле. [c.188]
Уже больше столетия химиков озадачивают комплексы воды с такими простыми молекулами, как молекулы хлора. Еще Деви [78] обратил внимание на образование такого типа молекул хлор — вода, а Фарадей [91] предложил для них формулу СЬ-ЮНгО. Известны работы Штакельберга с сотр. [278—287], Клауссена [54], Полинга, Марша [191] и Никитина [179, 181, 182], проясняющие природу этих соединений, впоследствии известных под общим названием газовых гидратов . К веществам, образующим эти гидраты , относятся аргон, неон, радон, хлор, двуокись серы, хлористый метил, метан и этилен. В результате исчерпывающих исследований появилась возможность описать две кристаллические клатратные формы. Первая форма, структура I, имеет постоянную кубической ячейки, равную 12 А, причем содержится сорок шесть молекул конституционной воды. [c.60]
Двойные гидраты, имеющие общую формулу. 4 2В 17НоО, в которой А может быть ацетоном, хло-ристы.м метиленол , хлороформом или четыреххлористым углеродом, а В — аргоном, криптоном, ксеноном, были изучены и описаны Штакельбергом и Ян- [c.96]
Одним из наиболее современных способов получения газовых гидратов является метод Уоллера [304], который сообщил о синтезе ряда новых клатратных соединений инертных газов. Гидраты были получены в автоклаве из нержавеющей стали при повышенных давлениях или в стеклянном приборе при атмосферном давлении. Газы медленно вводили в реакционный сосуд под давлением, в то же время поддерживая постоянное давление смеси путем перемешивания. Аргон при давлении порядка 120 атм вводили в реактор непосредственно из баллона, при более высоких давлениях его подавали компрессором. [c.120]
При изучении основных процессов переноса в водных биомолекулярных системах биологи исследовали гидраты с помощью методов электронной микроскопии и электронной дифракции. Они предлагают использовать гидраты в качестве основы для непосредственного изучения биологических систем в их нативном гидратном состоянии. Отмечая, что открытая структура воды способствует образованию клатратов, Фернандес-Моран [93] сообщил об исследованиях, которые позволяют представить структуру воды в виде клеточных составных частей с помощью локальных образований гидратов ксенона и аргона и муаровых узоров, проступающих через наложенные изоморфные кристаллы. В результате комбинирован- [c.144]
В отличие от гелия Д и Д5 с аргона с ростом температуры увеличиваются и при повыщенных температурах приобретают положительные значения. По абсолютной величине Д/ - ри Д5н о аргона значительно выше, чем у гелия. Эти данные подтверждают развитые в работах [33, 66] представления о различии механизмов стабилизирующего действия Не, с одной стороны, и Аг-Кп - с другой. В первом случае стабилизация происходит за счет увеличения доли упорядоченной структуры и соответствующий вклад в термодинамические характеристики изотопного эффекта растворения не может быть большим. Во втором слу чае, структура воды вблизи атома благородного газа перестраивается без разрыва протиевых (дейте-риевых) связей в додекаэдрический каркас газового гидрата. Более того, такая перестройка, видимо, сопровождается образованием дополнительных связей, что, в свою очередь, отражается на До, которое при Гизотопным эффектом энергии образования протиевой и дейтериевой связей в воде ( 1,2 кДж кал моль" ). [c.130]
Среди соединений включения, в которых основной кристалл имеет изолированные друг от друга пустоты, способные заполняться малыми, подходящими по размерам молекулами, можно назвать комплексы благородных газов с хинолом и гидраты некоторых углеводородов. В отсутствие жидкой фазы хинольные комплексы весьма устойчивы [90], и при любом исследовании равновесных условий необходимо присутствие какого-либо растворителя. Фазовая диаграмма системы хинол — аргон указывает на существование фазы, в которой одна треть пустот решетки р-хинола заполнена атомами аргона. Эта фаза характеризуется давлением разложения 3,4 атм при 25°, но при высоких давлениях аргона его концентрация в твердой фазе, по-видимому, возрастает [108]. Фазовое равновесие гидратов углеводородов не было исследовано. Тем не менее литературные данные показывают, что в этих системах существуют только две твердые фазы — лед и кристаллы комплекса, состоящего из шести молекул воды и одной [c.264]
chem21.info
- Как варить алюминий инвертором без аргона

- Аргонодуговая сварка википедия
- Сварка латуни аргоном технология

- Аргонодуговой аппарат

- Сварка аргоном металла черного

- Как правильно варить аргоном

- Сварка тонкой нержавейки аргоном

- Сварка алюминия полуавтоматом в аргоне видео

- Видео как варить аргоном

- Технология сварка чугуна аргоном

- Как варить аргоном видео алюминий