Благородные газы. Благородный газ аргон
| Общие сведения об открытиях благородных газов К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами. История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева. Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток. Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось. Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин... Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. “Воздух при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка. Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18. Этим было доказано, что воздух содержит газ, плотность которого больше плотности азота… Я получил 100 см3 этого вещества и нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную - почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит «недеятельный». Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия. После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов. Вначале Рамзай и его сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в конце прошлого века, эти «микроследы» не улавливались. Затем исследователи обратились к воздуху. Всего за четыре последующих года было открыто четыре новых элемента, при этом неон, криптон и ксенон были выделены из воздуха. Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. Сначала «летят» более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из методов поиска был спектральный анализ: газ помещали в разрядную трубку, подключали ток и по линиям спектра определяли «кто есть кто». Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать «болельщиком» отцовых работ. Увидев необычное свечение, он воскликнул: «new one!» Так возникло название газа «неон», по-древнегречески значит «новый». После того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый, пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9, 3 л аргона и всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон (“скрытый”). Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит «чужой»: в криптоновой фракции воздуха он действительно выглядел чужаком. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента! Хотя содержание ксенона в атмосфере крайне мало, именно воздух — практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый — потому, что почти весь ксенон возвращается в атмосферу. Заслуга открытия высшего представителя инертных газов принадлежит тому же Рамзаю. При помощи весьма тонких технических приёмов он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Его молекулярный вес – около 220 – был Рамзаем измерен по скорости диффузии. Если предположить, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия - -частицы, то заряд его должен быть равен 88-2=86, т.е. новый элемент должен действительно быть инертным газом с атомным весом 226-4=222. Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов. История открытия Аргона В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось. Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал «Nature» обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин... Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент! Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит «недеятельный». Его предложил председательствовавший на собрании доктор Медан. Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег... Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона. Обобщение истории открытия Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление. Строение Аргона Аргон это газ с завершенным последним электронным уровнемAr 1S2 2S2 2P6 3S2 3P610 электронов 18 протонов 22 нейтрона Физические свойстваОбщие свойства инертных газовВсе благородные газы– бесцветные одноатомные газ без цвета и запаха обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятсяНасыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом. Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления). В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них. Как все инертные газы, аргон диамагнитен. Это значит, что его магнитная восприимчивость отрицательна, он оказывает большее противодействие магнитным силовым линиям, чем пустота. Это свойство аргона (как и многие другие) объясняется «замкнутостью» электронных оболочек его атомов. Под действием электрического тока аргон ярко светится, сине-голубое свечение аргона широко используется в светотехнике. Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях. Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода. Химические свойства Химическая инертность аргона (как и других газов этой группы) и одноатомность его молекул объясняются прежде всего предельной насыщенностью электронных оболочек. Тем не менее разговор о химии аргона сегодня не беспредметен. Есть основания считать, что исключительно нестойкое соединение Hg – Ar, образующееся в электрическом разряде, – это подлинно химическое (валентное) соединение. Не исключено, что будут получены валентные соединения аргона с фтором и кислородом, которые, скорее всего, будут неустойчивыми, Как нестойки и даже взрывоопасны окислы ксенона – газа, более тяжелого и явно более склонного к химическим реакциям, чем аргон. Еще в конце прошлого века француз Вийяр, сжимая аргон под водой при 0°C, получил кристаллогидрат состава Аr · 6Н2О, а в 20...30-х годах XX столетия Б.А. Никитиным, Р.А. Франкраном и другими исследователями при повышенных давлениях и низких температурах были получены кристаллические клатратные соединения аргона с h3S, SO2, галогеноводородами, фенолами и некоторыми другими веществами. В 1976 г. появилось сообщение о синтезе гидрида аргона, но пока еще трудно сказать, является ли этот гидрид истинно химическим, валентным соединением. Вот пока и все успехи химии... Аргон на Земле и во ВселеннойНа Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3 в литре морской и до 0,55 см3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот...Главное «хранилище» земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы. Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40. Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты («К-захват»). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон. Период полураспада 40К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон «выдыхается» литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками. Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.). Соотношение изотопов 40Аr: 40К и 40Ar: 36Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии. Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне. Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше... Теперь о легких изотопах. Откуда берутся 36Аr и 38Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов. Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-«родители», но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35: 3617Cl β–→ 3618Ar + 0–1e + ν. 3316S + 42He → 3618Ar + 10n. 3517Cl + 42He → 3818Ar + 10n + 0+1e. В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле. В космическом аргоне главенствуют изотопы 36Аr и 38Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660 : 1. А раз мало калия, то откуда же взяться аргону-40?! Применение Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса Как добывают аргонЗемная атмосфера содержит 66 · 1013 т аргона. Этот источник аргона неисчерпаем, тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов.Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором. Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10...12% аргона, до 0,5% азота, остальное – кислород. В «аргонной» колонне, присоединенной к основному аппарату, получают аргон с примесью 3...10% кислорода и 3...5% азота. Дальше следует очистка «сырого» аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ной чистоты. Аргон извлекают также из отходов аммиачного производства – из азота, оставшегося после того, как большую его часть связали водородом. Аргон хранят и транспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленой полосой и зеленой надписью. Давление в них 150 атм. Более экономична перевозка сжиженного аргона, для чего используют сосуды Дюара и специальные цистерны. Искусственные радиоизотопы аргона получены при облучении некоторых стабильных и радиоактивных изотопов (37Cl, 36Аr, 40Аr, 40Са) протонами и дейтонами, а также при облучении нейтронами продуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37Аr и 41Аr используются как радиоактивные индикаторы: первый – в медицине и фармакологии, второй – при исследовании газовых потоков, эффективности спетом вентиляции и в разнообразных научных исследованиях. Но, конечно, не эти применения аргона самые важные. |
mognovse.ru
StudyPort.Ru - Благородные газы
Общие сведения об открытиях благородных газов
К благородным газам относятся гелий, неон, аргон, криптон, ксенон и радон. По своим свойствам они не похожи ни на какие другие элементы и в периодической системе располагаются между типичными металлами и неметаллами.
История открытия инертных газов представляет большой интерес: во-первых, как триумф введённых Ломоносовым количественных методов химии(открытие аргона), а во-вторых, как триумф теоретического предвидения (открытие остальных инертных газов), опирающегося на величайшее обобщение химии – периодический закон Менделеева.
Открытие физиком Рэлеем и химиком Рамзаем первого благородного газа – аргона – произошло в то время, когда построение периодической системы казалось завершённым и в ней оставалось лишь несколько пустых клеток.
Ещё 1785 году английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически. “Воздух при помощи раскалённой меди был лишён своего кислорода и затем нагрет с кусочками магния в трубочке. После того как значительное количество азота было поглощено магнием, была определена плотность остатка. Плотность оказалась в 15 раз больше плотности водорода, тогда как плотность азота только в 14 раз больше её. Эта плотность возрастала ещё по мере дальнейшего поглощения азота, пока не достигла 18. Этим было доказано, что воздух содержит газ, плотность которого больше плотности азота… Я получил 100 см3 этого вещества и нашёл его плотность равной 19,9. Оно оказалось одноатомным газом.” Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную - почти процент! Кстати, именно в этот день и час, 13 августа 1894 года, аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”.
Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. “гелиос”, что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
После этого открытия Рамзай пришёл к выводу, что существует целая группа химических элементов, которая располагается в периодической системе между щелочными металлами и галогенами. Пользуясь периодическим законом и методом Менделеева, было определено количество неизвестных благородных газов и их свойства, в частности их атомные массы. Это позволило осуществить и целенаправленные поиски благородных газов.
Вначале Рамзай и его сотрудники занялись минералами, природными водами, даже метеоритами. Результаты анализов неизменно оказывались отрицательными. Между тем—теперь мы это знаем—новый газ в них был. Но методами, существовавшими в конце прошлого века, эти “микроследы” не улавливались. Затем исследователи обратились к воздуху.
Всего за четыре последующих года было открыто четыре новых элемента, при этом неон, криптон и ксенон были выделены из воздуха.
Воздух, очищенный предварительно от углекислоты и влаги, сжижали, а затем начинали медленно испарять. Сначала “летят” более легкие газы. После испарения основной массы воздуха рассортировывают оставшиеся тяжелые инертные газы. Затем, полученные фракции исследовали. Одним из методов поиска был спектральный анализ: газ помещали в разрядную трубку, подключали ток и по линиям спектра определяли “кто есть кто”.
Когда в разрядную трубку поместили первую, самую легкую и низкокипящую фракцию воздуха, то в спектре наряду с известными линиями азота, гелия и аргона были обнаружены новые линии, из них особенно яркими были красные и оранжевые. Они придавали свету в трубке огненную окраску. В момент, когда Рамзай наблюдал спектр только что полученного газа, в лабораторию вошел его двенадцатилетний сын, успевший стать “болельщиком” отцовых работ. Увидев необычное свечение, он воскликнул: “new one!” Так возникло название газа “неон”, по-древнегречески значит “новый”.
После того как были открыты гелий, неон и аргон, завершающие три первых периода таблицы Менделеева, уже не вызывало сомнений, что четвёртый, пятый и шестой периоды тоже должны оканчиваться инертным газом. Но найти их удалось не сразу. Это и неудивительно: в 1 м3 воздуха 9, 3 л аргона и всего лишь 0, 08 мл ксенона. Но к тому времени стараниями ученых, прежде всего англичанина Траверса, появилась возможность получать значительные количества жидкого воздуха. Стал доступен даже жидкий водород. Благодаря этому Рамзай совместно с Траверсом смог заняться исследованием наиболее труднолетучей фракции воздуха, получающейся после отгонки гелия, водорода, неона, кислорода, азота и аргона. Остаток содержал сырой (то есть неочищенный) криптон (“скрытый”). Однако после откачки его в сосуде неизменно оставался пузырек газа. Этот газ голубовато светился в электрическом разряде и давал своеобразный спектр с линиями в областях от оранжевой до фиолетовой. Характерные спектральные линии — визитная карточка элемента. У Рамзая и Траверса были все основания считать, что открыт новый инертный газ. Его назвали ксеноном, что в переводе с греческого значит “чужой”: в криптоновой фракции воздуха он действительно выглядел чужаком. В поисках нового элемента и для изучения его свойств Рамзай и Траверс переработали около ста тонн жидкого воздуха; индивидуальность ксенона как нового химического элемента они установили, оперируя всего 0,2 см3 этого газа. Необычайная для того времени тонкость эксперимента! Хотя содержание ксенона в атмосфере крайне мало, именно воздух — практически единственный и неисчерпаемый источник ксенона. Неисчерпаемый — потому, что почти весь ксенон возвращается в атмосферу.
Заслуга открытия высшего представителя инертных газов принадлежит тому же Рамзаю. При помощи весьма тонких технических приёмов он доказал, что радиоактивное истечение из радия – эманация радия – представляет собой газ, подчиняющийся всем законам обычных газов, химически инертный и обладающий характерным спектром. Его молекулярный вес – около 220 – был Рамзаем измерен по скорости диффузии. Если предположить, что ядро атома эманации радия – это остаток ядра радия после выбрасывания из него ядра атома гелия - a -частицы, то заряд его должен быть равен 88-2=86, т.е. новый элемент должен действительно быть инертным газом с атомным весом 226-4=222.
 Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов.
Таким образом, после блестящих экспериментов 16 марта 1900 г. в Лондоне произошла встреча Менделеева и Рамзая, на которой было официально решено включить в периодическую систему новую группу химических элементов.
Аргон
История открытия Аргона
В 1785 г. английский химик и физик Г. Кавендиш обнаружил в воздухе какой-то новый газ, необыкновенно устойчивый химически. На долю этого газа приходилась примерно одна сто двадцатая часть объема воздуха. Но что это за газ, Кавендишу выяснить не удалось.
Об этом опыте вспомнили 107 лет спустя, когда Джон Уильям Стратт (лорд Рэлей) натолкнулся на ту же примесь, заметив, что азот воздуха тяжелее, чем азот, выделенный из соединений. Не найдя достоверного объяснения аномалии, Рэлей через журнал “Nature” обратился к коллегам-естествоиспытателям с предложением вместе подумать и поработать над разгадкой ее причин...
Спустя два года Рэлей и У. Рамзай установили, что в азоте воздуха действительно есть примесь неизвестного газа, более тяжелого, чем азот, и крайне инертного химически.
Когда они выступили с публичным сообщением о своем открытии, это произвело ошеломляющее впечатление. Многим казалось невероятным, чтобы несколько поколений ученых, выполнивших тысячи анализов воздуха, проглядели его составную часть, да еще такую заметную – почти процент!
Кстати, именно в этот день и час, 13 августа 1894 г., аргон и получил свое имя, которое в переводе с греческого значит “недеятельный”. Его предложил председательствовавший на собрании доктор Медан.
Между тем нет ничего удивительного в том, что аргон так долго ускользал от ученых. Ведь в природе он себя решительно ничем не проявлял! Напрашивается параллель с ядерной энергией: говоря о трудностях ее выявления, А. Эйнштейн заметил, что нелегко распознать богача, если он не тратит своих денег...
Скепсис ученых был быстро развеян экспериментальной проверкой и установлением физических констант аргона. Но не обошлось без моральных издержек: расстроенный нападками коллег (главным образом химиков) Рэлей оставил изучение аргона и химию вообще и сосредоточил свои интересы на физических проблемах. Большой ученый, он и в физике достиг выдающихся результатов, за что в 1904 г. был удостоен Нобелевской премии. Тогда в Стокгольме он вновь встретился с Рамзаем, который в тот же день получал Нобелевскую премию за открытие и исследование благородных газов, в том числе и аргона.
Обобщение истории открытия
Аргон был открыт как инертный газ в атмосфере в 1894 Дж.Рэлеем, который обнаружил, что атмосферный азот на 0,5% тяжелее, чем полученный химическим путем. Разница объяснялась присутствием ничтожного количества более тяжелых инертных газов, преимущественно аргона. Этот элемент был первым из инертных газов, обнаруженных в природе на нашей планете. Содержание аргона в атмосфере составляет 0,93%(об.), причем его несколько больше над поверхностью больших водоемов, чем над сушей, так как азот и кислород более растворимы в воде. В электротехнической промышленности ежемесячно расходуется несколько тысяч кубических метров аргона для создания инертной среды в лампах накаливания: аргоновая среда позволяет снизить скорость испарения вольфрамовой нити и предотвращает ее окисление.
Строение Аргона
Аргон это газ с завершенным последним электронным уровнем
Ar 1S2 2S2 2P6 3S2 3P6
10 электронов
18 протонов
22 нейтрона
Физические свойства
Общие свойства инертных газов
Все благородные газы– бесцветные одноатомные газ без цвета и запаха
обладают более высокой электропроводностью по сравнению с другими газами и при прохождении через них тока ярко светятсяНасыщенный характер атомных молекул инертных газов сказывается и в том, что инертные газы имеют более низкие точки сжижения и замерзания, чем другие газы с тем же молекулярным весом.
Из подгруппы тяжелых инертных газов аргон самый легкий. Он тяжелее воздуха в 1,38 раза. Жидкостью становится при – 185,9°C, затвердевает при – 189,4°C (в условиях нормального давления). В отличие от гелия и неона, он довольно хорошо адсорбируется на поверхностях твердых тел и растворяется в воде (3,29 см3 в 100 г воды при 20°C). Еще лучше растворяется аргон во многих органических жидкостях. Зато он практически нерастворим в металлах и не диффундирует сквозь них.
Как все инертные газы, аргон диамагнитен. Это значит, что его магнитная восприимчивость отрицательна, он оказывает большее противодействие магнитным силовым линиям, чем пустота. Это свойство аргона (как и многие другие) объясняется “замкнутостью” электронных оболочек его атомов.
Под действием электрического тока аргон ярко светится, сине-голубое свечение аргона широко используется в светотехнике.
Теперь о влиянии аргона на живой организм. При вдыхании смеси из 69% Ar, 11% азота и 20% кислорода под давлением 4 атм возникают явления наркоза, которые выражены гораздо сильнее, чем при вдыхании воздуха под тем же давлением. Наркоз мгновенно исчезает после прекращения подачи аргона. Причина – в неполярности молекул аргона, повышенное же давление усиливает растворимость аргона в нервных тканях.
Биологи нашли, что аргон благоприятствует росту растений. Даже в атмосфере чистого аргона семена риса, кукурузы, огурцов и ржи выкинули ростки. Лук, морковь и салат хорошо прорастают в атмосфере, состоящей из 98% аргона и только 2% кислорода.
Химические свойства
Химическая инертность аргона (как и других газов этой группы) и одноатомность его молекул объясняются прежде всего предельной насыщенностью электронных оболочек. Тем не менее разговор о химии аргона сегодня не беспредметен.
Есть основания считать, что исключительно нестойкое соединение Hg – Ar, образующееся в электрическом разряде, – это подлинно химическое (валентное) соединение. Не исключено, что будут получены валентные соединения аргона с фтором и кислородом, которые, скорее всего, будут неустойчивыми, Как нестойки и даже взрывоопасны окислы ксенона – газа, более тяжелого и явно более склонного к химическим реакциям, чем аргон.
Еще в конце прошлого века француз Вийяр, сжимая аргон под водой при 0°C, получил кристаллогидрат состава Аr · 6Н2О, а в 20...30-х годах XX столетия Б.А. Никитиным, Р.А. Франкраном и другими исследователями при повышенных давлениях и низких температурах были получены кристаллические клатратные соединения аргона с h3S, SO2, галогеноводородами, фенолами и некоторыми другими веществами. В 1976 г. появилось сообщение о синтезе гидрида аргона, но пока еще трудно сказать, является ли этот гидрид истинно химическим, валентным соединением.
Вот пока и все успехи химии...
Аргон на Земле и во Вселенной
На Земле аргона намного больше, чем всех прочих элементов его группы, вместе взятых. Его среднее содержание в земной коре (кларк) в 14 раз больше, чем гелия, и в 57 раз больше, чем неона. Есть аргон и в воде, до 0,3 см3 в литре морской и до 0,55 см3 в литре пресной воды. Любопытно, что в воздухе плавательного пузыря рыб аргона находят больше, чем в атмосферном воздухе. Это потому, что в воде аргон растворим лучше, чем азот...
Главное “хранилище” земного аргона – атмосфера. Его в ней (по весу) 1,286%, причем 99,6% атмосферного аргона – это самый тяжелый изотоп – аргон-40. Еще больше доля этого изотопа в аргоне земной коры. Между тем у подавляющего большинства легких элементов картина обратная – преобладают легкие изотопы.
Причина этой аномалии обнаружена в 1943 г. В земной коре находится мощный источник аргона-40 – радиоактивный изотоп калия 40К. Этого изотопа на первый взгляд в недрах немного – всего 0,0119% от общего содержания калия. Однако абсолютное количество калия-40 велико, поскольку калий – один из самых распространенных на нашей планете элементов. В каждой тонне изверженных пород 3,1 г калия-40.
Радиоактивный распад атомных ядер калия-40 идет одновременно двумя путями. Примерно 88% калия-40 подвергается бета распаду и превращается в кальций-40. Но в 12 случаях из 100 (в среднем) ядра калия-40 не излучают, а, наоборот, захватывают по одному электрону с ближайшей к ядру К-орбиты (“К-захват”). Захваченный электрон соединяется с протоном – образуется новый нейтрон в ядре и излучается нейтрино. Атомный номер элемента уменьшается на единицу, а масса ядра остается практически неизменной. Так калий превращается в аргон.
Период полураспада 40К достаточно велик – 1,3 млрд лет. Поэтому процесс образования 40Аr в недрах Земли будет продолжаться еще долго, очень долго. Поэтому, хотя и чрезвычайно медленно, но неуклонно будет возрастать содержание аргона в земной коре и атмосфере, куда аргон “выдыхается” литосферой в результате вулканических процессов, выветривания и перекристаллизации горных пород, а также водными источниками.
Правда, за время существования Земли запас радиоактивного калия основательно истощился – он стал в 10 раз меньше (если возраст Земли считать равным 4,5 млрд лет.).
Соотношение изотопов 40Аr: 40К и 40Ar: 36Аr в горных породах легло в основу аргонного метода определения абсолютного возраста минералов. Очевидно, чем больше эти отношения, тем древнее порода. Аргонный метод считается наиболее надежным для определения возраста изверженных пород и большинства калийных минералов. За разработку этого метода профессор Э.К. Герлинг в 1963 году удостоен Ленинской премии.
Итак, весь или почти весь аргон-40 произошел на Земле от калия-40. Поэтому тяжелый изотоп и доминирует в земном аргоне.
Этим фактором объясняется, кстати, одна из аномалий периодической системы. Вопреки первоначальному принципу ее построения – принципу атомных весов – аргон поставлен в таблице впереди калия. Если бы в аргоне, как и в соседних элементах, преобладали легкие изотопы (как это, по-видимому, имеет место в космосе), то атомный вес аргона был бы на две-три единицы меньше...
Теперь о легких изотопах.
Откуда берутся 36Аr и 38Аr? Не исключено, что какая-то часть этих атомов реликтового происхождения, т.е. часть легкого аргона пришла в земную атмосферу из космоса при формировании нашей планеты и ее атмосферы. Но большая часть легких изотопов аргона родилась на Земле в результате ядерных процессов.
Вероятно, еще не все такие процессы обнаружены. Скорее всего некоторые из них давно прекратились, так как исчерпались короткоживущие атомы-“родители”, но есть и поныне протекающие ядерные процессы, в которых рождаются аргон-36 и аргон-38. Это бета-распад хлора-36, обстрел альфа-частицами (в урановых минералах) серы-33 и хлора-35:
36
17Cl β–→ 3618Ar + 0–1e + ν.33
16S + 42He → 3618Ar + 10n.35
17Cl + 42He → 3818Ar + 10n + 0+1e.В материи Вселенной аргон представлен еще обильнее, чем на нашей планете. Особенно много его в веществе горячих звезд и планетарных туманностей. Подсчитано, что аргона в космосе больше, чем хлора, фосфора, кальция, калия – элементов, весьма распространенных на Земле.
В космическом аргоне главенствуют изотопы 36Аr и 38Аr, аргона-40 во Вселенной очень мало. На это указывает масс-спектральный анализ аргона из метеоритов. В том же убеждают подсчеты распространенности калия. Оказывается, в космосе калия примерно в 50 тыс. раз меньше, чем аргона, в то время как на Земле их соотношение явно в пользу калия – 660 : 1. А раз мало калия, то откуда же взяться аргону-40?!
Применение
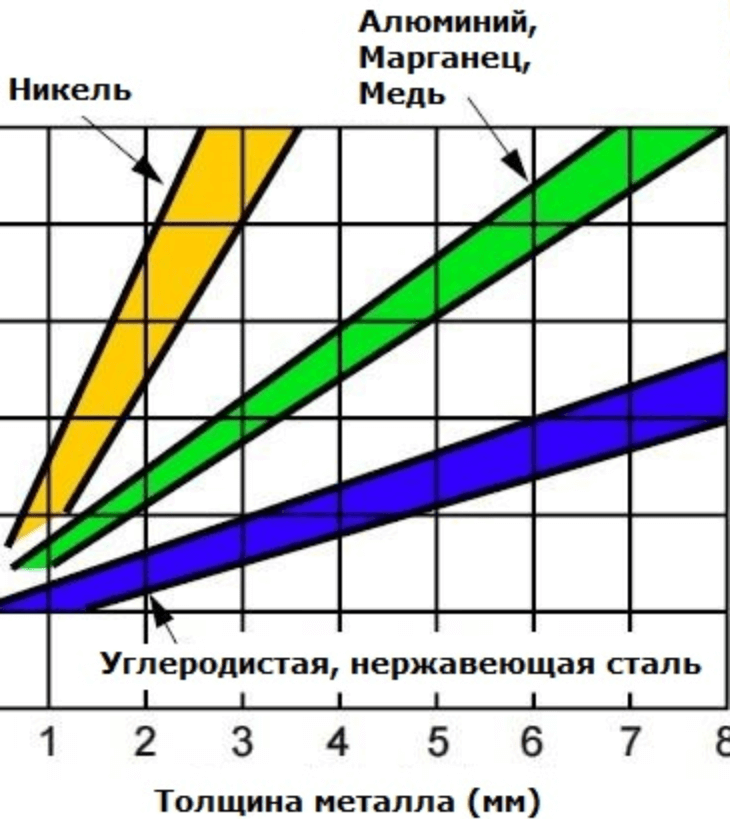
Все шире применяется дуговая электросварка в среде аргона. В аргонной струе можно сваривать тонкостенные изделия и металлы, которые прежде считались трудносвариваемыми. Не будет преувеличением сказать, что электрическая дуга в аргонной атмосфере внесла переворот в технику резки металлов. Процесс намного ускорился, появилась возможность резать толстые листы самых тугоплавких металлов. Продуваемый вдоль столба дуги аргон (в смеси с водородом) предохраняет кромки разреза и вольфрамовый электрод от образования окисных, нитридных и иных пленок. Одновременно он сжимает и концентрирует дугу на малой поверхности, отчего температура в зоне резки достигает 4000—6000° С. К тому же эта газовая струя выдувает продукты резки. При сварке в аргонной струе нет надобности во флюсах и электродных покрытиях, а стало быть, и в зачистке шва от шлака и остатков флюса
Как добывают аргон
Земная атмосфера содержит 66 · 1013 т аргона. Этот источник аргона неисчерпаем, тем более что практически весь аргон рано или поздно возвращается в атмосферу, поскольку при использовании он не претерпевает никаких физических или химических изменений. Исключение составляют весьма незначительные количества изотопов аргона, расходуемые на получение в ядерных реакциях новых элементов и изотопов.
Получают аргон как побочный продукт при разделении воздуха на кислород и азот. Обычно используют воздухоразделительные аппараты двукратной ректификации, состоящие из нижней колонны высокого давления (предварительное разделение), верхней колонны низкого давления и промежуточного конденсатора-испарителя. В конечном счете азот отводится сверху, а кислород – из пространства над конденсатором.
Летучесть аргона больше, чем кислорода, но меньше, чем азота. Поэтому аргонную фракцию отбирают в точке, находящейся примерно на трети высоты верхней колонны, и отводят в специальную колонну. Состав аргонной фракции: 10...12% аргона, до 0,5% азота, остальное – кислород. В “аргонной” колонне, присоединенной к основному аппарату, получают аргон с примесью 3...10% кислорода и 3...5% азота. Дальше следует очистка “сырого” аргона от кислорода (химическим путем или адсорбцией) и от азота (ректификацией). В промышленных масштабах ныне получают аргон до 99,99%-ной чистоты. Аргон извлекают также из отходов аммиачного производства – из азота, оставшегося после того, как большую его часть связали водородом.
Аргон хранят и транспортируют в баллонах емкостью 40 л, окрашенных в серый цвет с зеленой полосой и зеленой надписью. Давление в них 150 атм. Более экономична перевозка сжиженного аргона, для чего используют сосуды Дюара и специальные цистерны.
Искусственные радиоизотопы аргона получены при облучении некоторых стабильных и радиоактивных изотопов (37Cl, 36Аr, 40Аr, 40Са) протонами и дейтонами, а также при облучении нейтронами продуктов, образовавшихся в ядерных реакторах при распаде урана. Изотопы 37Аr и 41Аr используются как радиоактивные индикаторы: первый – в медицине и фармакологии, второй – при исследовании газовых потоков, эффективности спетом вентиляции и в разнообразных научных исследованиях. Но, конечно, не эти применения аргона самые важные.
studyport.ru
Благородные газы - это... Что такое Благородные газы?
| ||||||
| ||||||
| ||||||
| ||||||
Ине́ртные, или благоро́дные газы — химические элементы 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы VIII группы)[1].
К инертным газам относятся гелий, неон, аргон, криптон, ксенон, радон, и, возможно, унуноктий.Химические свойства
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определенных условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он сильно радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Унуноктий, несмотря на его принадлежность к 18 группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов он будет находиться в твердом состоянии [2].
Физические свойства
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[3][4]. Известны случаи гибели людей при утечках аргона.
Вдыхание радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются в следующем порядке (в сравнении приведены также азот и водород): Xe — Кr — Ar — N2 — h3 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа, азот — свыше 0,6 МПа, водород — свыше 2,0 МПа. Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[5].
Применение
Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. В частности, жидкий гелий, который кипит при 4,2 К (−268,95 °C; −452,11 °F), используется для магнитной сверхпроводимости, которая используется для магнитно-резонансной томографии и ядерного магнитного резонанса. Жидкий неон хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что у него охлаждающие свойства более чем в 40 раз выше, чем у жидкого гелия и более чем в три раза выше, чем у жидкого водорода.
Гелий используется как компонент дыхательного газа (дыхательной смеси) вместо азота, благодаря пониженной растворимости в жидкостях, особенно в липидах. Газы поглощаются кровью и биологическими тканями, когда они находятся под давлением, как например в подводном плавании, что является причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости, маленький гелий задерживается клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Пониженная растворимость гелия даёт другие выгоды в условии, известном как декомпрессионная болезнь. Уменьшение остатка растворённого газа в теле означает, что меньшее количество газовых пузырьков образуется во время всплытия. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[6] для подводного плавания, а также в больших количествах используется для обработки жидкой стали.
После крушения дирижабля Гинденбург в 1937, гелий заменил водород в качестве поднимающего газа в дирижаблях и воздушных шарах благодаря лёгкости и невоспламеняемости, несмотря на 8,6 % уменьшение плавучести (buoyancy).
См. также
Примечания
Ссылки
dikc.academic.ru
Благородный газ Википедия
| ||||||
| ||||||
| ||||||
| ||||||
Благоро́дные га́зы (также ине́ртные или ре́дкие га́зы[1]) — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запаха и вкуса с очень низкой химической реактивностью[en]. К благородным газам относятся гелий (He), неон (Ne), аргон (Ar), криптон (Kr), ксенон (Xe) и радиоактивный радон (Rn). Формально к этой группе также причисляют недавно открытый оганесон (Og), однако его химические свойства почти не исследованы.
В первых 6 периодах периодической таблицы химических элементов инертные газы относятся к последней, 18-й группе. Возможно, что из-за релятивистских эффектов элемент 7-го периода 14-й группы флеровий обладает некоторыми свойствами благородных газов[2]. Он может заменить в периодической таблице оганесон[3]. Благородные газы химически неактивны и способны участвовать в химических реакциях лишь при экстремальных условиях.
Характеристики благородных газов объяснены современными теориями структуры атома: их электронные оболочки из валентных электронов являются заполненными, тем самым позволяя участвовать лишь в очень малом количестве химических реакций: известны всего несколько сотен химических соединений этих элементов. При нормальном давлении температуры плавления и кипения у любого благородного газа отличаются менее чем на 10 °C; таким образом, они остаются жидкими лишь в малом температурном интервале.
Неон, аргон, криптон и ксенон выделяют из воздуха специальными установками, используя при этом методы сжижения газов и фракционированной конденсации. Источником гелия являются месторождения природного газа с высокой концентрацией гелия, который отделяется с помощью методов криогенного разделения газов. Радон обычно получают как продукт радиоактивного распада радия из растворов соединений этого элемента.
Химические свойства
Неон, как и все благородные газы, имеет полную электронную оболочку. Все атомы благородных газов имеют на внешней орбите 8 электронов. Исключением является гелий (только 2 электрона)Благородные газы не имеют цвета, запаха, вкуса, а также не возгораются при нормальных условиях.
| 2 | гелий | 2 |
| 10 | неон | 2, 8 |
| 18 | аргон | 2, 8, 8 |
| 36 | криптон | 2, 8, 18, 8 |
| 54 | ксенон | 2, 8, 18, 18, 8 |
| 86 | радон | 2, 8, 18, 32, 18, 8 |
Соединения
Структура тетрафторида ксенона XeF4, одного из первых когда-либо обнаруженных соединений благородных газовИнертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность (по сравнению с лёгкими инертными газами), но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона.
Оганесон, несмотря на его принадлежность к 18-й группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов, влияющих на движение электронов вблизи его ядра с высоким зарядом, он будет находиться в твердом состоянии[4].
Физические свойства
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов и планет земной группы
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[5][6]. Известны случаи гибели людей при утечках инертных газов.
Вдыхание значительного количества радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются по убыванию в следующем порядке (в сравнении приведены также азот и водород): Xe — Kr — Ar — N2 — h3 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа (2 атм), азот — свыше 0,6 МПа (6 атм), водород — свыше 2,0 МПа (20 атм). Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[7].
Применение
Благородные газы в вакуумных стеклянных колбах, через которые пропущен токИнертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. Жидкий гелий, который кипит при 4,2 К (−268,95 °C), используется для получения сверхпроводимости — в частности, для охлаждения сверхпроводящих обмоток электромагнитов, применяемых, например, для магнитно-резонансной томографии и других приложений ядерного магнитного резонанса. Жидкий неон, хотя его температура кипения (–246,03 °C) и не достигает таких низких значений как у жидкого гелия, также находит применение в криогенике, потому что его охлаждающие свойства (удельная теплота испарения) более чем в 40 раз лучше, чем у жидкого гелия, и более чем в три раза лучше, чем у жидкого водорода.
Гелий, благодаря его пониженной растворимости в жидкостях, особенно в липидах, используется вместо азота как компонент дыхательных смесей для дыхания под давлением (например, при подводном плавании). Растворимость газов в крови и биологических тканях растёт под давлением. В случае использования для дыхания обычного воздуха или других азотсодержащих дыхательных смесей это может стать причиной эффекта, известного как азотное отравление.
Благодаря меньшей растворимости в липидах, атомы гелия задерживаются клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Кроме того, пониженная растворимость гелия в жидкостях тела позволяет избежать кессонной болезни при быстром всплытии с глубины. Уменьшение остатка растворённого газа в теле означает, что во время всплытия образуется меньшее количество газовых пузырьков; это уменьшает риск газовой эмболии. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[8][неавторитетный источник?] для подводного плавания.
Аргон, наиболее дешёвый среди инертных газов (его содержание в атмосфере составляет около 1 %), широко используется при сварке в защитных газах, резке и других приложениях для изоляции от воздуха металлов, реагирующих при нагреве с кислородом (и азотом), а также для обработки жидкой стали. Аргон также применяется в люминесцентных лампах для предотвращения окисления разогретого вольфрамового электрода. Также, ввиду низкой теплопроводности, аргон (а также криптон) используют для заполнения стеклопакетов.
После крушения дирижабля «Гинденбург» в 1937 году огнеопасный водород был заменен негорючим гелием в качестве заполняющего газа в дирижаблях и воздушных шарах, несмотря на снижение плавучести на 8,6 % по сравнению с водородом. Несмотря на замену, катастрофа оказала непропорционально большое влияние на всю область герметичных летательных аппаратов легче воздуха и подорвала планы по расширению этой области авиации более чем на полвека. Они стали популярнее только в последнее время, с развитием нановолоконных тканей и альтернативной энергетики.
Цвета и спектры благородных газов
См. также
Примечания
Литература
- Беннетт, Питер. The Physiology and Medicine of Diving / Питер Беннетт, Эллиотт. — SPCK Publishing, 1998. — ISBN 0-7020-2410-4.
- Bobrow Test Preparation Services. CliffsAP Chemistry. — CliffsNotes, 2007-12-05. — ISBN 0-470-13500-X.
- Гринвуд, Н.Н. Chemistry of the Elements / Н.Н. Гринвуд, Ёрншо. — 2nd. — Oxford:Butterworth-Heinemann, 1997. — ISBN 0-7506-3365-4.
- Хардинг, Чарли Дж. Elements of the P Block / Чарли Дж. Хардинг, Джейнс. — Royal Society of Chemistry, 2002. — ISBN 0-85404-690-9.
- Холловэй, Джон. Noble-Gas Chemistry. — Лондон : Methuen Publishing, 1968. — ISBN 0-412-21100-9.
- Менделеев, Дмитрий. Основы Химии. — 7-е. — 1902–1903.
- Оджима, Минору. Noble Gas Geochemistry / Минору Оджима, Подосек. — Cambridge University Press, 2002. — ISBN 0-521-80366-7.
- Вайнхольд, Ф. Valency and bonding / Ф. Вайнхольд, Лэндис. — Cambridge University Press, 2005. — ISBN 0-521-83128-8.
- Скерри, Эрик. The Periodic Table, Its Story and Its Significance. — Oxford University Press, 2007. — ISBN 0-19-530573-6.
Ссылки
|
wikiredia.ru
Благородные (инертные) газы
| 2He | 10Ne | 18Ar | 36Kr | 54Xe | 86Rn | |
| Атомная масса | 4,0026 | 20,984 | 39,948 | 83,80 | 131,30 | [222] |
| Валентные электроны | 1s2 | (2)2s22p6 | (8)3s23p6 | (18)4s24p6 | (18)5s25p6 | (18)6s26p |
| Радиус атома | 0,122 | 0,160 | 0,192 | 0,198 | 0,218 | 0,22 |
| Энергия ионизации Э- → Э+ | 24,59 | 21,57 | 15,76 | 14,00 | 12,13 | 10,75 |
| Содержание в земной атмосфере, % | 5*10-4 | 1,8*10-3 | 9,3*10-1 | 1,1*10-4 | 8,6*10-6 | 6*10-20 |
Все благородные газы входят в состав атмосферы, их содержание в атмосфере составляет по объёму (%): гелия – 4,6 * 10-4; аргона – 0,93; криптона – 1,1* 10-4; ксенона – 0,8 * 10-6 и радона – 6 * 10-8 . Все они при нормальных условиях – газы без запаха и цвета, плохо растворимые в воде. Их температуры кипения и плавления возрастают с увеличением размеров атомов. Молекулы одноатомны.
| Свойства | He | Ne | Ar | Kr | Xe | Rn |
| Атомный радиус, нм | 0,122 | 0,160 | 0,191 | 0,201 | 0,220 | 0,231 |
| Энергия ионизации атомы, эВ | 24,58 | 21,56 | 15,76 | 14,00 | 12,13 | 10,75 |
| Температура кипения, оС | -268,9 | -245,9 | -185,9 | -153,2 | -181,2 | Около -65 |
| Температура плавления, оС | -272,6(под давлением) | -248,6 | -189,3 | -157,1 | -111,8 | Около -71 |
| Растворимость в 1 л воды при 0 оС, мл | 10 | - | 60 | - | 50 | - |
Гелий обнаружен в 1868г. Методом спектрального анализа солнечного излучения (Локьер и Франкленд, Англия; Жансен, Франция). На Земле Гелий был найден в 1894г. В минерале клевеите (Рамзай, Англия).
От греч. ἥλιος — «Солнце» (см. Гелиос). Любопытен тот факт, что в названии элемента было использовано характерное для металлов окончание «-ий» (по лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»). В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3.
Особая устойчивость электронной структуры атома отличает гелий от всех остальных химических элементов периодической системы.
Гелий по физическим свойствам наиболее близок к молекулярному водороду. Вследствие ничтожной поляризуемости атомов гелия, у него самые низкие температуры кипения и плавления.
Гелий хуже других газов растворяется в воде и в других растворителях. В Обычных условиях гелий химически инертен, но при сильном возбуждении атомов он может образовывать молекулярные ионы. В обычных условиях эти ионы неустойчивы; захватываю недостающий электрон, они распадаются на два нейтральных атома. Возможно также образование ионизированных молекул. Гелий – наиболее трудно сжимаемый из всех газов.
Гелий удаётся перевести в жидкое состояние только при температуре, приближающийся к абсолютному нулю, т.е. -273,15. Жидкий гелий при температура около 2К обладает уникальным свойством – сверхтекучестью, которая в 1938г. Была открыта П.Л. Капицей и теоретически обоснована Л.Д. Ландау, создавшим квантовую теорию свертекучести. Жидкий гелий существует в двух модификациях: гелий I, который ведет себя как обычная жидкость, и гелий II – сверхтеплопроводная и сверхлетучая жидкость. Гелий II проводит теплоту в 107 раз лучше, чем гелий I ( и в 1000 раз лучше, чем серебро). Он практически не имеет никакой вязкости, мгновенно проходит через узкие капилляры, самопроизвольно переливается через стенки сосудов в виде тонкой плёнки. Атомы He в сверхтекучем состоянии ведут себя почти так же, как электроны в сверхпроводниках.
В земной коре гелий накапливается за счёт распада частиц радиоактивных элементов, содержится растворенным в минералах, в самородных металлах.
Ядра гелия чрезвычайно устойчивы и широко используются для проведения различных ядерных реакций.
В промышленности гелий в основном выделяют из природных газов методом глубокого охлаждения. При этом он, как самое низкокипящее вещество, остается в виде газа, тогда как все остальные газы конденсируются.
Газообразный гелий применяется для создания инертной атмосферы при сварке металлов, при консервации пищевых продуктов и др. Жидкий гелий применяется в лаборатории в качестве хладоагента в физике низких температур.
§2. Неон
Неон открыли в июне 1898 года шотландский химик Уильям Рамзай и английский химик Морис Траверс. Они выделили этот инертный газ «методом исключения», после того, как кислород, азот, и все более тяжёлые компоненты воздуха были превращены в жидкость. Элементу дали незамысловатое название «неон», что в переводе с греческого означает «новый». В декабре 1910 года французский изобретатель Жорж Клод сделал газоразрядную лампу, заполненную неоном.Название происходит от греч. νέος — новый.
Существует легенда, согласно которой название элементу дал тринадцатилетний сын Рамзая — Вилли, который спросил у отца, как тот собирается назвать новый газ, заметив при этом, что хотел бы дать ему имя novum (лат. — новый). Его отцу понравилась эта идея, однако он посчитал, что название neon, образованное от греческого синонима, будет звучать лучше.
Неон, как и гелий, обладает очень высоким ионизационным потенциалом(21,57 эВ), поэтому соединений валентного типа не образует. Основное отличие его от гелия обуславливается относительно большей поляризуемостью атом, т.е. несколько большей склонностью образовывать межмолекулярную связь.
Неон имеет очень низкие температуры кипения (-245,9 оС) и плавления (-248,6 оС), уступая лишь гелию и водороду. По сравнению с гелием у неона несколько большая растворимость и способность адсорбироваться.
Как и гелий, неон при сильном возбуждении атомов образует молекулярные ионы типа Ne2+ .
Неон получают совместно с гелием в качестве побочного продукта в процессе сжижения и разделения воздуха. Разделение гелия и неона осуществляется за счёт адсорбции или конденсации. Адсорбированный метод основан на способности неона в отличии от гелия адсорбироваться активированным углём, охлаждённым жидким азотом. Конденсационный способ основан на вымораживании неона при охлаждении смеси жидким водородом.
Неон применяется в электровакуумной технике для наполнения стабилизаторов напряжения, фотоэлементов и других приборов. Различные типы неоновых ламп с характерным красным свечением употребляют на маяках и в других осветительных устройствах, в световой рекламе и т.п.
Природный неон состоит из трёх стабильных изотопов: 21Ne и 22Ne.
В мировой материи неон распределен неравномерно, однако в целом по распространенности во Вселенной он занимает пятое место среди всех элементов — около 0,13 % по массе. Наибольшая концентрация неона наблюдается на Солнце и других горячих звездах, в газовых туманностях, в атмосфере внешних планет Солнечной системы — Юпитера, Сатурна, Урана, Нептуна. В атмосфере многих звезд неон занимает третье место после водорода и гелия. Из всех элементов второго периода неон — самый малочисленный на Земле. В рамках восьмой группы неон по содержанию в земной коре занимает третье место — после аргона и гелия. Газовые туманности и некоторые звезды содержат неона во много раз больше, чем его находится на Земле.
На Земле наибольшая концентрация неона наблюдается в атмосфере — 1,82·10−3%по объему, а его общие запасы оцениваются в 7,8·1014 м³. В 1 м³ воздуха содержится около 18,2 см³ неона (для сравнения: в том же объеме воздуха содержится только 5,2 см³ гелия). Среднее содержание неона в земной коре мало − 7·10−9% по массе. Всего на нашей планете около 6,6·1010 т неона. В изверженных породах находится около 109 т этого элемента. По мере разрушения пород газ улетучивается в атмосферу. В меньшей мере атмосферу снабжают неоном и природные воды.
Причину неоновой бедности нашей планеты ученые усматривают в том, что некогда Земля потеряла свою первичную атмосферу, которая и унесла с собой основную массу инертных газов, которые не могли, как кислород и другие газы, химически связаться с другими элементами в минералы и тем самым закрепиться на планете.
§3. Аргон
В 1892 году британский ученый Джон Стретт, более известный нам как лорд Рэлей (см. Критерий Рэлея), занимался одной из тех однообразных и не слишком увлекательных работ, без которых тем не менее не может существовать экспериментальная наука. Он исследовал оптические и химические свойства атмосферы, поставив перед собой цель измерить массу литра азота с точностью, которой до него никому не удавалось достичь.
Однако результаты этих измерений казались парадоксальными. Масса литра азота, полученного методом удаления из воздуха всех других известных тогда веществ (таких, как кислород), и масса литра азота, полученного посредством химической реакции (пропусканием аммиака над нагретой до красного каления медью) оказывались разными. Получалось, что азот из воздуха на 0,5% тяжелее азота, полученного химическим путем. Это расхождение не давало Рэлею покоя. Убедившись, что никаких ошибок в эксперименте допущено не было, Рэлей опубликовал в журнале Nature письмо, в котором спрашивал, не может ли кто-нибудь объяснить причину этих расхождений.
Сэр Уильям Рамзай (Рэмзи) (Sir William Ramsay, 1852–1916), работавший в то время в Университетском колледже в Лондоне, ответил Рэлею на это письмо. Рамзай предположил, что в атмосфере может присутствовать не открытый еще газ, и для выделения этого газа предложил использовать новейшее оборудование. В проведенном эксперименте обогащенный кислородом воздух, смешанный с водой, подвергался воздействию электрического разряда, что вызывало соединение атмосферного азота с кислородом и растворение образующихся окислов азота в воде. К концу эксперимента, после того как весь азот и кислород из воздуха уже были исчерпаны, в сосуде все еще оставался маленький пузырек газа. Когда через этот газ пропустили электрическую искру и подвергли его спектроскопии, ученые увидели неизвестные ранее спектральные линии (см. Спектроскопия). Это означало, что был открыт новый элемент. Рэлей и Рамзай опубликовали свои результаты в 1894 году, назвав новый газ аргоном, от греческого «ленивый», «безразличный». А в 1904 году оба они за эту работу получили Нобелевскую премию. Однако она не была разделена между учеными, как это принято в наше время, а каждый получил премию в своей области — Рэлей по физике, а Рамзай — по химии.
Имел место даже своего рода конфликт. В то время многие ученые полагали, что «владеют» отдельными областями исследований, и не было до конца ясно, давал ли Рэлей Рамзаю разрешение работать над этой проблемой. К счастью, оба ученых оказались достаточно мудры, чтобы осознать преимущества совместной работы, и, сообща опубликовав ее результаты, они исключили возможность неприятной борьбы за первенство.
Аргон — одноатомный газ. Имея относительно больший размер атома, аргон более склонен к образованию межмолекулярных связей, чем гелий и неон. Поэтому аргон в виде просо вещества характеризуется несколько более высокими температурами кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота) и плавления(-184,3°C). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Аргон образует межмолекулярные соединения включения – клатраты примерного состава Ar*6h30 представляет собой кристаллическое вещество, разлагающееся при атмосферном давлении и температуре -42,8 °C. Его можно получить непосредственно взаимодействием аргона с водой при 0°C и давлении порядка 1,5*107 Па. С соединениями h3S, SO2, CO2, HCl аргон даёт двойные гидраты, т.е. смешанные клатраты.
Аргон получают при разделении жидкого воздуха, а также из отходов газов синтеза аммиака. Аргон применяют в металлургических и химических процессах, требующих инертной атмосферы, в светотехнике, электротехнике, ядерной энергетике и т.п.
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе.
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе, его запасы в атмосфере оцениваются в 4·1014 т. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере — 4·10-6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10-5 — 9,7·10-5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т.
§4. Криптон
В 1898 году английский учёный У.Рамзай выделил из жидкого воздуха (предварительно удалив кислород, азот и аргон) смесь, в которой спектральным методом были открыты два газа: криптон («скрытый», «секретный») и ксенон («чуждый», «необычный»).
От греч. κρυπτός — скрытый.
Находится в атмосферном воздухе. Образуется при ядерном делении, в том числе и в результате естественных процессов, происходящих в рудах радиоактивных металлов. Криптон получают как побочный продукт при воздуха разделении.
Газообразный кислород, содержащий Kr и Хе, из конденсатора установки для получения О2 подается на ректификацию в т. наз. криптоновую колонну, в к-рой Kr и Хе извлекаются из газообразного О2 при промывке его флегмой, образующейся в верх, конденсаторе криптоновой колонны. Кубовая жидкость при этом обогащается Kr и Хе; ее затем практически полностью испаряют, неиспаривщаяся часть -т. наз. бедный жрилтонксеноновый концентрат (менее 0,2% Kr и Хе) - непрерывно поступает через испаритель в газгольдер. При оптимальном флегмовом числе 0,13 степень извлечения Kr и Хе составляет 0,90. Выделенный концентрат сжимают до 0,5-0,6 МПа и через теплообменник подают в нагретый до ~1000 К контактный аппарат с СuО для выжигания содержащихся в нем углеводородов. После охлаждения в водяном холодильнике газовую смесь очищают от примесей СО2 и воды с помощью КОН сначала в скрубберах, а затем в баллонах. Выжигание и очистку повторяют неск. раз. Очищенный концентрат охлаждают и непрерывно подают в ректификац. колонну под давлением 0,2-0,25 МПа. При этом Kr и Хе накапливаются в кубовой жидкости до содержания 95-98%. Эту т. наз. сырую криптон-ксeноновую смесь через газификатор, аппарат для выжигания углеводородов и систему очистки направляют в газгольдеры. Из газгольдера газовая смесь поступает в газификатор, где ее конденсируют при 77 К. Часть этой смеси подвергают фракционированному испарению. В результате послед. очистки от О2 в контактном аппарате с СuО получают чистый криптон. Оставшуюся газовую смесь подвергают адсорбции в аппаратах с активир. углем при 200-210 К; при этом выделяется чистый криптон, а Хе и часть криптона поглощаются углем. Адсорбированные Kr и Хе разделяют фракционированной десорбцией. При мощности 20000 м3/ч перерабатываемого воздуха (273 К, 0,1 МПа) получают в год 105 м3 криптона. Его добывают также из метановой фракции продувочных газов в произ-ве Nh4. Выпускают чистый криптон (более 98,9% по объему криптона), техн. (более 99,5% смеси Kr и Хе) и крип-тон-ксеноновую смесь (менее 94,5% криптона). Используют криптон для наполнения ламп накаливания, газоразрядных и рентгеновских трубок. Радиоактивный изотоп 85Kr используют как источник b-излучения в медицине, для обнаружения течей в вакуумных установках, как изотопный индикатор при исследованиях коррозии, для контроля износа деталей. Хранят и транспортируют криптон и его смеси с Хе под давлением 5-10 МПа при 20°С в герметичных стальных баллонах черного цвета соотв. с одной желтой полосой и надписью "криптон" и двумя желтыми полосами и надписью "криптон-ксенон". Криптон открыли в 1898 У. Рамзай и М. Траверс. Лит.
§5. Ксенон
Открыт в 1898 году английскими учеными У.Рамзаем и У. Рэлей как небольшая примесь к криптону.
От греч. ξένος — чужой.
Температура плавления −112 °C,температура кипения −108 °C,свечение в разряде фиолетовым цветом.
Первый инертный газ, для которого были получены настоящие химические соединения. Примерами соединений могут быть дифторид ксенона, тетрафторид ксенона, гексафторид ксенона, триоксид ксенона.
Получают ксенон как побочный продукт при воздуха разделении. Его выделяют из криптон-ксенонового концентрата (см. Криптон). Выпускают ксенон чистый (99,4% по объему) и высокой чистоты (99,9%).Ксенон получают как побочный продукт производства жидкого кислорода на металлургических предприятиях.
В промышленности ксенон получают как побочный продукт разделения воздуха на кислород и азот. После такого разделения, которое обычно проводится методом ректификации, получившийся жидкий кислород содержит небольшие количества криптона и ксенона. Дальнейшая ректификация обогащает жидкий кислород до содержания 0.1-0.2 % криптоноксеноновой смеси, которая отделяется адсорбированием на силикагель или дистилляцией. В заключение, ксеноно-криптоновый концентрат может быть разделен дистилляцией на криптон и ксенон.
Из-за своей малой распространенности, ксенон гораздо дороже более легких инертных газов.
Несмотря на высокую стоимость, ксенон незаменим в ряде случаев:
- Ксенон используют для наполнения ламп накаливания, мощных газоразрядных и импульсных источников света (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания).
- Радиоактивные изотопы (127Xe, 133Xe, 137Xe, и др.) применяют в качестве источников излучения в радиографии и для диагностики в медицине, для обнаружения течи в вакуумных установках.
- Фториды ксенона используют для пассивации металлов.
- Ксенон как в чистом виде, так и с небольшой добавкой паров цезия-133, является высокоэффективным рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов.
- С конца XX века ксенон стал применяться как средство для общего наркоза (достаточно дорогой, но абсолютно нетоксичный, точнее — как инертный газ — не вызывает химических последствий). Первые диссертации о технике ксенонового наркоза в России — 1993 г., в качестве лечебного наркоза эффективно применяется для снятия острых абстинентных состояний и лечения наркомании, а также психических и соматических расстройств.
- Жидкий ксенон иногда используется как рабочая среда лазеров.
- Фториды и оксиды ксенона предложены в качестве мощнейших окислителей ракетного топлива, а так же в качестве компонентов газовых смесей для лазеров.
- В изотопе 129Xe возможно поляризовать значительную часть ядерных спинов для создания состояния с сонаправленными спинами — состояния называемого гиперполяризацией.
- Ксенон используется в конструкции ячейки Голея.
- В качестве химических катализаторов.
- Для транспортировки фтора, проявляющего сильные окисляющие свойства.
Ксенон находится в земной атмосфере в крайне незначительных количествах, 0.087±0.001 миллионной доли (μL/L), а также встречается в газах, испускаемых некоторыми минеральными источниками. Некоторые радиоактивные изотопы ксенона, например, 133Xe и 135Xe, получаются как результат нейтронного облучения ядерного топлива в реакторах.
§6. Радон
Английский ученый Э. Резерфорд в 1899 году отметил, что препараты тория испускают, кроме α-частиц, и некое неизвестное ранее вещество, так что воздух вокруг препаратов тория постепенно становится радиоактивным. Это вещество он предложил назвать эмана́цией (от латинского emanatio — истечение) тория и дать ему символ Em. Последующие наблюдения показали, что и препараты радия также испускают некую эманацию, которая обладает радиоактивными свойствами и ведет себя как инертный газ.
Первоначально эманацию тория называли торо́ном, а эманацию радия — радо́ном. Было доказано, что все эманации на самом деле представляют собой радионуклиды нового элемента — инертного газа, которому отвечает атомный номер 86. Впервые его выделили в чистом виде Рамзай и Грей в 1908 году, они же предложили назвать газ нитон (от лат. nitens, светящийся). В 1923 году газ получил окончательное название радон и символ Em был сменен на Rn.
Радон — радиоактивный одноатомный газ без цвета и запаха. Растворимость в воде 460 мл/л; в органических растворителях, в жировой ткани человека растворимость радона в десятки раз выше, чем в воде. Газ хорошо просачивается сквозь полимерные плёнки. Легко адсорбируется активированным углем и силикагелем.
Собственная радиоактивность радона вызывает его флюоресценцию. Газообразный и жидкий радон флюоресцирует голубым светом, у твёрдого радона при охлаждении до азотных температур цвет флюоресценции становится сперва жёлтым, затем красно-оранжевым.
Радон образует клатраты, которые, хотя и имеют постоянный состав, химических связей с участием атомов радона в них нет. С фтором радон при высоких температурах образует соединения состава RnFn, где n = 4, 6, 2. Так, дифторид радона RnF2 является белым нелетучим кристаллическим веществом. Фториды радона могут быть получены также под действием фторирующих агентов (например, фторидов галогенов). При гидролизе тетрафторида RnF4 и гексафторида RnF6 образуется оксид радона RnO3. Получены также соединения с катионом RnF+.
Для получения радона через водный раствор любой соли радия продувают воздух, который уносит с собой образующийся при радиоактивном распаде радия радон. Далее воздух тщательно фильтруют для отделения микрокапель раствора, содержащего соль радия, которые могут быть захвачены током воздуха. Для получения собственно радона из смеси газов удаляют химически активные вещества (кислород, водород, водяные пары и т. д.), остаток конденсируют жидким азотом, затем из конденсата отгоняют азот и другие инертные газы (аргон, неон и т.д).
Радон используют в медицине для приготовления радоновых ванн. Радон используется в сельском хозяйстве для активации кормов домашних животных[источник не указан 272 дня], в металлургии в качестве индикатора при определении скорости газовых потоков в доменных печах, газопроводах. В геологии измерение содержания радона в воздухе и воде применяется для поиска месторождений урана и тория, в гидрологии — для исследования взаимодействия грунтовых и речных вод. Динамика концентрации радона в подземных водах может применяться для прогноза землетрясений.
Входит в состав радиоактивных рядов 238U, 235U и 232Th. Ядра радона постоянно возникают в природе при радиоактивном распаде материнских ядер. Равновесное содержание в земной коре 7·10−16% по массе. Ввиду химической инертности радон относительно легко покидает кристаллическую решётку «родительского» минерала и попадает в подземные воды, природные газы и воздух. Поскольку наиболее долгоживущим из четырёх природных изотопов радона является 222Rn, именно его содержание в этих средах максимально.
Концентрация радона в воздухе зависит в первую очередь от геологической обстановки (так, граниты, в которых много урана, являются активными источниками радона, в то же время над поверхностью морей радона мало), а также от погоды (во время дождя микротрещины, по которым радон поступает из почвы, заполняются водой; снежный покров также препятствует доступу радона в воздух). Перед землетрясениями наблюдалось повышение концентрации радона в воздухе, вероятно, благодаря более активному обмену воздуха в грунте ввиду роста микросейсмической активности.
(Галина Афанасьевна – HELP с криптоном,ксеноном, аргоном!может ещё чтото добавить? И что писать дальше?)страница 1 
Смотрите также:
Благородные (инертные) газы 207.91kb. 1 стр.
Колин Ферт: «Последний легион» приключенческий роман-путешествие Сражения, мечи, кони, скачки, благородные порывы, ответственность за принятие решений и, конечно же 37.69kb. 1 стр.
Основные источники углеводородов нефть,природный и попутный нефтяной газы, уголь. Запасы их не безграничны 56.28kb. 1 стр.
moglobi.ru
Инертные газы - общие понятия, свойства и применение
Инертные газы, которые еще называют благородными, занимают главную подгруппу восьмой группы периодической системы. Их насчитывается всего шесть: гелий (He), неон (Ne), аргон (Ar), ксенон (Xe) и радон (Rn). Чтобы понять природу, для начала рассмотрим понятие инертности. Инертность – это слабая выраженность или отсутствие способности вступать в реакцию с другими химическими элементами. Вызвать химическую реакцию для образования новых связей у подобных веществ практически невозможно.
Соответственно, инертный газ – это редкий благородный одноатомный газ, обладающий высокой инертностью, которая обусловлена энергетически устойчивым внешним уровнем электронной оболочки атома. Например, у гелия в этой оболочке расположено два электрона, а у других благородных газов – по восемь. Этим объясняются их физические и химические свойства. Все инертные газы при нормальных условиях представляют собой бесцветные газы, не обладающие запахом и плохо растворимые в воде. Их температуры кипения и плавления увеличиваются сообразно увеличению размеров атомов.
До 1962 года ученые были уверены, что все благородные газы являются абсолютно инертными. Но канадский химик Н. Бартлетт смог доказать обратное, получив первое химическое соединение ксенона, так называемый гексафтороплатинат ксенона. Это соединение представляет собой твердое оранжевое вещество с кристаллической решеткой. В дальнейшем ряд соединений был значительно расширен.
Распространенность и образование в природе
Во Вселенной из благородных газов больше всего распространен гелий, а в земных условиях – аргон (по объему он занимает 0,934%). В очень маленьких количествах инертные газы имеются в горных породах и в газах природных горючих материалов, а в растворенном виде их можно найти в нефти и воде.
В природных условиях благородные газы могут образовываться как результат различных ядерных реакций. Например, источником радона служат радиоактивные препараты урана. Часть этих химических элементов имеет космогенное происхождение.
Все инертные газы, кроме родона, имеют ряд изотопов.
Запасы этих газов не уменьшаются. Только гелий постепенно, очень медленно, рассеивается в межзвездном пространстве.
Применение
Инертные газы нашли широкое применение в области электротехники. Аргон, ввиду своей неактивности и низкой теплопроводности, используется в смеси с азотом для наполнения электрических ламп. Аргоном и неоном наполняют трубки для световых реклам, при этом они светятся голубым, а неоновые – оранжево-красным.
Еще аргон используют в химической лабораторной практике. В промышленности он нашел свое применение для термической обработки легкоокисляемых металлов. Аргон создает защитную атмосферу, в которой можно производить сварку или резку редких и цветных металлов, плавку вольфрама, титана, циркония. Для контроля вентиляционных систем применяют радиоактивный изотоп аргона.
Криптон и ксенон обладают еще меньшей теплопроводностью, чем аргон, поэтому наполненные ими электрические лампы долговечнее и экономичнее, чем таковые, наполненные азотом или аргоном.
Водолазы дышат смесью гелия и кислорода, что позволяет значительно удлинить время их пребывания под водой и резко ослабляет болезненные явления, вызываемые изменением давления при подъеме на поверхность.
Жидкий гелий применяется в качестве хладоагента в различных исследованиях, поскольку температура кипения этого газа составляет -268,9°С.
Свойством полной инертности гелия пользуются для проведения сварки в его атмосфере, для производства сверхчистых металлов, хроматографии. А его высокая проницаемость позволила создать течеискатели в аппаратах низкого и высокого давления.
fb.ru
Благородные газы - это... Что такое Благородные газы?
| ||||||
| ||||||
| ||||||
| ||||||
Ине́ртные, или благоро́дные газы — химические элементы 18-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы VIII группы)[1].
К инертным газам относятся гелий, неон, аргон, криптон, ксенон, радон, и, возможно, унуноктий.Химические свойства
Инертные газы отличаются химической неактивностью (отсюда и название). Тем не менее, в 1962 году Нил Барлетт показал, что все они при определенных условиях могут образовывать соединения (особенно охотно со фтором). Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен (для инертных газов) и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он сильно радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено, в отличие от ксенона. Унуноктий, несмотря на его принадлежность к 18 группе периодической таблицы, может не являться инертным газом, так как предполагается, что при нормальных условиях в силу релятивистских эффектов он будет находиться в твердом состоянии [2].
Физические свойства
Инертные газы бесцветны и не имеют запаха. В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
Биологическое действие
Инертные газы не ядовиты. Однако атмосфера с увеличенной концентрацией инертных газов и соответствующим снижением концентрации кислорода может оказывать удушающее действие на человека, вплоть до потери сознания и смерти[3][4]. Известны случаи гибели людей при утечках аргона.
Вдыхание радиоактивного радона может вызвать рак.
Инертные газы обладают биологическим действием, которое проявляется в их наркотическом воздействии на организм и по силе этого воздействия располагаются в следующем порядке (в сравнении приведены также азот и водород): Xe — Кr — Ar — N2 — h3 — Ne — He. При этом ксенон и криптон проявляют наркотический эффект при нормальном барометрическом давлении, аргон — при давлении свыше 0,2 МПа, азот — свыше 0,6 МПа, водород — свыше 2,0 МПа. Наркотическое действие неона и гелия в опытах не регистрируются, так как под давлением раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[5].
Применение
Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике. В частности, жидкий гелий, который кипит при 4,2 К (−268,95 °C; −452,11 °F), используется для магнитной сверхпроводимости, которая используется для магнитно-резонансной томографии и ядерного магнитного резонанса. Жидкий неон хотя и не достигает таких низких температур как жидкий гелий, также находит применение в криогенике, потому что у него охлаждающие свойства более чем в 40 раз выше, чем у жидкого гелия и более чем в три раза выше, чем у жидкого водорода.
Гелий используется как компонент дыхательного газа (дыхательной смеси) вместо азота, благодаря пониженной растворимости в жидкостях, особенно в липидах. Газы поглощаются кровью и биологическими тканями, когда они находятся под давлением, как например в подводном плавании, что является причиной эффекта, известного как азотное отравление. Благодаря меньшей растворимости, маленький гелий задерживается клеточной мембраной, и поэтому гелий используется в дыхательных смесях, таких как тримикс и гелиокс, уменьшая наркотический эффект газов, возникающий на глубине. Пониженная растворимость гелия даёт другие выгоды в условии, известном как декомпрессионная болезнь. Уменьшение остатка растворённого газа в теле означает, что меньшее количество газовых пузырьков образуется во время всплытия. Другой инертный газ, аргон, рассматривается как лучший выбор для использования в качестве прослойки к сухому костюму[6] для подводного плавания, а также в больших количествах используется для обработки жидкой стали.
После крушения дирижабля Гинденбург в 1937, гелий заменил водород в качестве поднимающего газа в дирижаблях и воздушных шарах благодаря лёгкости и невоспламеняемости, несмотря на 8,6 % уменьшение плавучести (buoyancy).
См. также
Примечания
Ссылки
dic.academic.ru