Состав аргона различных сортов. Оксид аргона 8
Оксиды – Химия 8 класс
Химические формулы оксидов и их названия
Вам уже известно, что оксиды – это бинарные соединения, в состав которых обязательно входит химический элемент кислород. На сегодняшний день получены оксиды всех существующих в природе химических элементов кроме трех: гелия, неона и аргона.
Рассмотрим химические формулы оксидов, с которыми мы уже встречались: CO2, SO2, Fe3O4 и т.д. Как видно, в формулах оксидов на первом месте принято записывать химический символ элемента, который образует оксид, а на втором – химический символ кислорода.
Попробуем вывести общую формулу для оксидов, то есть формулу, при помощи которой можно составить формулу оксида любого элемента.
Элемент, образующих оксид, будем обозначать буквой R, а его валентность в оксиде, как х. С учетом того, что валентность кислорода равна II, получим:
Итак, общая формула оксидов: R2Ox.
Рассмотрим пример. Необходимо составить формулы оксидов серы, в которых сера проявляет валентность IV и VI. Получаем:
В тех случаях, когда оксид образован химическим элементом с переменной валентностью, после названия оксида, в скобках, римской цифрой указывается валентность элемента в данном оксиде. Например:
SO2 – оксид серы (IV), SO3 – оксид серы (VI).
Если валентность химического элемента постоянна, естественно, он может образовать с кислородом только один оксид. В таких случаях валентность в скобках после названия не указывается. Например:
ZnO – оксид цинка
Классификация оксидов
Оксиды – весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд природных пигментов. Оксидами также является класс минералов, представляющих собой соединения металлов с кислородом.
Самым распространенным оксидом в земной коре является минерал кварц, его систематическое название – оксид кремния (IV) – SiO2. Этот оксид образует множество различных минералов, которые геологи объединяют в минералы группы кварца.
По своему агрегатному состоянию оксиды могут быть газообразными: углекислый газ CO2, сернистый газ SO2 – эти газы бесцветны. А оксид азота (IV) NO2 – газ коричневого цвета.
Оксидов – жидкостей в обычных условиях сравнительно немного. Примеры таких оксидов: вода – оксид водорода, оксид марганца (VII) Mn2O7, оксид хлора (VII) Cl2O7, оксид хлора (VI) ClO3.
Большинство оксидов – твердые вещества, имеющие молекулярное или ионное строение.

Оксиды металлов имеют ионное строение. В кристаллических решетках оксидов металлов находятся ионы кислорода O2− и ионы соответствующего металла.
Оксиды неметаллов, как правило, имеют молекулярное строение. На рисунке 139 приведена модель молекулы оксида фосфора (V). Химическая формула оксида фосфора (V), которую мы уже записывали не раз – P2O5. На самом деле это эмпирическая, простейшая формула. Истинная химическая формула, которая реально отвечает строению оксида фосфора (V) – P4O10
Существуют оксиды и атомного строения. К таким оксидам относятся оксид бора B2O3, оксид кремния (IV) SiO2. Кристаллические решетки этих оксидов состоят из атомов.
Применение оксидов
Многие оксиды нашли разнообразное применение в различных сферах деятельности человека.
Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически нерастворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды. TiO2 добавляют в качестве наполнителя в мыло, лекарственные препараты, которые выпускаются в виде таблеток.
Оксид хрома (III) – Cr2O3 – кристаллы темно-зеленого цвета (см. рисунок 138, а), нерастворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это далеко не единственное их применение
Оксиды неметаллов так же имеют широкое применение. Углекислый газ, или оксид углерода (IV) – CO2 применяется как наполнитель углекислотных огнетушителей, так как данный оксид негорюч. Сернистый газ, или оксид серы (IV) – SO2 применяется в качестве дезинфицирующего вещества для зернохранилищ.
Как вы уже заметили, множество химических веществ имеют тривиальные названия. Ниже приведены тривиальные названия некоторых оксидов:
| Химическая формула | Химическое название | Тривиальное название |
| СО | Оксид углерода (II) | Угарный газ |
| СО2 | Оксид углерода (IV) | Углекислый газ |
| SO2 | Оксид серы (IV) | Сернистый газ |
| Al2O3 | Оксид алюминия | Глинозём |
| СаО | Оксид кальция | Негашеная известь |
- Оксиды – бинарные соединения, в состав которых входит химический элемент кислород
- Оксиды известны для всех химических элементов, встречающихся в природе, кроме гелия, неона, аргона
- Общая формула оксидов R2Ox
- В названии оксида нужно указывать валентность образующего оксид химического элемента, если она переменная
- Оксиды существуют во всех трех агрегатных состояниях, имеют разнообразную окраску и отличаются по строению
idaten.ru
Физические свойства газов, используемых в криогенной технике. Воздух, Аргон, СО2, Этилен, Гелий, Водород, метан, Азот, Оксид азота N20, Кислород, SF6 - гексафторид серы.
|
www.dpva.ru
Состав аргона различных сортов
| Показатель | Сорт | ||
| высший | 1-й | 2-й | |
| Содержание аргона, %, не менее | | 99,98 | 99,95 |
| Содержание кислорода, %, не более | 0,001 | 0,003 | 0,005 |
| Содержание азота, %, не более | 0,008 | 0,01 | 0,04 |
| Содержание влаги, при давлении 0,1 МПа, г/см, не более | 0,01 | 0,03 | 0,03 |
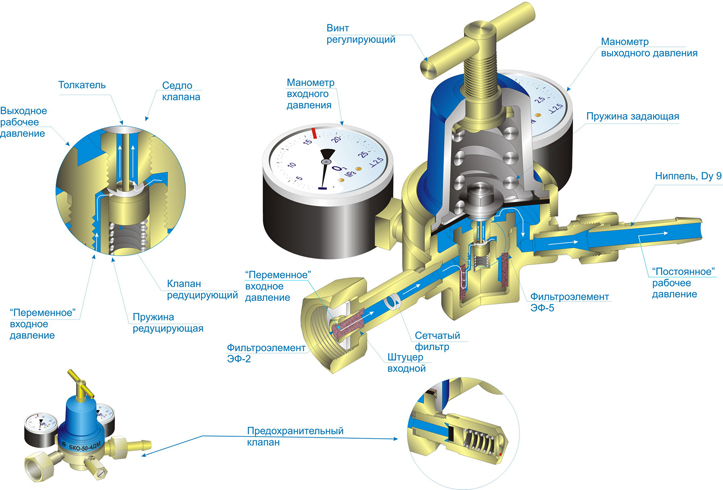
Электродуговая сварка в защитном газе применяется в тех случаях, когда свариваемые металлы очень активны химически и при высокой температуре интенсивно взаимодействуют с кислородом воздуха (окисляются или даже сгорают). К таким металлам относятся сплавы на основе алюминия, титана и ряда других, редко применяемых в технике.
При этом виде сварки поток защитного газа должен омывать нагретые участки сварного шва и зону горения сварочной дуги, так как в ней непосредственно происходит плавление присадочной проволоки, выполненной из того же, что и свариваемые заготовки, материала.
Недостатком сварки в среде аргона и гелия является их высокая стоимость.
Сварку в углекислом газе выполняют только плавящимся электродом на повышенных плотностях постоянного тока обратной полярности. Такой режим обусловлен теми же особенностями переноса электродного металла и формирования шва, которые рассмотрены для сварки плавящимся электродом в аргоне.
При применении СО2 в качестве защитного газа необходимо учитывать некоторые металлургические особенности процесса сварки, связанные с окислительным действием СО2. При высоких температурах сварочной дуги СО2 диссоциирует на оксид углерода СО и кислород О, который, если не принять специальных мер, приводит к окислению свариваемого металла и легирующих элементов. Окислительное действие О нейтрализуется введением в проволоку дополнительного количества раскислителей марганца и кремния. Поэтому для сварки в СО углеродистых низколегированных сталей применяют сварочную проволоку с повышенным содержанием этих элементов (Св-08ГС, Св-10Г2С и т. д.). На поверхности шва образуется тонкая шлаковая корка из оксидов раскислителей. Часто применяют смесь СО2 + 10% О2. Кислород играет ту же роль, что и при добавке в аргон.
Процесс сварки в углекислом газе необходимо вести на короткой дуге. При сварке на токах 200–250А длина дуги должна быть в пределах 1,5–4,0 мм, так как увеличение длины дуги повышает разбрызгивание жидкого металла и угар легирующих элементов. Существуют оптимальные соотношения между сварочным током и напряжением на дуге. Сварка возможна на постоянном токе, а также на переменном токе с применением осциллятора.
Для сварки плавящимся электродом в среде углекислого газа используются полуавтоматы и автоматы, причем для полуавтоматической сварки – полуавтоматы ПДШ-500, ПШ-54 и др.
Наиболее оригинальный полуавтомат А-547-Р для электродуговой сварки тонкой электродной проволокой в защитной среде углекислого газа спроектирован и изготовлен в Институте электросварки имени Е. О. Патона. Полуавтоматом можно выполнять сварку различных соединений листового металла толщиной до 3 мм и угловых соединений при катетах шва до 4 мм. Сварка возможна во всех пространственных положениях. Сварка производится электродной проволокой диаметром 0,8–1,0 мм постоянным током. Напряжение дуги составляет 17–21 В, сварочный ток – 70–200 А.
Сварка в атмосфере защитных газов в зависимости от степени механизации процессов подачи присадочной или сварочной проволоки и перемещения сварочной горелки может быть ручной, полуавтоматической и автоматической (рис. 7.2). По сравнению с ручной сваркой покрытыми электродами и автоматической под флюсом сварка в защитных газах имеет следующие преимущества: высокая степень защиты расплавленного металла от воздействия воздуха; отсутствие на поверхности шва при применении аргона оксидов и шлаковых включений; возможность ведения процесса во всех пространственных положениях; возможность визуального наблюдения за процессом формирования шва и его регулирования; более высокая производительность процесса, чем при ручной дуговой сварке; относительно низкая стоимость сварки в углекислом газе.
Области применения сварки в защитных газах охватывают широкий круг материалов и изделий (узлы летательных аппаратов, элементы атомных установок, корпуса и трубопроводы химических аппаратов и т. п.). Аргонодуговую сварку применяют для цветных (алюминия, магния, меди) и тугоплавких (титана, ниобия, ванадия, циркония) металлов и их сплавов, а также легированных и высоколегированных сталей.
В углекислом газе сваривают конструкции из углеродистой и низколегированной сталей (газо- и нефтепроводы, корпуса судов и т. д.). Преимущество полуавтоматической сварки в СО2 с точки зрения ее стоимости и производительности часто приводит к замене ею ручной дуговой сварки покрытыми электродами.
Рис. 7.2. Схемы сварки в среде защитных газов:
1 – присадочный пруток или проволока; 2 – сопло; 3 – токопроводящий мундштук; 4 – корпус горелки; 5 – неплавящийся вольфрамовый электрод;
6 – рукоять горелки; 7 – атмосфера защитного газа; 8 – сварочная дуга;
9 – ванна расплавленного металла; 10 – кассета с проволокой; 11 – механизм подачи; 12 – плавящийся металлический электрод (сварочная проволока)
Рекомендуемые типы сварных соединений для аргонодуговой сварки неплавящимся и плавящимся электродом приведены на рис. 7.3.
Рис. 7.3. Рекомендуемые типы сварных соединений для аргонодуговой сварки:
а, б, в, г, к, л, м, н, о – для сварки плавящимся и неплавящимся электродом; д, е, ж, з, и – для сварки неплавящимся электродом
(е – вариант для алюминиевых и магниевых сплавов)
studfiles.net
Оксиды благородных газов - Справочник химика 21
Источники газообразных углеводородов — в первую очередь, природные и нефтяные попутные газы, а также некоторые синтетические газы, полученные при переработке горючих ископаемых (например, термическая и термокаталитическая переработка нефти и нефтепродуктов, термическое разложение — газификация — твердого и жидкого топлив, а также коксование твердого топлива — коксовый газ). В отличие от природных, синтетические газы наряду с алканами содержат также и ненасыщенные углеводороды, значительные количества водорода и др. Природные газы содержат в основном метан и менее 20 % в сумме этана, пропана и бутана, примеси легкокипящих жидких углеводородов — пентана, гексаиа и др. Кроме того, присутствуют малые количества оксида углерода (IV), азота, сероводорода и благородных газов. Многие горючие природные газы, залегающие на глубине не более 1,5 км, состоят почти из одного метана. С увеличением глубины отбора содержание гомологов метана обычно растет. Образование горючих природных газов — в основном результат катагенетического преобразования органических веществ осадочных горных пород. Залежи горючих газов формируются в природных ловушках на путях его миграции. Миграция происходит при статической или динамической нагрузке пород, выжимающих газ, а также свободной диффузии газа из областей высокого давления в зоны меньшего давления. Подземными природными резервуарами для 85 % общего числа газовых и газоконденсатных залежей являются песчаные, песча-но-алевритные и алевритные породы, нередко переслоенные глинами. В остальных 15 % случаев коллекторами газа служат карбонатные породы. Все газовые и газонефтяные месторождения приурочены к тому или иному газонефтеносному осадочному (осадочно-породному) бассейну, представляющему собой автономные области крупного и длительного погружения в современной структуре земной коры. Все больше открывается газовых месторождений в зоне шельфа и в мелководных бассейнах, например Северное море. Наиболее крупные газовые месторождения СССР—Уренгойское и Заполярное — приурочены к меловым отложениям Западно-Сибирского бассейна. [c.194]
Периодическое изменение свойств элементов представлено в периодической таблице современного вида. При расположении элементов в порядке возрастания атомных номеров и группировке на основании общих свойств они образуют семь горизонтальных рядов, называемых периодами. Каждый вертикальный столбец - группа элементов - содержит элементы с близкими свойствами. Группа лития (Ы), состоит, например, из шести элементов. Все эти элементы - крайне реакционноспособные металлы, образующие хлориды и оксиды общей формулы ЭС1 и Э2О соответственно. Так же, как хлорид натрия, все хлориды и оксиды этих элементов — ионные соединения. В противоположность этому группа гелия, расположенная по правому краю таблицы, состоит из крайне инертных элементов (к настоящему времени известны соединения только ксенона и криптона). Элементы группы гелия известны под названием благородные газы. [c.127]
Большая часть углеводородов, 60% органических соединений 0,26—0,28 Кислород, азот, сероводород, оксид углерода, метан, этан, благородные газы.............0,28—0,30 [c.39]
Какой объем природного газа, который содержит метан (объемная доля 96%), азот, благородные газы, оксиды углерода и незначительные количества других примесей, потребуется для получения водорода, при помощи которого можно восстановить оксид молибдена (VI) массой [c.199]
ОКСИДЫ БЛАГОРОДНЫХ ГАЗОВ [c.346]
Получение. В технике азот получают нз жидкого воздуха. Воздух — это смесь газов, главным образом азота и кислорода. Сухой воздух у поверхности Земли содержит в объемных долях азота 78,09%, кислорода 20,95%, благородных газов 0,93%, оксида углерода (IV) 0,03 %. Случайные примеси пыль, микроорганизмы, сероводород, оксид серы (IV) и др. Воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (т. кип. азота —195,8 °С, кислорода —183 С). Получаемый таким образом азот содержит примеси благородных газов (преимущественно аргона). [c.103]
Эта теория в течение многих лет была предана почти полному забвению в результате критики Брунауэра, считавшего, что эффект поляризации недостаточно велик. Однако расчеты поверхностного потенциала, выполненные за последние годы, а учетом сил электрического изображения, показали, что при адсорбции органических молекул и благородных газов на металлах, графите, оксиде алюминия и др. возникают достаточно высокие Дф (до 0,8 В). [c.165]
Газы, предназначенные для наполнения газоразрядных и осветительных ламп, для создания восстановительной или инертной среды, необходимой для выполнения многих технологических операций, очищают разными способами. Для очистки благородных газов, азота и водорода от кислорода применяют губчатую медь (хуже медные опилки, стружки). Губчатую медь получают, восстанавливая чистый оксид меди СыО водородом в виде слабо спекшейся массы с сильно развитой поверхностью. Ею заполняют кварцевые трубы, по которым пропускают очищаемый газ. Трубы нагревают до 270—300° С. При этом губчатая медь активно поглощает кислород. [c.268]
В вертикальных столбцах таблицы — группах располагаются элементы, обладающие одинаковой валентностью в высших солеобразующих оксидах (она указана римской цифрой). Каждая группа разделена на две подгруппы, одна из которых (главная) включает элементы малых периодов и четных рядов больших периодов, а другая (побочная) образована элементами нечетных рядов больших периодов. Различия между главными и побочными подгруппами ярко проявляются в крайних группах таблицы (исключая VIII). Так, главная подгруппа I группы включает очень активные щелочные металлы, энергично разлагающие воду, тогда как побочная подгруппа состоит из меди Си,серебра Ag и золота Аи, малоактивных в химическом отношении. В VII группе главную подгруппу составляют активные неметаллы фтор F, хлор С1, бром Вг, иод I и астат At, тогда как у элементов побочной подгруппы — марганца Мп, технеция Тс и рения Re — преобладают металлические свойства. VIII группа элементов, занимающая особое положение, состоит из девяти элементов, разделенных на три триады очень сходных друг с другом элементов, и подгруппы благородных газов. [c.22]
Примерами веществ с молекулярной решеткой в неорганической химии являются лед, твердый оксид углерода (IV) ( сухой лед ), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (Рг, С12, ВГг, Ь, Н2, О2, N2), трех-(Оз), четырех-(Р4), восьми- (5р)-атомными молекулами.Молекулярная кристаллическая решетка иода представлена на рис. 41. Большинство кристаллических органических соединений имеют молекулярную решетку. [c.106]
Примерами их являются лед, твердый оксид углерода (IV) ( сухой лед ), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (Ра, С1а, Вга,Та, На, Оа, N2), [c.77]
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико. Примерами их являются лед, твердый оксид углерода (IV) ( сухой лед ), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (Е а, С1а, Вга, Ь, Нг, Ог, N2), [c.79]
Почти все химические элементы образуют оксиды. До настоящего времени еще не получены оксиды трех элементов — благородных газов гелия, неона и аргона. [c.123]
В природном газе содержатся углеводороды с низкой молекулярной массой. Он имеет следующий примерный состав (по объему) 80—98% метана, 2—3% его ближайших гомологов — этана, пропана, бутана и небольшое количество примесей — сероводорода, азота, благородных газов, оксида углерода (IV) и паров воды. Так, например, газ Ставропольского месторождения содержит 97,7 метана и 2,3% прочих газов, газ Саратовского месторождения — 93,4% метана, 3,6% этана, пропана, бутана и 3% негорючих газов. [c.304]
Как самый электроотрицательный из химических элементов (см. табл. 15) фтор во всех соединениях, в том числе и с кислородом (ОРг), проявляет степень окисления —1. Остальные галогены могут проявлять в соединениях и положительную степень окисления. Фтор реагирует почти со всеми простыми и сложными веществами, включая некоторые благородные газы. При реакции с аморфным оксидом кремния(IV) фтор воспламеняется [c.258]
Химия элементов, образующих группу благо(юдных газов, довольно ограничена, поскольку эти элементы обладают чрезвычайно устойчивыми электронными конфигурациями. Единственными примерами, свидетельствующими о наличии реакционной способности у благородных газов, являются фториды и оксиды ксенона, а также Кгр2. [c.329]
Кислород образует оксиды практически со всеми химическими элементами (кроме нескольких благородных газов). В большинстве случаев оксиды получаются прямым соединением простых веществ при нагревании. Некоторые оксиды (оксиды хлора, брома, золота и др.) могут быть получены только косвенным путем. [c.128]
Четвертый ряд также начинается со щелочного металла — калия. Судя по тому, как изменялись свойства в двух предыдущих рядах, можно было бы ожидать, что н здесь они будут изменяться в той же последовательности и седьмым элементом в ряду будет опять галоген, а восьмым — благородный газ. Однако этого ие наблюдается. Вместо галогена на седьмом месте находится марганец— металл, образующий как основные, так и кислотные оксиды, из которых лишь высший МпгОт аналогичен соответствующему оксиду хлора С12О7). После марганца в том же ряду стоят еще три металла — железо, кобальт и никель, очень сходные друг с другом. И только следующий, пятый ряд, начинающийся с меди, заканчивается благородным газом криптоном. Шестой ряд снова начинается со щелочного металла рубидия и т. д. Таким образом, у элементов, следующих за аргоном, более или менее полное поч вторение свойств наблюдается только через восемнадцать элементов, а не через восемь, как было во втором и третьем рядах. Эти восемнадчать элементов образуют четвертый — так называемый большой период, состоящий из двух рядов. [c.50]
Сквозная полная аналогия не просматривается и среди элемен тов УШАтруппы, хотя все они относятся к благородным газам Однако и здесь можно выделить типические элементы (неон и ар гон) и элементы подгруппы криптона, у которых в отличие от типи ческих присутствует заполненная предвнешняя (я—1) -оболочка Элементы подгруппы криптона характеризуются заметной хими ческой активностью и, как известно, в своих высших оксидах и фторидах могут проявлять степень окисления, отвечающую номеру группы (ЭО4, ЭРв). Следовательно, и в этой группе, как и у всех р-элементов, суш,ествует неполная электронная аналогия между типическими элементами и остальными р-элементами VIII группы. Следует отметить, что здесь типические элементы вообще не определяют облик группы в целом в силу своей химической инертности. [c.13]
Высшая положительная валентность элементов обычно отвечает номеру группы, причем в высших оксидах и гидроксидах кислотный характер растет слева направо по периодам, а основной — ослабевает. У фтора вообще не обнаружена положительная валентность в соединениях он всегда одновалентен. Положительная валентность кислорода проявляется только в соединениях с фтором и равна двум. Железо, кобальт и никель проявляют высшую валентность соответственно шесть, четыре и три, палладий — четыре, родий, иридий и платина — шесть, бром и астат — пять. У некоторых благородных газов высшая положительная валентность достигает восьми (ХеРв). У элементов подгруппы меди в образовании валентных связей могут участвовать с1-злектроны предпоследнего уровня, поэтому их высшая положительная валентность оказывается больше номера группы — бывает +1, +2, +3. Эти элементы являются неполными аналогами элементов главной подгруппы I группы и вместе с тем продолжают развитие свойств элементов семейства железа и платиновых металлов, к которым они вплотную примыкают в системе элементов. [c.79]
Подобная близость свойств объясняется тем, что в высшей степени окисления атом элемента, находящегося в третьем периоде (в главной подгруппе) и атомы элементов побочной подгруппы приобретают сходное электронное строение. Например, атом хрома имеет электронную конфигурацию 1з Когда хром находится в степени окисления 4-6 (например, в оксиде СгОз), шесть электронов его атома (пять М- и один 4б-электрон) вместе с валентными электронами соседних атомов (в случае СгОз — атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисления -Ьб (например, в триокси-де серы ЗОз), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных (1з 28 р ) также соответствует электронной структуре благородного газа. Короче говоря, сходство в свойствах соединений элементов побочной подгруппы и элемента третьего периода той же группы обусловлено тем, что их ионы, отвечающие высшим степеням окисления, являются электронными анапогами. Это легко видеть из данных табл. 21.1. [c.497]
I. Характерные степени окисления и важнейшие соединения. Для лантаноидов характерна одна степень окиспения -3. В этой закономерности имеется два важных исключения кроме Се устойчиво состояние Се (конфигурация атома благородного газа), для Ей и УЬ более характерна степень окисления +2 (конфигурации /7 и /14), хотя известно много веществ, содержащих Еи и Из соединений лантяноилов наиболее применимы оксиды, нитраты, сульфаты. [c.570]
Кристаллические решетки, состоящие из молекул полярных и неполярных), называются молекулярными. Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекуля[1-ными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число веществ с молекулярной решеткой в неорганической химии невелико. Примерами их являются лед, твердый оксид углерода (IV) ( сухой лед ), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (Ра, С1а, Вга, Ь, Нг, О2, М.,), трех- (О3), четырех- (Р4), восьми-(Зв) атомными молекулами. Молекулярная кристаллическая решетка иода представлена на рис. 1.22. Большинство кристаллических органических соединений имеют молекулярную решетку. [c.55]
Важнейшее химическое свойство кислорода — способность обра-зоЕывать оксиды почти со всеми элементами (для первых трех благородных газов оксиды пе получены). При этом с большинством веществ кислород реагирует непосредственно, особенно при нагревании. Например [c.175]
Наибольшее сродство к электрону имеют галогены и кислород. Отрицательное значение этой величины имеют благородные газы и некоторые другие элементы, например, для Не, Кг и Са оно соответственно равно —0,22, —0,42 и —1,93 эВ. Отрицательной величиной является сродство атомов всех элементов ко второму электрону для кислорода это —8,3 эВ. Таким образом, существование многозаряд-ных отрицательных ионов энергетически невыгодно, поэтому даже в кристаллических оксидах наиболее активных металлов (NaaO, СаО) реальный заряд атома кислорода имеет значение не больше —1. [c.91]
По химической активности кислород уступает только фтору. С большинством простых веществ он реагирует непосредственно, за исключением галогенов, благородных газов, платины и золота. Два неспаренных электрона в невозбужденном состоянии атома кислорода определяют его двухвалентность. Однако максимальная ковалентность его равна 4. Атом кислорода может находиться в яр-, sp и врЗ гибридном состоянии. В соединениях с делокализованными связями координационное число кислорода может быть больше 4 и достигать 6 и 8. Например, в оксидах со структурным типом Na l каждый атом кислорода соединен тремя трехцентровыми связями с шестью соседними атомами металла (к. ч. 6). А в оксидах типа Na20 координационное число достигает 8, и он образует четыре трехцентровые связи с 8 атомами металла. [c.434]
Высшая степень окисления элементов обычно отвечает номеру группы, причем в высших оксидах и гидроксилах кислотный характер растет слева направо по периодам, а основной — ослабевает. Фтор не имеет положительной степени окисления в соединениях он всегда имеет стенепь окисления —1 степень окисления кислорода обычно равна —2, но бывает —I (в нероксндных соединениях), а Ор2 имеет - -2. У железа, кобальта и никеля высшая степень окисления соответственно - -6, - -4 и +3, палладия +4, родия, иридия и платины 4-6, у брома и астата -)-5. У некоторых благородных газов высшая степень окисления достигает - -8 (ХеРз). У элементов подгруппы меди в образовании химических связей могут участвовать ( -электроны предпоследнего уровня, поэтому их высшая степень окисления оказывается больше номера группы бывает +1, -[-2, - -3. Эти элементы — непол- [c.97]
Химические свойства. Кислород обладает высокой химической активностью. Он взаимодействует непосредственно со всеми простыми веществами, кроме галогенов, благородных металлов Ag, Ли, и благородных газов, образуя оксиды. Наиболее активные щелочные металлы (К, КЬ, Сз) образуют при этом надпероксиды ЭО2, а Ыа — пероксид ЫазОг. Кислород окисляется только при взаимодействии с Р2. [c.350]
КАРБОНЙЛЫ МЕТАЛЛОВ, соед. металлов с оксидом углерода. Известны для большинства переходньк металлов. Наиб изучены К. м. У1-УП1 групп В молекулах К. м группы СО связаны с атомом металла через атомы С электронная пара от атома С передается атому металла, образуя а-связь, а /-электроны металла переходят на вакантные разрыхляющие я -орбитали СО (я-связь) За редким исключением металл координирует такое число групп СО, чтобы его электронная оболочка достраивалась до оболочки стоящего за ним благородного газа. При этом принимают, что СО является донором двух электронов, а металл находится в нулевой степени окисления ( в нейтральных К. м) [c.325]
Химия благородных газов зародилась в 1962, когда Н. Бартлетт получил первое хим. соед. ксенона-ХеР1Р , Ныне известны криптона дифторид, ксенона фториды, а также фториды радона, оксиды н хлориды ксенона, ксенаты и перксенаты, многочисл. комплексные соед., содержащие ксенон и криптон. Ми. соед. благородных газов м. б. получены только в условиях физ. активирования реагентов являются термодинамически неустойчивыми в-вами и сильнейшими [c.211]
chem21.info