Большая Энциклопедия Нефти и Газа. Масса азота
Плотность азота
Азот – химический элемент периодической системы, обозначающийся буквой N и имеющий порядковый номер 7. Существует в виде молекулы N2, состоящей из двух атомов. Это химическое вещество представляет собой бесцветный, без запаха и без вкуса газ, он является инертным при стандартных условиях. Плотность азота при нормальных условиях (при 0 °C и давлении 101,3 кПа) равна 1,251 г/дм3. Элемент входит в состав атмосферы Земли в количестве 78,09 % от ее объема. Впервые был обнаружен как компонент воздуха шотландским врачом Даниэлем Резерфордом в 1772 году.
Жидкий азот является криогенной жидкостью. При атмосферном давлении он кипит при температуре – 195,8 °C. Поэтому его можно хранить только в изолированных сосудах, которыми являются стальные баллоны для сжиженных газов или сосуды Дюара. Только в этом случае его можно хранить или транспортировать без особых потерь из-за испарения. Как и сухой лед (сжиженный углекислый газ, иначе называемый углекислота), жидкий азот используется в качестве хладагента. Кроме того, его применяют для криоконсервации крови, половых клеток (сперматозоидов и яйцеклеток), а также других биологических образцов и материалов. Он востребован и в клинической практике, например, в криотерапии при удалении кисты и бородавок на коже. Плотность жидкого азота равняется 0,808 г/см3.
Многие промышленно важные соединения, такие, как азотная кислота, аммиак, органические нитраты (взрывчатые вещества, топливо) и цианиды, содержат N2. Чрезвычайно сильные связи элементарного азота в молекуле вызывают трудности для участия его в химических реакциях, этим объясняется его инертность при стандартных условиях (температуре и давлении). В том числе и по этим причинам N2 имеет большое значение во многих научных и производственных сферах. Например, он необходим для поддержания внутрипластового давления при добыче нефти или газа. Любое его практическое или научное применений требует знать, какова будет плотность азота при конкретном давлении и температуре. Из законов физики и термодинамики известно, что при постоянном объеме с ростом температуры будет расти давление и плотность газа, и наоборот.
Когда и зачем нужно знать плотность азота? Расчет этого показателя применяется при проектировании технологических процессов, протекающих с применением N2, в лабораторной практике и на производстве. Используя известное значение плотности газа, можно рассчитать его массу в определенном объеме. Например, известно, что газ занимает при нормальных условиях объем 20 дм3. В этом случае можно рассчитать его массу: m = 20 • 1,251 = 25,02 г. Если условия отличные от стандартных, и известен объем N2 при этих условиях, то потребуется сначала найти (по справочникам) плотность азота при определенном давлении и температуре, а затем эту величину умножить на объем, занимаемый газом.
Подобные расчеты проводят на производстве при составлении материальных балансов технологических установок. Они необходимы для ведения технологических процессов, выбора контрольно-измерительных приборов, расчета технико-экономических показателей и прочее. Например, после остановки химического производства все аппараты и трубопроводы должны перед их вскрытием и выводом в ремонт продуваться инертным газом – азотом (он самый дешевый и наиболее доступный по сравнению, например, с гелием или аргоном). Как правило, они продуваются таким количеством N2, который в несколько раз превышает объем аппаратов или трубопроводов, только так можно удалить из системы горючие газы и пары и исключить взрыв или пожар. Планируя операции перед остановочным ремонтом, технолог, зная объем опорожняемой системы и плотность азота, рассчитывает массу N2, которая потребуется для продувки.
Для упрощенных расчетов, не требующих точности, реальные газы приравнивают к идеальным газам и применяют закон Авогадро. Так как масса 1 моль N2 численно равняется 28 граммам, а 1 моль любого идеального газа занимает объем 22,4 литра, то плотность азота будет равняться: 28/22,4 = 1,25 г/л = 1,25 г/дм3. Этот способ быстрого нахождения плотности применим для любого газа, а не только N2. Его часто используют в аналитических лабораториях.
fb.ru
Масса азота
Азот играет важнейшую роль в жизни всех живых организмов. В различных соединениях масса азота варьируется. Например, сухая масса растительных тканей содержит 1-3%. Очень часто недостаточная масса азота влияет на невысокую урожайность многих сельскохозяйственных культур. В природе замедляется рост растений, их побегов.
Основная масса азота напрямую зависит от биологической азотфиксации. Что означает соединительный процесс молекулярного атмосферного азота (N2) и его перевода в азотистые соединения. И составляет масса азота 17,2 - 107 т в год. На сегодня эти показатели превышают мировое промышленное производство аммиака в четыре раза.
Азот – незаменимый и необходимый элемент, поддерживающий существование растений и животных, несмотря на то, что означает «не поддерживающий жизни».
Масса азота в составе белков 16-18%, также он входит в состав нуклепротеидов, нуклеиновых кислот, аминокислот, гемоглобина, хлорофилла и др. Содержание атомов азота в составе живых клеток составляет около 2%, массовая доля – 2,5%.
 За счет инертных свойств, азот предупреждает процессы гниения и окисления в упаковке продуктов. Все больше и больше производителей пищевых продуктов применяют упаковку в модифицированной газовой среде. Основа такой упаковки - удаление воздуха, который находится внутри упаковки, осуществляется замещение смесью газов или его одним. Смесь газов определяется в зависимости от типа упаковываемой продукции.
За счет инертных свойств, азот предупреждает процессы гниения и окисления в упаковке продуктов. Все больше и больше производителей пищевых продуктов применяют упаковку в модифицированной газовой среде. Основа такой упаковки - удаление воздуха, который находится внутри упаковки, осуществляется замещение смесью газов или его одним. Смесь газов определяется в зависимости от типа упаковываемой продукции.
Основные газы, которые применяют для процесса упаковывания в модифицированной газовой среде: азот, углекислый газ, кислород. Азот рекомендован для упаковки картофельных чипсов, орехов, сухарей и крекеров, пищевых добавок, трав и специй, детских молочно-растительных смесей, чайных смесей, какао порошка, макаронных изделий, суповых концентратов, грибов, фруктов, рыбы и морепродуктов, а также других пищевых продуктов с повышенным содержанием пищевых жиров.
Масса азота, являющаяся газом-накопителем, помогает предотвратить сжатие упаковки, гарантируя тем самым ее привлекательность для потребителя.
Компания «Азотная станция» предлагает генераторы азота MAXIGAS, а также полную систему производства сжатого воздуха, его подготовку и последующее выделение из него азота.
azotnaya.ru
Вес - азот - Большая Энциклопедия Нефти и Газа, статья, страница 1
Вес - азот
Cтраница 1
Вес азота вычисляется следующим образом. Опытным путем найдено, что 1 мл N2 при 0 и 760 мм рт. ст. весит 1 2507 мг. В нашем опыте азот измерялся при 21 и 752 мм рт. ст. Кроме того, в величину, выражающую найденный объем азота, необходимо ввести эмпирические поправки на давление водяных паров над 50 % - ным раствором КОН ( над которым собирался азот) и на объем раствора едкого кали, смачивающего стенки азотометра. Эти поправки составляют в сумме 2 %, и их вычитают из отсчитанного объема азота. [1]
Вес азота составляет 63 кг, вес СО составляет 23 кг. [2]
Вес азота в единице объема является одним из важных показателей для характеристики жидких азотных удобрений. Контейнер для безводного аммиака объемом 378 л, который практически можно заполнить только на 90 %, вмещает 172 8 кг азота. Такого же размера контейнер для раствора NP-13 вмещает 160 9 кг, а при заполнении его некоторыми из растворов LP и МР - более 181 5 кг азота. Емкости и дозирующие устойства для этих растворов намного легче и дешевле, чем те, что требуются для безводного аммиака. Если принять во внимание разницу в весе оборудования, то вес азота на единицу веса готового к работе оборудования для внесения некоторых растворов может оказаться больше, чем в случае безводного аммиака. [4]
Вес азота вычисляется следующим образом. Кроме того, в величину, выражающую найденный объем азота, необходимо ввести эмпирические поправки на давление водяных паров над 50 % - ным раствором КОН ( над которым собирался азот) и на объем раствора едкого кали, смачивающего стенки азотометра. Эти поправки составляют в сумме 2 % и их вычитают из найденного объема азота. [5]
Вес азота вычисляется следующим образом. Опытным путем найдено, что 1 мл N2 при 0 С и 760 мм рт. ст. весит 1 2507 мг. В нашем опыте азот измерялся при 21 Си 752 мм рт. ст. Кроме того, в величину, выражающую найденный объем азота, необходимо ввести эмпирические поправки на давление водяных паров над 50 % - ным раствором КОН ( над которым собирался азот) и на объем раствора едкого кали, смачивающего стенки азотометра. Эти поправки составляют в сумме 2 % и их вычитают из найденного объема азота. [6]
Зная относительные атомные веса азота, натрия и аргона, найти абсолютные массы атомов и грамм-эквиваленты этих элементов. [7]
Зная относительные атомные веса азота, натрия и аргона, найти абсолютные веса атомов и грамм - атомные веса этих элементов. [8]
Шестое уравнение получается из равенства отношений веса азота к весу кислорода в дутье и в полученном газе. [9]
Из проведенного сравнения средних вытекает, что расхождение между весом азота из воздуха и из соединений не является случайным. [10]
Некоторые атомные веса были определены совершенно правильно, в том числе атомные веса азота, углерода, молибдена, селена, теллура. [11]
Исследование состава аммиака показало, что он заключает на 14 частей по весу азота не одну, а три весовые части водорода, или, как обыкновенно выражаются - аммиак состоит из 1 пая азота и 3 паев водорода. Каждый из этих трех водородных паев аммиака может быть выделен и замещен при образовании щелочей. Во всех этих случаях происходят щелочи, и вот почему, когда мы говорили выше о щелочах как замещенном аммиаке, нам пришлось сказать, что это аммиак более или менее замещенный. [12]
При коксовании из шихты переходит азота в N2 - ras не более 40 % от веса азота в шихте. [13]
Для упрощения решения системы уравнений с шестью неизвестными можно составить седьмое уравнение, которое получается из условия, что отношение веса азота к весу кислорода в техническом кислороде и в полученном газе ( учитывается вес компонентов газа, образованных только за счет кислорода дутья) равно друг другу. [14]
Аргон был открыт в 1892 г. английским физиком Рэлеем, который, определяя плотность газов, обратил внимание на расхождение в весе азота, полученного из воздуха, и химического азота, полученного прокаливанием азотнокислого аммония. Атмосферный азот, как выяснилось позднее, содержал в виде примеси инертные газы. В 1894 г. Рэлей вместе с химиком Рам-заем выделил из воздуха газ ( фактически это была смесь аргона, криптона и ксенона), отличительной чертой которого было полное отсутствие химической активности. Это название лишний раз подчеркивает правомерность закрепления за всеми элементами нулевой группы периодической системы Д. И. Менделеева названия инертные газы. Бытовавшее до недавнего времени название редкие газы в полной мере может быть справедливо лишь в отношении радона и частично в отношении криптона и ксенона. [15]
Страницы: 1 2 3
www.ngpedia.ru
Масса - азот - Большая Энциклопедия Нефти и Газа, статья, страница 2
Масса - азот
Cтраница 2
При таких условиях процесс разделения происходит при минимальном количестве тарелок, масса отводимого азота А для верхней колонны и А для нижней колонны равна нулю, Ф mf А оо и Ф tn lAf оо. [16]
Итак, мы нашли, что в удобрительной смеси с отношением масс азота и фосфора 1: 2 на 360 5 г фосфора должно приходиться 180 25 г азота. [17]
Сульфат аммония ( Nh5) 2S04, содержит 20 5 % по массе азота. Хорошо растворим в воде, малогигроскопичен, почти не слеживается при хранении, рассеивается туковой сеялкой. Широко применяется на орошаемых землях и в районах избыточного увлажнения. Может временно повышать кислотность почв и снижать урожай картофеля, лука, капусты и др. культур, отрицательно относящихся к хлору, однако при заблаговременном внесении ионы хлора вымываются из корнеоби-таемого слоя. [18]
Зная, что азот составляет приблизительно 75 5 % массы воздуха, вычислите массу азота в 5 л воздуха. [19]
В дилиндре под поршнем находится m / ц грамм-молекул азота, где m - масса азота, ц - его молекулярный вес. [20]
Средняя длина свободного пробега молекул азота при нормальных условиях равна 6 10 - 6 см. Некоторая масса азота перешла от нормальных условий к состоянию, при котором ее температура равна 300 С. [21]
Более того, опыты, проведенные с добавлением 4 % полиуретанов ( соответствует вводу в отходы 0 24 % по массе азота), показали, что концентрация выделяемой окиси азота лишь незначительно отличается от концентрации NO, полученной в опытах с добавлением полимеров, не содержащих азот. На основе этих результатов можно сделать вывод о том, что только очень маленькая доля ( 0 038) азота, содержащегося в твердых отходах, превращается в окись азота. [22]
При заполнении сосуда Дьюара жидким азотом, температура кипения которого при нормальном атмосферном давлении равна 77 3 К, оказалось, что за час испарилась масса Mi азота. [23]
Наибольшее количество азота и зольных элементов содержится в биосфере лесной растительности, почти во всех типах растительности масса зольных элементов в 2 - 3 раза превышает массу азота. Исключение составляет тундровая растительность, в которой содержание азота и зольных элементов примерно одинаково. [24]
При такой средней разности температур ( 5 - 6 С) и отношении давлений ( больше 5) между прямым и обратным потоками вся выпавшая из воздуха углекислота уносится азотом, несмотря на то, что по массе азота проходит через регенератор несколько меньше, чем воздуха. [25]
Аммиак, согласно условию задачи, занимает 34 об. % и, следовательно, в этом объеме его содержится 0 34 моля, что составляет 17 0 34 г. Рассуждая аналогично, прийдем к выводу, что масса водорода в смеси, заключенной в мольном объеме, составляет 2Х г, а масса азота - 28 ( 1 - 0 34 - X) г. Таким образом, в мольном объеме смеси заключено [ 17 0 34 - f 2X 28 ( 1 - 0 34 - X) ] г газа и 42 5 мае. [26]
Де Д тв - изотермический дроссель-эффект воздуха между начальным и конечным его давлением при расчетной температуре окружающей среды, кДж / кг; Д - доля воздуха, поступающего в турбодетандер, кг; т ] ад - адиабатный КПД турбодетандер a; qs - изоэнтропный перепад энтальпий в турбо-детандере, кДж / кг; А - масса азота, выводимого из установки, кг; Кт - масса получаемого технологического кислорода, кг; К - масса получаемого технического кислорода, кг; срд, Ср т и Срк. [28]
Неизвестными величинами в этих уравнениях являются: GO, Онажи и Ооажи - масса углерода, водорода и кислорода в образовавшейся саже; Q - r - - - объем отходящих газов ( без водяных паров, сероводорода и сероуглерода), получившихся в процессе сажеобразования; ивод-п - масса водяных паров, выделяющихся при процессе; 0 зд и Go 23A - масса азота и кислорода воздуха, необходимого для процесса. [29]
Основным природным источником азота является атмосфера. Масса азота в ней составляет 4 - Ю15 тонн, что соответствует 8 - 104 тонн на каждый гектар суши. Однако, газообразный молекулярный азот представляет одно из самых устойчивых химических веществ. Энергия связи в молекуле азота равна 940 5 кДж / моль. В расчете на атом азот обладает одной из самых высоких энтропии, именно поэтому элементарный азот не-реакционноспособен. [30]
Страницы: 1 2 3
www.ngpedia.ru
Чему равна масса молекулы азота
В 1811 г. итальянский физик Авогадро объяснил простые отношения между объемами газов, наблюдающиеся при химических реакциях установив закон: В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул.Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов. В частности, на его основе было предположено, что молекулы таких газов, как водород, хлор, кислород, азот, состоят из двух атомов. Это предположение объяснило установленные Гей-Люссаком отношения между объемами газов.Закон Авогадро сыграл большую роль в установлении атомных масс элементов и молекулярных масс сложных веществ.Переходим к решению задачи «чему равна масса молекулы азота». Молярная масса молекулы азота – 28 кг/моль. Рассчитать массу одной молекулы можно по формуле:
![Rendered by QuickLaTeX.com \[m_{0} \rightarrow m / N,\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-a8a973078006eb8a280ce2a0d1b40f38_l3.png)
где 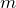 — масса вещества, а N – число молекул в нем. Для нахождения последней величины принято использовать выражение:
— масса вещества, а N – число молекул в нем. Для нахождения последней величины принято использовать выражение:
![Rendered by QuickLaTeX.com \[N \rightarrow N_{A} \times m/M,\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-65fcb601d2f211e219f59fe75476efb5_l3.png)
тогда
![Rendered by QuickLaTeX.com \[m_{0} \rightarrow (m \times M) / (N_{A} \times m),\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-59ce391d1296fa085a5d1aac25c963a7_l3.png)
![Rendered by QuickLaTeX.com \[m_{0} \rightarrow M / N_{A},\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-dbab06fc8cf122500767b01d04a44ae7_l3.png)
где 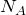 — постоянная Авогадро, равная
— постоянная Авогадро, равная 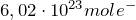 .Таким образом, масса молекулы азота равна:
.Таким образом, масса молекулы азота равна:
![Rendered by QuickLaTeX.com \[m_{0} (N_2) \rightarrow 28\cdot 10^{-2} / 6,02 \cdot 10^{23},\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d83a33c91d3b943669e4a5b7f5dc7d81_l3.png)
![Rendered by QuickLaTeX.com \[m_{0} (N_2) \rightarrow 4,65 \cdot 10^{-26} kg.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-87805b95b097ca38a39e4eaa1d7844da_l3.png)
ru.solverbook.com
Азот, масса - Справочник химика 21
Присадка Плотность при 1 5 С, кг/м" Вязкость, при 99° . мм /с Содержа- ние азота, % масс. Рекомендации по применению [c.157]
В одном из двух закрытых баллонов находится кислород, в другом — азот. Массы обоих газов одинаковы. Температура обоих газов 27°С. В каком баллоне давление больше и во сколько раз До какой температуры следует нагреть содержимое одного баллона, чтобы давление внутри него достигло давления в другом баллоне [c.13]
Содержание азота, % (масс.) [c.18]Полипропиленгликоль со второй ступени оксипропилирования подают в реакционный аппарат 4, где его оксиэтилируют. Окись этилена подают из мерника 5, оборудованного, так же как мерник 2, приборами для пневматического взвешивания. Оксиэтилирование ведут при температуре реакционной массы 130—140° С и избыточном давлении в реакционном аппарате 1,5—2 ат. По окончании оксп-этилирования аппарат продувают азотом, массу, не прекращая перемешивания, охлаждают до 80—90° С и сжатым азотом переводят в приемник 6 готового продукта. [c.146]
Содержание азота, % масс. 3,5 — — [c.208]
Ответ. Плотность азота (масса 1 л при н. у.) равна 1,25 г / л. Относительная плотность азота 1) по водороду равна 14,00 2) по воздуху —0,96 3) по гелию —7,00. [c.211]
При сжигании соединения азота массой 0 620 г с водоро-. дом получены вода НаО массой 0,696 г и азот N2 объемом [c.15]
Навеску удобрения, содержащего 26,05 % азота, массой [c.228]
Найдем плотность азота (масса 1 л 1,25 г) по воздуху (масса 1 л 1,29 г) В= -, 2в 1,29=0,97. Средняя молекулярная масса воздуха 29. Тогда молекулярная масса азота [-=0,97-29=28,013. [c.29]
Определите объём, который займет при нормальных условиях газовая смесь, содержащая водород массой 1,4 г и азот массой 5,6 I. [c.5]
Вычислите, какую массу сульфата аммония следует взять, чтобы внести в почву азот массой 0,5 т на площадь 1 га. Ответ 2,357 т. [c.146]
Отсюда следует, что в оксидах азота массы кислорода, приходящиеся на единицу массы азота, относятся между собой как 1 2 3 4 5. Это служит убедительной иллюстрацией закона кратных отношений [c.21]
Содержание азота, % (масс.) Состав, % (масс.) Плотность при 15°С, Т/мЗ Избыточное давление паров при 40 С. МПа Температура выпадения твердой фа.1Ы, °С [c.244]
Содержание азота, % (масс.) 34-37,5 37,5-41 30,5-31,6 [c.244]
Содержание азота, % масс. 60 Ю [c.12]
Содержание азота, % масс 20 Ю" [c.12]
Пример 12. Общее давление смеси, состоящей из азота массой 14 г и кислорода массой 8 г, равно 155 кИа. Вычислить значения парциальных давлений газов в смеси. [c.20]
При прокаливании в потоке аммиака сухой соли меди (И) образовались азот массой 4,9 г и вода массой [c.221]
Углеводородный состав, % (.масс.) ароматнмескне нафтеновые парафиновые Содержание азота, % (масс.) Октановое число (по И.М) [c.64]
Фракции Содержание азота, % (масс.) Содержание во фракции, в расчете на общее котичество азота, % (масс.) [c.203]
Сополимерные соединения Молеку- лярная масса Содержа -нне азота, % (масс) . Электропроводность топлива Т-7, пСм, при концентрации присадки. % (масс.) [c.58]
Навеску нитрозы Нг804 с оксидами азота) массой [c.300]
Рассчитайте массу сульфата ам у10ния (НН4)2504, который следует взять, чтобы внести в почву на площадь 5 га азот массой 2 т. Какая масса удобрения должна попасть на каждый квадратный метр почвы [c.93]
Катализатор на основе окиси платины (катализатор Адамса) 109]. В фарфоровой чашке перемептивают 20 г нитрата натрия с раствором твтрахлорида платины в 5 мл воды, содержащим 1 з платины. Смесь осторожно при перемешивании стеклянной палочкой нагревают до удалении воды. Нагревание продолжают до расплавления массы (400—5Q[) С) и начала выделения бурых паров окислов азота. После прекращения выделения окислов азота массу охлаждают и растворяют в 50 мл воды, образовавшийся коричневый осадок промывают сначала декантацией, а затем на фильтре до исчезновения реакции на нитрат в фильтрате. Однако получить продукт, совершенно свободный от щелочей, трудно, и обычно в нем содержится около 2% щелочей, если сплавление проводилось при 41)0—500° С. При более высоких температурах сплавлении содержание щелочей повышается. Коричневую окись платины сушат над концентрированной серной кислотой или в вакууме. Это очень удобный в работе и исключительно эффективный катализатор. [c.34]
В начале прибавления натрия температура повышается до Ю0°, под конец — до 125° Реакционную массу после внесения натр 1я нагревают при 122—125° 3 часа без перемешивания и 2 часа — при перемешивании до полного растворения остатков металлического натрия. Затем образовавшийся бутйлат натрия разлагают 5 л воды в токе азота, массу нагревают 1 час при 80—90° и отделяют верхний бутанольный слой, содержащий диол V. Водный слой экстрагируют бутанолом (2X0,5 л). Объединенные бутанольные растворы промывают водой до pH 7,0 и упаривают. К сухому остатку V приливают 1 л горячей воды (80°) до расплавления продукта, горячую массу охлаждают при перемешивании, кристаллы отфильтровывают, промывают 1 л холодной воды и высушивают. Получают 0,404 кг 94,9% (72% на -1У) V в виде кристаллов желтого цвета, т. пл. 69,5—71°. [c.216]
Хлорированные смолисто-асфальтеновые соединения взаимодействуют с различными органическими аминами (табл. 44). Хлор не полностью вступает во взаимодействие с аминами, несмотря на то, что в реакционной среде содержится избыток амина. При аминировании образуются амино-продукты с содержанием азота (масс. %) от 2,8 до 9,63. Наиболее глубоко аминиро-вание хлорированных продуктов протекает с полиэтиленполиамином. Образуются амиопродукты с наиболее высоким содержанием азота (5-10 %) и самым низким содержанием хлора (5-6 %), обменная емкость аминопродуктов составляет 2,5-3,8 мг-экв/г (табл. 44). [c.72]
Для этерификации в стальной эмалированный реактор 9 через люк загружают а-нафтол и нагревают аппарат до температуры плавления а-нафтола, т. е. до 96—98 °С, после чего при работающей мешалке из мерника 8 постепенно подают пирокатехинфосформонохлорид. Затем через реакционную массу пропускают сухой азот и повышают температуру до 120 °С. После 8 ч выдерживания при 120—130 °С и непрерывной подаче азота массу из аппарата 9 передают в кристаллизатор 11. [c.339]
Пеизвестное соединение водорода с азотом массой 0,24 г сожгли в избытке кислорода, в результате чего образовались вода массой [c.30]
Мономерное звено gH702(0H)з (0N02) содержит такую же нолю. ыога, чго и вся макромолекула. Рассмотрим один моль мономерных звеньев. Его масса равна молярной массе 6 - 12 + 7 + 2 16 + (3 - х) 17 + Л 62 = 162 + 45л г. В нем содержится х моль атомов азота массой 14Jf г. По условию массовая доля азота равна 6,76% [c.399]
Аналогично ведут себя соединения с атомом кислорода или другим атомом в гетероцикле вместе с атомом азота. Масс-спектры морфолина и некоторых его N-замещенных производных приведены на рис. 160. При рассмотрении спектров всех N-замещенных соединений можно отметить тенденцию к разрыву Р-связи по отношению к азоту. В спектре N-ацетилморфолина вероятность разрыва связи кольца (в а-положении по отношению к карбонильной группе) увеличивается по сравнению с вероятностью разрыва связи, находящейся в Р-положении по отношению к азоту и расположенной по другую сторону от карбонила. Для того чтобы получить детальную информацию о направлении распада таких гетероциклов, необходимо проводить точное измерение масс, позволяющее определить атомный состав осколков. Такая методика, возможная при наличии высокого разрешения, позволяет различать изобарные пары. [c.406]
chem21.info
Как определить массу азота
Содержание
Инструкция
|
completerepair.ru
- Сварка оптоволокна

- Пусковое устройство для автомобиля своими руками

- Шкаф силовой распределительный

- Шкаф распределительный силовой

- Силовой распределительный шкаф

- Ремонт бензиновых генераторов

- Ремонт генераторов бензиновых

- Переделка компьютерного блока питания atx в регулируемый блок питания

- Huter генератор

- Капли обезболивающие для глаз
- Масляный компрессор










