Как получить водород в домашних условиях. Как получить водород
Как получить водород из воды
 Электролиз воды – это самый старый способ получения водорода. Пропуская постоянный ток через воду, на катоде накапливается - водород, а на аноде – кислород. Получение водорода электролизом очень энергозатратный производство, поэтому используется исключительно в тех областях, где данный газ достаточно ценен и необходим.
Электролиз воды – это самый старый способ получения водорода. Пропуская постоянный ток через воду, на катоде накапливается - водород, а на аноде – кислород. Получение водорода электролизом очень энергозатратный производство, поэтому используется исключительно в тех областях, где данный газ достаточно ценен и необходим.
Получение водорода в домашних условиях достаточно легкий процесс и есть несколько способов сделать это:
1. Нам понадобится раствор щелочи не пугайтесь этих названий т.к. все это есть в свободном доступе.
Например, средство для очистки труб «крот» отлично подойдет по составу. Насыпаем в колбу немного щелочи и заливаем 100 мл воды;
Тщательно перемешиваем для полного растворения кристаллов;
Добавляем несколько небольших кусочков алюминия;
Ждем около 3-5 минут, пока реакция будет проходить максимально быстро;
Добавляем дополнительно несколько кусочков алюминия и 10-20 грамм щелочи;
Закрываем резервуар специальной колбой с трубкой, которая ведет в резервуар для сбора газа и ждем несколько минут пока воздух не выйдет под давлением водорода из сосуда.
2. Выделение водорода из алюминия, пищевой соли и сульфата меди.
В колбу насыпаем сульфат меди и чуть больше соли;
Разбавляем все водой и хорошо перемешиваем;
Ставим колбу в резервуар с водой, так как при реакции будет выделяться много тепла;
В остальном все нужно делать так же как в первом способе.
3. Получение водорода из воды путем пропускания тока в 12В через раствор соли в воде. Это самый простой способ и больше всего подходит для домашних условий. Единственный минус этого способа в том, что водорода выделяется сравнительно мало.
Итак. Теперь вы знаете, как получить водород из воды и не только. Вы можете проводить очень много экспериментов. Не забывайте придерживаться правил безопасности во избежание травм.
Получение водорода в домашних условиях
В данной статье описаны наиболее популярные способы получения дешевого водорода в домашних условиях.
Способ 1. Водород из алюминия и щелочи.
Используемый раствор щелочи – едкого кали, либо едкого натра. Выделяемый водород более чистый, чем при реакции кислот с активными металлами.
Насыпаем в колбу небольшое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся.
Дождавшись пока реакция будет происходить более активно, аккуратно добавим еще 10г. щелочи и несколько кусочком алюминия. Так мы значительно усилим процесс.
Закупориваем колбу, пробиркой с трубкой ведущей сосуд для сбора газа. Ждем примерно 3 -5 мин. пока водород вытеснит воздух из сосуда.
Как образуется водород? Оксидная пленка, которая покрывающая поверхность алюминия, при контакте с щелочью разрушается. Так как алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6h4O → 2Na + 3h4↑
Способ 2. Водород из алюминия, сульфата меди и пищевой соли.
В колбу насыпаем немного сульфата меди, и соли. Добавляем воду и перемешиваем до полного растворения. Раствор должен, окрасится в зеленый цвет, если этого не произошло, добавьте еще небольшое количество соли.
Колбу необходимо поставить в чашку наполненной холодной водой, т.к. при реакции, будет выделятся большое количество тепла.
Добавляем в раствор несколько кусочков алюминия. Начнется реакция.
Как происходит выделение водорода? В процессе образуется хлорид меди, смывающий оксидную пленку с метала. Одновременно с восстановлением меди происходит образование газа.
Способ 3. Водород из цинка и соляной кислоты.
Помещаем в пробирку кусочки цинка и заливаем их соляной кислотой.
Являясь активным металлом цинк, взаимодействуя с кислотой, вытесняет из нее водород.
Zn + 2HCl → ZnCl2 + h4↑
Способ 4. Производство водорода электролизом.
Пропускаем через раствор воды и проваренной соли электрический ток. При реакции, будет выделятся водород и кислород.
Получение водорода электролизом воды.
 Давно хотел сделать подобную штуку. Но дальше опытов с батарейкой и парой электродов не доходило. Хотелось сделать полноценный аппарат для производства водорода, в количествах для того чтобы надуть шарик. Прежде чем делать полноценный аппарат для электролиза воды в домашних условиях, решил все проверить на модели.
Давно хотел сделать подобную штуку. Но дальше опытов с батарейкой и парой электродов не доходило. Хотелось сделать полноценный аппарат для производства водорода, в количествах для того чтобы надуть шарик. Прежде чем делать полноценный аппарат для электролиза воды в домашних условиях, решил все проверить на модели.
Эта модель не подходит для полноценной ежедневной эксплуатации. Но проверить идею удалось. Итак для электродов я решил применить графит. Прекрасный источник графита для электродов это токосъемник троллейбуса. Их полно валяется на конечных остановках. Нужно помнить, что один из электродов будет разрушаться.
Пилим и дорабатываем напильником. Интенсивность электролиза зависит от силы тока и площади электродов. К электродам прикрепляются провода. Провода должны быть тщательно изолированы. Для корпуса модели электролизера вполне подойдут пластиковые бутылки. В крышке делаются дырки для трубок и проводов. Все тщательно промазывается герметиком.
Для соединения двух ёмкостей подойдут отрезанные горлышки бутылок. Их необходимо соединить вместе и оплавить шов. Гайки делаются из бутылочных крышек. В двух бутылках в нижней части делаются отверстия. Все соединяется и тщательно заливается герметиком.
В качестве источника напряжения будем использовать бытовую сеть 220в. Хочу предупредить, что это довольно опасная игрушка. Так что, если нет достаточных навыков или есть сомнения, то лучше не повторять. В бытовой сети у нас ток переменный, для электролиза его необходимо выпрямить. Для этого прекрасно подойдет диодный мост. Тот что на фотографии оказался не достаточно мощным и быстро перегорел. Наилучшим вариантом стал китайский диодный мост MB156 в алюминиевом корпусе.
Диодный мост сильно нагревается. Понадобится активное охлаждение. Кулер для компьютерного процессора подойдет как нельзя лучше. Для корпуса можно использовать подходящую по размеру распаячную коробку. Продается в электротоварах.
Под диодный мост необходимо подложить несколько слоев картона. В крышке распаячной коробки делаются необходимые отверстия. Так выглядит установка в сборе. Электролизер запитывается от сети, вентилятор от универсального источника питания. В качестве электролита применяется раствор пищевой соды. Тут нужно помнить, что чем выше концентрация раствора, тем выше скорость реакции. Но при этом выше и нагрев. Причем свой вклад в нагрев будет вносить реакция разложения натрия у катода. Эта реакция экзотермическая. В результате неё будет образовываться водород и гидроксид натрия.
Тот аппарат, что на фото выше, очень сильно нагревался. Его приходилось периодически отключать и ждать пока остынет. Проблему с нагревом удалось частично решить путем охлаждения электролита. Для этого я использовал помпу для настольного фонтана. Длинная трубка проходит из одной бутылки в другую через помпу и ведро с холодной водой.
Место подсоединения трубки к шарику хорошо снабдить краником. Продаются в зоомагазинах в отделе для аквариумов.
Основные знания по классическому электролизу.
Принцип экономичности электролизёра для получения газа h4 и O2.
Наверняка все знают, если опустить два гвоздя в раствор питьевой соды и подать на один гвоздь плюс, а на другой минус, то на минусе будет выделяться Водород, а на плюсе Кислород.
Теперь наша задача найти такой подход, чтобы получить как можно больше этого газа и потратить при этом минимальное количество электроэнергии.
Урок 1. Напряжение
Разложение воды начинается при подаче на электроды чуть больше 1,8 вольта. Если подавать 1 вольт, то ток практически не идёт и не выделяется газ, а вот когда напряжение подходит к значению 1,8 вольта, то ток резко начинает расти. Это называется минимальный электродный потенциал при котором начинается электролиз. Поэтому- если мы подадим 12 вольт на эти 2 гвоздя - то такой электролизёр будет жрать много электроэнергии, а газу будет мало. Вся энергия уйдёт в нагрев электролита.
Для того. чтобы наш электролизёр был экономичным - надо подавать не более 2-х вольт на ячейку. Поэтому, если у нас 12 вольт - мы делим их на 6 ячеек и получаем на каждой по 2 вольта.
А теперь упрощаем - просто разделим ёмкость на 6 частей пластинами- в результате получится 6 ячеек, соединённых последовательно на каждой ячейке будет по 2 вольта каждая внутренняя пластина с одной стороны будет плюсом, а с другой минусом. Итак - урок номер 1 усвоили = подавать маленькое напряжение.
Теперь 2-ой урок экономичности: Расстояние между пластинами
Чем больше расстояние - тем больше сопротивление, тем больше потратим тока для получения литра газа. Чем меньше расстояние - тем меньше потратим Ватт в Час на Литр газа. Далее буду пользоваться именно этим термином - показатель экономичности электролизёра / Из графика видно, что чем ближе находятся пластины друг к другу - тем меньше напряжение требуется для прохождения одного и того же тока. А как известно выход газа прямо пропорционален количеству тока прошедшего через электролит.
Перемножая более маленькое напряжение на ток - мы получим меньше ватт на то же количество газа.
Теперь 3-й урок. Площадь пластин
Если мы возьмём 2 гвоздя и используя первые два правила расположим их близко и подадим на них 2 вольта - то газу получится совсем мало, так как они пропустят очень мало тока. Попробуем при тех же условиях взять две пластины. Теперь количество тока и газа будет увеличено прямо пропорционально площади этих пластин.
Теперь 4-й урок: Концентрация электролита
Используя первые 3 правила возьмём большие железные пластины на маленьком расстоянии друг от друга и подадим на них 2 вольта. И опустим их в водичку, добавив одну щепотку соды. Электролиз пойдёт, но очень вяло, вода будет нагреваться. Ионов в растворе много будет, сопротивление будет маленькое, нагрев уменьшится а количество газа увеличится
Источники: 505sovetov.ru, all-he.ru, zabatsay.ru, xn----dtbbgbt6ann0jm3a.xn--p1ai, domashnih-usloviyah.ru
Это интересно

Эльфы и феи: история о парне, который служил фейри. Часть2
На следующий день он дал парню свинцовый топорик, бумажную пилу и тачку из дубовых листьев, попросив ...

Высокие каблуки и варикозное расширение вен
Статистическая женщина использует обувь на каблуке три - четыре раза в неделю, а ее любимая высота обуви - ...

Озерное чудище
Кроме таинственного Несси, в подводных глубинах живут и другие монстры. Согласно легендам, в канадском озере Оканаган обитает Большой ...

Римские боги
Предания и легенды древности сильно повлияли на развитие искусства и культуры. Начиная с эпохи Возрождения творческие люди широко ...
Тайна брахманов
В глубине озера Тегид, в Уэльсе, жила Керидвен, богиня плодородия, у которой был волшебный котел — неотъемлемый признак божества изобилия. Подобно...
Золотые яблоки Гесперид
Апис – священный бык египтян. Бог плодородия Мемфиса. Этот культ имеет очень глубокие корни, связанные с животноводством,...
objective-news.ru
Получение водорода. Водородная энергетика
Водородная энергетика возникла как одна из линий развития НТП в 70-х годах предыдущего столетия. По мере расширения области исследований, касающихся получения, перевозки и хранения, а также использования водорода, становились очевиднее экологические преимущества технологий получения водорода в разных сферах народного хозяйства. Эффективность развития некоторых водородных технологий (топливные элементы, металлогидридные системы, транспортные водородные системы и т.д.) показали, что применение водорода дает совершенно новые качественные показатели в функционировании агрегатов и систем.

Проведенные технико-экономические тестирования показали, что, несмотря на то, что элемент водород – вторичный носитель энергии, то есть он дороже по стоимости, чем природные топлива, его использование в некоторых случаях экономики уже сегодня целесообразно. Поэтому работы в отрасли водородной энергетики в большинстве странах, тем более с развитой промышленностью, считаются приоритетными направлениями развития техники и науки. Они все больше поддерживаются финансами со стороны государства и частного капитала.
Свойства водорода
При нормальных условиях в свободном состоянии водород представлен бесцветным газом, не имеющим и запаха. Водород имеет плотность относительно воздуха 1/14. Обычно он встречается в комбинации с остальными элементами, например, углерода в метане, кислорода в воде, в разных органических соединениях. Поскольку водород чрезвычайно активен химически, он редко находится в несвязанном виде.
Водород, охлажденный до состояния жидкости, занимает 1/700 объема состояния в газообразном виде. При его соединении с кислородом, водород имеет максимально большое содержание энергии на одну единицу массы: 120,7 ГДж/т. Это является одной из нескольких причин, почему водород в жидком виде применяется в качестве ракетного топлива и служит энергетикой для современных космических кораблей, для которой большое удельное содержание энергии водорода и малая молекулярная масса имеет большое значение. В чистом кислороде при сжигании единственные продукты – это вода и тепло высокой температуры. Так, в случае применения водорода не выделяются вредные парниковые газы и даже не происходит нарушение в природе круговорота воды.
Производство водорода
Ресурсы водорода, которые содержатся в воде и в органическом веществе, почти неисчерпаемы. Разрыв данных связей дает возможность для получения водорода, после чего водород применяется для топлива. Разработано множество процессов по разделению воды на составные части.
Вода при нагревании более 2500°С начинает разлагаться на кислород и водород (прямой термолиз). Такую высокую температуру получают, например, при помощи концентраторов энергии солнца. Здесь проблема состоит в том, чтобы не допустить рекомбинацию кислорода и водорода.
Сегодня в мире основная часть получаемого водорода в промышленном масштабе получается в ходе паровой конверсии метана (ПКМ). Таким образом, получение водорода дает возможность применять его как реагент для процесса очистки нефти и в качестве составляющей азотных удобрений и для ракетной техники. Тепловая энергия и пар при температурах 750-800°С необходимы для выделения водорода из углеродной основы в метане, что и случается на каталитических поверхностях в химических реформерах. Самая первая ступень ПКМ процесса разделяет водяной пар и метан на моно оксид углерода, а также водород. На второй ступени в процессе «реакции сдвига» моно оксид углерода и вода преобразуются в водород и диоксид углерода. Данная реакция протекает при 200-250°С.
В СССР в 30-е годы в промышленных масштабах получали синтез-газ благодаря паровоздушной газификации угля. Сегодня в ИПХФ РАН, расположенном в Черноголовке, создается технология для газификации угля в сверхадиабатическом режиме. Данная технология дает возможность преобразовывать энергию тепла угля в тоже тепловую энергию синтез-газа с КПД 98%.
Начиная с 70-х годов предыдущего века, в нашей стране были сделаны и получили научно-техническое объяснение и подтверждение путем эксперимента проекты гелиевых высокотемпературных реакторов (ВТГР) энерготехнологических атомных станций (АЭТС) для черной металлургии и химической промышленности: АБТУ-50, а затем – проект атомной энергетической станции с реактором ВГ-400, мощность которой 1060 МВт для химико-ядерного комплекса по получению водорода и смесей, содержащих его, по выпуску метанола и аммиака, еще несколько проектов в данном направлении.
Базой для всех проектов ВТГР стали разработки ядерных двигателей для ракет на базе водорода. Испытательные высокотемпературные реакторы, выпущенные в нашей стране для данных целей, а также ядерные демонстрационные двигатели для ракет показали работоспособность при нагревании водорода до максимальной температуры 3000К.
Высокотемпературные реакторы на основе гелиевого теплоносителя – новейший тип универсальных экологически чистых атомных энергетических источников, уникальные характеристики которых – способность получать тепло при температурах выше 1000°С и высочайший уровень безопасности – определяют невероятные возможности их применения для получения в газотурбинном цикле электрической энергии с большим КПД и для обеспечения высокотемпературным теплом и электроэнергией производственных процессов получения водорода, технологических процессов нефтеперерабатывающей, химической, металлургической и других отраслей, для процессов опреснения воды.
Самым современным в этой области считается международный проект ГТ-МГР, разрабатывающийся общими стараниями отечественных институтов и компании GA из США. Также с проектом сотрудничают компании Фуджи электрик и Фраматом.
Получение атомного водорода
Источником атомного водорода являются вещества, которые отщепляют атомы водорода при их облучении. В процессе облучения ультрафиолетом, например, йодистого водорода начинает протекать реакция с выделением атомного водорода.
HI + hv® H + I
Для выделения атомного водорода используется термическая диссоциация молекулярного водорода на палладиевой, платиновой проволоке или проволоке из вольфрама, нагретой при давлении меньше 1,33 Па в атмосфере водорода. Разделения водорода на атомы удается достигнуть также, применяя радиоактивные вещества. Есть метод синтеза атомного водорода в электрическом высокочастотном разряде с дальнейшим вымораживанием молекулярного водорода.
Физические варианты способов получения водорода из смесей, содержащих его
Водород в значимых количества имеется во многих смесях газов, в коксовом газе, например, который выделяется при пиролизе бутадиена, в получении дивинила.
Чтобы выделить водород из смесей газов, содержащих водород, применяют физические методы концентрирования и выделения водорода.
Фракционирование и низкотемпературная конденсация. Данный процесс описывается высокой степенью получения водорода из газовой смеси и выгодными экономическими показателями. Как правило, при давлении газа 4 МПа для выделения 93-94%-ного водорода температура должна составлять 115К. При содержании в исходном газе водорода больше 40% степень его получения может достигать 95%. Затрата энергии на концентрирование Н2 70-90% приравнивается к 22 кВт.ч на 1000 м3 получаемого водорода.
Адсорбционное выделение. Данный процесс происходит с помощью использования молекулярных сит, адсорберов, работающих циклически. Его можно реализовывать под давлением, равным 3-3,5 МПа с извлечением до 80-85% Н2 в виде 90%-го концентрата. В сравнении с низкотемпературным способом получения водорода для осуществления данного процесса нужно приблизительно на 25-30% меньше материальных затрат и на 30-40% меньше эксплуатационных.
Адсорбционное производство водорода с использованием жидких растворителей. В некоторых случаях способ подходит для получения водорода в чистом виде. Данный метод позволяет извлекать до 80-90% водорода, который содержится в первоначальной смеси газов, а также достигать его концентрации в конечном продукте до 99,9%. Затраты энергии на получение водорода достигают 68 кВт.ч на 1000 м3 Н2.
Получение водорода путем электролиза воды
Электролиз воды – это один из распространенных и хорошо изученных способов получения водорода. Он гарантирует получение продукта в чистом виде (99,6-99,9% Н2) за одну технологическую ступень. На получение водорода в затратах на производство стоимость электроэнергии составляет около 855.
Данный способ применяется в нескольких странах, которые имеют значительные запасы недорогой гидроэнергии. Крупнейшие электрохимические комплексы располагаются в Индии, Канаде, Норвегии, Египте, но созданы и функционируют множество мелких установок в разных странах мира. Этот способ считается важным еще и потому, что он наиболее универсален относительно применения первичных энергетических источников. В связи с распространением атомной энергетики стал возможен новый расцвет процессов электролиза воды за счет недорогой электрической энергии атомных электростанций. Ресурсы электроэнергетики сегодня недостаточны для синтеза водорода как продукта для дальнейшего использования в энергетике.
Электрохимический метод получения водорода из воды имеет следующие преимущества:
1. Высокая чистота водорода в конечном продукте – до 99,99% и более;
2. Легкость и постоянство технологического процесса, можно автоматизировать процесс, в электролитической ячейке нет движущихся частей;
3. Возможность получения очень ценных дополнительных продуктов – кислорода и тяжелой воды;
4. Неисчерпаемое и доступное исходное сырье – вода;
5. Возможность получения водорода прямо под давлением;
6. Физическое распределение кислорода и водорода в ходе электролиза.
Во всех приведенных примерах получения водорода путем разложения воды побочным продуктом являются большие объемы кислорода. Это открывает новые возможности для его использования. Он сможет найти свое место не только в качестве ускорителя процессов технологии, но и в качестве незаменимого очистителя водоемов. Данная область применения кислорода может распространиться и на почву, атмосферу и воду. Сгорание в кислороде увеличивающихся количеств бытовых отходов поможет решить вопрос твердых отбросов крупных городов.
Еще один ценный продукт электролиза воды – тяжелая вода – прекрасный замедлитель нейтронов во всех атомных реакторах. Данная тяжелая вода может применяться в качестве сырья для синтеза дейтерия, который служит материалом для термоядерной энергетики.
zeleneet.com
Чистый водород - MEL Chemistry
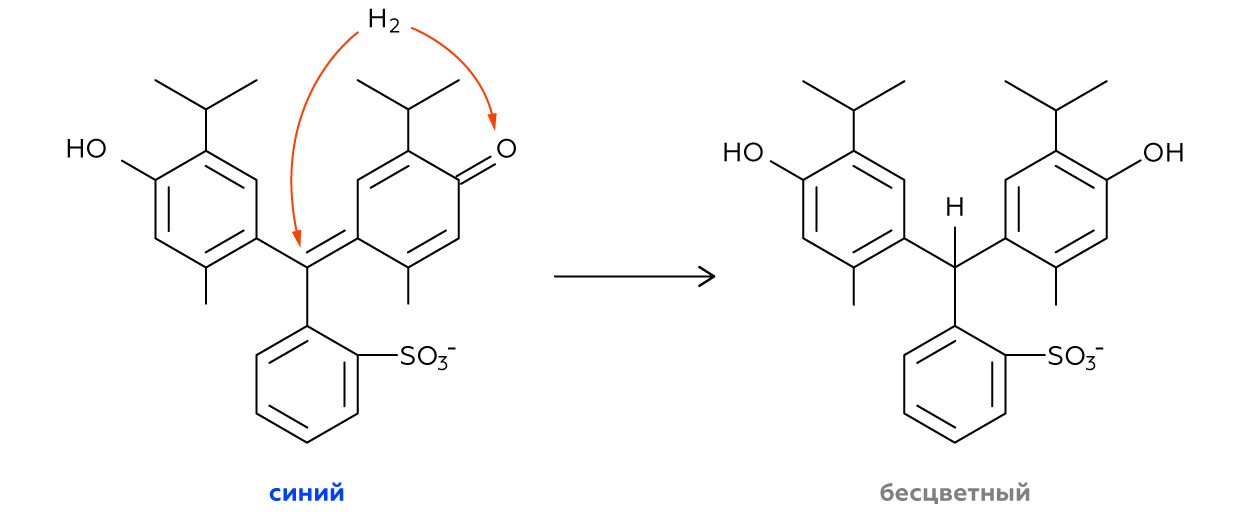
Что произошло
Что случилось с фольгой?
Блестящая алюминиевая фольга (Al) прореагировала с разбавленной щёлочью (NaOH) с выделением водорода (h3). В результате алюминий превратился в тетрагидроксоалюминат натрия (Na[Al(OH)4]):
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑
Но это соединение неустойчиво в слабощелочной среде, а у нас в пробирке образовался именно такой раствор. В конечном итоге большая часть тетрагидроксоалюмината натрия распадается на гидроксиды натрия (NaOH) и алюминия (Al(OH)3). Гидроксид алюминия же практически не растворим в воде: его частички под влиянием гравитации постепенно оседают, образуя замутнённый слой ближе ко дну пробирки.
Почему раствор обесцветился?
Как уже было сказано выше, в пробирке происходит реакция между алюминием (Al) и раствором гидроксида натрия (NaOH):
2Al + 2NaOH + 6h3O → 2Na[Al(OH)4] + 3h3↑
В ходе этой реакции образуется водород. В момент выделения способность атома водорода отдать один электрон (то есть стать восстановителем) максимальна. Именно это и происходит внутри пробирки. Только что образовавшийся водород восстанавливает молекулу тимолового синего до бесцветного соединения, в результате чего мы наблюдаем обесцвечивание раствора.
Узнать больше
Нам хорошо известно, что молекула водорода состоит из двух одинаковых атомов. Но далеко не все знают, что в процессе получения первые мгновения своего существования атом водорода проводит в гордом одиночестве. Именно такой атомарный водород способен эффективно восстанавливать органические соединения. Связано это с тем, что водороду невыгодно существование в виде отдельных атомов, поскольку энергия, необходимая для удержания единственного электрона возле ядра при отсутствии атома-соседа, слишком велика.
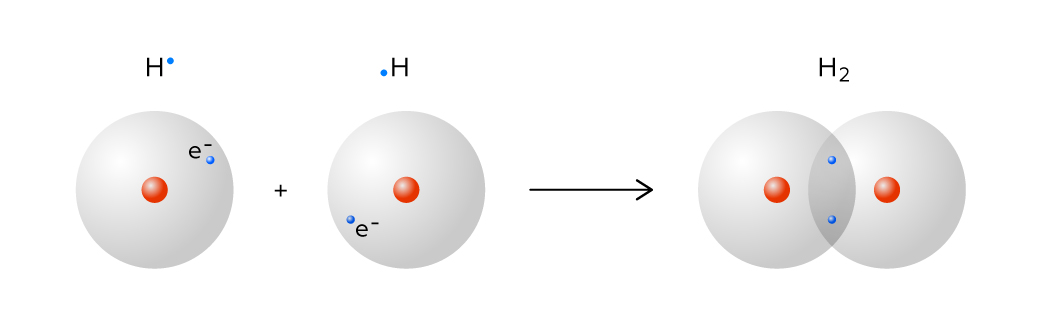
Стоит только двум таким атомам образовать молекулу водорода, как их реакционная способность резко падает. Причина в том, что теперь два ядра участвуют в удержании каждого из электронов, то есть они связаны намного прочнее. Молекулярный водород уже не способен восстановить тимоловый синий в тех условиях, в которых легко справляется с этой задачей в атомарной форме.
Это интересно
Как получают водород в промышленности?
Промышленное производство водорода осуществляется в основном по методу, который называется «паровая конверсия метана». Конверсия в химической промышленности – это направленное изменение состава смеси газов. В нашем случае, как видно из названия, метан Ch5 в смеси с водяным паром h3O (исходная смесь) претерпевает изменения, в результате чего количество метана в ней уменьшается, зато образуется большое количество водорода. В ходе этого процесса исходное газовое сырьё нагревается до температуры порядка 1000oC:
Ch5 + h3O ↔ CO + 3h3
В условиях избыточного количества водяного пара происходит более полная конверсия:
CO + h3O ↔ CO2 + h3
В реальных условиях, конечно, стопроцентная конверсия метана недостижима. На выходе из реакционной зоны мы имеем смесь, содержащую ~ 40 % водорода. Помимо целевого продукта, в ней содержатся недоокисленные углеводороды, оксиды углерода (CO и CO2). Для отделения водорода от остальных компонентов смеси необходима температура порядка 115 К (-158oC) и давление в 40 атмосфер. При этих условиях остаточные углеводороды, вода и диоксид углерода отделяются, позволяя получить газ чистотой от 90 до 95 %.
Современные методы многоступенчатой конверсии предполагают сложный температурный режим, при котором нагревание и охлаждение газа происходит постепенно, причём строго определённым образом. Такие методы вкупе с использованием поглотителей CO2 повышают содержание водорода примерно до 95 %. При необходимости получить газ с минимальным содержанием примесей применяется одноступенчатая очистка с использованием цеолитных сорбентов, позволяющая получить 99,99%-й водород.
Современные лабораторные методы получения водорода
В настоящее время в химических лабораториях водород в 99,9 % случаев получают двумя основными способами: из баллона и из генератора. По поводу добычи газа из баллона никаких вопросов обычно не возникает. Хотя и здесь есть один нюанс! Все газовые баллоны имеют правую резьбу, а вот баллоны для водорода – левую. В результате редукторы (специальные приспособления с датчиками давления для контролируемого извлечения газа из баллона) на них накручиваются по часовой стрелке. Это сделано для того, чтобы физически исключить возможность использования оборудования, не предназначенного для работы с водородом и снизить вероятность возгорания. Вернёмся к получению водорода в лаборатории. Второй способ – использование водородного генератора. В основе его действия лежит разложение воды на кислород и водород под действием электрического тока (электролиз):
2h3O → O2↑ + 2h3↑
Электролитический способ получения водорода также иногда используется в промышленности, но из-за большой энергоёмкости является не особо выгодным.
Для чего используют водород?
Трудно переоценить важность водорода в современном мире.
Связывание атмосферного азота с образованием аммиака – процесс, позволивший поднять химическую промышленность и сельское хозяйство на новый уровень. Ранее азотные удобрения (нитраты) и азотную кислоту получали из минералов (селитр), запасы которых в мире были крайне ограничены (подробнее про селитры можно прочитать в разделе «Это интересно» опыта «Огненная надпись»). Теперь же практически весь азот «вынимается» из воздуха благодаря простой реакции:
N2 + 3h3 ↔ 2Nh4
При кажущейся простоте процесса такое взаимодействие – дело не из лёгких. Многие учёные бились над тем, чтобы подобрать условия, позволяющие снизить затраты на производство.
Ещё одним важным продуктом, в производстве которого участвует водород, является метанол Ch4OH. Ранее его получали за счёт нагревания древесины без доступа воздуха. Теперь же для этого используется смесь оксида углерода CO с водородом, при нагревании которой в присутствии оксидов меди CuO и цинка ZnO образуется целевой продукт:
CO + 2h3 → Ch4OH
Восстановительные свойства водорода применяют для получения металлов из их оксидов. В основном таким образом производят вольфрам (W):
WO3 + 3h3 → W + 3h3O
С помощью водорода можно превратить жидкие растительные масла в твёрдые за счёт присоединения его к жирным кислотам в составе масла. Получаемые таким образом жиры входят в состав важного пищевого продукта – маргарина. У этого метода отверждения масел есть существенный недостаток: в процессе образуются вредные для здоровья вещества, которые могут попасть в организм человека. По этой причине в настоящее время такой способ получения твёрдых растительных жиров уступает место более безопасным, в ходе которых водород уже не используется.
В своё время водород помогал в проведении театральных представлений. Горелки с водородно-кислородным пламенем позволяют получить температуру до 4000oC. Их применяют для резки и сварки тугоплавких материалов. Казалось бы, причём тут театр? Именно из-за очень горячего пламени такие горелки использовались для театрального освещения до повсеместной электрификации. Яркий белый «свет рампы» получали за счёт нагрева большого куска оксида кальция CaO. Этот материал является достаточно тугоплавким (нагревается до белого каления, оставаясь твёрдым), а также способен выделять света больше, чем многие другие материалы в тех же условиях. Несмотря на то, что сочетание водородной горелки и оксида кальция для освещения театральной сцены использовали на протяжении достаточно короткого времени, они оставили след в английском языке: слово «the limelight» (дословно – свечение извести) употребляется теперь в значении «центр внимания».
Большие надежды возлагается на водород, как на топливо. Из-за того, что при его сгорании единственным продуктом является вода, водород считается самым безопасным для экологии горючим. Основной проблемой использования такого топлива является тот факт, что пока оно экономически невыгодно. Ещё не изобретён дешёвый способ получения чистого водорода в достаточных количествах для развития отрасли. О пользе этого газа для экологии в данный момент, естественно, речи быть не может.
melscience.com
Водород
| Атомный номер | 1 |
| Внешний вид простого вещества | газ без цвета, вкуса и запаха |
| Атомная масса(молярная масса) | 1,00794 а.е.м. (г/моль) |
| Радиус атома | 79 пм |
| Энергия ионизации(первый электрон) | 1311,3 кДж/моль (эВ) |
| Электронная конфигурация | 1s1 |
| Ковалентный радиус | 32 пм |
| Радиус иона | 54 (−1 e) пм |
| Электроотрицательность(по Полингу) | 2,20 |
| Электродный потенциал | |
| Степени окисления | 1, −1 |
| Плотность вещества | 0,0000899 (при 273K (0 °C)) г/см³ |
| Молярная теплоёмкость | 14,235 Дж/(K·моль) |
| Теплопроводность | 0,1815 Вт/(м·K) |
| Температура плавления | 14,01K |
| Теплота плавления | 0,117 кДж/моль |
| Температура кипения | 20,28K |
| Теплота испарения | 0,904 кДж/моль |
| Молярный объём | 14,1 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,780 c=6,167 Å |
| Отношение c/a | 1,631 |
| Температура Дебая | 110 K |
| H | 1 |
| 1,00794 | |
| 1s1 | |
| Водород | |
Водород является первым элементом периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода 1H— протон. Свойства ядра 1H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Трое из пяти изотопов водорода имеют собственные названия: 1H— протий (Н), 2H— дейтерий (D) и 3H— тритий (радиоактивен) (T).
Простое вещество водород— h3— лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История водорода
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и М. В. Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Г. Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик А. Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783г. осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Происхождение названия водород
Лавуазье дал водороду название hydrogène (отὕδωρ— «вода» и γενναω— «рождаю»)— «рождающий воду». Русское наименование «водород» предложил химик М.Ф.Соловьев в 1824 году— по аналогии с ломоносовским «кислородом».
Распространённость водорода
Во Вселенной
Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92% всех атомов (8% составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1%). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Земная кора и живые организмы
Массовая доля водорода в земной коре составляет 1%— это десятый по распространённости элемент. Однако его роль в природе определяется не массой, а числом атомов, доля которых среди остальных элементов составляет 17% (второе место после кислорода, доля атомов которого равна ~52%). Поэтому значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках. В живых клетках по числу атомов на водород приходится почти 50%.
Получение Водорода
Промышленные способы получения простых веществ зависят от того, в каком виде соответствующий элемент находится в природе, то есть что может быть сырьём для его получения. Так, кислород, имеющийся в свободном состоянии, получают физическим способом— выделением из жидкого воздуха. Водород же практически весь находится в виде соединений, поэтому для его получения применяют химические методы. В частности, могут быть использованы реакции разложения. Одним из способов получения водорода служит реакция разложения воды электрическим током.
Основной промышленный способ получения водорода— реакция с водой метана, который входит в состав природного газа. Она проводится при высокой температуре (легко убедиться, что при пропускании метана даже через кипящую воду никакой реакции не происходит):
СН4 +2Н2O =CO2↑ +4Н2 −165 кДж
В лаборатории для получения простых веществ используют не обязательно природное сырьё, а выбирают те исходные вещества, из которых легче выделить необходимое вещество. Например, в лаборатории кислород не получают из воздуха. Это же относится и к получению водорода. Один из лабораторных способов получения водорода, который иногда применяется и в промышленности,— разложение воды электротоком.
Обычно в лаборатории водород получают взаимодействием цинка с соляной кислотой.
Получение водорода в промышленности
1.Электролиз водных растворов солей:2NaCl +2h3O → h3↑ +2NaOH +Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:h3O +C ⇄ h3↑ +CO↑
3.Из природного газа.
Конверсия с водяным паром:Ch5 +h3O ⇄ CO↑ +3h3↑ (1000°C)Каталитическое окисление кислородом:2Ch5 +O2 ⇄ 2CO↑ +4h3↑
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
Получение водорода в лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:Zn +2HCl → ZnCl2 +h3↑
2.Взаимодействие кальция с водой:|Ca +2h3O → Ca(OH)2 +h3↑
3.Гидролиз гидридов:NaH +h3O → NaOH +h3↑
4.Действие щелочей на цинк или алюминий:2Al +2NaOH +6h3O → 2Na[Al(OH)4] +3h3↑Zn +2KOH +2h3O → K2[Zn(OH)4] +h3↑
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:2h4O+ +2e- → h3↑ +2h3O
Дополнительная информация про Водород
Биореактор для производства водорода
Физические свойства Водорода
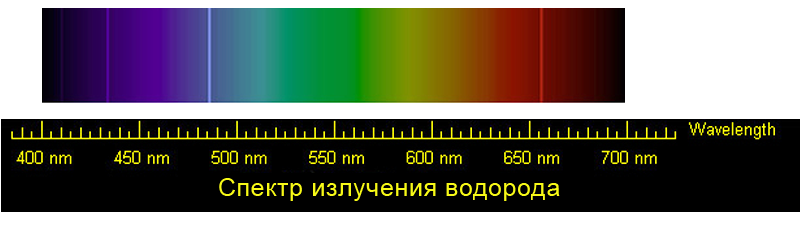 Спектр излучения водорода
Спектр излучения водорода
 Эмиссионный спектр водорода
Эмиссионный спектр водорода
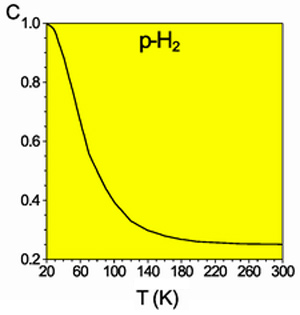 Равновесная мольная концентрация пара-водорода
Равновесная мольная концентрация пара-водорода
Разделить модификации водорода можно адсорбцией на активном угле при температуре жидкого азота. При очень низких температурах равновесие между ортоводородом и параводородом почти нацело сдвинуто в сторону последнего. При 80 К соотношение форм приблизительно 1:1. Десорбированный параводород при нагревании превращается в ортоводород вплоть до образования равновесной при комнатной температуре смеси (орто-пара: 75:25). Без катализатора превращение происходит медленно (в условиях межзвездной среды— с характерными временами вплоть до космологических), что даёт возможность изучить свойства отдельных модификаций.
Водород — самый лёгкий газ, он легче воздуха в 14,5 раз. Очевидно, что чем меньше масса молекул, тем выше их скорость при одной и той же температуре. Как самые лёгкие, молекулы водорода движутся быстрее молекул любого другого газа и тем самым быстрее могут передавать теплоту от одного тела к другому. Отсюда следует, что водород обладает самой высокой теплопроводностью среди газообразных веществ. Его теплопроводность примерно в семь раз выше теплопроводности воздуха.
Молекула водорода двухатомна — Н2. При нормальных условиях — это газ без цвета, запаха и вкуса. Плотность 0,08987 г/л (н.у.), температура кипения −252,76 °C, удельная теплота сгорания 120.9·106 Дж/кг, малорастворим в воде — 18,8 мл/л. Водород хорошо растворим во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1объём Pd). С растворимостью водорода в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия водорода с углеродом (так называемая декарбонизация). Практически не растворим в серебре.
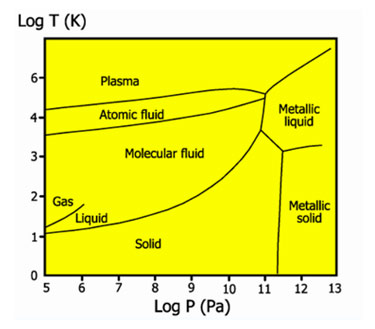 Фазовая диаграмма водорода
Фазовая диаграмма водорода
Жидкий водород существует в очень узком интервале температур от −252,76 до −259,2 °C. Это бесцветная жидкость, очень лёгкая (плотность при −253 °C 0,0708 г/см3) и текучая (вязкость при −253 °C 13,8 спуаз). Критические параметры водорода очень низкие: температура −240,2 °C и давление 12,8 атм. Этим объясняются трудности при ожижении водорода. В жидком состоянии равновесный водород состоит из 99,79% пара-Н2, 0,21% орто-Н2.
Твердый водород, температура плавления −259,2 °C, плотность 0,0807 г/см3 (при −262 °C) — снегоподобная масса, кристаллы гексогональной сингонии, пространственная группа P6/mmc, параметры ячейки a=3,75 c=6,12. При высоком давлении водород переходит в металлическое состояние.
Изотопы
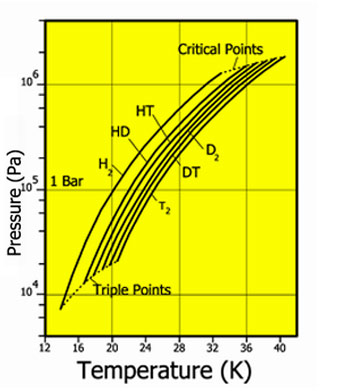 Давление пара для различных изотопов водорода
Давление пара для различных изотопов водорода
Водород встречается в виде трёх изотопов, которые имеют индивидуальные названия: 1H— протий (Н), 2Н— дейтерий (D), 3Н— тритий (радиоактивный) (T).
Протий и дейтерий являются стабильными изотопами с массовыми числами 1и 2. Содержание их в природе соответственно составляет 99,9885±0,0070% и 0,0115 ± 0,0070%. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода.
Изотоп водорода 3Н (тритий) нестабилен. Его период полураспада составляет 12,32 лет. Тритий содержится в природе в очень малых количествах.
В литературе также приводятся данные об изотопах водорода с массовыми числами 4— 7и периодами полураспада 10−22— 10−23 с.
Природный водород состоит из молекул h3 и HD (дейтероводород) в соотношении 3200:1. Содержание чистого дейтерийного водорода D2 ещё меньше. Отношение концентраций HD и D2, примерно, 6400:1.
Из всех изотопов химических элементов физические и химические свойства изотопов водорода отличаются друг от друга наиболее сильно. Это связано с наибольшим относительным изменением масс атомов.
| 13.95 | 20,39 | 13,96 /7,3 | 32,98 /1,31 | 70,811 /1,316 |
| 16,60 | 22,13 | 16,60 /12,8 | 35,91 /1,48 | 114,80 /1,802 |
| 22,92 | 17,63 /17,7 | 37,13 /1,57 | 158,62 /2,310 | |
| 18,62 | 23,67 | 18,73 /17,1 | 38,35 /1,67 | 162,50 /2,230 |
| 24.38 | 19,71 /19,4 | 39,42 /1,77 | 211,54 /2,694 | |
| 25,04 | 20,62 /21,6 | 40,44 /1,85 | 260,17 /3,136 |
Дейтерий и тритий также имеют орто- и пара- модификации: p-D2, o-D2, p-T2, o-T2. Гетероизотопный водород (HD, HT, DT) не имеют орто- и пара- модификаций.
Химические свойства
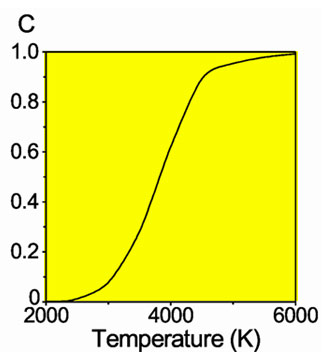 Доля диссоциировавших молекул водорода
Доля диссоциировавших молекул водорода
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 =2Н − 432 кДжПоэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca +Н2 =СаН2и с единственным неметаллом— фтором, образуя фтороводород:
F2 +h3 =2HFС большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 +2Н2 =2Н2ООн может «отнимать» кислород от некоторых оксидов, например:
CuO +Н2 =Cu +Н2OЗаписанное уравнение отражает восстановительные свойства водорода.
N2 +3h3 → 2Nh4С галогенами образует галогеноводороды:
F2 +h3 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,Cl2 +h3 → 2HCl, реакция протекает со взрывом, только на свету.С сажей взаимодействует при сильном нагревании:
C +2h3 → Ch5Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
2Na +h3 → 2NaHCa +h3 → Cah3Mg +h3 → Mgh3Гидриды— солеобразные, твёрдые вещества, легко гидролизуются:
Cah3 +2h3O → Ca(OH)2 +2h3↑Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO +h3 → Cu +h3OFe2O3 +3h3 → 2Fe +3h3OWO3 +3h3 → W+3h3OГидрирование органических соединений
Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы навзывают реакциями гидрирования. Эти реакции проводят в присутствии катализатора при повышенных давлении и температуре. Катализатор может быть как гомогенным (напр. Катализатор Уилкинсона), так и гетерогенным (напр. никель Ренея, палладий на угле).
Так, в частности, при каталитическом гидрировании ненасыщенных соединений, таких как алкены и алкины, образуются насыщенные соединения — алканы.
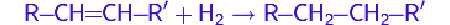
Геохимия водорода
На Земле содержание водорода понижено по сравнению с Солнцем, гигантскими планетами и первичными метеоритами, из чего следует, что во время образования Земля была значительно дегазирована и водород вместе с другими летучими элементами покинул планету во время аккреции или вскоре после неё.
Свободный водород h3 относительно редко встречается в земных газах, но в виде воды он принимает исключительно важное участие в геохимических процессах.
В состав минералов водород может входить в виде иона аммония, гидроксил-иона и кристаллической воды.
В атмосфере водород непрерывно образуется в результате разложения воды солнечным излучением. Имея малую массу, молекулы водорода обладают высокой скоростью диффузионного движения (она близка ко второй космической скорости) и, попадая в верхние слои атмосферы, могут улететь в космическое пространство.
Особенности обращения
 | Водород при смеси с воздухом образует взрывоопасную смесь— так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21%. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение. Взрывоопасные концентрации водорода с кислородом возникают от 4% до 96% объёмных. При смеси с воздухом от 4% до 75(74)% объёмных. |
Применение водорода
Атомарный водород используется для атомно-водородной сварки.
Химическая промышленность
При производстве аммиака, метанола, мыла и пластмасс
Пищевая промышленность
При производстве маргарина из жидких растительных масел.Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Авиационная промышленность
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XXв. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием.
Топливо
Водород используют в качестве ракетного топлива. Ведутся исследования по применению водорода как топлива для легковых и грузовых автомобилей. Водородные двигатели не загрязняют окружающей среды и выделяют только водяной пар.
В водородно-кислородных топливных элементах используется водород для непосредственного преобразования энергии химической реакции в электрическую.
Водород, Hydrogenium, Н (1)Как горючий (воспламеняемый) воздух водород известен довольно давно. Его получали действием кислот на металлы, наблюдали горение и взрывы гремучего газа Парацельс, Бойль, Лемери и другие ученые XVI— XVIII вв. С распространением теории флогистона некоторые химики пытались получить водород в качестве «свободного флогистона». В диссертации Ломоносова «О металлическом блеске» описано получение водорода действием «кислотных спиртов» (например, «соляного спирта», т. е. соляной кислоты) на железо и другие металлы; русский ученый первым (1745) выдвинул гипотезу, о том что водород («горючий пар»— vapor inflammabilis) представляет собой флогистон. Кавендиш, подробно исследовавший свойства водорода, выдвинул подобную же гипотезу в 1766 г. Он называл водород «воспламеняемым воздухом», полученным из «металлов» (Inflammable air from metals), и полагал, как и все флогистики, что при растворении в кислотах металл теряет свой флогистон. Лавуазье, занимавшийся в 1779 г. исследованием состава воды путем ее синтеза и разложения, назвал водород Hydrogine (гидроген), или Hydrogene (гидрожен), от греч. гидор— вода и гайноме— произвожу, рождаю.
Номенклатурная комиссия 1787 г. приняла словопроизводство Hydrogene от геннао, рождаю. В «Таблице простых тел» Лавуазье водород (Hydrogene) упомянут в числе пяти (свет, теплота, кислород, азот, водород) «простых тел, относящихся ко всем трем царствам природы и которые следует рассматривать как элементы тел»; в качестве старых синонимов названия Hydrogene Лавуазье называет горючий газ (Gaz inflammable), основание горючего газа. В русской химической литературе конца XVIII и начала XIX в. встречаются два рода названий водорода: флогистические (горючий газ, горючий воздух, воспламенительный воздух, загораемый воздух) и антифлогистические (водотвор, водотворное существо, водотворный гас, водородный гас, водород). Обе группы слов представляют собой переводы французских названий водорода.
Изотопы водорода были открыты в 30-x годах текущего столетия и быстро приобрели большое значение в науке и технике. В конце 1931 г. Юри, Брекуэдд и Мэрфи исследовали остаток после длительного выпаривания жидкого водорода и обнаружили в нем тяжелый водород с атомным весом 2. Этот изотоп назвали дейтерием (Deuterium, D) от греч.— другой, второй. Спустя четыре года в воде, подвергнутой длительному электролизу, был обнаружен еще более тяжелый изотоп водорода 3Н, который назвали тритием (Tritium, Т), от греч.— третий.
Периодическая система химических элементов Дмитрия Ивановича Менделеева:
www.himsnab-spb.ru
Водород. Получение и свойства - видео!
Водород - самый распространенный химический элемент во Вселенной. В нашей Солнечной системе количество водорода (и по числу атомов, и по массе) намного превосходит количество всех других элементов вместе взятых. Водород прародитель всех других химических элементов. В недрах звезд в результате ядерных реакций водород превращается в гелий, гелий - в литий, бериллий, бор. В конечном итоге именно в звездных ядерных котлах синтезируются ядра атомов всех химических элементов и их изотопов. Когда ядерные реакции слишком ускоряются происходит взрывной процесс. Часть массы звезды выбрасывается в околозвездное и межзвездное пространство. Из этой массы формируются планеты, на которых при определенных условиях могут возникнуть разумные существа. И все это как бы заложено в свойствах водорода.
На планете Земля по распространенности водород занимает девятое место. На его долю приходится примерно 1 % от массы земной коры. Химический элемент водород представляет собой смесь изотопов: 1H (протий) - 99.985 %, 2D (дейтерий) - 0.015 %, 3T (тритий) - радиоактивный изотоп с периодом полураспада 12.3 года (испуская b-лучи он превращается в легкий изотоп гелия 3He). Сейчас научились разделять изотопы протия и дейтерия и поэтому можно говорить достаточно надежно о различиях в свойствах протия и его соединений и дейтерия и его соединений. Для дейтерия широко используют свой символ D, хотя, строго говоря, природа химического элемента определяется зарядом его ядра, а он у всех изотопов водорода одинаков и равен 1.
При нормальных условиях водород - газ состава h3. Это самый легкий бесцветный газ без запаха и вкуса. В твердом состоянии водород существует при температуре ниже 14 K, в жидком состоянии - в интервале температур 14 - 20.5 K. Водород плохо растворяется в воде, и в органических растворителях, но он хорошо растворяется во многих металлах: так, один объем палладия растворяет до 900 объемов водорода. Растворимость водорода в таких металлах как Cr, Fe, Co, Ni, Cu, Pt, Ag с ростом температуры увеличивается. Водород практически нерастворим в Au, Zn, Cd, Hg.
Молекулярный водород может существовать в виде двух аллотропных форм: орто-водорода и пара-водорода Протоны, ядра атомов водорода, обладают спином. В молекулу h3 входят два ядра и их спины могут быть направлены либо в одну сторону (орто-h3), либо в разные стороны Ї (пара-h3). Суммарный ядерный спин у молекулы пара-h3 равен 0, а у молекулы орто-h3 - 1 и, следовательно, он тремя независимыми способами может ориентироваться в пространстве, давая проекции +1, 0 и -1, т.е. множество состояний у молекул орто-h3 в три раза больше, чем у молекул пара-Н2. Этот энтропийный (или статистический) фактор приводит к тому, что при температурах выше 100 K отношение орто-водорода к пара-водороду равно 3:1 и не изменяется с ростом температуры.
Молекула h3 достаточно прочная, и поэтому, молекулярный водород химически малоактивен. Для реакции водорода с активными металлами (натрием, кальцием), неметаллами (азотом, серой, йодом) требуется повышенная температура (300 - 500o C), а иногда и катализатор:
h3 + Ca = Cah3,
h3 + S = h3S,
3h3 + N2 2Nh4,
h3 + I2 = 2HI.
Водород при горении в кислороде образует молекулы воды. При этом выделяется очень большое количество теплоты. Смесь водорода и кислорода, также называемая "гремучим газом" очень взрывоопасна (см. видео)
Напомним, что практическая химия - крайне опасное занятие. Выполнение химических опытов допускается только в присутствии опытных химиков, например, учителя химии! |
При взаимодействии с металлами водород ведет себя как окислитель, а при взаимодействии с неметаллами - как восстановитель.
Н2 способен восстанавливать металлы из оксидов:
CuO + h3 = Cu + h3O.
При комнатной температуре h3 реагирует непосредственно только со фтором, при интенсивном освещении - с хлором, при наличии катализатора, например Pt, - с кислородом.
h3 - ковалентная неполярная молекула с расстоянием между ядрами 0.74142 A у протия и 0.7416 A у дейтерия. Энергия диссоциации молекулы h3 равна 432 кДж/моль, D2 - 439.6 кДж/моль. Для сравнения приведем энергии диссоциации ряда молекул на атомы:
Пусть Э - символ химического элемента. Чтобы оценить реакционную способность водорода, необходимо знать энергию связи Э-H в гидридах. Сначала выпишем энтальпии образования некоторых веществ при 0 K.
И, наконец, рассчитаем сами энергии связи Э-H.
Итак, суть химического превращения состоит в том, что в результате химической реакции вместо одних связей образуются новые. Чем менее прочно связаны атомы в исходных молекулах и чем более прочно атомы связаны в молекулах продуктов реакции, тем с большей скоростью и с большей полнотой протекает реакция. Итак h3 + F2 = 2HF. В молекуле F2 связь F-F очень слабая, поэтому неудивительно, что уже при комнатной температуре молекулярный фтор в ничтожно малой степени, но все-таки диссоциирует на атомы фтора (10-11 молей на 1 моль F2 или 6·10+12 атомов F). Далее идет процесс F + h3 = HF + H с выделением большого количества тепла. И, наконец, H + F2 = HF + F с еще большим выделением энергии.
При взаимодействии водорода и хлора при комнатной температуре реакция сама по себе не идет. Молекула Cl2 более прочная, чем F2. В этом случае на один моль Cl2 в равновесии приходится 5·10-19 молей атомов Cl, что явно недостаточно для инициирования реакции. При интенсивном освещении диссоциация молекулярного хлора резко возрастает и реакция идет.
Читателю предлагается самостоятельно объяснить, как будут взаимодействовать водород и пары йода.
Неожиданными могут показаться данные о энергии связи N-H в молекуле Nh4. Она меньше энергии связи H-H и в три раза меньше энергии связи N-N. Почему же возможен синтез аммиака из азота и водорода? Запишем уравнение реакции синтеза аммиака: 3h3 + N2 = 2Nh4. В левой части уравнения разрываются четыре связи и при этом затрачивается энергия 2238 кДж/моль. В энергия двух молекулах аммиака образуются 6 связей N-H и выделяется 2316 кДж/моль.
Таким образом, современный уровень изучения строения молекул, точное определение их энергий диссоциации, тщательный анализ условий протекания химических реакций позволяют во многих случаях не просто констатировать экспериментальные факты, но и давать им объяснение на основе термодинамики.
При изучении кислорода специально подчеркивают, что он существует в виде двух аллотропических модификаций: молекулярного кислорода O2 и озона - O3. Мы будем считать как самостоятельную аллотропическую модификацию и атомарный кислород. Свойства озона в химии оговариваются специально. При изучении химических свойств водорода следует помнить, что он реально может существовать не только в виде молекул h3, но и в атомарном виде. При этом свойства атомарного водорода в отличаются от свойств молекулярного водорода. Но сначала о его получении. При температуре выше 3000 K практически весь водород существует как атомарный. Если такой газ быстро охладить, то мы получим атомарный водород. При его рекомбинации в газовых горелках реакция 2H = h3 идет с выделением большого количества тепла. Она используется при проведении специальных видов сварки, когда необходима восстановительная среда. В лабораторной практике атомарный водород получают по реакции Zn + 2HCl = ZnCl2 + 2H в том же сосуде, где проводят реакцию гидрирования. Обычно его не называют атомарным водородом, а называют "водородом в момент выделения". Реакционная способность такого водорода чрезвычайно высока.
Получение и применение водорода
В лаборатории водород обычно получают в аппарате Киппа по реакции:
Zn + 2HCl = ZnCl2 + h3
Если для реакции берут серную кислоту, то водород может содержать следы сероводорода.
Можно привести еще ряд реакций, которые приводят к получению водорода:
Zn + 2NaOH + 2h3O = Na2[Zn(OH)4] + h3
2Na + 2h3O = 2NaOH + h3,
Cah3 + 2h3O = Ca(OH)2 + 2h3,
3Fe + 4h3O = Fe3O4 + 4h3 .
Чтобы рассказать о промышленных способах получения водорода, необходимо сначала вспомнить те вещества (доступные и дешевые) в состав которых он входит. Это, прежде всего, вода и метан (природный газ). Наиболее чистый водород обычно получают электролизом раствора щелочи. Щелочь добавляют для повышения электропроводности воды. На катоде при этом выделяется водород, а на аноде кислород. Как правило, получаемый водород на этом же химическом комбинате используется для получения других веществ, например метилового спирта, аммиака, других веществ методами органического синтеза и т.д. Поэтому мы рассмотрим сначала получение смеси водорода и окиси углерода, называемой "синтез-газ".
Газификация угля. В специальных печах при температуре 900-1000o C через раскаленный уголь продувают водяной пар:
C(гр) + h3O = CO + h3 -125 кДж
Поскольку эта реакция эндотермическая, то постепенно температура в печи снижается с 1000 до 900o C. После этого перекрывают подачу водяного пара в печь и начинают продувать воздух:
C(гр) + 1/2O2 = CO + 114 кДж.
Эта реакция идет с выделением тепла и температура в печи повышается. Синтез-газ содержит CO, h3 и N2. Если он далее будет использоваться для синтеза аммиака, то его нужно освободить от окиси углерода:
CO + h3O CO2 + h3
Углекислый газ хорошо растворяется в воде и может быть легко удален из газовой смеси.
Конверсия метана. При температурах 800-900o C смесь метана и паров воды пропускают над никелевым катализатором:
Ch5 + h3O = CO + 3h3 .
Окисление метана. При температуре порядка 1300o C проводят неполное термическое окисление метана кислородом воздуха:
2Ch5 + O2 = 2CO + 4h3 .
В химической промышленности водород в больших количествах используется для синтеза аммиака, метилового спирта, хлористого водорода, для каталитической гидрогенизации твердых топлив (каменного угля и сланцев), мазута и каменноугольной смолы. При гидрировании жиров получают маргарин. Водород используют для получения металлов из их оксидов и галогенидов. Водород - это самое эффективное ракетное топливо.
www.himikatus.ru
Как получить водород в домашних условиях — Elfterra.ru
Содержание статьи:

Давно хотел сделать подобную штуку. Но дальше опытов с батарейкой и парой электродов не доходило. Хотелось сделать полноценный аппарат для производства водорода, в количествах для того чтобы надуть шарик. Прежде чем делать полноценный аппарат для электролиза воды в домашних условиях, решил все проверить на модели.
Общая схема электролизера выглядит так.
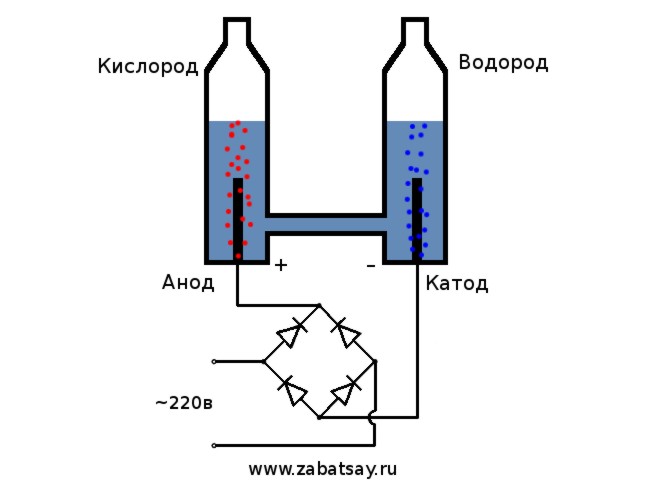
Эта модель не подходит для полноценной ежедневной эксплуатации. Но проверить идею удалось.
Итак для электродов я решил применить графит. Прекрасный источник графита для электродов это токосъемник троллейбуса. Их полно валяется на конечных остановках. Нужно помнить, что один из электродов будет разрушаться.

Пилим и дорабатываем напильником. Интенсивность электролиза зависит от силы тока и площади электродов.

К электродам прикрепляются провода. Провода должны быть тщательно изолированы.

Для корпуса модели электролизера вполне подойдут пластиковые бутылки. В крышке делаются дырки для трубок и проводов.

Все тщательно промазывается герметиком.

Для соединения двух ёмкостей подойдут отрезанные горлышки бутылок.

Их необходимо соединить вместе и оплавить шов.

Гайки делаются из бутылочных крышек.

В двух бутылках в нижней части делаются отверстия. Все соединяется и тщательно заливается герметиком.

В качестве источника напряжения будем использовать бытовую сеть 220в. Хочу предупредить, что это довольно опасная игрушка. Так что, если нет достаточных навыков или есть сомнения, то лучше не повторять. В бытовой сети у нас ток переменный, для электролиза его необходимо выпрямить. Для этого прекрасно подойдет диодный мост. Тот что на фотографии оказался не достаточно мощным и быстро перегорел. Наилучшим вариантом стал китайский диодный мост MB156 в алюминиевом корпусе.

Диодный мост сильно нагревается. Понадобится активное охлаждение. Кулер для компьютерного процессора подойдет как нельзя лучше. Для корпуса можно использовать подходящую по размеру распаячную коробку. Продается в электротоварах.

Под диодный мост необходимо подложить несколько слоев картона.

В крышке распаячной коробки делаются необходимые отверстия.

Так выглядит установка в сборе. Электролизер запитывается от сети, вентилятор от универсального источника питания. В качестве электролита применяется раствор пищевой соды. Тут нужно помнить, что чем выше концентрация раствора, тем выше скорость реакции. Но при этом выше и нагрев. Причем свой вклад в нагрев будет вносить реакция разложения натрия у катода. Эта реакция экзотермическая. В результате неё будет образовываться водород и гидроксид натрия.

Тот аппарат, что на фото выше, очень сильно нагревался. Его приходилось периодически отключать и ждать пока остынет. Проблему с нагревом удалось частично решить путем охлаждения электролита. Для этого я использовал помпу для настольного фонтана. Длинная трубка проходит из одной бутылки в другую через помпу и ведро с холодной водой.

Место подсоединения трубки к шарику хорошо снабдить краником. Продаются в зоомагазинах в отделе для аквариумов.

Процесс изготовления на видео.
Взрыв шарика с водородом
Добавлять комментарии могут только зарегистрированные пользователи.
Авторизация
© 2015 Забацай. Все права защищены.
При использовании материалов этого сайта, обязательно указывайте ссылку на источник.
 Электролиз воды – это самый старый способ получения водорода. Пропуская постоянный ток через воду, на катоде накапливается — водород, а на аноде – кислород. Получение водорода электролизом очень энергозатратный производство, поэтому используется исключительно в тех областях, где данный газ достаточно ценен и необходим.
Электролиз воды – это самый старый способ получения водорода. Пропуская постоянный ток через воду, на катоде накапливается — водород, а на аноде – кислород. Получение водорода электролизом очень энергозатратный производство, поэтому используется исключительно в тех областях, где данный газ достаточно ценен и необходим.
Получение водорода в домашних условиях достаточно легкий процесс и есть несколько способов сделать это:
1. Нам понадобится раствор щелочи не пугайтесь этих названий т.к. все это есть в свободном доступе.
Например, средство для очистки труб «крот» отлично подойдет по составу. Насыпаем в колбу немного щелочи и заливаем 100 мл воды;
Тщательно перемешиваем для полного растворения кристаллов;
Добавляем несколько небольших кусочков алюминия;
Ждем около 3-5 минут, пока реакция будет проходить максимально быстро;
Добавляем дополнительно несколько кусочков алюминия и 10-20 грамм щелочи;
Закрываем резервуар специальной колбой с трубкой, которая ведет в резервуар для сбора газа и ждем несколько минут пока воздух не выйдет под давлением водорода из сосуда.
2. Выделение водорода из алюминия, пищевой соли и сульфата меди.
В колбу насыпаем сульфат меди и чуть больше соли;
Разбавляем все водой и хорошо перемешиваем;
Ставим колбу в резервуар с водой, так как при реакции будет выделяться много тепла;
В остальном все нужно делать так же как в первом способе.
3. Получение водорода из воды путем пропускания тока в 12В через раствор соли в воде. Это самый простой способ и больше всего подходит для домашних условий. Единственный минус этого способа в том, что водорода выделяется сравнительно мало.
Итак. Теперь вы знаете, как получить водород из воды и не только. Вы можете проводить очень много экспериментов. Не забывайте придерживаться правил безопасности во избежание травм.
Получение водорода в домашних условиях
В данной статье описаны наиболее популярные способы получения дешевого водорода в домашних условиях.
Способ 1. Водород из алюминия и щелочи.
Используемый раствор щелочи – едкого кали, либо едкого натра. Выделяемый водород более чистый, чем при реакции кислот с активными металлами.
Насыпаем в колбу небольшое количество едкого кали либо натра и заливаем 50 -100 мл воды, перемешиваем раствор до полного растворения кристаллов. Далее добавляем несколько кусочков алюминия. Сразу же начнется реакция с выделением водорода и тепла, сначала слабая, но постоянно усиливающаяся.
Дождавшись пока реакция будет происходить более активно, аккуратно добавим еще 10г. щелочи и несколько кусочком алюминия. Так мы значительно усилим процесс.
Закупориваем колбу, пробиркой с трубкой ведущей сосуд для сбора газа. Ждем примерно 3 -5 мин. пока водород вытеснит воздух из сосуда.
Как образуется водород? Оксидная пленка, которая покрывающая поверхность алюминия, при контакте с щелочью разрушается. Так как алюминий является активным металлом, то он начинает реагировать с водой, растворяясь в ней, при этом выделяется водород.
2Al + 2NaOH + 6h4O → 2Na + 3h4↑
Способ 2. Водород из алюминия, сульфата меди и пищевой соли.
В колбу насыпаем немного сульфата меди, и соли. Добавляем воду и перемешиваем до полного растворения. Раствор должен, окрасится в зеленый цвет, если этого не произошло, добавьте еще небольшое количество соли.
Колбу необходимо поставить в чашку наполненной холодной водой, т.к. при реакции, будет выделятся большое количество тепла.
Добавляем в раствор несколько кусочков алюминия. Начнется реакция.
Как происходит выделение водорода? В процессе образуется хлорид меди, смывающий оксидную пленку с метала. Одновременно с восстановлением меди происходит образование газа.
Способ 3. Водород из цинка и соляной кислоты.
Помещаем в пробирку кусочки цинка и заливаем их соляной кислотой.
Являясь активным металлом цинк, взаимодействуя с кислотой, вытесняет из нее водород.
Способ 4. Производство водорода электролизом.
Пропускаем через раствор воды и проваренной соли электрический ток. При реакции, будет выделятся водород и кислород.
Получение водорода электролизом воды.
 Давно хотел сделать подобную штуку. Но дальше опытов с батарейкой и парой электродов не доходило. Хотелось сделать полноценный аппарат для производства водорода, в количествах для того чтобы надуть шарик. Прежде чем делать полноценный аппарат для электролиза воды в домашних условиях, решил все проверить на модели.
Давно хотел сделать подобную штуку. Но дальше опытов с батарейкой и парой электродов не доходило. Хотелось сделать полноценный аппарат для производства водорода, в количествах для того чтобы надуть шарик. Прежде чем делать полноценный аппарат для электролиза воды в домашних условиях, решил все проверить на модели.
Эта модель не подходит для полноценной ежедневной эксплуатации. Но проверить идею удалось. Итак для электродов я решил применить графит. Прекрасный источник графита для электродов это токосъемник троллейбуса. Их полно валяется на конечных остановках. Нужно помнить, что один из электродов будет разрушаться.
Пилим и дорабатываем напильником. Интенсивность электролиза зависит от силы тока и площади электродов. К электродам прикрепляются провода. Провода должны быть тщательно изолированы. Для корпуса модели электролизера вполне подойдут пластиковые бутылки. В крышке делаются дырки для трубок и проводов. Все тщательно промазывается герметиком.
Для соединения двух ёмкостей подойдут отрезанные горлышки бутылок. Их необходимо соединить вместе и оплавить шов. Гайки делаются из бутылочных крышек. В двух бутылках в нижней части делаются отверстия. Все соединяется и тщательно заливается герметиком.
В качестве источника напряжения будем использовать бытовую сеть 220в. Хочу предупредить, что это довольно опасная игрушка. Так что, если нет достаточных навыков или есть сомнения, то лучше не повторять. В бытовой сети у нас ток переменный, для электролиза его необходимо выпрямить. Для этого прекрасно подойдет диодный мост. Тот что на фотографии оказался не достаточно мощным и быстро перегорел. Наилучшим вариантом стал китайский диодный мост MB156 в алюминиевом корпусе.
Диодный мост сильно нагревается. Понадобится активное охлаждение. Кулер для компьютерного процессора подойдет как нельзя лучше. Для корпуса можно использовать подходящую по размеру распаячную коробку. Продается в электротоварах.
Под диодный мост необходимо подложить несколько слоев картона. В крышке распаячной коробки делаются необходимые отверстия. Так выглядит установка в сборе. Электролизер запитывается от сети, вентилятор от универсального источника питания. В качестве электролита применяется раствор пищевой соды. Тут нужно помнить, что чем выше концентрация раствора, тем выше скорость реакции. Но при этом выше и нагрев. Причем свой вклад в нагрев будет вносить реакция разложения натрия у катода. Эта реакция экзотермическая. В результате неё будет образовываться водород и гидроксид натрия.
Тот аппарат, что на фото выше, очень сильно нагревался. Его приходилось периодически отключать и ждать пока остынет. Проблему с нагревом удалось частично решить путем охлаждения электролита. Для этого я использовал помпу для настольного фонтана. Длинная трубка проходит из одной бутылки в другую через помпу и ведро с холодной водой.
Место подсоединения трубки к шарику хорошо снабдить краником. Продаются в зоомагазинах в отделе для аквариумов.
Основные знания по классическому электролизу.
Принцип экономичности электролизёра для получения газа h4 и O2.
Наверняка все знают, если опустить два гвоздя в раствор питьевой соды и подать на один гвоздь плюс, а на другой минус, то на минусе будет выделяться Водород, а на плюсе Кислород.
Теперь наша задача найти такой подход, чтобы получить как можно больше этого газа и потратить при этом минимальное количество электроэнергии.
Разложение воды начинается при подаче на электроды чуть больше 1,8 вольта. Если подавать 1 вольт, то ток практически не идёт и не выделяется газ, а вот когда напряжение подходит к значению 1,8 вольта, то ток резко начинает расти. Это называется минимальный электродный потенциал при котором начинается электролиз. Поэтому- если мы подадим 12 вольт на эти 2 гвоздя — то такой электролизёр будет жрать много электроэнергии, а газу будет мало. Вся энергия уйдёт в нагрев электролита.
Для того. чтобы наш электролизёр был экономичным — надо подавать не более 2-х вольт на ячейку. Поэтому, если у нас 12 вольт — мы делим их на 6 ячеек и получаем на каждой по 2 вольта.
А теперь упрощаем — просто разделим ёмкость на 6 частей пластинами- в результате получится 6 ячеек, соединённых последовательно на каждой ячейке будет по 2 вольта каждая внутренняя пластина с одной стороны будет плюсом, а с другой минусом. Итак — урок номер 1 усвоили = подавать маленькое напряжение.
Теперь 2-ой урок экономичности: Расстояние между пластинами
Чем больше расстояние — тем больше сопротивление, тем больше потратим тока для получения литра газа. Чем меньше расстояние — тем меньше потратим Ватт в Час на Литр газа. Далее буду пользоваться именно этим термином — показатель экономичности электролизёра / Из графика видно, что чем ближе находятся пластины друг к другу — тем меньше напряжение требуется для прохождения одного и того же тока. А как известно выход газа прямо пропорционален количеству тока прошедшего через электролит.
Перемножая более маленькое напряжение на ток — мы получим меньше ватт на то же количество газа.
Теперь 3-й урок. Площадь пластин
Если мы возьмём 2 гвоздя и используя первые два правила расположим их близко и подадим на них 2 вольта — то газу получится совсем мало, так как они пропустят очень мало тока. Попробуем при тех же условиях взять две пластины. Теперь количество тока и газа будет увеличено прямо пропорционально площади этих пластин.
Теперь 4-й урок: Концентрация электролита
Используя первые 3 правила возьмём большие железные пластины на маленьком расстоянии друг от друга и подадим на них 2 вольта. И опустим их в водичку, добавив одну щепотку соды. Электролиз пойдёт, но очень вяло, вода будет нагреваться. Ионов в растворе много будет, сопротивление будет маленькое, нагрев уменьшится а количество газа увеличится
Источники: 505sovetov.ru, all-he.ru, zabatsay.ru, xn—-dtbbgbt6ann0jm3a.xn--p1ai, domashnih-usloviyah.ru

Земельный участок в коттеджном поселке
Коттеджные поселки с таунхаусами и домами, становятся все более привлекательным типом жилой недвижимости. Этому способствует не только .

Цивилизация Древней Японии
Уникальным и отличным от других японскую историю и культуру, мировосприятие, искусство и литературу, делает ее большая, по сравнению .

Персидское государство в древности
В свете мировых политических событий последних нескольких десятков лет, когда остро встал иранский вопрос по ядерной .

О сотворении мира, пусть и в разных формах, но говорят все без исключения религии мира. Так, в Библии .

Описание Героев Древней Греции следует начать с Геракла который родился от любовной связи смертной Алкмены и главного .

Немало историй рассказано о них. Многие наслышаны, мало, кто видел. И совсем единицам реально известно об их .

Всемирная сеть позволяет людям, находящимся далеко друг от друга, общаться, если там есть интернет, находить друзей, общаться с ними .
- Как добыть водород в домашних условиях
- Как очистить вещи от жвачки
- Как научиться играть на барабанах
- пластиковая бутылка емкостью 1,5 литра, резиновый шарик, кастрюля с водой, гидроксид калия или гидроксид натрия (каустическая сода, едкий натр), 40 сантиметров проволоки из алюминия, кусочек цинка, стеклянная емкость с узким горлышком, раствор соляной кислоты, резиновый шарик, аккумулятор 12 Вольт, провод из меди, провод из цинка, стеклянный сосуд, вода, поваренная соль, клей, шприц.

- Колба Вюрца, гидроксид натрия, алюминий в гранулах и пудра, мерный стакан, алюминиевая ложка, штатив,капельная воронка. Защитные очки и перчатки, лучина, зажигалка или спички.
Возьмите колбу Вюрца, в которой к горловине припаяна стеклянная отводная трубка, и капельную воронку. Соберите систему на штативе, прикрепив колбу зажимом и установив ее на поверхность стола. Сверху в нее вставьте капельную воронку с краником.
Возьмите мерный стакан и алюминиевую пудру. Налейте гидроксид натрия в стакан, примерно половину объема.
elfterra.ru
Как получить водород - Инфа в доме

Российский исследователь сконструировал электролизер, позволяющий получать водород из воды, затрачивая на это очень мало энергии.
Водород — экологически чистый энергоноситель, к тому же практически неисчерпаемый. Согласно расчетам, из 1 л воды можно получить 1234, 44 л водорода. Однако переход энергетики на водородное топливо тормозят большие затраты энергии, необходимые для получения водорода из воды. Процесс электролиза идет при напряжении 1,6—2,0 В и силе тока в десятки и сотни ампер. Самые современные электролизеры расходуют на получение кубометра водорода больше энергии, чем можно получить при его сжигании (4 и 3,55 кВт.ч соответственно). Проблему уменьшения затрат энергии на получение водорода из воды решают многие лаборатории мира, но существенных результатов достичь пока не удалось. Однако в природе существует экономный процесс разложения молекул воды на водород и кислород. Протекает он при фотосинтезе. При этом атомы водорода участвуют в формировании органических молекул, а кислород уходит в атмосферу. Ячейка электролизера, разработанная Ф.Канаревым из Кубанского государственного аграрного университета, моделирует этот процесс.
Сходство с фотосинтезом заключается в том, что ячейка потребляет очень мало энергии. Фактически устройство использует напряжение всего в 0,062 В при силе тока 0,02 А. Ф.Канарев сконструировал две лабораторные модели электролизера: с коническими и цилиндрическими стальными электродами. По замыслу своего создателя, они моделируют годовые кольца ствола дерева. Даже при полном отсутствии электролита на электродах ячейки появляется разность потенциалов около 0,1В. После заливки раствора разность потенциалов возрастает. При этом положительный знак заряда всегда появляется на верхнем электроде, отрицательный — на нижнем. Ячейка низкоамперного электролизера представляет собой конденсатор. Вначале он заряжается при напряжении 1,5-2 В и силе тока, значительно большей 0,02 А, а затем постепенно разряжается под действием происходящих в нем электролитических процессов. И в это время устройство потребляет совсем немного энергии, которую тратит на подзарядку конденсатора. Даже в отключенном от сети приборе электролиз идет еще пять часов, о чем свидетельствует интенсивное бульканье пузырьков газа.
Обе модели электролизера, и с коническими, и с цилиндрическими электродами, работают с одинаковой энергетической эффективностью. Показатель этой эффективности еще предстоит уточнять. Но уже сейчас ясно, что затраты энергии на получение водорода из воды при низкоамперном электролизе уменьшаются в 12 раз, а по самым смелым подсчетам — почти в 2000 раз (т.е. составляют всего от 0,407 до 0,0023 кВт.ч на кубометр водорода). По мнению Ф.Канарева, предложенный им метод получения дешевого водорода из воды можно будет использовать для создания промышленных электролизеров, которые найдут применение в будущей водородной энергетике.
infavdome.online