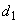Готовые домашние задания, готовые задачи по химии и биологии. Характеристика кислорода
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение » HimEge.ru
 Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16О, 17О и 18О (преобладает 16О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.

Строение молекулы озона
3О2 = 2О3 – 285 кДжОзон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2
2. В лаборатории кислород получают:1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4:2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
Оксида марганца (+4) MnO2:4MnO2 = 2Mn2O3 + O2↑ (700 oC),
3MnO2 = 2Mn3O4 + O2↑ (1000 oC),
Пероксид бария BaO2 :2BaO2 = 2BaO + O2↑
3. Разложением пероксида водорода:2h3O2 = h3O + O2↑ (катализатор MnO2)
4. Разложение нитратов:2KNO3 → 2KNO2 + O2
На космических кораблях и подводных лодках кислород получают из смеси K2O2 и K2O4:2K2O4 + 2h3O = 4KOH +3O2↑4KOH + 2CO2 = 2K2CO3 + 2h3O
Суммарно:2K2O4 + 2CO2 = 2K2CO3 + 3О2 ↑
Когда используют K2O2, то суммарная реакция выглядит так:2K2O2 + 2CO2 = 2K2CO3 + O2 ↑
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода
 Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
 Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
 Кислород легко реагирует с щелочными и щелочноземельными металлами:
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O2 → 2Li2O,
2K + O2 → K2O2,
2Ca + O2 → 2CaO,
2Na + O2 → Na2O2,
2K + 2O2 → K2O4
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O2 → Fe3O4
2Mg + O2 → 2MgO
2Cu + O2 → 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O2 → SO2,
C + O2 → CO2,
2h3 + O2 → h3O,
4P + 5O2 → 2P2O5,
Si + O2 → SiO2, и т.д
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2h3S + 3O2 → 2SO2 + 2h3O (избыток кислорода),
2h3S + O2 → 2S + 2h3O (недостаток кислорода),
4Nh4 + 3O2 → 2N2 + 6h3O (без катализатора),
4Nh4 + 5O2 → 4NO + 6h3O (в присутствии катализатора Pt ),
Ch5 (метан) + 2O2 → CO2 + 2h3O,
4FeS2 (пирит) + 11O2 → 2Fe2O3 + 8SO2.
Известны соединения, содержащие катион диоксигенила O2+, например, O2+ [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).

Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I— в растворе Kl:
O3 + 2Kl + h3O = I2 + O2 + 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
himege.ru
Характеристика кислорода. Задачи 834- 836
Задача 834.Исходя из строения атома кислорода, указать его валентные возможности. Какие степени окисленности проявляет кислород в соединениях?Решение:Распределение электронов внешнего электронного уровня кислорода…2s22p4 (учитывая правило Хунда, получим: 2s22pх22ру12рz1) по квантовым ячейкам имеет вид:
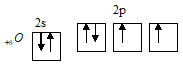
На валентном энергетическом уровне имеется два неспаренных электрона. Таким образом, на внешнем электронном слое атома кислорода содержится шесть электронов – два на s-подуровне и четыре на р-подуровне. Атом кислорода отличается от атомов элементов своей подгруппы тем, что у него отсутствует d-подуровень на внешнем энергетическом уровне. Такая электронная структура атома кислорода обуславливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. К тому же атому кислорода выгоднее присоединять электроны, чем отдавать. Поэтому ковалентность (валентность) кислорода, как правило, равна 2. По величине электроотрицательности кислород уступает только фтору, только в соединениях с атомом фтора степень окисления кислорода равна +2 (OF2). В соединениях со всеми другими элементами степень окисления кислорода отрицательна и обычно равна -2, за исключением как в перооксидах, где степень окисления его равна -1 (Н2О2).
Задача 835. Указать лабораторные и промышленные способы получения кислорода, перечислить важнейшие области его практического применения.Решение:
Лабораторные способы получения кислорода:
1). Электролиз водных растворов щелочей. При электролизе раствора щёлочи, например, едкого натра на катоде водород, а на аноде – кислород:
(4ОН- = О2↑ + 2Н2О + 4 ).
).
2). Можно получить кислород при взаимодействии раствора перманганата калия с подкисленным раствором пероксида водорода:
2KMnO4 + 5h3O2 + 3h3SO4 = 2MnSO4 + K2SO4 + 8h3O + 5O2↑
3). При термическом разложении некоторых кислородсодержащих веществ, например:
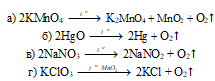
4). Каталитическое разложение пероксида водорода:
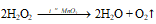
5). Взаимодействием пероксидов щелочных металлов с углекислым газом:
2К2О2 + 2СО2 ↔ 2К2СО3 + O2↑
Промышленные способы получения кислорода:
1). Сжижение воздуха при низких температурах и его дальнейшей фракционной перегонке. Вначале из жидкого воздуха отгоняют азот, затем углекислый газ, а в жидком состоянии остаётся почти чистый кислород. Объясняется это тем, что у кислорода более высокая температура кипения, чем у азота и углекислого газа.
2). Электролиз воды. Для этого проводят электролиз раствора КОН на железном катоде и никелевом аноде, которые разделены асбестовой диффузной диафрагмой. На электродах происходят следующие процессы:
На катоде: 4Н2О + 4 = 2Н2↑+ 4ОН-На аноде: 4ОН- + 4
= 2Н2↑+ 4ОН-На аноде: 4ОН- + 4 = О2↑ + 2Н2О
= О2↑ + 2Н2О
Важнейшие области практического применения кислорода:
1). Получение высоких температур. Для чего различные газы (водород, ацетилен, «светильный газ» и т. д.) сжигают в специальных горелках.
2). Кислород используют в медицине при затруднении дыхания.
3). Кислород используют для интенсификации ряда важнейших производственных процессов в металлургической и химической промышленности, например, в доменном процессе, в производстве серной кислоты и других процессах.
4). Взрывчатые смеси. Применяемые при подрывных работах, так называемые оксиликвиты, представляют собой смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами.
5). Жидкий кислород применяют в ракетах, а также для приготовления дыхательных смесей.
Задача 836. Дать характеристику молекулярного кислорода О2, указав: а) его химические свойства; б) строение молекулы по методу МО; в) магнитные свойства молекулы. С какими простыми веществами кислород непосредственно не взаимодействует?Решение:а) Химические свойства кислорода.Кислород, обладая высокой электроотрицательностью, образует соединения со всеми химическими элементами, кроме гелия, аргона и неона. Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры в системе. Некоторые вещества, например, оксид азота (II), гемоглобин крови и др., уже при комнатной температуре соединяются со значительной скоростью. При применении катализаторов многие реакции с кислородом протекают со взрывом, например, в присутствии дисперсной платины смесь водорода и кислорода воспламеняется со взрывом при комнатной температуре:
2Н2 + О2 ↔ 2Н2О
В обычных условиях эта реакция протекает только при нагревании (смесь водорода с кислородом в отношении 2 : 1 взрывается от удара). Характерной особенностью реакций различных веществ с кислородом является то, что во внешнюю среду выделяется теплота и свет, т. е. наблюдается горение вещества. Реакция горения веществ встречается в природе, в промышленности, например, горение органических веществ (природный газ, торф, растительный покров и др.). При горении органических веществ всегда выделяется углекислый газ, вода, теплота и свет:
СН4 + 2О2 = СО2 + 2Н2О
Металлы и неметаллы при взаимодействии с кислородом образуют оксиды:
S + O2 = SO2;4Na + O2 = 2Na2O.
В реакциях кислород проявляет свойства окислителя, т. е. свойства элемента, атомом которого присоединяет электроны от атомов других элементов, понижая при этом свою степень окисления, обычно от 0 до -2. В некоторых случаях, например при образовании пероксида водорода кислород проявляет свою степень окисления -1 (h3+1O2-1 ). Медленно протекающие реакции кислорода с органическими веществами называются тлением или окислением:
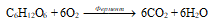
б) Строение молекулы кислорода по методу МО:
Энергетическая схема образования молекулярных орбиталей молекулы О2 имеет вид:
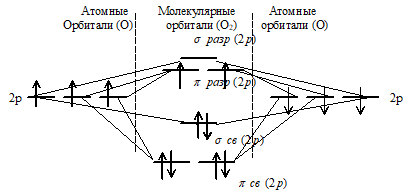
Кратность связи (n) равна:
n = (6 -2)/2 = 2.
Кратность 2 указывает на наличие в молекуле О2 двух ковалентных связей.
в) Наличие двух неспаренных электронов на πу(разр.) и πz(разр.) - орбиталях в молекуле О2 указывает на парамагнитность молекулы – жидкий кислород притягивается магнитом. Кислород непосредственно не взаимодействует с галогенами (F2, Cl2, Br2, I2), золотом и платиной. С инертными газами, такими как гелий, неон и аргон кислород даже не образует соединения.
buzani.ru
23. Кислород и его свойства
Кислород (О) стоит в 1 периоде, VI группе, в главной подгруппе. р-элемент. Электронная конфигурация 1s22s22p4 . Число электронов на внешнем уровне – 6. Кислород может принять 2 электрона и в редких случаях отдать. Валентность кислорода 2, степень окисления -2.
Физические свойства: кислород ( О2) – бесцветный газ, без запаха и вкуса; в воде малорастворим, немного тяжелее воздуха. При -183 °C и 101,325 Па кислород сжижается, приобретая голубоватый цвет. Строение молекулы: молекула кислорода двухатомна, в обычных условиях прочная, обладает магнитными свойствами. Связь в молекуле ковалентная неполярная. Кислород имеет аллотропную модификацию – озон (О3) – более сильный окислитель, чем кислород.
Химические свойства: до завершения энергетического уровня кислороду нужно 2 электрона, которые он принимает проявляя степень окисления -2, но в соединении со фтором кислород ОF2 -2 и О2F2 -1. Благодаря химической активности кислород взаимодействует почти со всеми простыми веществами. С металлами образует оксиды и пероксиды:
Кислород не реагирует только с платиной. При повышенных и высоких температурах реагирует со многими неметаллами:
Непосредственно кислород не взаимодействует с галогенами. Кислород реагирует со многими сложными веществами:
Кислороду характерны реакции горения:
В кислороде горят многие органические вещества:
При окислении кислородом уксусного альдегида получают уксусную кислоту:
Получение: в лаборатории: 1) электролизом водного раствора щелочи: при этом на катоде выделяется водород, а на аноде – кислород; 2) разложением бертолетовой соли при нагревании: 2КСlО3?2КСl + 3О2?; 3) очень чистый кислород получают: 2КМnO4?К2МnO4 + МnО2 + О2?.
Нахождение в природе: кислород составляет 47,2 % массы земной коры. В свободном состоянии он содержится в атмосферном воздухе – 21 %. Входит в состав многих природных минералов, огромное его количество содержится в организмах растений и животных. Природный кислород состоит из 3 изотопов: О(16), О(17), О(18).
Применение: используется в химической, металлургической промышленности, в медицине.
24. Озон и его свойства
В твердом состоянии у кислорода зафиксировано три модификации: ?-, ?– и ?– модификации. Озон ( О3) – одна из аллотропных модификаций кислорода. Строение молекулы: озон имеет нелинейное строение молекулы с углом между атомами 117°. Молекула озона обладает некоторой полярностью (несмотря на атомы одного рода, образующих молекулу озона), диамагнитна, так как не имеет неспаренных электронов.
Физические свойства: озон – синий газ, имеющий характерный запах; молекулярная масса = 48, температура плавления (твердого) = 192,7 °C, температура кипения = 111,9 °C. Жидкий и твердый озон взрывчат, токсичен, хорошо растворим в воде: при 0 °C в 100 объемах воды растворяется до 49 объемов озона.
Химические свойства: озон – сильный окислитель, он окисляет все металлы, в том числе золото – Au и платину – Pt (и металлы платиновой группы). Озон воздействует на блестящую серебряную пластинку, которая мгновенно покрывается черным пероксидом серебра – Аg2О2; бумага, смоченная скипидаром, воспламеняется, сернистые соединения металлов окисляются до солей серной кислоты; многие красящие вещества обесцвечиваются; разрушает органические вещества – при этом молекула озона отщепляет один атом кислорода, и озон превращается в обыкновенный кислород. Атакже большинство неметаллов, переводит низшие оксиды в высшие, а сульфиды их металлов – в их сульфаты:
Йодид калия озон окисляет до молекулярного йода:
Но с пероксидом водорода Н2О2 озон выступает в качестве восстановителя:
В химическом отношении молекулы озона неустойчивы – озон способен самопроизвольно распадаться на молекулярный кислород:
Получение: получают озон в озонаторах путем пропускания через кислород или воздух электрические искры. Образование озона из кислорода:
Озон может образовываться при окислении влажного фосфора, смолистых веществ. Определитель озона: чтобы опознать в воздухе наличие озона, необходимо в воздух погрузить бумажку, пропитанную раствором йодида калия и крахмальным клейстером – если бумажка приобрела синюю окраску, значит, в воздухе присутствует озон. Нахождение в природе: в атмосфере озон образуется во время электрических разрядов. Применение: будучи сильным окислителем озон уничтожает различного рода бактерии, поэтому широко применяется в целях очищения воды и дезинфекции воздуха, используется как белящее средство.
studfiles.net
Характеристика кислорода как химического элемента и как простого вещества — Науколандия
Кислород (O) занимает восьмое место в Периодической системе химических элементов. То есть его порядковый номер 8. Он стоит после азота (N) и перед фтором (F).
Масса атома кислорода составляет около 16 а.е.м.
Кислород является самым распространенным на Земле химическим элементом. Он входит в состав воды, большинство горных пород, является составной частью атмосферы. Тела живых организмов больше, чем наполовину, состоят из воды, а следовательно содержат много кислорода. Кроме того кислород входит в состав органических молекул (белков, жиров и углеводов).
В атмосфере кислород содержится в виде простого вещества — газа кислорода O2. Также в верхних слоях атмосферы присутствует трехатомный газ — озон O3.
Двухатомный кислород (O2) при обычных условиях газ без цвета и запаха. Он плохо растворим в воде (в 100 литрах воды растворяется 3 литра кислорода), с понижением температуры растворимость немного повышается. Именно поэтому в теплых морях обитает меньше живых организмов, чем в умеренной зоне, так как им не хватает кислорода для дыхания. Кислород превращается в синеватую жидкость при температуре –183 °C, а при температуре –219 °C становится твердым кристаллическим веществом.
Озон (O3) имеет запах (его можно почувствовать после грозы как запах «свежести»). В атмосфере озон образуется под действием электрических разрядов. В атмосфере Земли на высоте около 15 км находится озоновый слой, который защищает живые организмы от вредных ультрафиолетовых лучей Солнца.
Кислород достаточно активный газ. Он поддерживает горение.
Газ кислород на Земле выделяют растения в процессе фотосинтеза (синтеза органических соединений из неорганических). Кислород является побочным продуктом фотосинтеза, однако играет очень важную роль для живых организмов, так как используется для дыхания. В процессе дыхания происходит окисление органических веществ, при этом выделяется энергия, которая необходима для жизни.
scienceland.info
Характеристика кислорода. Задачи 834- 836
Задача 834.Исходя из строения атома кислорода, указать его валентные возможности. Какие степени окисленности проявляет кислород в соединениях?Решение:Распределение электронов внешнего электронного уровня кислорода…2s22p4 (учитывая правило Хунда, получим: 2s22pх22ру12рz1) по квантовым ячейкам имеет вид:

На валентном энергетическом уровне имеется два неспаренных электрона. Таким образом, на внешнем электронном слое атома кислорода содержится шесть электронов – два на s-подуровне и четыре на р-подуровне. Атом кислорода отличается от атомов элементов своей подгруппы тем, что у него отсутствует d-подуровень на внешнем энергетическом уровне. Такая электронная структура атома кислорода обуславливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. К тому же атому кислорода выгоднее присоединять электроны, чем отдавать. Поэтому ковалентность (валентность) кислорода, как правило, равна 2. По величине электроотрицательности кислород уступает только фтору, только в соединениях с атомом фтора степень окисления кислорода равна +2 (OF2). В соединениях со всеми другими элементами степень окисления кислорода отрицательна и обычно равна -2, за исключением как в перооксидах, где степень окисления его равна -1 (Н2О2).
Задача 835. Указать лабораторные и промышленные способы получения кислорода, перечислить важнейшие области его практического применения.Решение:
Лабораторные способы получения кислорода:
1). Электролиз водных растворов щелочей. При электролизе раствора щёлочи, например, едкого натра на катоде водород, а на аноде – кислород:
(4ОН- = О2↑ + 2Н2О + 4 ).
).
2). Можно получить кислород при взаимодействии раствора перманганата калия с подкисленным раствором пероксида водорода:
2KMnO4 + 5h3O2 + 3h3SO4 = 2MnSO4 + K2SO4 + 8h3O + 5O2↑
3). При термическом разложении некоторых кислородсодержащих веществ, например:
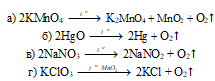
4). Каталитическое разложение пероксида водорода:
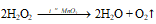
5). Взаимодействием пероксидов щелочных металлов с углекислым газом:
2К2О2 + 2СО2 ↔ 2К2СО3 + O2↑
Промышленные способы получения кислорода:
1). Сжижение воздуха при низких температурах и его дальнейшей фракционной перегонке. Вначале из жидкого воздуха отгоняют азот, затем углекислый газ, а в жидком состоянии остаётся почти чистый кислород. Объясняется это тем, что у кислорода более высокая температура кипения, чем у азота и углекислого газа.
2). Электролиз воды. Для этого проводят электролиз раствора КОН на железном катоде и никелевом аноде, которые разделены асбестовой диффузной диафрагмой. На электродах происходят следующие процессы:
На катоде: 4Н2О + 4 = 2Н2↑+ 4ОН-На аноде: 4ОН- + 4
= 2Н2↑+ 4ОН-На аноде: 4ОН- + 4 = О2↑ + 2Н2О
= О2↑ + 2Н2О
Важнейшие области практического применения кислорода:
1). Получение высоких температур. Для чего различные газы (водород, ацетилен, «светильный газ» и т. д.) сжигают в специальных горелках.
2). Кислород используют в медицине при затруднении дыхания.
3). Кислород используют для интенсификации ряда важнейших производственных процессов в металлургической и химической промышленности, например, в доменном процессе, в производстве серной кислоты и других процессах.
4). Взрывчатые смеси. Применяемые при подрывных работах, так называемые оксиликвиты, представляют собой смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами.
5). Жидкий кислород применяют в ракетах, а также для приготовления дыхательных смесей.
Задача 836. Дать характеристику молекулярного кислорода О2, указав: а) его химические свойства; б) строение молекулы по методу МО; в) магнитные свойства молекулы. С какими простыми веществами кислород непосредственно не взаимодействует?Решение:а) Химические свойства кислорода.Кислород, обладая высокой электроотрицательностью, образует соединения со всеми химическими элементами, кроме гелия, аргона и неона. Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры в системе. Некоторые вещества, например, оксид азота (II), гемоглобин крови и др., уже при комнатной температуре соединяются со значительной скоростью. При применении катализаторов многие реакции с кислородом протекают со взрывом, например, в присутствии дисперсной платины смесь водорода и кислорода воспламеняется со взрывом при комнатной температуре:
2Н2 + О2 ↔ 2Н2О
В обычных условиях эта реакция протекает только при нагревании (смесь водорода с кислородом в отношении 2 : 1 взрывается от удара). Характерной особенностью реакций различных веществ с кислородом является то, что во внешнюю среду выделяется теплота и свет, т. е. наблюдается горение вещества. Реакция горения веществ встречается в природе, в промышленности, например, горение органических веществ (природный газ, торф, растительный покров и др.). При горении органических веществ всегда выделяется углекислый газ, вода, теплота и свет:
СН4 + 2О2 = СО2 + 2Н2О
Металлы и неметаллы при взаимодействии с кислородом образуют оксиды:
S + O2 = SO2;4Na + O2 = 2Na2O.
В реакциях кислород проявляет свойства окислителя, т. е. свойства элемента, атомом которого присоединяет электроны от атомов других элементов, понижая при этом свою степень окисления, обычно от 0 до -2. В некоторых случаях, например при образовании пероксида водорода кислород проявляет свою степень окисления -1 (h3+1O2-1 ). Медленно протекающие реакции кислорода с органическими веществами называются тлением или окислением:
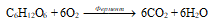
б) Строение молекулы кислорода по методу МО:
Энергетическая схема образования молекулярных орбиталей молекулы О2 имеет вид:

Кратность связи (n) равна:
n = (6 -2)/2 = 2.
Кратность 2 указывает на наличие в молекуле О2 двух ковалентных связей.
в) Наличие двух неспаренных электронов на πу(разр.) и πz(разр.) - орбиталях в молекуле О2 указывает на парамагнитность молекулы – жидкий кислород притягивается магнитом. Кислород непосредственно не взаимодействует с галогенами (F2, Cl2, Br2, I2), золотом и платиной. С инертными газами, такими как гелий, неон и аргон кислород даже не образует соединения.
buzani.ru
Характеристика кислорода. Задачи 834- 836
Задача 834.Исходя из строения атома кислорода, указать его валентные возможности. Какие степени окисленности проявляет кислород в соединениях?Решение:Распределение электронов внешнего электронного уровня кислорода…2s22p4 (учитывая правило Хунда, получим: 2s22pх22ру12рz1) по квантовым ячейкам имеет вид:

На валентном энергетическом уровне имеется два неспаренных электрона. Таким образом, на внешнем электронном слое атома кислорода содержится шесть электронов – два на s-подуровне и четыре на р-подуровне. Атом кислорода отличается от атомов элементов своей подгруппы тем, что у него отсутствует d-подуровень на внешнем энергетическом уровне. Такая электронная структура атома кислорода обуславливает большие энергетические затраты на «распаривание» его электронов, не компенсируемые энергией образования новых ковалентных связей. К тому же атому кислорода выгоднее присоединять электроны, чем отдавать. Поэтому ковалентность (валентность) кислорода, как правило, равна 2. По величине электроотрицательности кислород уступает только фтору, только в соединениях с атомом фтора степень окисления кислорода равна +2 (OF2). В соединениях со всеми другими элементами степень окисления кислорода отрицательна и обычно равна -2, за исключением как в перооксидах, где степень окисления его равна -1 (Н2О2).
Задача 835. Указать лабораторные и промышленные способы получения кислорода, перечислить важнейшие области его практического применения.Решение:
Лабораторные способы получения кислорода:
1). Электролиз водных растворов щелочей. При электролизе раствора щёлочи, например, едкого натра на катоде водород, а на аноде – кислород:
(4ОН- = О2↑ + 2Н2О + 4 ).
).
2). Можно получить кислород при взаимодействии раствора перманганата калия с подкисленным раствором пероксида водорода:
2KMnO4 + 5h3O2 + 3h3SO4 = 2MnSO4 + K2SO4 + 8h3O + 5O2↑
3). При термическом разложении некоторых кислородсодержащих веществ, например:
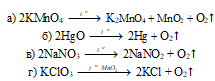
4). Каталитическое разложение пероксида водорода:
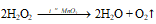
5). Взаимодействием пероксидов щелочных металлов с углекислым газом:
2К2О2 + 2СО2 ↔ 2К2СО3 + O2↑
Промышленные способы получения кислорода:
1). Сжижение воздуха при низких температурах и его дальнейшей фракционной перегонке. Вначале из жидкого воздуха отгоняют азот, затем углекислый газ, а в жидком состоянии остаётся почти чистый кислород. Объясняется это тем, что у кислорода более высокая температура кипения, чем у азота и углекислого газа.
2). Электролиз воды. Для этого проводят электролиз раствора КОН на железном катоде и никелевом аноде, которые разделены асбестовой диффузной диафрагмой. На электродах происходят следующие процессы:
На катоде: 4Н2О + 4 = 2Н2↑+ 4ОН-На аноде: 4ОН- + 4
= 2Н2↑+ 4ОН-На аноде: 4ОН- + 4 = О2↑ + 2Н2О
= О2↑ + 2Н2О
Важнейшие области практического применения кислорода:
1). Получение высоких температур. Для чего различные газы (водород, ацетилен, «светильный газ» и т. д.) сжигают в специальных горелках.
2). Кислород используют в медицине при затруднении дыхания.
3). Кислород используют для интенсификации ряда важнейших производственных процессов в металлургической и химической промышленности, например, в доменном процессе, в производстве серной кислоты и других процессах.
4). Взрывчатые смеси. Применяемые при подрывных работах, так называемые оксиликвиты, представляют собой смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами.
5). Жидкий кислород применяют в ракетах, а также для приготовления дыхательных смесей.
Задача 836. Дать характеристику молекулярного кислорода О2, указав: а) его химические свойства; б) строение молекулы по методу МО; в) магнитные свойства молекулы. С какими простыми веществами кислород непосредственно не взаимодействует?Решение:а) Химические свойства кислорода.Кислород, обладая высокой электроотрицательностью, образует соединения со всеми химическими элементами, кроме гелия, аргона и неона. Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры в системе. Некоторые вещества, например, оксид азота (II), гемоглобин крови и др., уже при комнатной температуре соединяются со значительной скоростью. При применении катализаторов многие реакции с кислородом протекают со взрывом, например, в присутствии дисперсной платины смесь водорода и кислорода воспламеняется со взрывом при комнатной температуре:
2Н2 + О2 ↔ 2Н2О
В обычных условиях эта реакция протекает только при нагревании (смесь водорода с кислородом в отношении 2 : 1 взрывается от удара). Характерной особенностью реакций различных веществ с кислородом является то, что во внешнюю среду выделяется теплота и свет, т. е. наблюдается горение вещества. Реакция горения веществ встречается в природе, в промышленности, например, горение органических веществ (природный газ, торф, растительный покров и др.). При горении органических веществ всегда выделяется углекислый газ, вода, теплота и свет:
СН4 + 2О2 = СО2 + 2Н2О
Металлы и неметаллы при взаимодействии с кислородом образуют оксиды:
S + O2 = SO2;4Na + O2 = 2Na2O.
В реакциях кислород проявляет свойства окислителя, т. е. свойства элемента, атомом которого присоединяет электроны от атомов других элементов, понижая при этом свою степень окисления, обычно от 0 до -2. В некоторых случаях, например при образовании пероксида водорода кислород проявляет свою степень окисления -1 (h3+1O2-1 ). Медленно протекающие реакции кислорода с органическими веществами называются тлением или окислением:
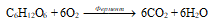
б) Строение молекулы кислорода по методу МО:
Энергетическая схема образования молекулярных орбиталей молекулы О2 имеет вид:

Кратность связи (n) равна:
n = (6 -2)/2 = 2.
Кратность 2 указывает на наличие в молекуле О2 двух ковалентных связей.
в) Наличие двух неспаренных электронов на πу(разр.) и πz(разр.) - орбиталях в молекуле О2 указывает на парамагнитность молекулы – жидкий кислород притягивается магнитом. Кислород непосредственно не взаимодействует с галогенами (F2, Cl2, Br2, I2), золотом и платиной. С инертными газами, такими как гелий, неон и аргон кислород даже не образует соединения.
buzani.ru
Краткая характеристика кислорода. - Полезная информация для всех
Краткая характеристика кислорода.
Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе) , 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2 при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления 2 (валентность II) и, реже, 1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора) .
В свободном виде кислород газ без цвета, запаха и вкуса.
Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2 при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления 2 (валентность II) и, реже, 1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора).
В свободном виде кислород газ без цвета, запаха и вкуса.
Масса атома кислорода составляет около 16 а. е. м.
Кислород является самым распространенным на Земле химическим элементом. Он входит в состав воды, большинство горных пород, является составной частью атмосферы. Тела живых организмов больше, чем наполовину, состоят из воды, а следовательно содержат много кислорода. Кроме того кислород входит в состав органических молекул (белков, жиров и углеводов) .
В атмосфере кислород содержится в виде простого вещества газа кислорода O2. Также в верхних слоях атмосферы присутствует трехатомный газ озон O3.
Двухатомный кислород (O2) при обычных условиях газ без цвета и запаха. Он плохо растворим в воде (в 100 литрах воды растворяется 3 литра кислорода) , с понижением температуры растворимость немного повышается. Именно поэтому в теплых морях обитает меньше живых организмов, чем в умеренной зоне, так как им не хватает кислорода для дыхания. Кислород превращается в синеватую жидкость при температуре 183 C, а при температуре 219 C становится твердым кристаллическим веществом.
Озон (O3) имеет запах (его можно почувствовать после грозы как запах свежести) . В атмосфере озон образуется под действием электрических разрядов. В атмосфере Земли на высоте около 15 км находится озоновый слой, который защищает живые организмы от вредных ультрафиолетовых лучей Солнца.
Кислород достаточно активный газ. Он поддерживает горение.
Газ кислород на Земле выделяют растения в процессе фотосинтеза (синтеза органических соединений из неорганических) . Кислород является побочным продуктом фотосинтеза, однако играет очень важную роль для живых организмов, так как используется для дыхания. В процессе дыхания происходит окисление органических веществ, при этом выделяется энергия, которая необходима для жизни.
info-4all.ru