Медный электрод для дуговой сварки стали малой толщины. Медный электрод
Медный электрод для дуговой сварки стали малой толщины
Класс 21h, 30ii
И 73138
СССР
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Н ЗАВИСИМОМУ АВТОРСКОМУ СВИДЕТЕЛ„
Г. Л. Ануфриев
МЕДНЫИ ЭЛЕКТРОД ДЛЯ ДУГОВОИ СВАР.
ТОЛЩИНЫ
Заявлено 17 октября 1947 г. аа № 4, 198(371197) в Министерство судостроитсльно11 промышленности CCCÐ
Основное авт. св. ¹ 65215 от 31 августа 1945 г. на имя П. Б. Мумрнкова и И. Л. Стспыкпна
Предмет изобретения
Медный электрод для дуговой сварки стали малой толщины по авт. св. ¹ 65215, о тл и ч а ющи и с я тем, что поверх обмазки электрода надета медная трубка для отвода тепла и предохранения обмаз 11 от механических повреждений.
Предлагается конструкция медного обмазанного электрода для дуговой сварки тонкого листового железа по авт. св. М 65215.
Отличительной особенностью предлагаемого электрода является наличие иа его обмазке теплоотводящего элемента — медной тр1 Оки, предохраняющей обмазку от механических повреждеии1ь
На чертеже показан предлагаемый электрод, Медный электрод 1 имеет обмазку 2, поверх которой надета медная теплоотводящая трубка 3. Электрод вставлен в специально скоиструированный для него электродержатель с ручкой 4. Ток и электроду подводится через токоподводящий стержень б.
М 73138
Поди. к печ. 5/I — 62 г
3 а к. 3237/8. формат бум. 70 Р 108 /ы.
Тираж 220.
ЦБТИ при Комитете по делам изобретений и открытий при Совете Министров СССР
Москва, Центр, М. Черкасский пер., д. 2/6.
Объем 0,18 изд. л.
Цена 4 коп.
Типография, пр. Сапунова, 2.
Редактор Н. Л. Леонтьева. Техред А. А. Кудрявицкая, Корректор В. Г. Корпачева


www.findpatent.ru
медный электрод — с русского на итальянский
См. также в других словарях:
Электрод сравнения медно-сульфатный — Медно сульфатный электрод сравнения: электрод сравнения, представляющий собой медный стержень, помещенный в насыщенный раствор медного купороса. Это наиболее часто применяемый электрод сравнения для измерения потенциала между подземными… … Официальная терминология
медносульфатный электрод сравнения — 3.27 медносульфатный электрод сравнения : Электрод сравнения, представляющий собой медный стержень, помещенный в насыщенный раствор медного купороса. Это наиболее часто применяемый электрод сравнения для измерения потенциала между подземными… … Словарь-справочник терминов нормативно-технической документации
медно-сульфатный электрод сравнения — 3.34 медно сульфатный электрод сравнения: Электрод сравнения, в котором медный электрод помещен в насыщенный раствор сернокислой меди. Источник: СТО Газпром 2 2.3 310 2009: Организация коррозионных обследований объектов ОАО "Газпром".… … Словарь-справочник терминов нормативно-технической документации
Электричество — (Electricity) Понятие электричество, получение и применение электричества Информация о понятии электричество, получение и применение электричества Содержание — это понятие, выражающее свойства и явления, обусловленные структурой физических… … Энциклопедия инвестора
ЭЛЕКТРОХИМИЯ — раздел физической химии, изучающий химические процессы, которые сопровождаются появлением электрического тока или, наоборот, возникают под действием электрического тока. Предметом электрохимических исследований также являются электролиты и… … Энциклопедия Кольера
СТО Газпром 9.2-002-2009: Защита от коррозии. Проектирование электрохимической защиты подземных сооружений — Терминология СТО Газпром 9.2 002 2009: Защита от коррозии. Проектирование электрохимической защиты подземных сооружений: 3.1.1 анодное заземление; AЗ: Элемент системы катодной защиты, осуществляющий контакт положительного полюса преобразователя… … Словарь-справочник терминов нормативно-технической документации
Р Газпром 9.2-005-2009: Критерии защищенности от коррозии для участков газопроводов, проложенных в высокоомных (скальных, песчаных, многолетнемерзлых) грунтах — Терминология Р Газпром 9.2 005 2009: Критерии защищенности от коррозии для участков газопроводов, проложенных в высокоомных (скальных, песчаных, многолетнемерзлых) грунтах: 3.1 анодное заземление: Элемент системы катодной зашиты, осуществляющий… … Словарь-справочник терминов нормативно-технической документации
Р Газпром 9.4-006-2009: Инструкция по электрометрическому обследованию подземных технологических трубопроводов компрессорных станций — Терминология Р Газпром 9.4 006 2009: Инструкция по электрометрическому обследованию подземных технологических трубопроводов компрессорных станций: 3.1.1 аварийный режим работы системы ЭХЗ: режим работы системы электрохимической защиты,… … Словарь-справочник терминов нормативно-технической документации
Электрический ток* — Если погрузить в проводящую жидкость, например в раствор серной кислоты, два разнородных металла, например Zn и Сu, и соединить эти металлы между собой металлической проволокой, то в этой системе возникает особый процесс, называемый электрическим … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Электрический ток — Если погрузить в проводящую жидкость, напр. в раствор серной кислоты, два разнородных металла, напр. Zn и Cu, и соединить эти металлы между собой металлической проволокой, то в этой системе возникает особый процесс, называемый электрическим током … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
СТО Газпром 2-2.3-310-2009: Организация коррозионных обследований объектов ОАО "Газпром". Основные требования — Терминология СТО Газпром 2 2.3 310 2009: Организация коррозионных обследований объектов ОАО "Газпром". Основные требования: 3.1 активная защита: Торможение коррозионных процессов посредством катодной поляризации подземных объектов от… … Словарь-справочник терминов нормативно-технической документации
translate.academic.ru
Медно-никелевый электрод - Большая Энциклопедия Нефти и Газа, статья, страница 1
Медно-никелевый электрод
Cтраница 1
Медно-никелевые электроды в производстве применяют главным образом для заварки литейных дефектов, обнаруживаемых в процессе механической обработки чугунного литья на рабочих поверхностях, где местное повышение твердости недопустимо. [1]
Медно-никелевые электроды МНЧ-1 состоят из проволоки монель-металла ( 28 % меди, 2 5 % железа, 1.5 % марганца, остальное - никель) или из константановой проволоки ( 40 % никеля. [3]
Вместо медно-никелевых электродов можно использовать железоникелевые типа ЖНБ. [4]
Технология сварки медно-никелевыми электродами включает следующие основные требования: минимально возможная глубина расплавления основного металла ( не более 0 5 - 2 0 мм), наложение тонких швов с малым объемом металла ( длина шва не должна превышать 40 - 60 мм), тщательная проковка шва, выполняемая сразу после наложения шва по горячему металлу. [5]
При сварке чугуна медно-никелевыми электродами получают легкообрабатываемый слой, так как медь и никель не растворяют углерод и не образуют с ним соединений. Величина и характер переходных зон при сварке электродами из цветных металлов существенно отличаются от величины и характера зон, образующихся при сварка стальными электродами. Основное различие состоит в отсутствии диффузии углерода из основного металла в шов. [6]
При холодной сварке чугуна сваривают стальными, медно-железными, медно-никелевыми электродами и электродами из аустенитного чугуна. В случае применения стальных электродов валики наплавляют низкоуглеродистыми электродами со стабилизирующей или качественной обмазкой. Заготовку сваривают при малых погонных энергиях электродами небольшого диаметра. Применяют также стальные электроды с покрытием, содержащим большое количество карбидо-образующпх элементов. Наплавленный металл имеет мягкую основу с вкрапленными карбидами. Эти способы не исключают образования отбеленных и закалочных структур в околошовной зоне, но они просты и обеспечивают мягкую хорошо обрабатываемую наплавку. [7]
Медно-железные электроды состоят из медного прутка с оплеткой из жести или пучка из медных и стальных стержней. Электроды имеют специальное или стабилизирующее покрытие. Медно-никелевые электроды состоят из стержней монель-металла ( 70 % Ni, 28 % Си, остальное Fe) или мельхиора ( 80 % Си, 20 % Ni) со стабилизирующим покрытием. [8]
Медно-железные электроды состоят из медного прутка с оплеткой из жести или пучка из медных и стальных стержней. Покрытием этих электродов служит меловая обмазка. Медно-никелевые электроды состоят из стержней из монельметалла ( 70 / 6 Ni; 28 % Си и остальные Fe) или мельхиора ( 80 % Си и 20 % Ni) со стабилизирующей обмазкой. Эти электроды уменьшают отбеливание. [9]
Дуговой сваркой ( холодный способ) восстанавливают большую часть чугунных деталей. Сварка может быть ручной или механизированной с электродами из цветных металлов. Чаще используют медные электроды марки ОЗЧ-1 с покрытием, содержащим железный порошок, и медно-никелевые электроды марки МНЧ-1 с покрытием типа УОНИИ-55. [10]
При сварке железо-никелевыми электродами близкие к свойствам основного металла механические свойства обеспечиваются только при температуре предварительного подогрева выше 300 С. Успешно применяются как в СССР, так и за рубежом медно-никелевые электроды, обычно изготовляемые из монель-металла. Существенным недостатком электродов на основе никеля является их высокая стоимость. [11]
Страницы: 1
www.ngpedia.ru
медный, цинковый, каломельный и хлорсеребрянный.
Если электрод - неметалл, посылающий анионы в раствор, то уравнение будет иметь вид:

В связи с тем, что невозможно измерить абсолютный потенциал одного электрода, измеряют его потенциал относительно другого электрода, взятого для сравнения. Таким электродом сравнения является нормальный водородный электрод. Нормальный водородный электрод состоит из платиновой пластинки, покрытой губчатой платиной для усиления адсорбции Н2, опущенной в раствор Н2SO4 с аН+ = 1 моль/л при Т = 298 К. В сосуд подается газообразный Н2 под нормальным давлением. Молекулы Н2 адсорбируются на платине, некоторые из них диссоциируют на атомы, часть из которых, ионизируясь, отдает электроны платине. На границе между платиной и раствором образуется двойной электрический слой, возникает электродный потенциал.

В этом полуэлементе происходят процессы:
Н2  2Н
2Н  2Н+ + 2
2Н+ + 2 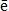 .
.
Возникший электродный потенциал в нормальном водородном электроде условно принято считать равным нулю, φ0Н2/Н+ = 0. Для определения стандартного потенциала собирают гальванический элемент из нормального водородного электрода и электрода из испытуемого металла, погруженного в раствор его соли с концентрацией, равной 1 моль/л, и определяют при стандартных условиях его ЭДС. Полученная величина по абсолютному значению численно равна стандартному потенциалу металла φ0. Знак перед ней зависит от направления движения электронов в гальваническом элементе. Если поток электронов идет от металла к водородному электроду, потенциал металла считается отрицательным, а при обратном движении электронов - положительным.
φ0 определены практически для всех металлов и являются табличными величинами.
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.

Металлический электрод обратим по отношению к катиону. Его электродный потенциал
|
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (h3, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями:
 |
 |
Соответствующие им уравнения Нернста имеют вид:
 |
 |
Очевидно, что их электродный потенциал зависит от давления и активности (концентрации) ионов в растворе.
2. Редокс-электроды состоят из электрохимически инертного проводника (платины, графита и т. д.), погруженного в раствор, в котором находятся окисленная и восстановленная формы потенциалопределяющего вещества. Такой инертный проводник способствует передаче электронов от восстановителя к окислителю через внешнюю цепь. Примерами таких электродов могут служить редокс-электроды с ионами в различных степенях окисления: (Pt)Sn4+, Sn2+, (Pt)Fe3+, Fe2+.
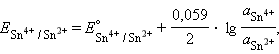 |
 |
Электроды второго рода представляют собой металлические электроды, покрытые слоем труднорастворимой соли того же металла. При погружении в раствор соли одноименного аниона его потенциал будет определяться активностью иона в растворе.
а) Хлорсеребряный электрод (ХСЭ) Ag, AgCl|Cl– представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KCl.
Серебро электрохимически взаимодействует со своим ионом:
Уравнение Нернста для этого процесса:
| (7.2) |
Однако в присутствии труднорастворимого AgCl активность ионов серебра очень мала и ее трудно определить. Но активность ионов Ag+ связана с легко задаваемой в данной системе активностью ионов Cl– произведением растворимости хлорида серебра ПРAgCl:
 |
откуда
 |
Подставляя это выражение в (7.2)
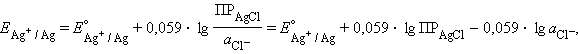 |
и обозначив
 |
получим уравнение Нернста для хлорсеребряного электрода:
|
Потенциалопределяющими являются ионы хлора, а электродный процесс может быть представлен уравнением
 |
б) Каломельный электрод (КЭ) Hg, Hg2Cl2|Cl– – это ртуть, находящаяся в контакте с пастой из смеси ртути и каломели Hg2Cl2, которая, в свою очередь, соприкасается с насыщенным раствором KCl.
Принцип действия каломельного электрода тот же, что и хлорсеребряного.
Электродная реакция сводится к восстановлению каломели до металлической ртути:
 |
Потенциал каломельного электрода определяется активностью ионов хлора:
  |
23) Электрохимические цепи. Их классификация. Определение ЭДС этих цепей.
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ, системы из электродов, находящихся в одном и том же электролите либо в контактирующих друг с другом разл. электролитах. Иногда электрохимические цепи наз. гальванич. цепями. Электрохимические цепи могут быть замкнутыми или разомкнутыми; в частности, электрохимическую цепь наз. правильно разомкнутой, если на концах разомкнутой цепи находятся одинаковые проводники. Последовательность соединения проводников в электрохимических цепях изображают схемой: M| раствор 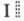 раствор II | М' | М, где М и М' - металлы, сплошные вертикальные черточки указывают границы раздела фаз, а двойная вертикальная пунктирная черта указывает на то, что диффузионный потенциал между р-рами I и II отсутствует (элиминирован) (в противном случае используют одинарную пунктирную черту). Отрицат. электродрасполагают слева. Разность потенциалов на концах правильно разомкнутой электрохимической цепи наз. электродвижущей силой цепи (эдс). Электрохимические цепи строго равновесны лишь тогда, когда они не содержат границы двух электролитов и когда эдс цепи скомпенсирована разностью потенциалов от внеш. источника тока. Электрохимические цепи обычно различают по наличию или отсутствию в цепи границы двух разл. р-ров - соотв. цепи с переносом и цепи без переноса. Т. наз. ф и з. электрохимические цепи составлены из химически одинаковыхэлектродов, погруженных в один и тот же электролит, но отличаются друг от друга физ. состоянием. Источником электрич. энергии служит различие в физ. состоянии электродов, а при работе цепи электрод, находящийся в менее устойчивом состоянии, переходит в более устойчивое. Выделяют аллотропич., гравитационные и термогальванические электрохимические цепи. В аллотропич. электрохимических цепях электродами служат разл. аллотропич. модификации в-ва: в результате протекания тока при замыкании цепи происходит переход менее устойчивой модификации в более устойчивую. В гравитац. электрохимических цепях два жидких электрода имеют разную высоту, а электродные процессы при замыкании цепи приводят к переносу в-ва от электрода с более высоким уровнем к электроду с более низким уровнем и происходит выравнивание уровней. В термогальванич. цепях электрич. энергия возникает за счет переноса тепла от горячего электрода к холодному.
раствор II | М' | М, где М и М' - металлы, сплошные вертикальные черточки указывают границы раздела фаз, а двойная вертикальная пунктирная черта указывает на то, что диффузионный потенциал между р-рами I и II отсутствует (элиминирован) (в противном случае используют одинарную пунктирную черту). Отрицат. электродрасполагают слева. Разность потенциалов на концах правильно разомкнутой электрохимической цепи наз. электродвижущей силой цепи (эдс). Электрохимические цепи строго равновесны лишь тогда, когда они не содержат границы двух электролитов и когда эдс цепи скомпенсирована разностью потенциалов от внеш. источника тока. Электрохимические цепи обычно различают по наличию или отсутствию в цепи границы двух разл. р-ров - соотв. цепи с переносом и цепи без переноса. Т. наз. ф и з. электрохимические цепи составлены из химически одинаковыхэлектродов, погруженных в один и тот же электролит, но отличаются друг от друга физ. состоянием. Источником электрич. энергии служит различие в физ. состоянии электродов, а при работе цепи электрод, находящийся в менее устойчивом состоянии, переходит в более устойчивое. Выделяют аллотропич., гравитационные и термогальванические электрохимические цепи. В аллотропич. электрохимических цепях электродами служат разл. аллотропич. модификации в-ва: в результате протекания тока при замыкании цепи происходит переход менее устойчивой модификации в более устойчивую. В гравитац. электрохимических цепях два жидких электрода имеют разную высоту, а электродные процессы при замыкании цепи приводят к переносу в-ва от электрода с более высоким уровнем к электроду с более низким уровнем и происходит выравнивание уровней. В термогальванич. цепях электрич. энергия возникает за счет переноса тепла от горячего электрода к холодному.
| Учитывая природу электродной реакции, можно классифицировать не только различные типы электродов, но и их комбинации. Электрохимические цепи обычно классифицируют по двум признакам: по источнику электрической энергии (физические, концентрационные, химические) и по наличию или отсутствию в цепи границы двух различных растворов (цепи с переносом и без переноса). 1. Система составлена из двух химически одинаковых электродов, на которых совершается одна и та же электродная реакция. ЭДС таких систем была бы равна нулю, если бы физические свойства электродов, а следовательно, и их стандартные потенциалы были одинаковыми. Электрохимические системы, в которых электроды отличаются только физическими свойствами, называются физическими цепями. Как правило, один из двух электродов физической цепи находится в более устойчивом, а другой - в менее устойчивом при данных условиях состоянии. Источником электрической энергии в физических цепях служит свободная энергия перехода электрода из менее устойчивого в более устойчивое состояние. 2. Два электрода совпадают по своим физическим свойствам, качественному химическому составу и природе электродной реакции. Они отличаются лишь тем, что активность одного или нескольких участников реакции на электродах неодинакова. Электрохимические цепи, в которых электроды отличаются только активностью (концентрацией) участников электродной реакции, называются концентрационными цепями. Источником электрической энергии в концентрационных цепях служит энергия переноса вещества от большей активности к меньшей. 3. Два электрода могут отличаться и по химическим, и по физическим свойствам. Такие цепи называются химическими. В химических цепях источником электрической энергии служат протекающие в них химические реакции. |
Концентрационные электрохимические цепи состоят из электродов с одинаковыми потенциалопределяющими реакциями. Физические и химические свойства материала электродов одинаковы, но активности одного (или нескольких) участников реакции на каждом из электродов различны.
Примером концентрационной цепи может служить следующий гальванический элемент:
 .
.

ЭДС цепи определяется следующим образом:
 .
.
В уравнение Нернста для ЭДС цепи не входят стандартные электродные потенциалы, так как они одинаковы. По результатам измерений ЭДС такой цепи и известной активности компонента в одном электроде можно рассчитать активность компонента в другом электроде.
Химические цепи.
Химические цепи состоят из электродов, потенциалопределяющие реакции которых различны. Электроды в таких системах отличаются и по физическим, и по химическим свойствам.
Электрическая энергия возникает за счет энергии суммарной химической реакции. Химические цепи разнообразны по природе и свойствам электродов, из которых они состоят. Примером такой цепи может служить серебряно-цинковый элемент:
 .
.
Уравнения потенциалопределяющих электродных реакций:
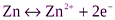 ,
,  .
.
Суммарная реакция в цепи
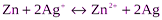
ЭДС элемента по уравнению Нернста равна

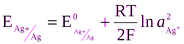 ;
;


 .
.
Важным частным случаем химических цепей являются цепи, в которых хотя бы один из электродов является окислительно–восстановительным.Электрический ток в таких цепях возникает за счет реакций окисления и восстановления, протекающих в растворе. Примером такой цепи является цепь, составленная из стандартного водородного электрода и железного окислительно–восстановительного (редокс) электрода:
 .
.
lektsia.com
Электрод цинк-медный - Справочник химика 21
Если в цепи электрический ток с э. д. с., большей, чем у данного элемента, пустить в обратном направлении, то это вызовет обратные химические процессы на электродах цинк будет выделяться на электроде, а медь растворяться, система будет возвращаться к исходному состоянию. Подобные элементы, у которых прохождение тока в обратном направлении вызывает обратные процессы, называют обратимыми. Примером необратимого элемента может служить элемент из медного и цинкового электродов, опущенных в серную кислоту. При его работе цинк растворяется, а водород выделяется на медном электроде. При обратном направлении тока растворяется медь, а на цинке выделяется водород. Таким образом, прохождение тока в обратном направлении не ведет к восстановлению исходного состояния. [c.49]
О электродов, изготовленных в виде круглых пластинок 1 и 2 диаметром 5 мм пластинки расположены горизонтально одна под другой на расстоянии 2—3 мм. Эти электроды припаяны к платиновым проволокам, вплавленным в стеклянные трубки 3 и 4. Внутри стеклянных трубок к платиновым проволокам припаяны медные проволоки, которые выходят наружу и сверху спаяны друг с другом. При погружении в коллоидный раствор, находящийся в пробирке, зонд действует как коротко замкнутый гальванический элемент (медь — положительно заряженный электрод, цинк — отрицательно). Через несколько минут после погружения зонда в золь возле электрода, заряженного одинаково с коллоидными частицами, появляется тонкая светлая полоска. [c.244]
Если системы (13,2) и (13.3) объединить в одну,соединив цинковую и медную пластины металлическим проводником с электронной проводимостью, а растворы гпЗО и СиЗО —электролитическим проводником с ионной проводимостью, то получится замкнутая неравновесная система— гальванический элемент, схема которого приведена на рис. 13.1. Поскольку потенциалы электродов различны, по соединяющему их металлическому проводнику (II) перемещается поток электронов—электрический ток. Для восстановления равновесного потенциала цинкового электрода цинк должен переходить в раствор. Увеличение же отрицательности потенциала медного электрода за счет переместившихся электронов повлечет разрядку части ионов и выделение из раствора металлической меди на медном электроде. В результате около цинкового электрода электролит приобретает избыточное число положительно заряженных ионов по сравнению с исходным, а около медного электрода образуется недостаток ионов 50 -. Результатом различия заряда ионных растворов будет ионный [c.141]
Потенциометрическое измерение электродвижущей силы. Потенциометр представляет собой прибор для определения э.д.с. гальванического элемента. Рассмотрим кратко принцип работы потенциометра. На рис. 9-3 а показал цинк-медный элемент, электроды которого соединены друг с другом проволокой, которая является. внешней цепью элемента. В этой цепи находится гальванометр О, измеряющий ток. [c.272]
Градиенты концентраций на поверхностях электродов в процессе электролиза. Как только цинк-медный элемент начинает функционировать как электролитическая ячейка, происходит реакция [c.406]
Какова эффективность диффузии, миграции и конвекции в уменьшении градиентов концентраций, вызываемых электролизом Механическое перемешивание наиболее эффективно для описанного здесь электролиза. Однако даже если раствор, находящийся в контакте с электродами, очень энергично перемешивается, то согласно теории гидродинамики электрод, погруженный в перемешиваемый раствор, всегда будет окружен тонким слоем стационарной жидкости. Поэтому движение ионов цинка к поверхности катода осуществляется в две стадии в результате перемешивания раствора нитрата цинка ионы цинка переносятся вплоть до края тонкой пленки неподвижной жидкости и затем диффундируют и мигрируют через пленку к поверхности катода — цинкового электрода, на котором они восстанавливаются. У медного анода ионы меди(II) диффундируют и мигрируют от электрода через тонкий слой стационарной жидкости, а затем вследствие перемешивания уносятся в объем раствора сульфата меди (И). Если через цинк-медную ячейку потечет больщой ток, то, несмотря на диффузию, миграцию и перемешивание, в результате процесса электролиза на каждом электроде обязательно будет существовать градиент концентраций. [c.407]
Наложенное на анод и катод электролитической ячейки напряжение необходимо увеличить не только для компенсации омического падения потенциала это связано также с возникновением градиента концентрации на поверхности каждого электрода наложенное напряжение должно быть увеличено настолько, чтобы обеспечить необходимую скорость электролиза. В соответствии с рис. 12-1, допустим, что через цинк-медную ячейку протекал ток г. Допустим также, что при достижении этой скорости электролиза концентрация цинка (И) на поверхности катода уменьшилась до 0,1 М, а концентрация меди(II) увеличилась до 1,9 М. Используя уравнение Нернста, можно рассчитать, что э. д. с. электрохимического элемента, состоящего из цинкового электрода в [c.407]
Энергетические барьеры для реакций переноса электронов. Подобно другим химическим процессам перенос электронов от химических частиц к электроду (или наоборот) сводится к реакции, связанной с преодолением энергетического барьера с соответствующей энергией активации (AGI). В отличие от обычных химических реакций, высота энергетического барьера такого процесса зависит от потенциала электрода. Можно использовать следующую простую картину для исследования поведения цинкового электрода в цинк-медной электролитической, ячейке. [c.408]
Когда через цинк-медную ячейку протекает действительно суммарный ток, то цинковый электрод функционирует как катод и происходит результирующее восстановление цинка (II) до металлического цинка. Рассмотрим следующий гипотетический случай что необходимо сделать для того, чтобы вызвать результирующее восстановление цинка (II) до металлического цинка, когда активности цинка(II) и металлического [c.408]
В, как это имеет место для обратимого цинк-медного элемента, описанного ранее (см. рис. 12-1). Однако это утверждение справедливо только в том случае, когда активность выделенного цинка равна единице (или когда чистый цинковый электрод первоначально находится в контакте с раствором нитрата цинка). Когда же на поверхности пла- [c.411]
Заметим, что в цинк-медной ячейке медный электрод является анодом, а цинковый электрод — катодом, поэтому общее уравнение для наложенного напряжения для любого реального процесса электролиза можно записать в виде [c.413]
Медно-цинковый элемент имеет постоянную электродвижущую силу при работе (не поляризуется). При стоянии с электролитом с разомкнутыми электродами цинк постепенно разрушается поэтому следует, при сравнительно больших перерывах в работе, выливать из элемента обе жидкости. Амальгамирование предохраняет цинк от разрушения при длительном стоянии элемента без работы. [c.243]
Когда электроды соединят проволокой, цинк будет окисляться, поскольку он более положителен, а ион — восстанавливаться. Электроны перемеш,аются по проволоке от цинкового электрода к медному. [c.38]
При работе элемента, т. е. ири замкнутой цени, цинк окисляется на поверхности его соприкосновения с раствором атомы цинка превращаются в ионы и, гидратируясь, переходят в раствор. Высвобождающиеся при этом электроны движутся по внешней цепи к медному электроду. Вся совокупность этих процессов схематически изображается уравнением полуреакции, или электрохимическим уравнением [c.274]
Цепь (ХП1, 1) является обратимой, так как она удовлетворяет второму условию. Если к ней приложить противоположно направленную э. д. с., превышающую э. д. с. элемента, то будет происходить электролиз, при котором на одном электроде будет выделяться цинк из раствора, а на втором — растворяться медный электрод, т. е. будут происходить процессы, обратные протекающим при нормальной работе этого элемента . [c.421]
Растворы отделены друг от друга пористой (керамической) перегородкой, препятствующей их смешению, но обеспечивающей прохождение электрического тока. Такой элемент был сконструирован русским электрохимиком Б. С. Якоби. На обоих электродах образуются двойные электрические слои. Величина и знак электрических зарядов в двойных слоях определяются работой удаления электрона из металла и энергией гидратации его ионов. Б раствор будут легче переходить те металлы, у которых меньше работа выхода электронов и больше энергия гидратации ионов, т. е. менее благородные металлы. Так как цинк менее благороден, чем медь, то он зарядится более отрицательно по сравнению с медью. Если электроды соединить проводником, то электроны будут перемещаться от цинка к меди. При этом ионы цинка уходят из двойного слоя в объем раствора, а электроны, перешедшие на медный электрод, разряжают ионы меди. [c.156]
Все реакции, протекающие в гальванических элементах, являются процессами окисления-восстановления, поскольку они сопровождаются переходом электронов. Л. В. Писаржевский одним из первых предложил считать, что вещество, теряющее электроны, окисляется, а приобретающее — восстанавливается. Так, при работе медно-цинкового элемента цинк переходит в раствор, отдавая свои электроны электроду, т. е. окисляется. При этом электрод заряжается отрицательно по отношению к раствору. Одновременно с процессом окисления цинка происходит восстановление ионов Си на медном электроде. [c.182]
Цинк, электродный потенциал которого имеет отрицательное значение (—0,76 В), посылает в раствор большее число катионов, чем медь, поэтому отрицательный заряд цинкового электрода будет выше, электроны с цинковой пластины переходят на медную и, соединяясь с катионами меди из раствора вблизи медного электрода, приводят к осаждению металлической меди на электроде. Таким образом, на цинковом электроде самопроизвольно проходит реакция окисления цинка, а на медном— восстановление ионов Сц2+ [c.328]
Медный и цинковый электроды, находящиеся в 0,1 М растворе соляной кислоты, подсоедините к источнику регулируемого напряжения постоянного тока и вольтметру (О—30 В) и подберите такое напряжение, при котором цинк перестает растворяться, а водород — выделяться. Как в технологии защиты от коррозии называется подобное устройство [c.381]
В полученном гальваническом элементе цинк заряжается положительно, а медь отрицательно (электроны с цинка по металлу переходят на медь), поэтому положительно заряженные частицы перемещаются к медному электроду, а отрицательно заряженные — к цинковому. [c.426]
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинко-2п вом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выравняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь). Итак, при работе элемента Якоби — Даниэля протекают следующие процессы [c.186]
В рассматриваемом элементе Якоби —Даниеля цинк легче отдает свои валентные электроны, чем медь, т. е. потенциал цинкового электрода является более отрицательным. Если соединить металлическим проводником оба электрода, то избыток электронов от цинка будет переходить к меди. Таким образом гальванический элемент дает электрический ток. Это нарушает электростатическое равновесие в обоих двойных слоях, и процессы на электродах возобновляются. Ионы цинка будут переходить в объем раствора, а ионы меди будут восстанавливаться электронами и осаждаться в виде нейтральных атомов металла на медном электроде. [c.104]
Элемент Якоби—Даниэля. Такой элемент имеет электроды из цинка и меди, погруженные в растворы соответствующих солей (рис. 18). В соответствии с данными табл. 13 цинк заряжается отрицательно, а медь — положительно. При замыкании внешней цепи возникает электрический ток, причем электроны с цинка переходят на медный электрод, присоединяясь к осаждающимся на нем ионам меди. Цинк постепенно будет растворяться, а медь, наоборот, выделяться из раствора на электроде. Образующийся избыток ионов Zn + в левой части элемента диффундирует через трубочку, заполненную агаром, содержащим КС1, в правую часть, а S0 " — в левую, взаимно нейтрализуясь. [c.49]
Такой элемент имеет электроды из цинка и меди, погруженные в растворы соответствующих солей (рис. 18). В соответствии с данными табл. 15 цинк заряжается отрицательно, а медь — положительно. При замыкании внешней цепи возникает электрический ток, причем электроны с цинка переходят на медный электрод, присоединяясь к осаждающимся на нем ионам меди. [c.61]
Второе принципиальное условие. термодинамической обратимости работы элемента заключается в том, что процессы, протекающие в нем, могут проходить как в прямом, так и в обратном направлениях. Так, если в рассмотренном ранее медно-цинковом элементе приложенная разность потенциалов меньше ЭДС, то положительные ионы внутри элемента идут от цинкового электрода к медному. Цинк будет растворяться, а медь осаждаться. Если же приложить разность потенциалов, большую ЭДС, то положительные ионы пойдут от меди к цинку и, следовательно, должна растворяться медь, а цинк осаждаться. Это обратимый элемент. Можно было бы поместить и цинк и медь в раствор Си304. В этом случае в прямом направлении элемент работал бы также, однако в обратном направлении медь будет растворяться в правом отделе элементами осаждаться на цинке в левом, т. е. процессы в прямом и обратном направлениях не совпадают. Этот элемент принципиально не обратим ни при каких условиях. [c.370]
| Рис. 1.4. Неполяризующийся цинксульфатный электрод (цинк — сульфат цинка 2п504), созданный проф, Ф. Габером в 1908 г. / деревянный стержень 2 — медная проволока 3 — капилляр 4 — фиксатор пробки 5 — цинковый стержень в — цннксульфатная масса 7 — керамическая ячейка 4 —смоляная замазка |  |
Подобные рассуждения приводят к заключению, что в том случае,, когда необходимо вызвать результирующее окисление меди до меди(II) даже в отсутствие градиента концентрации, потенциал медного электрода в цинк-медной ячейке нужно сдвинуть в положительном направлении от значения потенциала, при котором отсутствует ток. Таким образом, существует активационный сверхпотенциал, связанный с процессом переноса электронов у каждого электрода в электролитической ячейке. [c.409]
Форма записи соответствует положительному значению напряжения системы слева указан отрицательный электрод (цинк), справа — положительный (медь). В наименовании же нсточнн.ка тока первым принято называть положительный электрод медно-цинковый элемент. [c.12]
Из поляризационной диаграммы медно-цинкового элемента (рис. 4.2) видно, что если за счет внешней поляризации сместить потенциал цинка до потенциала анода при разомкнутой цепи, то потенциал обоих электродов будет одинаков и цинк не будет корродировать. На этом основана катодная защита металлов — эффективный практический способ свести коррозию к нулю (этот вопрос рассмотрен в гл. 12). Внешний ток прилагают к корроди- [c.68]
Электрический ток непрерывно поддерживается благодаря протеканию самопроизвольной реакции, состоящей в вытеснении меди из раствора цинком. На границе мелпористая перегородка, препятствующая их смешению, но позволяющая диффундировать ионам SOI" из правой половины элемента в левую. Это необходимо, чтобы цепь была замкнутой. Часто такие элементы снабжают солевым мостиком, который также препятствует смешению растворов, но обеспечивает проводимость благодаря движению ионов. Таким образом, при работе элемента цинк растворяется, а медь осаждается из раствора uSOe на медном электроде. Это описывается реакцией [c.104]
При работе элемента цинк переходит в раствор, отдавая электроны 2п2п2++2е. Электроны по внешней цепи проходят к меди, на медном электроде из раствора выделяется медь u +- -2е- - Си. Поток электронов, т. е. электрический ток во внешней цепи, может быть использован для работы, что и является целью применения ХИЭЭ. На цинковом электроде происходит реакция окисления, а на медном — реакция восстановления. Цинковый электрод несет отрицательный заряд, а медь — положительный. Химическая реакция, протекающая в медно-цинковом элементе, может быть записана следующим образом [c.462]
chem21.info