Двенадцать газов, которые легче воздуха. Аргон легче воздуха или тяжелее
Что тяжелее – воздух или углекислый газ: ответ на вопрос
Наверное, вопрос, что тяжелее – воздух или углекислый газ, может возникнуть у любого человека. С одной стороны дышать воздухом приходится постоянно – без него даже натренированный человек не продержится дольше нескольких минут. С другой – каждый с детства знает, что при дыхании выделяется углекислый газ. Поэтому давайте разберемся с этим вопросом более детально.
Состав воздуха
Воздух, в отличие от углекислого газа, является не одним веществом, а сложнейшей смесью, в состав которой входят больше десяти веществ. И это только нормальный воздух, а не городской, в который входит еще несколько десятков опасных для человека ингредиентов.

Итак, самая большая доля приходится на азот – воздух состоит из него на 76%. Он не поддерживает горение, не используется при дыхании.
А вот следующий компонент жизненно важен всему живому – кислород. Его в составе воздуха значительно меньше, лишь 23%. Но именно он позволяет человеку, животным, птицам, рыбам и растениям жить. Да-да, растения тоже дышат, хотя это и известно не всем.
Третий газ в составе воздуха – аргон. Его уже совсем немного, лишь 1,3 процента. В живой природе он также почти не применяется, зато активно используется людьми в разных сферах деятельности.
Четвертое же место занимает именно углекислый газ. Правда, количество очень невелико – только 0,046%. Представьте себе, все заводы, автомобили и живые существа на планете почти не могут повысить этот показатель. Хотя, по прогнозам экологов, вредное производство и вырубка лесов приводят к тому, что этот показатель все-таки увеличивается.
Также воздух состоит из неона, криптона, метана, гелия, водорода и ксенона. Последний занимает всего 0,00004% от общей массы. Другие примеси настолько незначительны, что о них можно и не говорить.
Из чего состоит углекислый газ?
Углекислый газ же представляет собой отдельное вещество. Его формула – СО2. Что интересно, в отличие от большинства химических смесей, в природе он совершенно не существует в жидком состоянии. Встречается только в газообразном и твердом, постепенно переходя из одного состояния в другое при определенных условиях.

Он легко пропускает ультрафиолетовые лучи, позволяя Солнцу обогревать Землю. А вот инфракрасное тепло, исходящее от поверхности планеты, не пропускает. Из-за этого оно накапливается, и постепенно температура во всем мире повышается. Это и называется парниковым эффектом, из-за которого экологи всего мира бьют тревогу.
Сравнение плотности
Ученые любят все взвешивать, сравнивать и анализировать. Разумеется, этой участи не избежали и воздух с углекислым газом. Путем сложнейших вычислений с использованием современного оборудования удалось предельно точно установить плотность обоих веществ. Зная их, можно определить, что тяжелее – воздух или углекислый газ, а что – легче.
Для углекислого газа этот показатель составляет 1,977 килограмма на кубический метр. У обычного воздуха же меньше – всего 1,204 кг/м3. Однако стоит учитывать, что столь чистый воздух в природе редко встречается – обычно в нем присутствует также пыль, влага и различные примеси.
Но с научной точки зрения рассматривать следует именно эталонные показатели. Поэтому можно с уверенностью сказать, во сколько раз углекислый газ тяжелее воздуха – почти в 1,64 раза.
Почему они важны?
О важности воздуха уже говорилось выше. Но любой образованный человек и так прекрасно знает, что без него ничто живое на планете Земля не смогло бы выжить в принципе.
А вот что можно сказать про углекислый газ? Парадоксально, но если он внезапно исчезнет с Земли, то и человечество вымрет удивительно быстро. Дело даже не в том, что углекислый газ активно применяется в различных сферах промышленности. Просто он необходим растениям.
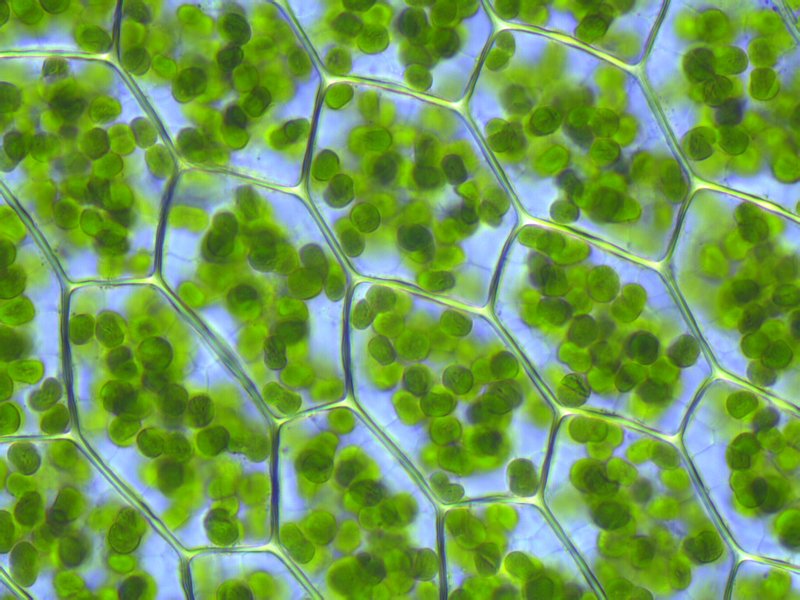
Как говорилось выше, любые живые организмы дышат кислородом. И растения – не исключение. Однако им также необходим углекислый газ. Ведь на свету в зеленых клетках активно идет процесс фотосинтеза. Он заключается в расщеплении клеток CO2 на углерод и кислород. Последний выделяется в атмосферу (или в воду, если речь идет о зеленых водорослях, в которых также идет фотосинтез), а углерод используется для построения новых клеток и роста растений. Если весь углекислый газ исчезнет, то и процесс фотосинтеза замрет. А значит, растения перестанут расти, животные и люди останутся без еды, что очень быстро приведет к голоду и вымиранию всего человечества.
Где используется разница массы?
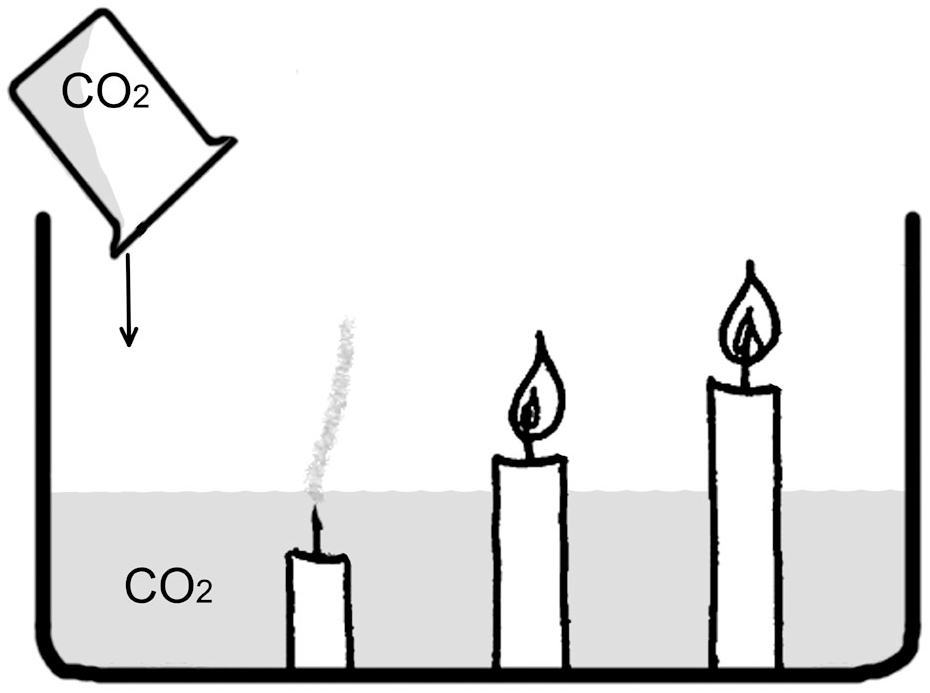
Зная, что тяжелее – воздух или углекислый газ, можно предположить, что последний всегда стремится вниз. И это можно использовать на практике. Например, применяется данный эффект водолазами при погружении с колпаком. Запас воздуха здесь ограничен, и, если бы углекислый газ смешивался с ним равномерно, дыхание было бы затруднено. Но его избыток преимущественно выделяется и опускается ниже, позволяя человеку легко дышать.

Применяется этот эффект и при пожаротушении. Углекислым газом заправляют специальные огнетушители – углекислотные. Когда сжиженный газ вырывается из раструба, он тут же расширяется примерно в 400-500 раз, заодно охлаждаясь на 72 градуса. Уже этого достаточно, чтобы многие горящие предметы потухли. Но тяжелый газ расползается по полу и горящим предметам, вытесняя воздух. Так как СО2 не поддерживает горение, то пламя, оставшись без подпитки кислородом, просто гаснет.
Заключение
На этом можно закончить статью. Теперь вам известно, что тяжелее – воздух или углекислый газ, и во сколько раз. Заодно вы узнали об основных свойствах обоих веществ, их важности в природе, а также использовании разницы плотности в человеческой жизни. Будем надеяться, что эта информация окажется для вас полезной.
fb.ru
Какие газы легче воздуха? - FAQ
Количество газов, которые легче воздуха, невелико.
Способ определения того, какие газы легче или тяжелее воздуха, заключается в сравнении их молекулярного веса (который вы можете найти в списке обнаруживаемых газов). Вы даже можете вычислить молекулярный вес M вещества, если вам известна химическая формула, установив H = 1, C = 12, N = 14, и O = 16 г/моль.
Этанол, химическая формула C2H5OH, содержит 2 C, 6 H, и 1 O,
отсюда M = 2∗12 + 6∗1 + 1∗16 =46 г/моль.
Метан, химическая формула Ch5, содержит 1 C и 4 H,
отсюда M = 1∗12 + 4∗1 = 16 г/моль.
Молекулярный вес воздуха, состоящего из 20,9 объемн. % O2 (M = 2∗16 = 32 г/моль) и 79,1 объемн. % N2 (M = 2∗14 = 28 г/моль), составляет 0,209∗32 + 0,791∗28 = 28,836 г/моль.
Вывод: любое вещество с молекулярным весом менее 28,836 г/моль легче воздуха.
Удивительно, что существует лишь 12 газов легче воздуха:
| ГАЗ | ФОРМУЛА | МОЛ.ВЕС | ОТН.ВЕС (Воздух=1) | ТОЧКА КИПЕНИЯ | ГОРЮЧЕСТЬ |
| Водород | Н2 | 2 | 0,069 | - 252.8 °C | Да |
| Гелий | He | 4 | 0,139 | - 268.9 °C | Нет |
| Метан | СН4 | 16 | 0,560 | - 161.5 °C | Да |
| Аммиак | Nh4 | 17 | 0,589 | - 33.4 °C | Да |
| Фтористый водород | HF | 20 | 0,694 | 19.5 °C | Нет |
| Неон | Ne | 20 | 0,694 | - 246.1 °C | Нет |
| Ацетилен | С2Н2 | 26 | 0,902 | - 84.0 °C | Да |
| Диборан | В2Н6 | 27 | 0,936 | - 92.5 °C | Да |
| Синильная кислота | HCN | 27 | 0,936 | 25.7 °C *) | Да |
| Угарный газ | СО | 28 | 0,971 | - 191.6 °C | Да |
| Азот | N2 | 28 | 0,971 | - 195.8 °C | Нет |
| Этилен(Этен) | С2Н4 | 28 | 0,971 | - 103.8 °C | Да |
*) На самом деле синильная кислота в большей степени жидкость, нежели газ, давление ее паров составляет 817 мбар при 20 °C (по определению, газы имеют точку кипения ниже 20°C).
Кстати: пары еще одного, крайне важного негорючего вещества легче воздуха: h3O, молярный вес - 18 г/моль. Вывод: сухой воздух тяжелее влажного, который поднимается и конденсируется наверху в облаках.
Что касается размещения сенсоров на горючие газы, то это необходимо учитывать лишь для метана, водорода и аммиака. Эти газы поднимаются вверх до потолка, где и следует устанавливать сенсоры.
Помните, что любые горючие пары тяжелее воздуха!
ural-test.ru
Вист - промышленные газы - Аргон

Аргон (от греч. «аргос» - недеятельный) – инертный, одноатомный газ без цвета, вкуса и запаха; tпл. = -189°С, tкип. = -186°С; из подгруппы тяжелых инертных газов аргон самый легкий, но тяжелее воздуха в 1,38 раза; растворим в воде (3,29 см3 в 100 г воды при 20°С) и органических жидкостях; высокая электропроводность, под действием эл. тока светится, сине-голубое свечение. Электроны атома аргона прочно связаны с ядром, поэтому аргон не вступает в химические реакции. Химическая формула: Ar
Технические требования
По физико-химическим показателям газообразный и жидкий аргон должен соответствовать нормам по ГОСТ 10157:
|
№ п/п |
Наименование показателя
|
Норма |
||||||||
|
Высший сорт |
Первый сорт |
|||||||||
| 1. |
Объемная доля аргона, %, не менее |
99,993 |
99,987 |
|||||||
| 2. |
Объемная доля кислорода, %, не более |
0,0007 |
0,002 |
|||||||
| 3. |
Объемная доля азота, %, не более |
0,005 |
0,01 |
|||||||
| 4. |
Объемная доля водяных паров, %, не более,что соответствует температуре насыщения аргона водяными парами при давлении 101,3 кПа (760 мм рт. ст.), °С, не выше |
0,0009
минус 61 |
0,001
минус 58 |
|||||||
| 5. |
Объемная доля суммы углеродсодержащих соединений в перерасчете на СО2, %, не более |
0,0005 |
0,001 |
|||||||
Гарантийный срок хранения газообразного аргона - 18 мес. со дня изготовления.
Применение
Аргон находит широкое применение как инертный газ при производстве электрических ламп; при сварке, резке и плавке активных и редких металлов и сплавов на их основе; в металлургических процессах. Для заполнения электрических ламп накаливания используется технический аргон, представляющий собой смесь 85% аргона и 15% азота. Применение этой смеси, обладающей высокой плотностью и малой теплопроводностью, обусловливает длительный срок службы металлической нити в лампочке. При электрической дуговой сварке нержавеющих сталей, сплавов алюминия, магния и титана аргон используется как защитный газ для предохранения расплавленного металла от окисления кислородом атмосферного воздуха. В аргонной струе можно сваривать тонкостенные изделия и металлы, резать толстые листы тугоплавких металлов. При сварке в среде аргона нет необходимости во флюсах и электродных покрытиях, соответственно и в зачистке шва от шлака и остатков флюса. В производстве редких, легкоокисляемых металлов – титана, вольфрама, циркония, полупроводниковых материалов, в атомной и химической промышленности используется аргон в качестве защитной инертной среды. В пищевой промышленности аргон используется в качестве пищевой добавки (Е938), упаковочного газа, а также в качестве пропеллента (инертное химическое вещество, которое обеспечивает избыточное давление в аэрозольном баллоне и вытеснение из упаковки активного состава).
Требования безопасности
Аргон нетоксичен и невзрывоопасен, однако представляет опасность для жизни: при его вдыхании человек мгновенно теряет сознание от удушья, и через несколько минут может наступить смерть. Для обеспечения безопасности работающих, аппаратура и оборудование должны быть герметичны, производственные помещения обеспечены вентиляцией. Газообразный аргон тяжелее воздуха и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования, предназначенного для получения, хранения и транспортирования газообразного и жидкого аргона. При этом снижается содержание кислорода в воздухе, что приводит к кислородной недостаточности, а при значительном понижении содержания кислорода - к удушью, потере сознания и смерти человека. В местах возможного накопления газообразного аргона необходимо контролировать содержание кислорода в воздухе (объемная доля кислорода в воздухе должна быть не менее 19%). Жидкий аргон - низкокипящая жидкость, которая может вызвать обмораживание кожи и поражение слизистой оболочки глаз. При отборе проб и анализе жидкого аргона необходимо работать в защитных очках.
| Способ определения того, какие газы легче или тяжелее воздуха, заключается в сравнении их молярной массы с молярной массой воздуха. Можно легко вычислить молярную массу M любых веществ, например, углеводородов, если известна их химическая формула. Для этого требуется рассчитать сумму относительных атомных масс образующих его элементов. Значения относительных атомных масс приведены в периодической системе химических элементов Д.И.Менделеева (H = 1, C = 12, N = 14, и O = 16 г/моль). Пример: Молярная масса воздуха, состоящего из 20,9 % объемных долей кислорода O2 (M = 2*16 = 32 г/моль) и 79,1 % объемных долей азота N2 (M = 2*14 = 28 г/моль), составляет 0,209*32 + 0,791*28 = 28,836 г/моль. Значит любое вещество с молярной массой менее 28,836 г/моль легче воздуха. Этанол, химическая формула которого C2H5OH, содержит два атома углерода (2*C), шесть атомов водорода (6*H) и один атом кислорода (1*O). Отсюда молярная масса этанола M = 2*12 + 6*1 + 1*16 = 46 г/моль. Метан, химическая формула Ch5, содержит один атом углерода и четыре атома водорода, отсюда молекулярная масса метана M = 1*12 + 4*1 = 16 г/моль. Удивительно, но существует лишь 12 газов, которые легче воздуха:
* Синильная кислота в большей степени жидкость, нежели газ, давление ее паров составляет 817 мбар при 20 °C (по определению, газы имеют точку кипения ниже 20°C). Кстати, пары еще одного, крайне важного негорючего вещества легче воздуха: пары обычной воды h3O имеют молярную массу 18 г/моль. Можно сделать вывод, что сухой воздух тяжелее влажного. При размещении сенсоров на горючие газы, необходимо помнить, что лишь три горючих газа: метан, водород и аммиак, легче воздуха. Эти газы в случае утечки поднимаются вверх до потолка помещения и скапливаются там. Поэтому газоанализаторы для обнаружения утечек метана, водорода или аммиака следует устанавливать как можно выше. Остальные горючие газы и пары горючих жидкостей тяжелее воздуха и скапливаются на уровне пола или в различных углублениях: траншеях, колодцах, подземных тоннелях. Соответственно газоанализаторы для контроля утечек горючих жидкостей следует размещать как можно ниже, учитывая при этом необходимый запас по высоте над уровнем пола для удобства последующего сервисного обслуживания и калибровки датчиков. |
gasdetection.ru
Газы легче воздуха
Какие газы легче воздуха.
Ответ:
Количество газов, которые легче воздуха, невелико. Способ определения того, какие газы легче или тяжелее воздуха, заключается в сравнении их молекулярного веса (который вы можете найти в списке обнаруживаемых газов). Вы даже можете вычислить молекулярный вес M вещества, если вам известна химическая формула, установив H = 1, C = 12, N = 14, и O = 16 г/моль.
Пример:
Этанол, химическая формула C2H5OH, содержит 2 C, 6 H, и 1 O, отсюда M = 2*12 + 6*1 + 1*16 = 46 г/моль;
Метан, химическая формула Ch5, содержит 1 C и 4 H, отсюда M = 1*12 + 4*1 = 16 г/моль;
Молекулярный вес воздуха, состоящего из 20,9 объемн. % O2 (M = 2*16 = 32 г/моль) и 79,1 объемн. % N2 (M = 2*14 = 28 г/моль), составляет 0,209*32 + 0,791*28 = 28,836 г/моль.
Вывод: любое вещество с молекулярным весом менее 28,836 г/моль легче воздуха. Удивительно, что существует лишь 12 газов легче воздуха:
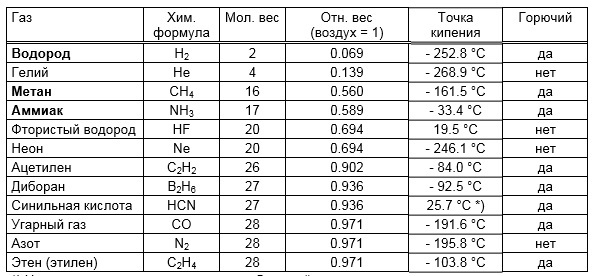
* На самом деле синильная кислота в большей степени жидкость, нежели газ, давление ее паров составляет 817 мбар при 20 °C (по определению, газы имеют точку кипения ниже 20°C).
Кстати: пары еще одного, крайне важного негорючего вещества легче воздуха: h3O, молярный вес - 18 г/моль. Вывод: сухой воздух тяжелее влажного, который поднимается и конденсируется наверху в облаках.
Что касается размещения газоанализаторов на горючие газы, то это необходимо учитывать лишь для метана, водорода и аммиака. Эти газы поднимаются вверх до потолка, где и следует устанавливать сенсоры.
Помните, что любые горючие пары тяжелее воздуха!
Присоединяйтесь к нам в социальных сетях:
life-techno.ru
Азот и воздух. Аргон и его аналоги
из "Основы химии"
Азот образуется в свободном состоянии при разрушении азотистых органических веществ, входящих в состав организмов, напр., при горении их. Всякие органические вещества, заключающие азот, при накаливании в воздухе, или напр., с окисью меди, сгорают кислород соединяется с углеродом, серою и водородом, а азот выделяется в свободном состоянии, потому что при возвышенной температуре не образует каких-либо прочных соединений, а становится свободным. Вместе с ним образуется из угля углекислый газ, а из водорода вода, а потому, чтобы получить чистый азот, необходимо (после высушивания) удалить из полученных при этом газообразных продуктов углекислый газ, что производится посредством действия щелочи, напр., едкого натра. Этим способом можно даже определять содержание азота в органических веществах. [c.154] До 1894 г. считалось, что азот, приготовленный из воздуха и из соединений азота, ничем — после надлежащего очищения — между собою не отличаются, но в указанном году лорд Релей (Rayleigh), наблюдая вес определенного объема азота. [c.155] Азот представляет газообразное вещество, не отличающееся на вид от воздуха плотность его по отношению к водороду 13,9, т.-е. азот немного легче воздуха, и один литр азота весит (при 0° и 760 мм) 1,251 i. В смеси с кислородом, немного более тяжелым, чем воздух, азот образует этот последний. Азот есть газ, трудно сгущаемый в жидкость, подобно кислороду, и мало растворимый в воде и других жидкостях. Температура абсолютного кипения определена около —146°. Сжиженный азот кипит при —193°, уд. вес при этой температуре около 0,89. Около —213°, испаряясь при уменьшенном давлении, азот затвердевает в бесцветную снегообразную массу. Азот сам прямо не горит, не поддерживает горения, не поглощается (химически) ни одним из реагентов при обыкновенной температуре, одним словом, представляет целый ряд отрицательных химических признаков. Это выражают, говоря, что этот газ не обладает энергиею для образования соединений. Хотя он способен образовать соединения как с водородом, так и с кислородом, углеродом и некоторыми металлами, но эти соединения образуются при особых условиях, к которым мы тотчас обратимся. При накаливании азот прямо соединяется с бором, титаном, кремнием, барием, магнием и литием, образуя очень прочные азотистые соединения [154], показывающие совершенно иные свойства азота, чем в соединениях с Н, О и С. Прямое соединение азота с углем, хотя и не совершается при накаливании их одних, происходит сравнительно легко при накаливании смеси угля с углещелочными солями, особенно с К СО и ВаСО на воздухе, причем образуются (до некоторого предела) углеазотистые или синеродистые металлы, напр. К2СОЗ + 4С +N2 = 2K N + 3 O. [c.156] В воздухе разнообразных стран земли, с разных широт, с разных высот над ее поверхностью, с моря и суши, словом, в воздухе разнообразнейших мест земли находится везде постоянное отношение между количеством кислорода и азота, подразумевая (пока) вместе с ним и небольшие количества постоянно в нем содержащихся аргона, криптона и других газов, недеятельных, как и сам азот (см. далее в этой главе). Это впрочем и понятно само по себе вследствие того, что воздух постоянно диффундирует (перемешивается в силу внутреннего движения газовых частиц), движется, перемещается ветрами, а потому уравнивается в своем составе на всей поверхности земли. В тех местах, где воздух подвергается изменению, находясь в более или менее замкнутом пространстве или, по крайней мере, в пространстве непроветриваемом, воздух может изменяться весьма сильно в своем составе. Оттого-то воздух жилых помещений, копей, подвалов и колодцев, в которых находятся вещества, поглощающие кислород, содержит менее этого газа, тогда как воздух, находящийся на поверхности стоячей воды, в которой растут многие низшие растения и выделяют кислород, содержит избыток этого последнего газа. Постоянство отношений между кислородом и азотом воздуха на всей поверхности земли доказано было множеством весьма тщательных исследований [157]. [c.159] В воздухе, лишенном влаги и углекислоты, оказывается по весу от 23,17 до 23,Q3 o кислорода, среднее содержание которого будет около 23,12 0,05 /о по весу, а по объему 20,91°/о кислорода. [c.160] Кали-аппарат Гейслера. Гаа входит в а в шариках Ьу С н d он проходит чрез раствор едкого кали, где и поглощается углекислота выходит чрез е. Шарики Ь, с и й расположены треугольником, так что прибор можно ставить. [c.162] С хлористым кальцием для поглощения воды, и аспиратором заставляют проходить измеряемую массу воздуха чрез все приборы. Таким образом, в большинстве случаев, определение воды соединяется с поглощением угольной кислоты. Прибор, изображенный на предшествующей странице, представляет именно такое соединение. [c.162] Трубка для поглощения уг лекислого гааа. В а положен клочек ваты, чтобы порошок ие высыпался. Затем кладется натристая известь и потом хлористый кальций для удержания влаги. [c.162] Знание точного веса литра воздуха особенно важно при поправке взвешиваний на вес вытесненного (предметами и гирями) воздуха и при обсуждении явлений в атмосфере, так как ее движение прежде всего определяется разностями веса равных объемов воздуха, свободно перемещающегося и находящегося на одной высоте. [c.164] Обращаясь к другим составным частям воздуха (кроме , 0 0 и СО ), прежде всего должно упомянуть о содержании в нем аргона Аг (означается иногда просто А), об открытии которого (1894) Релеем и Рамзаем сказано уже выше. Когда Релей нашел, что азот, остающийся из воздуха после удаления О , 0 и СО , тяжелее на ( /200) азота, приготовляемого из всяких (кислородных, водородных, металлических и углеродных) его соединений, стало несомненным, что в азоте воздуха содержится подмесь газа, более тяжелого, чем азот. [c.168] Прибор для превращения азота воздуха (при содействии добавленного кислорода) в ааотную кислоту. Чреа С вводится воздух, смешанный с кислородом- EQ и гН — проводники от румкорфовой спирали. В колбу В налит раствор едкого натра, чтобы поглощать HNO, происходящую от проходящих искр. Колба охлаждается водою. [c.169] Таким образом, аргон должно определить как особый газ, отличающийся беспримерною (до его открытия) химическою недеятельностью, но совершенно определенный по физическим свойствам, из которых должно также обратить внимание на самостоятельность спектра аргона. А так как самостоятельными спектрами обладают преимущественно (гл. 13) тела простые, то аргон принято считать в их числе, хотя главной характеристики простых тел, т.-е. самостоятельных и своеобразных соответственных соединй ний, для аргона неизвестно. Однако, можно умственно допустить и такой разряд элементов, который не соединяется ни с водородом, ни с кислородом для образования кислотных или основных веществ, так как известны многие элементы, не соединяющиеся с водородом, а фтор не соединен с кислородом, — для образования солеобразных веществ. Если же это так, то мы имеем право образовать особую группу — аргоновых элементов, причисляя к ней гелий Не, неон Не, аргон Аг, криптон Кг и ксенон Хе, не только потому, что они друг друга сопровождают при азоте воздуха и представляют полное между собою сходство—по своей инертности или неспособности вступать известными нам способами в соединения, более или менее сходные с основаниями, кислотами или солями, но также и потому, что эта группа аргоновых элементов совершенно сходна (даже по величине атомных весов) с другими наиболее характерными группами элементов, о чем подробнее говорится в главе 15. [c.170] Обратимся теперь к немногим остальным газам и парам, найденным в нормальном воздухе (случайные подмеси, очевидно, могут быть всякие). [c.172] Исследования Соссюра (1806), Буссенго (1833) и особенно А. Готье (1899) показали, что в воздухе всегда, даже на высоких горах, содержится около 0,02 /о (по объему) водорода и изменчивое количество (более в городах и лесах, менее в горах) углеводородных веществ, подобных болотному газу, выделяющемуся при некоторых процессах гниения растений (гл. 8) [168]. Определяется их присутствие тем, что воздух, совершенно освобожденный от воды и углекислоты, при пропускании чрез длинный слой накаленной окиси меди, вновь дает эти вещества, притом на 1 вес. ч. водорода, определяемого этим путем, приходится обыкновенно менее 3 вес, ч. углерода, а в горах даже в 10 раз менее, а в составе болотного газа СН , содержащего наиболее водорода из всех известных соединений углерода, на 1 ч. водорода содержится 3 вес. ч. углерода. Так как водород атмосферы отчасти может окисляться в воду, а отчасти должен удаляться в междупланетное пространство, обладая большею скоростью своего движения, определяющего диффузию (доп. 63), то очевидно, что постоянное присутствие водорода в воздухе не может быть понято, если не найдутся постоянные источники образования водорода в природе. Такими источниками, по наблюдению А. Готье, служат обычные твердые каменистые породы, подобные гранитным, так как они выделяют водород (правда, в небольшом количестве) в пустоту при действии паров воды и при накаливании с фосфорным ангидридом, а потому надо полагать, что часть содержащегося в массе горных пород водорода постоянно притекает в атмосферу. [c.172] Существование в воздухе азотной кислоты несомненно доказывается уже тем, что дождевая вода, особенно после грозы, содержит всегда некоторое количество азотной кислоты. [c.173] Затем в воздухе содержится, как упомянуто выше (гл. 4), некоторое — малое и переменное количество озона, перекиси водорода и азотистой кислоты (и ее аммиачной соли), т.-е. веществ, действующих прямо окислительно, напр., на иодокрахмальную бумажку (гл. 4) [170], но их очень мало в воздухе. [c.173] Воздух, представляя смешение разных веществ, может претерпевать значительные изменения, вследствие местных и случайных обстоятельств. В особенности важно заметить то изменение в составе воздуха, которое происходит в жилищах и в различных помещениях, где люди должны оставаться долгое время. Дыхание человека и животных изменяет воздух и делает его под конец вредным [174]. Такую же порчу воздуха производит влияние разлагающихся в нем органических веществ, а в особенности горящих в нем тел тогда в воздухе уменьшается кислород, а увеличивается количество углекислоты и вредных подмесей. По этой причине необходимо заботиться об очищении воздуха жилых помещений. Освежение воздуха, замена выдыхаемого свежим, называется вентиляциею, проветриванием, а удаление посторонних и вредных подмесей воздуха носит название дезинфекции [175]. Накопление в воздухе жилищ и городов всякого рода подмесей составляет причину того, что воздух гор, лесов, морей и неболотистых мест суши, покрытых зеленью или снегом, отличается своим освежающим и во всех отношениях благотворным действием [176]. [c.175] Сухая перегонка костей, производимая фабрично. В вертикальных цилиндрах (около м вышины, а в диаметре около 30 см) С вставленных в печь, помещаются кости и нагреваются. Пары продуктов перегонки (т.-е. ле чие продукты разложения) проходят по трубкам Т в охлаждаемые трубы В и сборники F Когда нары перестанут отделяться, открывают задвижку И, и обожженные кости вываливаются в тележки V, Тогда, открыв крышку М, наполняют цилиндры вновь костями. Аммиачная аода отстаивается и идет для переделки в соли, как покг1заио на следующем рисунке. [c.176]Вернуться к основной статье
chem21.info
Что легче: углекислый газ или воздух?
Блин конечно же воздух легче CO2 .А CO2 в свою очередь тяжелее воздуха!
Углекислый газ или двуокись углерода СО2 тяжелее воздуха в 1,509 раз.
Углекислый газ играет важнейшую роль в жизнедеятельности всего живого на Земле и круговороте углерода в природе.
Углекислый газ участвует в регуляции дыхания и кровообращения.
В атмосфере содержится содержится около 0,03 об.% углекислого газ и в воздухе, который вдыхает человек до 4%, а в больших концентрациях углекислый газ токсичен.
Обычно в шахтах, в пещерах, погребах содержится до 10% углекислого газа, что очень опасно для человека при долгом пребывании в таком месте.
Конечно же воздух легче, чем углекислый газ.
Углекислый газ - это двуокись углерода. Его химическая формула - СО2.
Молекулярная масса углекислого газа (СО2) составляет - 44 г/моль, а молекулярная масса воздуха равна - г/моль.
Из этого можно с полной уверенностью сказать, что углекислый газ в полтора раза тяжелее воздуха.
Сравнивая воздух и углекислый газ, ученые пришли к выводу, что последний тяжелее. Ведь воздух имеет плотность 1,2041 кг/м, а углекислый газ - 1,9769 кг/м. Следовательно,углекислый газ будет в 1,64 раза тяжелее нежели воздух.
Миллионы лет назад концентрация углекислого газа в атмосфере составляла 90%, поэтому этот газ для нас не менее важен чем кислород.
Молекулярная масса углекислого газа СО2 равна 44, а средняя молекулярная масса воздуха равна 29. Говорят о средней молекулярной массе воздуха,т.к. это - смесь газов: 78% (по объему) азота N2 и 21 % (по объему) кислорода О2 и 1 % инертные газы - это основные компоненты воздуха. Поэтому воздух легче углекислого газа.
Хотя углекислый газ является составной частью воздуха (можно было предполагать, что чем больше составных частей - тем тяжелее), именно СО2 тяжелее воздуха. Это мы узнаем по их атомным массам: у углекислого газа это значение равно 44 Г/л, тогда как у воздуха - 29 Г/л.
Таким образом, воздух легче углекислого газа.
Углекислый газ тяжелее воздуха почти в 1.6 раза. Хотя следует отметить, что углекислый газ входит в состав воздуха. Атомная масса углекислого газа составляет 44 Г/л, а воздуха 29 Г/л. Также оседая в погребах и подвалах углекислый газ представляет опасность для человека.
Строго говоря, углекислый газ - это ведь тоже один из составляющих воздуха. Конечно, его количество минимально и составляет всего 0,046% от общей массы состава воздухе, где лидирующие позиции занимают азот (75,50%), кислород (23,15%) и аргон (1,292%). Так что же весит больше - сам воздух или углекислый газ? Для правильного ответа нужно всего лишь сравнить значения атомного веса обоих веществ: у воздуха это значение составит 29 г/моль (среднее значение всех составляющих воздуха), а у углекислого газа - целых 44 г/моль. Отсюда вывод: углекислый газ в 1,5 раза тяжелее воздуха.
Для более подробной информации можно почитать статьи в Википедии о Воздухе и Углекислом газе.
Воздух состоит в основном из азота (атомный вес 28 г/моль) и кислорода (32 г/моль). Средний атомный вес воздуха - 29 г/моль. Атомный вес углекислого газа СО2 - 44 г/моль, поэтому он существенно тяжелее и сконцентрирован в основном в приземном слое воздуха.
Углекислый газ, тяжелее чем воздух, поэтому в природе, он оседает, а воздух, напротив на его уровне, всегда находится внизу. Воздух же, легче углекислого газ, за счет того, что в его составе, присутствует кислород, который гораздо легче, чем углекислый газ.
Вс проверяется на опыте. Если закрыть дровяную печь раньше времени, то углекислый газ (или угар) начнт стелиться по полу и угарят в первую очередь те, кто находятся у самого пола. Отсюда делаем вывод, что углекислый газ вс же тяжелее воздуха.
info-4all.ru

















