Углерод и его характеристики. Углерод это газ или нет
Что такое углерод? Описание, свойства и формула углерода :: SYL.ru
Кратко рассказать о том, что такое углерод, невозможно. Ведь он – основа жизни. Данный элемент имеется во всех органических соединениях, и только он может формировать молекулы ДНК из миллионов атомов. Его свойства многочисленны, так что о нем стоит рассказать поподробней.
Формула, обозначения, особенности
Данный элемент, находящийся в таблице под порядковым номером шесть, обозначается символом «С». Электронная структурная формула углерода выглядит следующим образом: 1s2 2s2 2p2. Его масса – 12,0107 а.е.м. У этого вещества имеется:
- Два неспаренных электрона в основном состоянии. Проявляет валентность II.
- Четыре неспаренных электрона в возбужденном состоянии. Проявляет валентность IV.
Следует отметить, что определенная масса углерода содержится в земной коре. 0,023%, если быть точнее. Главным образом он накапливается в верхней части, в биосфере. Большая часть массы углерода литосферы накапливается в доломитах и известняках, в виде карбонатов.
Физические характеристики
Итак, что такое углерод? Это вещество, которое существует в огромном множестве аллотропных модификаций, и их физические свойства перечислять можно долго. А разнообразие веществ обуславливается способностью углерода к образованию химических связей отличающихся типов.
Что касательно свойств углерода, как простого вещества? Их можно обобщить следующим образом:
- При нормальных условиях плотность составляет 2,25 г/см³.
- Температура кипения равна 3506,85 °C.
- Молярная теплоемкость – 8,54 Дж/(K•моль).
- Критическая температура фазового перехода (когда газ не конденсируется ни при каком давлении) - 4130 К, 12 МПа.
- Молярный объем 5,3 см³/моль.
Также стоит перечислить углеродные модификации.
Из кристаллических веществ самыми известными являются: алмаз, карбин, графит, наноалмаз, фуллерит, лонсдейлит, фуллерен, а также углеродные волокна.
К аморфным образованиям относится: древесный, ископаемый и активированный уголь, антрацит, кокс, стеклоуглерод, сажа, техуглерод и нанопена.
Но ничто из перечисленного не является чистой аллотропной формой обсуждаемого вещества. Это лишь химические соединения, в которых углерод содержится в высокой концентрации.
Структура
Интересно, что электронные орбитали атома углерода не одинаковы. Они имеют разную геометрию. Все зависит от степени гибридизации. Есть три наиболее часто встречающиеся геометрии:
- Тетраэдрическая. Она образуется, когда происходит смешение трех р- и одного s-электронов. Такая геометрия атома углерода наблюдается у лонсдейлита и алмаза. Аналогичную структуру имеет метан и прочие углеводороды.
- Тригональная. Данную геометрию образует смешение двух р- и одной s-электронной орбитали. Еще один р-элемент не принимает участия в гибридизации, но он задействован при образовании π-связи с прочими атомами. Эта структура свойственна фенолу, графиту и прочим модификациям.
- Дигональная. Эта структура образуется вследствие смешения s- и р-электронов (по одному). Интересно, что выглядят электронные облака, как несимметричные гантели. Вытянуты они вдоль оного направления. Еще два р-электрона образуют пресловутые π-связи. Данная геометрия характерна для карбина.
Не так давно, в 2010 году, ученые из университета, который находится в Ноттингеме, открыли соединение, в котором сразу четыре атома оказались в одной плоскости. Его название – мономерный дилитио метандий.
Молекулы
О них стоит сказать в отдельности. Атомы обсуждаемого вещества могут соединяться, вследствие чего образуются сложные молекулы углерода. От насыщенных Na, С2 и Н2, между которыми слишком слабое притяжение, их отличает склонность конденсироваться в твердое состояние. Молекулы углерода могут оставаться в газообразном состоянии, только если поддерживать высокую температуру. Иначе вещество мгновенно затвердеет.
Некоторое время тому назад в США, в Берклеевской национальной лаборатории, была синтезирована новая форма твердого углерода. Это – С36. И его молекулу образует 36 углеродных атомов. Вещество образуется вместе с фуллеренами С60. Происходит это между двумя электродами графита, в условиях пламени дугового разряда. Ученые предполагают, что молекулы нового вещества обладают интересными химико-электрическими свойствами, которые пока не изучены.
Графит
Теперь можно более подробно рассказать о самых известных модификациях такого вещества, как углерод.
Графит – это самородный минерал со слоистой структурой. Вот его особенности:
- Он отлично проводит ток.
- Является относительно мягким веществом из-за своей низкой твердости.
- При нагревании в отсутствие воздуха проявляет устойчивость.
- Не плавится.
- На ощупь жирный, скользкий.
- В природном графите содержится 10-12% примесей. Как правило, это окислы железа и глины.
Если говорить о химических свойствах, то стоит отметить, что с солями и щелочными металлами это вещество образует так называемые соединения включения. Еще графит при высокой температуре реагирует с кислородом, сгорая до углекислого газа. Но вот контакт с неокисляющими кислотами никакого результата за собой не влечет – это вещество в них просто не растворяется.
Применяют графит в самых разных сферах. Его используют при изготовлении футеровочных плит и плавильных тиглей, в производстве нагревательных элементов и электродов. Без участия графита невозможно получить синтетические алмазы. Также он играет роль замедлителя нейтронов в ядерных реакторах. И, конечно же, из него делают стержни для карандашей, мешая с каолином. И это лишь часть сфер, где он используется.
Алмаз
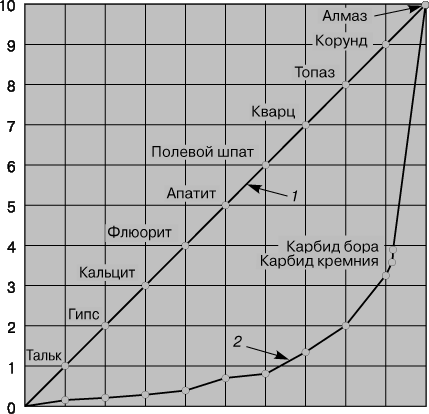
Это метастабильный минерал, который может существовать неограниченное количество времени, что в некоторой степени обусловлено прочностью и плотностью углерода. Алмаз является самым твердым веществом по шкале Мооса, он легко разрезает стекло.
У него высокая теплопроводность, дисперсия, показатель преломления. Он износостойкий, а чтобы заставить его плавиться, нужна температура в 4000 °C и давление около 11 ГПа. Его особенность – люминесценция, способность светиться разными цветами.
Это редкое, хоть и распространенное вещество. Возраст минералов, согласно данным определенных исследований, может колебаться от 100 миллионов до 2,5 миллиарда лет. Обнаружены алмазы внеземного происхождения, возможно, даже досолнечного.
Этот минерал нашел свое применение в ювелирном деле. Ограненный алмаз, именуемый бриллиантом, стоит дорого, но статус драгоценности и красота сделали его еще более популярным. Кстати, также это вещество используют при изготовлении резцов, сверл, ножей и т. д. Благодаря своей исключительной твердости, минерал применяют во многих производствах.
Карбин
В продолжение темы о том, что такое углерод, нужно пару слов сказать и о такой его модификации, как карбин. Он выглядит как черный мелкокристаллический порошок, обладает полупроводниковыми свойствами. Получен искусственным образом в начале 60-х годов советскими учеными.
Особенность данного вещества заключается в увеличивающейся под световым воздействием проводимости. Именно поэтому его стали применять в фотоэлементах.
Графен
Это первый в мире двумерный кристалл. У данной модификации большая механическая жесткость, чем у графита, и рекордно высокая теплопроводность, составляющая ~5•103 Вт•м−1•К−. У носителей заряда графена высокая подвижность, именно поэтому вещество имеет перспективы в плане его использования в разных приложениях. Считается, что он может стать будущей основой наноэлектроники и даже заменить кремний в интегральных микросхемах.
Графен получают искусственно, в научных лабораториях. Для этого приходится прибегать к механическому отщеплению графитовых слоев от высокоориентированного вещества. Так получают образцы высокого качества с необходимой подвижностью носителей.
Его свойства изучены не полностью, но кое-что интересное ученые уже успели отметить. Например, в графене нет вингеровской кристаллизации. А в двойном слое вещества поведение электронов напоминает то, которое свойственно жидким кристаллам. Если соблюсти параметры скалывания на кристалле, удастся получить графеновую коробчатую наноструктуру.
Токсичность
Эту тему стоит отметить в заключение рассказа о том, что такое углерод. Дело в том, что это вещество выделяется в атмосферу вместе с выхлопными газами автомобилей. А еще при сжигании угля, подземной газификации и во многих других процессах.
Повышенное содержание этого вещества в воздухе приводит к увеличению численности заболеваний. В частности, это касается легких и верхних дыхательных путей. А токсическое действие обусловлено взаимодействием радиационного характера с β-частицами, которое ведет к тому, что химический состав молекулы меняется и свойства вещества – тоже.
www.syl.ru
УГЛЕРОД - это... Что такое УГЛЕРОД?
Смотреть что такое "УГЛЕРОД" в других словарях:
Углерод-14 — Таблица нуклидов Общие сведения Название, символ Углерод 14, 14C Альтернативные названия радиоуглерод, радиокарбон Нейтронов 8 Протонов 6 Свойства нуклида Атомная масса … Википедия
Углерод-12 — Таблица нуклидов Общие сведения Название, символ Углерод 12, 12C Нейтронов 6 Протонов 6 Свойства нуклида Атомная масса 12,0000000(0) … Википедия
Углерод-13 — Таблица нуклидов Общие сведения Название, символ Углерод 13, 13C Нейтронов 7 Протонов 6 Свойства нуклида Атомная масса 13,0033548378(10) … Википедия
УГЛЕРОД — (лат. Carboneum) С, химический. элемент IV группы периодической системы Менделеева, атомный номер 6, атомная масса 12,011. Основные кристаллические модификации алмаз и графит. При обычных условиях углерод химически инертен; при высоких… … Большой Энциклопедический словарь
УГЛЕРОД — (Carboneum), C, химический элемент IV группы периодической системы, атомный номер 6, атомная масса 12,011; неметалл. Содержание в земной коре 2,3?10 2% по массе. Основные кристаллические формы углерода алмаз и графит. Углерод главный компонент… … Современная энциклопедия
Углерод — (Carboneum), C, химический элемент IV группы периодической системы, атомный номер 6, атомная масса 12,011; неметалл. Содержание в земной коре 2,3´10 2% по массе. Основные кристаллические формы углерода алмаз и графит. Углерод главный компонент… … Иллюстрированный энциклопедический словарь
УГЛЕРОД — (1) хим. элемент, символ С (лат. Carboneum), ат. и. 6, ат. м. 12,011. Существует в нескольких аллотропных модификациях (формах) (алмаз, графит и редко карбин, чаоит и лонсдейлит в метеоритных кратерах). С 1961 г. / массы атома изотопа 12С принята … Большая политехническая энциклопедия
УГЛЕРОД — (символ С), широко распространенный неметаллический элемент четвертой группы периодической таблицы. Углерод образует огромное количество соединений, которые вместе с углеводородами и другими неметаллическими веществами составляют основу… … Научно-технический энциклопедический словарь
Углерод — C (a. carbon; н. Kohlenstoff; ф. carbone; и. carbono), хим. элемент IV группы периодич. системы Mенделеева, ат.н. 6, ат. м. 12,041. Природный У. состоит из смеси 2 стабильных изотопов: 12C (98,892%) и 13C (1,108%). Известно также 6… … Геологическая энциклопедия
Углерод — химический элемент, важнейшая составляющая органических веществ. По английски: Carbon Синонимы английские: C См. также: Органические вещества Топливо Финансовый словарь Финам … Финансовый словарь
УГЛЕРОД — 14С, радиоактивный изотоп углерода, имеющий массу ядра, равную 14. Изотоп образуется в углекислом газе под воздействием солнечной радиации в предельно малых, но постоянных количествах. После смерти организма углерод 14 разрушается с постоянной… … Экологический словарь
Книги
- Углерод. Углеродные волокна. Углеродные композиты, А. И. Мелешко, С. П. Половников. Книга посвящена углеродным материалам и композитам на их основе. Рассмотрены структурные формы графита и их свойства. Описаны углеродные волокна, полученные из различного исходного материала,… Подробнее Купить за 1156 грн (только Украина)
- Углерод, углеродные волокна, углеродные композиты, Мелешко А.И.. Книга посвящена углеродным материалам и композитам на их основе. Рассмотрены структурные формы графита и их свойства. Описаны углеродные волокна, полученные из различного исходного материала,… Подробнее Купить за 962 руб
- Углерод в лесном фонде и сельскохозяйственных угодьях России, Д. Г. Замолодчиков. В книге рассмотрен комплекс проблем, связанных с оценкой углеродного бюджета лесов, болот и сельскохозяйственных земель России. Приведен детальный обзор источников первичной информации,… Подробнее Купить за 176 руб электронная книга
dic.academic.ru
Что такое углерод ? | Интересные факты, мифы, заблуждения
Углерод — это химический элемент, играющий важнейшую роль для любого живого существа. Вся материя, существующая на Земле, содержит менее одного процента углерода, но, тем не менее, он есть в любом организме – либо в живом, либо уже мертвом.
Тело любого живого организма состоит из веществ, содержащих в своем составе углерод. Если он есть в какой-либо точке на земле, хотя бы в мизерном количестве, то, скорее всего, в том месте когда-то существовала жизнь.
Растения получают углерод из углекислого газа — двуокиси углерода — который содержится в атмосфере, и используют его в качестве строительного материала для корней, стеблей и листьев. К животным он попадает через пищу, когда они поедают эти растения. И те, и другие выделяют его в воздух в виде все того же углекислого газа при дыхании, а в почве двуокись углерода накапливается при разложении тел умерших существ.
Уголь – вот наиболее известная и наиболее ценная для людей форма существования чистого углерода в природе. Состав угля содержит примерно 4/5 углерода, остальное же составляют водород и ряд других элементов.
Ценность угля складывается из химических свойств углерода, важнейшим из которых – это то, что он стремится к взаимодействию с кислородом. Этот процесс происходит при сжигании угля на воздухе, в ходе которого выделяется большое количество тепловой энергии, использовать которую можно для самых разных целей.
Тем не менее, углерод в неживой природе можно встретить не только в виде угля. Существование его в чистом виде в других формах имеет кардинальные различия – графит и алмаз. На ощупь, как известно, графит жирный, довольно мягкий, и является отличным смазочным материалом для некоторых механизмов.
Также из него производятся грифели карандашей – для уменьшения мягкости грифеля графит смешивается с глиной. Алмазы, наоборот, являются самыми прочными из минералов, известных человеку. Из них создаются ювелирные украшения, а в промышленности – особо прочные резцы.
Атомы углерода могут формировать связи между собой и с атомами других элементов. Как результат - образуется огромное количество углеродных соединений. Стоит упомянуть, что одним из наиболее простых является уже упомянутая выше двуокись углерода, которая образуется при сжигании углерода в кислороде или на воздухе. Окись углерода является ядовитым для людей и животных, образуется, если углерод горит в атмосфере, где имеется недостаток кислорода.
С большим трудом углерод реагирует с другими элементами или веществами. В большинстве случаев, это происходит при довольно высокой температуре.
zablugdeniyam-net.ru
углерод - это... Что такое углерод?
УГЛЕРО́Д -а; м. Химический элемент (C), важнейшая составная часть всех органических веществ в природе. Атомы углерода. Процент содержания углерода. Без углерода невозможна жизнь.
◁ Углеро́дный, -ая, -ое. У-ые атомы. Углеро́дистый, -ая, -ое. Содержащий углерод. У-ая сталь.
УГЛЕРО́Д (лат. Carboneum, от cаrbo — уголь), С (читается «це»), химический элемент с атомным номером 6, атомная масса 12,011. Природный углерод состоит из двух стабильных нуклидов: 12С, 98,892% по массе и 13C — 1,108%. В природной смеси нуклидов в ничтожных количествах всегда присутствует радиоактивный нуклид 14C (b--излучатель, период полураспада 5730 лет). Он постоянно образуется в нижних слоях атмосферы при действии нейтронов космического излучения на изотоп азота 14N: 147N + 10n = 146C + 11H. Углерод расположен в группе IVA, во втором периоде периодической системы. Конфигурация внешнего электронного слоя атома в основном состоянии 2s2p2. Важнейшие степени окисления +2 +4, –4, валентности IV и II. Радиус нейтрального атома углерода 0,077 нм. Радиус иона C4+ 0,029 нм (координационное число 4), 0,030 нм (координационное число 6). Энергии последовательной ионизации нейтрального атома равны 11,260, 24,382, 47,883, 64,492 и 392,09 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 2,5. Историческая справка Углерод известен с глубокой древности. Древесный уголь использовали для восстановления металлов из руд, алмаз (см. АЛМАЗ (минерал)) — как драгоценный камень. В 1789 французский химик А. Л. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран) сделал вывод об элементарной природе углерода. Искусственные алмазы впервые были получены в 1953 шведскими исследователями, но результаты они не успели опубликовать. В декабре 1954 искусственные алмазы получили, а в начале 1955 опубликовали результаты сотрудники компании «Дженерал электрик». (см. ДЖЕНЕРАЛ ЭЛЕКТРИК) В СССР искусственные алмазы впервые были получены в 1960 группой ученых под руководством В. Н. Бакуля и Л. Ф. Верещагина (см. ВЕРЕЩАГИН Леонид Федорович) . В 1961 группой советских химиков под руководством В. В. Коршака была синтезирована линейная модификация углерода — карбин. Вскоре карбин был обнаружен в метеоритном кратере Рис (Германия). В 1969 в СССР были синтезированы нитевидные кристаллы алмаза при обычном давлении, обладающие высокой прочностью и практически лишенные дефектов. В 1985 Г. Крото (см. КРОТО Гаролд) обнаружил новую форму углерода —фуллерены (см. ФУЛЛЕРЕНЫ)С60 и С70 в масс-спектре испаряемого при облучении лазером графита. При высоких давлениях получен лонсдейлит. Нахождение в природе Содержание в земной коре 0,48% по массе. Накапливается в биосфере: в живом веществе 18% угля, в древесине 50%, торфе 62%, природных горючих газах 75%, горючих сланцах 78%, каменном и буром угле 80%, нефти 85%, антраците 96%. Значительная часть угля литосферы сосредоточена в известняках и доломитах. Углерод в степени окисления +4 входит в состав карбонатных пород и минералов (мел, известняк, мрамор, доломиты). Углекислый газ CO2 (0,046% по массе) постоянный компонент атмосферного воздуха. Углекислый газ в растворенном виде всегда присутствует в воде рек, озер и морей. В атмосфере звезд, планет и в метеоритах обнаружены вещества, содержащие углерод. Получение С древности уголь получали при неполном сгорании древесины. В 19 веке древесный уголь в металлургии заменили каменным углем (коксом). В настоящее время для промышленного получения чистого углерода используют крекинг (см. КРЕКИНГ) природного газа метана (см. МЕТАН) СН4: СН4 = С + 2Н2Уголь для медицинских целей готовят сжиганием кожуры кокосовых орехов. Для лабораторных нужд чистый уголь, не содержащий несгораемых примесей, получают неполным сжиганием сахара. Физические и химические свойства Углерод — неметалл. Многообразие соединений углерода объясняется способностью его атомов связываться между собой, образуя объемные структуры, слои, цепи, циклы. Известны четыре аллотропические модификации углерода: алмаз, графит, карбин и фуллерит. Древесный уголь состоит из мельчайших кристалликов с неупорядоченной структурой графита. Его плотность 1,8—2,1 г/см3 . Сажа представляет собой сильно измельченный графит. Алмаз — минерал с кубической гранецентрированной решеткой. Атомы С в алмазе находятся в sp3-гибридизованном состоянии. Каждый атом образует 4 ковалентные s-связи с четырьмя соседними атомами С, расположенными по вершинам тетраэдра, в центре которого находится атом С. Расстояния между атомами в тетраэдре 0,154 нм. Электронная проводимость отсутствует, ширина запрещенной зоны 5,7 эВ. Из всех простых веществ алмаз имеет максимальное число атомов, приходящихся на единицу объема. Его плотность 3,51 г/см3.. Твердость по минералогической шкале Мооса (см. МООСА ШКАЛА) принята за 10. Алмаз можно поцарапать только другим алмазом; но он хрупок и при ударе раскалывается на куски неправильной формы. Термодинамически устойчив лишь при высоких давлениях. Однако, при 1800 °C превращение алмаза в графит происходит быстро. Обратное превращение графита в алмаз происходит при 2700°C и давлении 11—12 ГПа. Графит — слоистое темно-серое вещество с гексагональной кристаллической решеткой. Термодинамически устойчив в широком интервале температур и давлений. Состоит из параллельных слоев, образованных правильными шестиугольниками из атомов С. Углеродные атомы каждого слоя расположены против центров шестиугольников, находящихся в соседних слоях; положение слоев повторяется через один, а каждый слой сдвинут относительно другого в горизонтальном направлении на 0,1418 нм. Внутри слоя связи между атомами ковалентные, образованы sp2-гибридными орбиталями. Связи между слоями осуществляются слабыми ван-дер-ваальсовыми (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ) силами, поэтому графит легко расслаивается. Такое состояние стабилизирует четвертая делокализованная p-связь. Графит обладает хорошей электрической проводимостью. Плотность графита 2,1—2,5 кг/дм3. Во всех аллотропических модификациях при обычных условиях углерод химически малоактивен. В химические реакции вступает только при нагревании. При этом химическая активность углерода убывает в ряду сажа—древесный уголь—графит—алмаз. Сажа на воздухе воспламеняется при нагревании до 300°C, алмаз — при 850—1000°C. При горении образуется углекислый газ СО2 и CO. Нагревая СО2 с углем, также получают оксид углерода (II) CО: СО2+ С = 2СО С + Н2О (перегретый пар) = СО +Н2Синтезирован оксид углерода С2О3. СО2 — кислотный оксид, ему отвечает слабая неустойчивая, существующая только в сильно разбавленных холодных водных растворах угольная кислота Н2СО3. Соли угольной кислоты — карбонаты (см. КАРБОНАТЫ) (К2СО3, СаСО3) и гидрокарбонаты (см. ГИДРОКАРБОНАТЫ) (NaHCO3, Са(НСО3)2). С водородом (см. ВОДОРОД) графит и древесный уголь реагируют при температуре выше 1200°C, образуя смесь углеводородов. Реагируя со фтором при 900°C, образует смесь фторуглеродных соединений. Пропуская электрический разряд между угольными электродами в атмосфере азота, получают газ циан (CN)2; если в газовой смеси присутствует водород, образуется синильная кислота HCN. При очень высоких температурах графит реагирует с серой, (см. СЕРА) кремнием, бором, образуя карбиды — CS2, SiC, В4С. Карбиды получают взаимодействием графита с металлами при высоких температурах: карбид натрия Na2C2, карбид кальция CaC2, карбид магния Mg2C3, карбид алюминия Al4C3. Эти карбиды легко разлагаются водой на гидроксид металла и соответствующий углеводород: Al4C3 + 12Н2О = 4Al(ОН)3 + 3СН4С переходными металлами углерод образует металлоподобные химически стойкие карбиды, например, карбид железа (цементит) Fe3C, карбид хрома Cr2C3, карбид вольфрама WС. Карбиды — кристаллические вещества, природа химической связи может быть различной. При нагревании уголь восстанавливает многие металлы из их оксидов: FeO + C = Fe + CO, 2CuO+ C = 2Cu+ CO2При нагревании восстанавливает серу(VI) до серы(IV) из концентрированной серной кислотой: 2h3SO4+ C = CO2+ 2SO2+ 2h3O При 3500°C и нормальном давлении углерод сублимирует. Применение Свыше 90% всех первичных источников потребляемой в мире энергии приходится на органическое топливо. 10% добываемого топлива используется в качестве сырья для основного органического и нефтехимического синтеза, для получения пластмасс. Физиологическое действие Углерод — важнейший биогенный элемент, является структурной единицей органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, витамины, гормоны, медиаторы и другие). Содержание углерода в живых организмах в расчете на сухое вещество составляет 34,5—40% у водных растений и животных, 45,4—46,5% у наземных растений и животных и 54% у бактерий. В процессе жизнедеятельности организмов происходит окислительный распад органических соединений с выделением во внешнюю среду CO2. Углекислый газ (см. УГЛЕРОДА ДИОКСИД) , растворенный в биологических жидкостях и природных водах, участвует в поддержании оптимальной для жизнедеятельности кислотности среды. В составе CaCO3 углерод образует наружный скелет многих беспозвоночных, содержится в кораллах, яичной скорлупе. При различных производственных процессах частицы угля, сажи, графита, алмаза попадают в атмосферу и находятся в ней в виде аэрозолей. ПДК для углеродной пыли в рабочих помещениях 4,0 мг/м3 , для каменного угля 10 мг/м3.dic.academic.ru
УГЛЕРОД | Энциклопедия Кругосвет
УГЛЕРОД, С (carboneum), неметаллический химический элемент IVA группы (C, Si, Ge, Sn, Pb) периодической системы элементов. Встречается в природе в виде кристаллов алмаза (рис. 1), графита или фуллерена и других форм и входит в состав органических (уголь, нефть, организмы животных и растений и др.) и неорганических веществ (известняк, пищевая сода и др.).
Углерод широко распространен, но содержание его в земной коре всего 0,19%.
Рис. 1. СТРУКТУРА алмаза (а) и графита (б).

Углерод широко используется в виде простых веществ. Кроме драгоценных алмазов, являющихся предметом ювелирных украшений, большое значение имеют промышленные алмазы – для изготовления шлифовального и режущего инструмента.
Древесный уголь и другие аморфные формы углерода применяются для обесцвечивания, очистки, адсорбции газов, в областях техники, где требуются адсорбенты с развитой поверхностью. Карбиды, соединения углерода с металлами, а также с бором и кремнием (например, Al4C3, SiC, B4C) отличаются высокой твердостью и используются для изготовления абразивного и режущего инструмента. Углерод входит в состав сталей и сплавов в элементном состоянии и в виде карбидов. Насыщение поверхности стальных отливок углеродом при высокой температуре (цементация) значительно увеличивает поверхностную твердость и износостойкость. См. также СПЛАВЫ.
В природе существует множество различных форм графита; некоторые получены искусственно; имеются аморфные формы (например, кокс и древесный уголь). Сажа, костяной уголь, ламповая сажа, ацетиленовая сажа образуются при сжигании углеводородов при недостатке кислорода. Так называемый белый углерод получается сублимацией пиролитического графита при пониженном давлении – это мельчайшие прозрачные кристаллики графитовых листочков с заостренными кромками.
Историческая справка.
Графит, алмаз и аморфный углерод известны с древности. Издавна известно, что графитом можно маркировать другой материал, и само название «графит», происходящее от греческого слова, означающего «писать», предложено А.Вернером в 1789. Однако история графита запутана, часто за него принимали вещества, обладающие сходными внешними физическими свойствами, например молибденит (сульфид молибдена), одно время считавшийся графитом. Среди других названий графита известны «черный свинец», «карбидное железо», «серебристый свинец». В 1779 К.Шееле установил, что графит можно окислить воздухом с образованием углекислого газа.
Впервые алмазы нашли применение в Индии, а в Бразилии драгоценные камни приобрели коммерческое значение в 1725; месторождения в Южной Африке были открыты в 1867. В 20 в. основными производителями алмазов являются ЮАР, Заир, Ботсвана, Намибия, Ангола, Сьерра-Леоне, Танзания и Россия. Искусственные алмазы, технология которых была создана в 1970, производятся для промышленных целей.
Аллотропия.
Если структурные единицы вещества (атомы для одноатомных элементов или молекулы для полиатомных элементов и соединений) способны соединяться друг с другом в более чем одной кристаллической форме, это явление называется аллотропией. У углерода три аллотропические модификации – алмаз, графит и фуллерен. В алмазе каждый атом углерода имеет 4 тетраэдрически расположенных соседа, образуя кубическую структуру (рис. 1,а). Такая структура отвечает максимальной ковалентности связи, и все 4 электрона каждого атома углерода образуют высокопрочные связи С–С, т.е. в структуре отсутствуют электроны проводимости. Поэтому алмаз отличается отсутствием проводимости, низкой теплопроводностью, высокой твердостью; он самый твердый из известных веществ (рис. 2). На разрыв связи С–С (длина связи 1,54 Å, отсюда ковалентный радиус 1,54/2 = 0,77 Å) в тетраэдрической структуре требуются большие затраты энергии, поэтому алмаз, наряду с исключительной твердостью, характеризуется высокой температурой плавления (3550° C).
Другой аллотропической формой углерода является графит, сильно отличающийся от алмаза по свойствам. Графит – мягкое черное вещество из легко слоящихся кристалликов, отличающееся хорошей электропроводностью (электрическое сопротивление 0,0014 Ом·см). Поэтому графит применяется в дуговых лампах и печах (рис. 3), в которых необходимо создавать высокие температуры. Графит высокой чистоты применяют в ядерных реакторах в качестве замедлителя нейтронов. Температура плавления его при повышенном давлении равна 3527° C. При обычном давлении графит сублимируется (переходит из твердого состояния в газ) при 3780° C.
Структура графита (рис. 1,б) представляет собой систему конденсированных гексагональных колец с длиной связи 1,42 Å (значительно короче, чем в алмазе), но при этом каждый атом углерода имеет три (а не четыре, как в алмазе) ковалентные связи с тремя соседями, а четвертая связь (3,4 Å) слишком длинна для ковалентной связи и слабо связывает параллельно уложенные слои графита между собой. Именно четвертый электрон углерода определяет тепло- и электропроводность графита – эта более длинная и менее прочная связь формирует меньшую компактность графита, что отражается в меньшей твердости его в сравнении с алмазом (плотность графита 2,26 г/см3, алмаза – 3,51 г/см3). По той же причине графит скользкий на ощупь и легко отделяет чешуйки вещества, что и используется для изготовления смазки и грифелей карандашей. Свинцовый блеск грифеля объясняется в основном наличием графита.
Волокна углерода имеют высокую прочность и могут использоваться для изготовления искусственного шелка или другой пряжи с высоким содержанием углерода.
При высоких давлении и температуре в присутствии катализатора, например железа, графит может превращаться в алмаз. Этот процесс реализован для промышленного получения искусственных алмазов. Кристаллы алмаза растут на поверхности катализатора. Равновесие графит  алмаз существует при 15 000 атм и 300 K или при 4000 атм и 1500 K. Искусственные алмазы можно получать и из углеводородов.
алмаз существует при 15 000 атм и 300 K или при 4000 атм и 1500 K. Искусственные алмазы можно получать и из углеводородов.
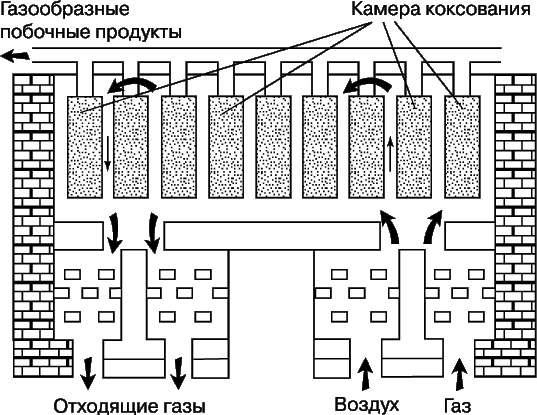
К аморфным формам углерода, не образующим кристаллов, относят древесный уголь, получаемый нагревом дерева без доступа воздуха, ламповую и газовую сажу, образующуюся при низкотемпературном сжигании углеводородов при недостатке воздуха и конденсируемую на холодной поверхности, костяной уголь – примесь к фосфату кальция в процессе деструкции костной ткани, а также каменный уголь (природное вещество с примесями) и кокс, сухой остаток, получаемый при коксовании топлив методом сухой перегонки каменного угля или нефтяных остатков (битуминозных углей), т.е. нагреванием без доступа воздуха. Кокс применяется для выплавки чугуна, в черной и цветной металлургии. При коксовании образуются также газообразные продукты – коксовый газ (h3, Ch5, CO и др.) и химические продукты, являющиеся сырьем для получения бензина, красок, удобрений, лекарственных препаратов, пластмасс и т.д. Схема основного аппарата для производства кокса – коксовой печи – приведена на рис. 3.
Различные виды угля и сажи отличаются развитой поверхностью и поэтому используются как адсорбенты для очистки газа, жидкостей, а также как катализаторы. Для получения различных форм углерода применяют специальные методы химической технологии. Искусственный графит получают прокаливанием антрацита или нефтяного кокса между углеродными электродами при 2260°С (процесс Ачесона) и используют в производстве смазочных материалов и электродов, в частности для электролитического получения металлов.
Строение атома углерода.
Ядро наиболее стабильного изотопа углерода массой 12 (распространенность 98,9%) имеет 6 протонов и 6 нейтронов (12 нуклонов), расположенных тремя квартетами, каждый содержит 2 протона и два нейтрона аналогично ядру гелия. Другой стабильный изотоп углерода – 13C (ок. 1,1%), а в следовых количествах существует в природе нестабильный изотоп 14C с периодом полураспада 5730 лет, обладающий b-излучением. В нормальном углеродном цикле живой материи участвуют все три изотопа в виде СO2. После смерти живого организма расход углерода прекращается и можно датировать С-содержащие объекты, измеряя уровень радиоактивности 14С. Снижение b-излучения 14CO2 пропорционально времени, прошедшему с момента смерти. В 1960 У.Либби за исследования с радиоактивным углеродом был удостоен Нобелевской премии. См. также ДАТИРОВКА ПО РАДИОАКТИВНОСТИ.
В основном состоянии 6 электронов углерода образуют электронную конфигурацию 1s22s22px12py12pz0. Четыре электрона второго уровня являются валентными, что соответствует положению углерода в IVA группе периодической системы (см. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ). Поскольку для отрыва электрона от атома в газовой фазе требуется большая энергия (ок. 1070 кДж/моль), углерод не образует ионные связи с другими элементами, так как для этого необходим был бы отрыв электрона с образованием положительного иона. Имея электроотрицательность, равную 2,5, углерод не проявляет и сильного сродства к электрону, соответственно не являясь активным акцептором электронов. Поэтому он не склонен к образованию частицы с отрицательным зарядом. Но с частично ионным характером связи некоторые соединения углерода существуют, например, карбиды. В соединениях углерод проявляет степень окисления 4. Чтобы четыре электрона смогли участвовать в образовании связей, необходимо распаривание 2s-электронов и перескок одного из этих электронов на 2pz-орбиталь; при этом образуются 4 тетраэдрические связи с углом между ними 109°. В соединениях валентные электроны углерода лишь частично оттянуты от него, поэтому углерод образует прочные ковалентные связи между соседними атомами типа С–С с помощью общей электронной пары. Энергия разрыва такой связи равна 335 кДж/моль, тогда как для связи Si–Si она составляет всего 210 кДж/моль, поэтому длинные цепочки –Si–Si– неустойчивы. Ковалентный характер связи сохраняется даже в соединениях высокореакционноспособных галогенов с углеродом, CF4 и CCl4. Углеродные атомы способны предоставлять на образование связи более одного электрона от каждого атома углерода; так образуются двойная С=С и тройная СєС связи. Другие элементы также образуют связи между своими атомами, но только углерод способен образовывать длинные цепи. Поэтому для углерода известны тысячи соединений, называемых углеводородами, в которых углерод связан с водородом и другими углеродными атомами, образуя длинные цепи или кольцевые структуры. См. ХИМИЯ ОРГАНИЧЕСКАЯ.
В этих соединениях возможно замещение водорода на другие атомы, наиболее часто на кислород, азот и галогены с образованием множества органических соединений. Важное значение среди них занимают фторуглеводороды – углеводороды, в которых водород замещен на фтор. Такие соединения чрезвычайно инертны, и их используют как пластичные и смазочные материалы (фторуглероды, т.е. углеводороды, в которых все атомы водорода замещены на атомы фтора) и как низкотемпературные хладагенты (хладоны, или фреоны, – фторхлоруглеводороды).
В 1980-х годах физиками США был обнаружены очень интересные соединения углерода, в которых атомы углерода соединены в 5- или 6-угольники, образующие молекулу С60 по форме полого шара, имеющего совершенную симметрию футбольного мяча. Поскольку такая конструкция лежит в основе «геодезического купола», изобретенного американским архитектором и инженером Бакминстером Фуллером, новый класс соединений был назван «бакминстерфуллеренами» или «фуллеренами» (а также более коротко – «фазиболами» или «бакиболами»). Фуллерены – третья модификация чистого углерода (кроме алмаза и графита), состоящая из 60 или 70 (и даже более) атомов, – была получена действием лазерного излучения на мельчайшие частички углерода. Фуллерены более сложной формы состоят из нескольких сотен атомов углерода. Диаметр молекулы С60 ~ 1нм. В центре такой молекулы достаточно пространства для помещения большого атома урана. См. также ФУЛЛЕРЕНЫ.
Стандартная атомная масса.
В 1961 Международные союзы теоретической и прикладной химии (ИЮПАК) и по физике приняли за единицу атомной массы массу изотопа углерода 12C, упразднив существовавшую до того кислородную шкалу атомных масс. Атомная масса углерода в этой системе равна 12,011, так как она является средней для трех природных изотопов углерода с учетом их распространенности в природе. См. АТОМНАЯ МАССА.
Химические свойства углерода и некоторых его соединений.
Некоторые физические и химические свойства углерода приведены в статье ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ. Реакционная способность углерода зависит от его модификации, температуры и дисперсности. При низких температурах все формы углерода достаточно инертны, но при нагревании окисляются кислородом воздуха, образуя оксиды:

Мелкодисперсный углерод в избытке кислорода способен взрываться при нагревании или от искры. Кроме прямого окисления существуют более современные методы получения оксидов.
Субоксид углерода
C3O2 образуется при дегидратации малоновой кислоты над P4O10:

C3O2 имеет неприятный запах, легко гидролизуется, вновь образуя малоновую кислоту.
| ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ УГЛЕРОДА | |||
| CO | CO2 | C3O2 | |
| Молекулярная масса | 28,010 | 44,010 | 68,030 |
| Температура кипения, °С | –192 | –56,6 | –7 |
| Температура замерзания, °С | –199 | –78,5 | –111,3 |
| Плотность, г/л (при 0° С) | 1,250 | 1,977 | 1,114 |
| Растворимость, объем/объем воды (при 0° С) | 0,03 | 1,7 | Реагирует с водой |
Монооксид углерода(II) СО образуется при окислении любой модификации углерода в условиях недостатка кислорода. Реакция экзотермична, выделяется 111,6 кДж/моль. Кокс при температуре белого каления реагирует с водой: C + h3O = CO + h3; образующаяся газовая смесь называется «водяной газ» и является газообразным топливом. СO образуется также при неполном сгорании нефтепродуктов, в заметных количествах содержится в автомобильных выхлопах, получается при термической диссоциации муравьиной кислоты:

Степень окисления углерода в СО равна +2, а поскольку углерод более устойчив в степени окисления +4, то СО легко окисляется кислородом до CO2: CO + O2 → CO2, эта реакция сильно экзотермична (283 кДж/моль). СО применяют в промышленности в смеси с h3 и другими горючими газами в качестве топлива или газообразного восстановителя. При нагревании до 500° C CO в заметной степени образует С и CO2, но при 1000° C равновесие устанавливается при малых концентрациях СO2. CO реагирует с хлором, образуя фосген – COCl2, аналогично протекают реакции с другими галогенами, в реакции с серой получается сульфид карбонила COS, с металлами (M) СO образует карбонилы различного состава M(CO)x, являющиеся комплексными соединениями. Карбонил железа образуется при взаимодействии гемоглобина крови с CO, препятствуя реакции гемоглобина с кислородом, так как карбонил железа – более прочное соединение. В результате блокируется функция гемоглобина как переносчика кислорода к клеткам, которые при этом погибают (и в первую очередь поражаются клетки мозга). (Отсюда еще одно название СО – «угарный газ»). Уже 1% (об.) СO в воздухе опасен для человека, если он находится в такой атмосфере более 10 мин. Некоторые физические свойства СО приведены в таблице.
Диоксид углерода, или оксид углерода(IV)CO2 образуется при сгорании элементного углерода в избытке кислорода c выделением тепла (395 кДж/моль). CO2 (тривиальное название – «углекислый газ») образуется также при полном окислении СО, нефтепродуктов, бензина, масел и др. органических соединений. При растворении карбонатов в воде в результате гидролиза также выделяется СО2:

Такой реакцией часто пользуются в лабораторной практике для получения CO2. Этот газ можно получить и при прокаливании бикарбонатов металлов:

при газофазном взаимодействии перегретого пара с СО:

при сжигании углеводородов и их кислородпроизводных, например:
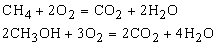
Аналогично окисляются пищевые продукты в живом организме с выделением тепловой и других видов энергии. При этом окисление протекает в мягких условиях через промежуточные стадии, но конечные продукты те же – СO2 и h3O, как, например, при разложении сахаров под действием ферментов, в частности при ферментации глюкозы:

Многотоннажное производство углекислого газа и оксидов металлов осуществляется в промышленности термическим разложением карбонатов:
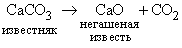
CaO в больших количествах используется в технологии производства цемента. Термическая стабильность карбонатов и затраты теплоты на их разложение по этой схеме возрастают в ряду CaCO33 3. Углекислый газ – химически неактивное соединение, однако в некоторых случаях он может поддерживать процесс горения, например, магний горит в среде СО2. Материалы, горящие при низких температурах – дерево, нефтепродукты, бумага и др., – не горят в среде СО2. Поэтому, а также из-за большей, чем у воздуха, плотности (СO2 в 1,5 раза тяжелее), углекислый газ используют в огнетушителях. В твердом состоянии СО2 известен как «сухой лед». При высоких концентрациях CO2 опасен для человека, так как блокирует доступ кислорода (см. также ПОЖАРНАЯ ПРОФИЛАКТИКА И ПРОТИВОПОЖАРНАЯ ЗАЩИТА).
Электронное строение оксидов углерода.
Электронное строение любого оксида углерода можно описать тремя равновероятными схемами с различным расположением электронных пар – тремя резонансными формами:
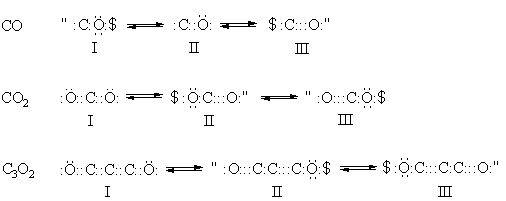
Все оксиды углерода имеют линейное строение.
Угольная кислота.
При взаимодействии СO2 с водой образуется угольная кислота h3CO3. В насыщенном растворе CO2 (0,034 моль/л) только часть молекул образует h3CO3, а бóльшая часть CO2 находится в гидратированном состоянии CO2Чh3O.
Карбонаты.
Карбонаты образуются при взаимодействии оксидов металлов с CO2, например, Na2O + CO2 Na2CO3.
Na2CO3.
За исключением карбонатов щелочных металлов, остальные практически нерастворимы в воде, а карбонат кальция частично растворим в угольной кислоте или растворе CO2 в воде под давлением:
CaCO3 + h3O + CO2 Ca(HCO3)2
Ca(HCO3)2
Эти процессы происходят в подземных водах, протекающих через пласт известняка. В условиях низкого давления и испарения из грунтовых вод, содержащих Ca(HCO3)2, осаждается CaCO3. Так происходит рост сталактитов и сталагмитов в пещерах. Окраска этих интересных геологических образований объясняется присутствием в водах примесей ионов железа, меди, марганца и хрома. Углекислый газ реагирует с гидроксидами металлов и их растворами с образованием гидрокарбонатов, например:
NaOH + CO2 → NaHCO3
которые при нагревании разлагаются с выделением СО2:
2NaHCO3 → Na2CO3 + h3O + CO2
Карбонат натрия, или соду, производят в содовой промышленности в больших количествах преимущественно методом Сольве:
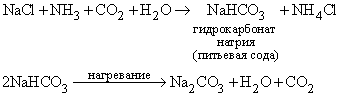
Другим методом соду получают из CO2 и NaOH

Карбонат-ион CO32– имеет плоское строение с углом O–C–O, равным 120°, и длиной СО-связи 1,31 Å (см. также ЩЕЛОЧЕЙ ПРОИЗВОДСТВО).
Галогениды углерода.
Углерод непосредственно реагирует с галогенами при нагревании, образуя тетрагалогениды, но скорость реакции и выход продукта невелики. Поэтому галогениды углерода получают другими методами, например, хлорированием дисульфида углерода получают CCl4:
CS2 + 2Cl2 ® CCl4 + 2S
Тетрахлорид CCl4 – негорючее вещество, используется в качестве растворителя в процессах сухой чистки, но не рекомендуется применять его как пламегаситель, так как при высокой температуре происходит образование ядовитого фосгена (газообразное отравляющее вещество). Сам ССl4 также ядовит и при вдыхании в заметных количествах может вызвать отравление печени. СCl4 образуется и по фотохимической реакции между метаном Сh5 и Сl2; при этом возможно образование продуктов неполного хлорирования метана – CHCl3, Ch3Cl2 и Ch4Cl. Аналогично протекают реакции и с другими галогенами.
Реакции графита.
Графит как модификация углерода, отличающаяся большими расстояниями между слоями гексагональных колец, вступает в необычные реакции, например, щелочные металлы, галогены и некоторые соли (FeCl3) проникают между слоями, образуя соединения типа KC8, KC16 (называемые соединениями внедрения, включения или клатратами). Сильные окислители типа KClO3 в кислой среде (серной или азотной кислоты) образуют вещества с большим объемом кристаллической решетки (до 6 Å между слоями), что объясняется внедрением кислородных атомов и образованием соединений, на поверхности которых в результате окисления образуются карбоксильные группы (–СООН) – соединения типа оксидированного графита или меллитовой (бензолгексакарбоновой) кислоты С6(COOH)6. В этих соединениях отношение С:O может изменяться от 6:1 до 6:2,5.
Карбиды.
Углерод образует с металлами, бором и кремнием разнообразные соединения, называемые карбидами. Наиболее активные металлы (IA–IIIA подгрупп) образуют солеподобные карбиды, например Na2C2, CaC2, Mg4C3, Al4C3. В промышленности карбид кальция получают из кокса и известняка по следующим реакциям:

Карбиды неэлектропроводны, почти бесцветны, гидролизуются с образованием углеводородов, например
CaC2 + 2h3O = C2h3 + Ca(OH)2
Образующийся по реакции ацетилен C2h3 служит исходным сырьем в производстве многих органических веществ. Этот процесс интересен, так как он представляет переход от сырья неорганической природы к синтезу органических соединений. Карбиды, образующие при гидролизе ацетилен, называются ацетиленидами. В карбидах кремния и бора (SiC и B4C) связь между атомами ковалентная. Переходные металлы (элементы B-подгрупп) при нагревании с углеродом тоже образуют карбиды переменного состава в трещинах на поверхности металла; связь в них близка к металлической. Некоторые карбиды такого типа, например WC, W2C, TiC и SiC, отличаются высокой твердостью и тугоплавкостью, обладают хорошей электропроводностью. Например, NbC, TaC и HfC – наиболее тугоплавкие вещества (т.пл. = 4000–4200° С), карбид диниобия Nb2C – сверхпроводник при 9,18 К, TiC и W2C по твердости близки алмазу, а твердость B4C (структурного аналога алмаза) составляет 9,5 по шкале Мооса (см. рис. 2). Инертные карбиды образуются, если радиус переходного металла 3C, Ni3C3, Fe3C.
Азотпроизводные углерода.
К этой группе относится мочевина Nh3CONh3 – азотное удобрение, применяемое в виде раствора. Мочевину получают из Nh4 и CO2 при нагревании под давлением:

Дициан (CN)2 по многим свойствам подобен галогенам и его часто называют псевдогалоген. Дициан получают мягким окислением цианид-иона кислородом, пероксидом водорода или ионом Cu2+: 2CN– ® (CN)2 + 2e.
Цианид-ион, являясь донором электронов, легко образует комплексные соединения с ионами переходных металлов. Подобно СО, цианид-ион является ядом, связывая жизненно важные соединения железа в живом организме. Цианидные комплексные ионы имеют общую формулу [M(CN)x]–0,5x, где х – координационное число металла (комплексообразователя), эмпирически равно удвоенному значению степени окисления иона металла. Примерами таких комплексных ионов являются (строение некоторых ионов приведено ниже) тетрацианоникелат(II)-ион [Ni(CN)4]2–, гексацианоферрат(III) [Fe(CN)6]3–, дицианоаргентат [Ag(CN)2]–:

Карбонилы.
Монооксид углерода способен непосредственно реагировать со многими металлами или ионами металлов, образуя комплексные соединения, называемые карбонилами, например Ni(CO)4, Fe(CO)5, Fe2(CO)9, [Fe(CO)4]3, Mo(CO)6, [Co(CO)4]2. Связь в этих соединениях аналогична связи в описанных выше цианокомплексах. Ni(CO)4 – летучее вещество, используется для отделения никеля от других металлов. Ухудшение структуры чугуна и стали в конструкциях часто связано с образованием карбонилов. Водород может входить в состав карбонилов, образуя карбонилгидриды, такие, как h3Fe(CO)4 и HCo(CO)4, проявляющие кислотные свойства и реагирующие со щелочью:
h3Fe(CO)4 + NaOH → NaHFe(CO)4 + h3O
Известны также карбонилгалогениды, например Fe(CO)X2, Fe(CO)2X2, Co(CO)I2, Pt(CO)Cl2, где Х – любой галоген (см. также МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ).
Углеводороды.
Известно огромное количество соединений углерода с водородом (см. ХИМИЯ ОРГАНИЧЕСКАЯ).
www.krugosvet.ru
Углерод и его характеристики
Общая характеристика углерода
Углерод находится в природе как в свободном состоянии, так и в виде многочисленных соединений. Свободный углерод встречается в виде алмаза и графита. Кроме ископаемого угля, в недрах Земли находятся большие скопления нефти. В земной коре встречаются в огромных количествах соли угольной кислоты, особенно карбонат кальция. В воздухе всегда имеется диоксид углерода. Наконец, растительные и животные организмы состоят из веществ, в образовании которых участие принимает углерод. Таким образом, этот элемент – один из распространенных на Земле, хотя общее его содержание в земной коре составляет всего около 0,1% (масс.).
Атомная и молекулярная масса углерода
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии углерод существует в виде одноатомных молекул С, значения его атомной и молекулярной масс совпадают. Они равны 12,0064.
Аллотропия и аллотропные модификации углерода
В свободном состоянии углерод существует в виде алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе (рис. 1). Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем – это карбин и поликумулен – разновидности углерода, построенные из линейных цепных полимеров типа -C= C- или = C = C= .
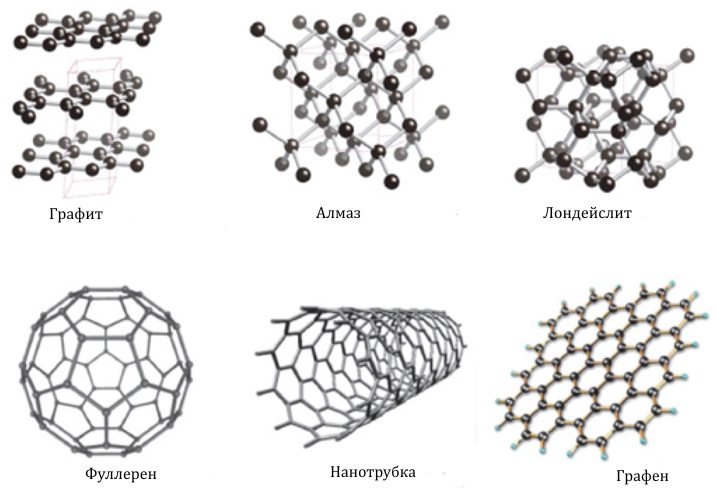
Рис. 1. Аллотропные модификации углерода.
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
Изотопы углерода
В природе углерод существует в виде двух стабильных изотопов 12С (98,98%) и 13С (1,07%). Их массовые числа равны 12 и 13 соответственно. Ядро атома изотопа углерода 12С содержит шесть протонов и шесть нейтронов, а изотопа 13С – такое же количество протонов и пять нейтронов.
Существует один искусственный (радиоактивный) изотоп углерода 14Сс периодом полураспада равным 5730 лет.
Ионы углерода
На внешнем энергетическом уровне атома углерода имеется четыре электрона, которые являются валентными:
1s22s22p2.
В результате химического взаимодействия углерод может терять свои валентные электроны, т.е. являться их донором, и превращаться в положительно заряженные ионы или принимать электроны другого атома, т.е. являться их акцептором, и превращаться в отрицательно заряженные ионы:
С0 –2e → С2+;
С0-4e → С4+;
С0+4e → С4-.
Молекула и атом углерода
В свободном состоянии углерод существует в виде одноатомных молекул С. Приведем некоторые свойства, характеризующие атом и молекулу углерода:
|
Энергия ионизации атома, эВ |
11,25 |
|
Относительная электроотрицательность |
2,55 |
|
Радиус атома, нм |
0,077 |
Сплавы углерода
Наиболее известные сплавы углерода во всем мире – это сталь и чугун. Сталь – это сплав железа с углеродом, содержание углерода в котором не превышает 2%. В чугуне (тоже сплав железа с углеродом) содержание углерода выше – от 2-х до 4%.
Примеры решения задач
ru.solverbook.com
УГЛЕРОД - ЧТО ТАКОЕ? КТО ТАКОЙ?
В этой книге слово «углерод» встречается довольно часто: в рассказах о зелёном листе и о железе, о пластмассах и кристаллах и ещё во многих других. Углерод — «рождающий уголь» — один из удивительнейших химических элементов. Его история — это история возникновения и развития жизни на Земле, потому что он входит в состав всего живого Земли.
А как выглядит углерод?
Сделаем несколько опытов. Возьмём сахар и нагреем его без доступа воздуха. Он сначала расплавится, станет коричневым, а потом почернеет и превратится в уголь, выделив воду. Если теперь нагреть этот уголь в присутствии КИСЛОРОДА, он сгорит без остатка и превратится в УГЛЕКИСЛЫЙ ГАЗ. Стало быть, сахар состоял из угля и воды (сахар, кстати, и называют углеводом), а «сахарный» уголь — это, видимо, и есть чистый углерод, потому что углекислый газ — это соединение углерода с кислородом. Значит, углерод — чёрный, мягкий порошок.
Возьмём серый мягкий камень графит, хорошо тебе знакомый благодаря карандашам. Если его нагреть в кислороде, он тоже сгорит без остатка, хотя и немного медленней, чем уголь, а в приборе, где он горел, останется углекислый газ. Значит, графит тоже чистый углерод? Конечно, но и это ещё не всё.
Если в том же приборе в кислороде накалить алмаз, прозрачный сверкающий драгоценный камень, самый твердый из всех минералов, он тоже сгорит, превратившись в углекислый газ. Если же нагревать алмаз без доступа кислорода, он превратится в графит, а при очень высоких давлениях и температурах можно из графита получить алмаз.
Итак, уголь, графит и алмаз — это различные формы существования одного и того же элемента — углерода.
Ещё более удивительна способность углерода «принимать участие» в огромном количестве разнообразных соединений (поэтому-то слово «углерод» так часто встречается в этой книге).
104 элемента периодической системы образуют более сорока тысяч изученных соединений. А соединений, основу которых составляет углерод, уже известно свыше миллиона!
Причина такого разнообразия заключается в том, что атомы углерода могут соединяться между собой и с другими атомами прочной связью, образуя сложные МОЛЕКУЛЫ в виде цепей, колец и других фигур. Ни один элемент в таблице МЕНДЕЛЕЕВА, кроме углерода, не способен на это.
Бесконечно число фигур, которые можно построить из атомов углерода, и поэтому бесконечно число возможных его соединений. Это могут быть и очень простые вещества, например светильный газ метан, в молекуле которого четыре атома ВОДОРОДА связаны с одним атомом углерода, и настолько сложные, что строение их молекул ещё не установлено. К таким веществам относится БЕЛОК — основа всего живого на Земле.
www.what-who.com