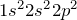Справочник химика 21. Углекислый газ плотность
Углекислый газ определение мол. веса
Сущность метода. Анализируемый известняк обрабатывают кислотой и определяют вес выделяющегося углекислого газа. Определение может быть проведено двумя методами 1) путем улавливания СО2 щелочами (прямой метод) и 2) путем определения веса СОа по уменьшению веса реагирующих веществ (косвенный метод). [c.205]
Взвешиваемая углемедная соль должна быть суха, иначе кроме окнси меди и углекислого гааа при разложении получится еще вода. В малахите она содержится в его составе, а потому должна быть принята во внимание. Воду, происходящую при разложении, можно всю собрать, поглощая серною кислотою или хлористым кальцием, как будет описано далее. А для сушения соли следует ее или нагревать при температуре около 1СЮ° до постоянного веса, или оставить под колоколом воздушного насоса над серною кислотою, что будет также описано далее. Так как вода встречается почти всюду и многими телами поглощается из влаги воздуха, то возможность ее присутствия никогда не следует упускать из вида при определении веса. [c.359]Далее Блэк показал, что если оксид кальция оставить на воздухе, то он медленно превращается в карбонат кальция. Исходя из этого, Блэк заключил (правильно ), что в атмосфере присутствует небольшое количество углекислого газа. Это было первое четкое указание на то, что воздух не простое вещество и, следовательно, вопреки представлениям древних греков он не является элементом в определении Бойля, а представляет собой смесь по крайней мере двух различных веществ обычного воздуха и углекислого газа. Изучая влияние нагревания на примере карбоната кальция, Блэк установил, как меняется вес вещества при нагревании. Он также определил, какое количество карбоната кальция нейтрализует заданное количество кислоты. Таким образом, Блэк изучал химические реакции, используя метод количественного измерения. Этот метод был развит и усовершенствован Лавуазье. [c.40]
Кавендиш первым установил вес определенных объемов различных газов и в результате сумел установить плотность каждого из них. Он обнаружил, что водород необычайно легок и что его плотность составляет лишь 1/14 плотности воздуха. (И в настоящее время это самый легкий из известных нам газов.) Как выяснилось, водород обладает еще одним необычным свойством в отличие от углекислого газа и собственно воздуха он легко воспламеняется, и Кавендиш не исключал вероятности того, что он получил сам флогистон. [c.41]
Методика количественного определения углекислоты карбонатов основана на измерении количества углекислого газа, выделяющегося при воздействии на иавеску топлива соляной кислоты. В настоящее время применяются два метода определения углекислоты карбонатов (ГОСТ 2962-45) — нормальный, состоящий в непосредственном улавливании в специальных поглотительных приборах и взвешивании выделяющейся углекислоты, и ускоренный, при котором количество выделившейся углекислоты определяется по потере веса. [c.95]
В настоящей работе сущность указанного метода заключалась в следующем. К торзионным весам на тонкой нити из нихрома подвешивалась чашка с точной навеской воздушно-сухого анионита, находящаяся в термошкафу с регулируемой температурой. Изменение веса анионита регистрировали через определенные интервалы времени. После достижения постоянного веса исследуемого образца при данной температуре последнюю повышали и снова проводили кинетические измерения. В указанной последовательности опыт вели до достижения температуры 270° включительно. Параллельно с измерением веса определяли количества воды и углекислого газа, выделившиеся при нагревании анионита в каждом изучавшемся интервале температур. Для этого абсолютно одинаковую навеску смолы помещали в стеклянную трубку, находящуюся в термошкафу, через которую медленно пропускали воздух, предварительно освобожденный от влаги и углекислоты в поглотительных склянках с ангидроном и аскаритом и нагретый в металлическом змеевике, имевшем температуру термошкафа. Воздух, проходя через трубку с навеской смолы, увлекал воду и углекислый газ, выделяющиеся анионитом при нагревании, которые затем поглощались в находящихся вне шкафа специальных склянках с ангидроном и аскаритом соответственно. По привесу этих склянок (взвешивание с точностью до 0,0001 г) определяли количества выделившихся воды и углекислого газа. [c.174]
Определение молекулярного веса углекислого газа. [c.69]
Для определения молекулярного веса углекислого газа им наполняют плоскодонную колбу с узким горлом емкостью 250 мл. Колбу предварительно моют, высушивают и подбирают пробку, плотно входящую в нее. Колбу с пробкой взвешивают на технохимических весах (с точностью до 0,01 г). Затем в колбу до дна вставляют газоотводную трубку и заполняют колбу углекислым газом из аппарата Киппа или из баллона. Для очистки и высушивания газа его пропускают последовательно через склянки с водой и серной кислотой. Колбу закрывают пробкой, взвешивают, снова пропускают в нее углекислый газ и еще раз взвешивают. По достижении постоянного веса (расхождение не более чем на 0,01 г) записывают этот вес и определяют объем колбы, заполнив ее водой и измерив затем объем воды мерным цилиндром. Отмечают температуру и давление воздуха и вычисляют мо- [c.70]
Определение молекулярного веса углекислого газа Получение карбонатов и бикарбонатов и их взаимные [c.228]
Настоящий стандарт устанавливает метод определения компонентного состава сухого газа, содержащего углеводороды С1 — С4 и не более 5 вес. % углеводородов суммы С5, а также неуглеводородные компоненты водород, кислород, азот, углекислый газ, окись углерода, сероводород в любых соотношениях. [c.76]
В качестве газов-носителей могут применяться водород, азот и углекислый газ. Найдено, что средняя ошибка при определениях молекулярного веса составляет около 4%. [c.270]
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОГО ВЕСА УГЛЕКИСЛОГО ГАЗА [c.35]
Зная вес углекислого газа в определенном объеме при нормальных условиях, можно найти его плотность по водороду или воздуху и подсчитать его молекулярный вес. [c.63]
Для определения молекулярного веса углекислого газа собрать прибор по рис. 50. [c.63]
Фотометрическое определение морфина в коробочках и других органах мака (по Вегнеру). Экстракция. 5 г размолотого и доведенного при температуре 75° до постоянного веса растительного материала хорошо смачивают в небольшой ступке 5 мл раствора углекислого натрия (7,5 г безводного карбоната натрия в 100 мл воды) и оставляют слегка прижатым на 1 час для набухания. После такой предварительной обработки переводят пробу в экстрактивную гильзу, закрывают ее пробкой из ваты и с помощью хлористого метилена подвергают 8—10-часовой экстракции в экстракторе на водяной бане. Ввиду низкой точки кипения хлористого метилена (42°) нужно хорошо охладить содержимое, не допуская сильного кипения водяной бани. После экстракции экстракт оставляют в закрытой колбе до следующего дня. [c.99]
Выход углекислого газа в процентах от веса расщепленного жира может быть определен по формуле [c.113]
Для этого определения нужно прокалить белую магнезию до постоянного веса и высчитать происшедшую от этого потерю в весе, которая называется потерей от прокаливания. При прокаливании из белой магнезии улетучиваются гидратная вода и углекислый газ. [c.66]
Волюмометрия газов, под которой следует понимать определение веса твердого или жидкого вещества путем выделения газа и измерения его объема, широко используется в аналитической химии. Определение углекислого кальция (известняка) [c.100]
Некоторые данные термогравиметрического анализа представляют также интерес для количественного анализа. Так, термогравиметриче-скими измерениями было установлено, что температура полного обезвоживания гидроокиси алюминия различна в зависимости от того, какой реактив применялся для осаждения. Гидроокись алюминия, полученная осаждением гидроокисью аммония, полностью обезвоживается только при температуре более 1000°, в то время как применение для осаждения углекислого или сернистого аммония снижает температуру обезвоживания приблизительно до 420 . Этим же методом было найдено, что превращение магнийаммоннйфссфата в пирофосфат магния достигается уже при температуре около 500 Оксихинолинаты многих металлов имеют после высушивания вполне определенный состав, и их можно применять для весового определения ряда элементов. Однако это ке относится к ок-сихинолинату титана, который при повышении температуры не дает горизонтальной площадки на кривой термолиза его вес медленно уменьшается при повышении температуры вплоть до полного превращения в двуокись титана . [c.89]
Подготовка к сплавлению. Определение кремневой кислоты, окислов железа, титана, алюминия, кальция и магния, а также сульфата, ведут из одной общей навески. Для этого отвешивают на часовом стекле 1,0000 г размельченной высушенной пробы. Затем взвешивают на технических весах 6 г безводной соды или углекислого калия-нат-рия (смесь К2СО3 и Na Oj). Небольшое количество взвешенной соды насыпают в платиновый тигель так, чтобы его дно было покрыто тонким слоем соды. Навеску силиката ссыпают теперь с часового стекла в тигель, сметая кисточкой отдельные крупинки силиката, оставшиеся на стекле. Для удаления последних следов порошка стекло споласкивают содой соду насыпают небольшими порциями на стекло, а затем сметают кисточкой в тигель. [c.462]
В случае необходимости экспериментального определения щелочей пользуются следующим методом. Навеску золы около 1 г, очень тщательно измельченную в порошок, неощутимый наощупь, помещают в платиновый тигель, смачивают ее несколькими каплями воды и затем прибавляют 0,5 мл крепкой h3SO4 (уд. вес ],84) и 10--15 мл плавиковой кислоты. Тигель по.мещают на водяную баню и оставляют стоять сначала с закрытой крышкой, при частом помешивании платиновым шпателем через некоторое время крышку открывают и выпаривают до прекращения выделения паров плавиковой кислоты. Затем ставят тигель на песчаную баню и нагревают до появления интенсивных паров серной кислоты для уверенности в полном удалении плавиковой кислоты. Массе, несколько влажной от серной кислоты, дают охладиться, смывают ее в стакан, разбавляют 300-ьЮО мл горячей воды и кипятят до перехода всей соли в раствор. К фильтрату, слабо подкисленному соляной кислотой, прибавляют небольшой избыток кипящего раствора ВаСЬ для осаждения серной кислоты, а затем, не отфильтровывая осадка, аммиака и углекислого аммония для осаждения полуторных окислов и избытка хлористого бария и кальция. Затем осадок отфильтровывают, тщательно промывая его горячей водой с прибавлением раствора углекислого аммония сначала декантацией, а затем на фильтре. Фильтрат выпаривают досуха, удаляют аммонийные соли слабым прокаливанием, приливают каплю соляной кислоты, растворяют в небольшом количестве воды, добавляют баритовой воды до сильно-щелочной реакции, кипятят и [c.266]
Тетрахлорметан, четыреххлористын углерод ССЦ, негорючая бесцветная летучая жидкость. Мол. вес 153,82 плотн. 1595 кг/ж т. пл. —22,6° С т. кип 76,7° С плоти, пара по воздуху 5,3 теплота сгорания 242 ккал/кг. Пары I4 оказывают значительное флегматизирующее (ингибирующее) действие иа горение многих органических веществ. Минимальная огнегасительная концентрация его (определенная по спирту) равна 10,5% объемн. сравнить азот 31,5 /о объемн., углекислый газ 23% объемн.). При термическом распаде в присутствии паров воды может образоваться фосген. В связи с этим I4 ие применяется в качестве огнегасительного средства. [c.245]
Ввиду быстрого окисления метилового спирта в организме, количественное определение метилового спирта в перегоне внутренностей обыкновенно не может иметь места (см. стр. 80). Количественное определение в различных жидкостях (напитках, одеколонах и пр.) при достаточных количествах его, в отсутствии винного спирта, может быть, произведено по удельному весу дестиллата. Для этого дестиллат предварительно очищают от летучих кислот взбалтыванием со свежеосажденным углекислым кальцием от Э5би/ ных масел Спри исследовании одеколонов, настоек и прочих ароматны.х жидкостей) —извлечением последних при взбалтывании дестиллата (разбавленного равным объемом воды) с петролейным эфиром . [c.81]
Определение СО2. Углекислый газ, обра--зующийся при брожении, определяют по разности массы колбы при постановке опыта и после его окончания. Конец броже-.ния устанавливают по прекращению газообразования. Брожение обычно продолжается 2—3 даш. Не- смотря на то что колбу взвешивают только на технических весах, уч т углекислого газа получается достаточно точный, так как его в процессе брожения выделяется -много (на долю СО2 приходится почти 50% сброженного сахара) [c.89]
Этот процесс при температурах выше 840° сопровождается образованием неравновесной микроэвтек-тической жидкой фазы на границе раздела карбонат—титанат натрия, что также способствует образованию соединения, богатого натрием. В связи с этим суммарное количество двуокиси титана, связанной в тпта-наты, в начальный период несколько больше теоретически необходимого (на рис. 2 диагональ, проходящая через начало координат), но во всех случаях не превышает 3—5%. Таким образом, с определенной степенью точности можно предположить, что убыль в весе за счет выделяющегося углекислого газа в температурном [c.250]
Порошкообразную надперекись натрия мы растирали на холоду с определенным количеством льда. Полученный таким образом твердый продукт, по своему химическому составу отвечаюш,ий эмпирической формуле КазОа ЗНаО, обрабатывался при 0° С углекислым газом при периодическом встряхивании реактора и эвакуации освобождаюш,ейся в реакции воды. Концентрация углекислого газа в газовоздушной смеси в начале процесса была около 1% по объему. По мере образования нового продукта и уменьшения гидрата перекиси натрия концентрация углекислого газа увеличивалась и к концу опыта доводилась до 100%. Опыт прекращался по достижении постоянного веса продуктов реакции. Полученный продукт промывался предварительно охлажденными спиртом и эфиром, а затем освобождался от адсорбированных иаров эфира путем их испарения в вакууме. Для сравнения мы получили пероксодикарбонат натрия из перекиси натрия по известной методике Вольфенштейна. Результаты представлены в табл. 2. [c.134]
Количественное определение углерода и водорода. Количества углерода и водорода в соединении определяют одновременно. Для этого органическое вещество сжигают в токе кислорода над окисью меди СиО или двуокисью свинца РЬОг при температуре около 600°С. Продукты сгорания — углекислый газ и воду — улавливают поглотителями воду — безводным хлористым кальцием СаСЬ или ангидроном (перхлоратом магния) Mg( 104)2, а углекислый газ — едким кали или. натронной известью. Зная увеличение веса этих поглотителей, вычисляют количество углерода и водорода в исходном соединении. [c.9]
Аргоновый детектор Ловелокка проявляет одинаковую чувствительность ко всем веществам с молекулярным весом выше 100, поскольку чувствительность и линейность его реакции являются, главным образом, функциями напряжения на электродах. С газом-носителем аргоном этот детектор нечувствителен к тем веществам, потенциал ионизации которых выше 11,6 эв. Так, СН4, О2, N2, СО и вода почти не поддаются определению, за исключением того случая, когда кислородсодержащие молекулы дают отрицательный сигнал, соответствующий понижению фонового тока за счет захвата электронов. Нечувствительность детекторов ионизационного типа к воздуху и углекислому газу с успехом используется при анализе запахов, загрязнений воздуха и т. д. без применения обычных практически нежелательных операций концентрирования. [c.327]
Вещество, используемое в качестве первичного стандарта, должно отвечать целому ряду очень строгих требований. Прежде всего оно должно поддаваться очистке, так чтобы можно было получить соединение определенного известного состава. Оно должно быть устойчиво к воздействию атмосферы, особенно к действию ки vГIopoдa, воды и углекислого газа. Стандартное вещество не должно быть гигроскопичным, а вещества, содержащие кристаллизационную воду, по возможности не должны выветриваться если два последних требования не выполняются, высушивание и взвешивание осложняются. Это вещество должно иметь достаточно большой эквивалентный вес, чтобы ошибки взвешивания были малы по сравнению с другими ошибками при стандартизации. В качестве первичных стандартов для стандартизации раствора КМ.ПО4 можно использовать оксалат натрия Ыа >С204 или окись мышьяка (П1) Аз40б. Оба эти соединения являются твердыми веществами, легко получаются с [c.228]
Определение алкалоидов в растительном материале. Растение высушивают при 50°, измельчают, добавляют двойное (по весу) количество углекислого натрия и экстрагируют алкалоиды хлороформом в аппарате Сокслета 8—10 час. Затем хлороформный экстракт в делительной воронке встряхивают 5 раз с 5 мл серной кислоты каждый раз. После этого к кислотному раствору добавляют концентрированный аммиак и вновь встряхивают с серной кислотой, как и в первый раз. В кислот-HOiM растворе алкалоиды разделяют хроматографией на бумаге (круговой или нисходящей). Хроматографическую бу.магу предварительно обрабатывают фосфатным буфером с pH 7 или 40 М щавелевой кислотой. В каче- [c.117]
Для определения неодима и празеодима нужен прибор большой дисперсии [65]. Изготовление эталонов для определения редкоземельных элементов возможно по следующей схеме. Вначале готовят синтетичеокие эталоны из порошков окислов редкоземельных элементов на основе из углекислого кальция (внутренний стандарт — окись скандия, вводимая в угольный порошок в количестве 0,5% эталоны смешивают с угольным порошком в соотношении 1 1 по весу) [65]. Далее из сплавов, содержащих необходимый интервал редкозе.мельных элементов, выделяется их сумма и многократно анализируется по синтетическим пер- [c.171]
chem21.info
Удельный вес углекислого газа - Справочник химика 21
При вытеснении нефти оторочкой углекислого газа нефтеотдача может быть на 50—100% больше, чем при обычном заводнении, если удельный расход углекислого газа составлял не менее [c.119]
С, удельным объемом твердой фазы 0,661 дм кг и жидкой фазы 0,849 дм /кг. В критической точке давление равно 7,528 МПа, температура 31,04 °С, удельный объем 2,14 дм кг. При 0°С и 101,325 кПа удельный объем углекислого газа составляет 506 дм кг, а относительная плотность по воздуху 1,529. [c.156]Разноречивы мнения о роли твердых частиц в механизме перемешивания газа. Одни [6, 22 считают, что порции газа чисто механически захватываются частицами, движущимися навстречу основному потоку газа, другие [23, 24] указывают на преимущественно адсорбционный характер переноса газа пористыми частицами. Такие выводы сделаны но результатам экспериментов с непористыми материалами. Вероятно, в зависимости от гидродинамического режима (пузырчатый и агрегатный) удельный вес того и другого механизма различен, а в общем рассмотрении оба они имеют место. Так же, как и для твердых частиц, при описании перемешивания газа применяют диффузионную модель, когда степень перемешивания характеризуется через коэффициент осевой эффективной диффузии Величину этого коэффициента определяют опытами с трассирующим газом. При этих опытах на какой-то высоте над газораспределительной решеткой по оси аппарата вводят газ-трассер, например, гелий или углекислый газ. По высоте и радиусу слоя ниже и выше точки ввода трассера отбирают и анализируют пробы газовой смеси. Характер распределения концентраций трассера по разным сечениям иллюстрируют [25] кривые рис. 22. [c.35]
Удельная теплоемкость [в ккал кг-град)]-, топочных газов —0,24, сырого бикарбоната — 0,44, соды — 0,26, углекислого газа — 0,21, мазута — 0,16, пара — 0,47. [c.534]
Обычная дистиллированная вода обладает электропроводимостью порядка 2-10 ом -см , что объясняется присутствием в ней растворенного аммиака, углекислого газа, органических веществ и других примесей. Поэтому удельная электропроводимость входящая в уравнения (4) и [c.53]
Варгафтик для графического обобщения теплопроводности углекислого газа [Л. 4-12] использовал координатную систему (X—Яо)=/(7), где А, — теплопроводность при р и Хо — теплопроводность при той же и давлении, равном 1 кГ/см у — удельный вес. В указанной координатной системе получается единая зависимость в виде кривой, выходящей из начала координат. Экспериментальные точки, полученные при различных температурах и давлениях, ложатся около этой кривой в пределах точности опытов. [c.169]
На фиг. 29 представлен график зависимости износа образцов от изменения скорости скольжения в пределах от 0,005 до 12 м/сек при постоянной удельной нагрузке 50 кг/см , при испытании в газовых средах — кислороде (кривая 1), аргоне (кривая 2), углекислом газе (кривая износа валов и образцов в среде аргона (кривая 5) и воздуха (кривая 5). [c.51]
Условия работы исследуемых сопряженных деталей — плиты и опорного кольца (малые скорости относительного перемещения деталей, вызванного изменением их температуры, большие удельные давления 1000—1200 кг см , очень высокая пластичность металлов, из которых изготовлены детали, среда — углекислый газ) способствуют возникновению и развитию процесса схватывания металлов. [c.159] Для устранения процесса схватывания первого рода в деталях машин, изготовленных из мягких сталей, работающих в условиях сухого трения при больших удельных нагрузках, малых скоростях относительного перемещения, в среде углекислого газа, можно рекомендовать следующие простые и технологичные мероприятия [c.166]Сопоставление результатов расчетов возможного содержания углекислоты в основных потоках, поступающих в конденсатор, с концентрацией углекислоты, определенной по удельной электрической проводимости собственно конденсата турбины, дает достаточно хорошую сходимость. Углекислота, поступающая с различными потоками в конденсат турбины, появляется главным образом вследствие процесса насыщения воды углекислым газом. При этом для водных растворов, находящихся в контакте с СО2, действительно равновесие [c.118]
Непредельные углеводороды, % (азот), % НаЗ (серово- дород), % СО, (углекислый газ), % О, (кислород), % (низшая теплота сгорания), ккал/м Удельный вес газа, кг/м [c.11]
Схема производства сухого льда методом прессования с циклом высокого давления. Снег, получаемый при дросселировании жидкой углекислоты до давления ниже давления тройной точки, превращается в блоки сухого льда в результате его сжатия (прессования). Удельная масса сухого льда зависит от давления и продолжительности сжатия, а также от формы блока и практически составляет 1,4—1,6 кг/дм . Прн получении сухого льда методом прессования в специальных сухоледных прессах давление сжатия снегообразной массы больше, чем в льдогенераторах. Углекислый газ и отсасываемые из пресса пары (нижний отсос) поступают к всасывающей стороне основного компрессора, Которым они сжимаются до давления конденсации. Схема сжижения [c.288]
Сг, Рг, К, Тг - соответственно удельная теплоемкость, плотность, теплопроводность, температура углекислого газа. [c.9]
Выгруженный из шаровой мельницы порошок поступает на прессование, которое проводится при 140—170 С, удельном давлении 15—20 МПа и выдержке 1,5—2 мин на 1 мм толщины заготовки. В процессе прессования происходит размягчение и сплавление частиц полистирола в сплошную массу. Кроме того, газообразователь начинает разлагаться с образованием пузырьков газа — азота в случае динитрила азобисизомасляной кислоты (см. стр. 42) и аммиака, углекислого газа и воды в случае карбоната аммония, равномерно распределяющихся по всей массе запрессованной заготовки. [c.99]
Если уголь обработать химически активными кислородсодержащими газами (водяной пар, углекислый газ, дымовые газы или воздух) при высокой температуре, то смолистые вещества окислятся и разрушатся, закрытые поры откроются, что приведет к увеличению сорбционной способности угля. Однако сильное окисление способствует выгоранию микропор, уменьшая этим удельную поверхность и сорбционные свойства угля. Практически выход активного угля составляет 30—40% от веса сухого угля-сырца. [c.162]
Углекислый газ (СОд). Удельный вес углекислого газа или углекислоты по отношению к воздуху равен 1,529. Вес 1 л при 0° и 760 мм рт. столба равен 1,9767 г. Углекислый газ в значительной степени поглощается водой, а именно 1 л воды при 760 мм рт. столба растворяет СО2 в л [c.73]
На анионите, видимо, весьма ограниченно происходит только молекулярная сорбция. Попадание гуминовой кислоты в фильтрат вызывает снижение его pH, Удельное сопротивление фильтрата ири полном отсутствии минеральных веществ и углекислого газа определяется в рассмотренном случае наличием гуминовых кислот. [c.112]
При обработке катализатора кислородом наблюдается выделение углекислого газа, удельная радиоактивность которого близка по величина радиоактивности окиси этилена. Это указывает иа адсорбцию окиси эт шена поверхностью серебра. [c.70]
В табл. 24 приведены результаты радиометрии продуктов окисления смеси ацетальдегида, этилена и кислорода. Зная исходную удельную радиоактивность меченого компонента и определив величину удельной радиоактивности продуктов, легко подсчитать долю участия этилена и ацетальдегида в генерации СО и СО 2. Как углекислый газ, так и окись углерода в смесях данного состава образуются примерно на /4 из ацетальдегида и на из углеводорода, минуя альдегид. Во время окисления смеси удельные радиоактивности ацетальдегида и этилена остаются постоянными. Следовательно, [c.73]
Пометив ацетальдегид радиоактивным изотопом С , можно по распределению радиоактивности выяснить происхождение различных продуктов реакции (см. табл. 26, опыт 2). Окпсь углерода образуется в равной степени как из альдегида, так и из окиси этилена. Углекислый газ получается на 80% из альдегида и только на 20% из окиси этилена. На поверхности контакта альдегида сорбируется больше, чем окиси этилена, — это показывает удельная радиоактивность углекислого газа, полученного после обработки кислородом катализатора при 430 . Отношение скоростей образования СО и СО 2 из чистого альдегида 3,4 в присутствии окиси этилена 1,3. [c.77]
Во время окислительной реакции из пропилена образуется немеченый ацетальдегид, который разбавляет введенный в систему ацетальдегид, содержащий С вследствие этого удельная радиоактивность ацетальдегида уменьшается. Кривая изменения удельной радиоактивности углекислого газа проходит через максимум и не пересекает кривую удельной радиоактивности ацетальдегида. Это [c.79]
Кривая а (см. рис. 120) характеризует температуру стенки контрольного участка под слоем нагара при работе ГТД без испарительного охлаждения. За период с 5-й по 10-ю мин At=22° . Перевод двигателя для работы на том же топливе Т-1пп, но с подачей СО2 в поток воздуха не отразился на тепловой напряженности двигателя, но масса нагара в форкамере несколько уменьшилась и нагарное число находилось в пределах 98,0— 90,6. Углекислый газ как инертная среда незначительно влияет на режим горения, поэтому с увеличением массового расхода СО2 перепад температур на стенке снижается с At=22° до At(y 0°С при максимальном расходе СО2 (в этом случае СО2 подавали не через форсунки, а через трубопровод диаметром 3 мм при р= =35 кгс/см ). Теплоизоляционное число нагара находилось в пределах 86,5—45,4, а удельная теплоизоляционность изменялась от 0,880 до 0,503. [c.283]
Таким образом, чем больше вес литра газа, тем при меньшем давлении нефть будет переходить в раствор в сжатом газе. Нефть легко растворяется в удельно тяжелом углекислом газе, а также в метано, если к нему добавлено некоторое количество пентана. В раствор Б сжатом газе может перейти вся нефть, за исключением асфальтенов, не растворимых в легких углеводородах, к которым по свойствам приближается смесь сжатых газов. Обратное растворение нефти в газе рассматривается как причина поремеш,ения или миграции нефти в области с меньшим давлением, в которых и происходит разделение смеси на газ и жидкую нефть. [c.75]
Ингибитор ИКСГ-1 используют для защиты оборудования газоконденсатных скважин от коррозии, вызываемой совместным действием углекислого газа, уксусной, муравьиной кислоты в смеси водного и углеводородного конденсатов. Удельный расход применяемого на месторождениях Ставропольгазпрома ингибитора ИКСГ-1 составляет в среднем 175 г на 1(Ю0 м газа, а на месторождениях Кубаньгазпрома -40 г на ЮОО газа. На Майкопском месторождении ингибитор ИКСГ-1 применяют с расходом 60 г на 1000 м газа, а на Опошнянском и Та-дячском месторождениях — 20 г на 1000 газа. [c.170]
Автором была проведена целая серия лабораторных испытаний (по принятой методике) по определению влияния различных сред, в которых происходит трение сопряженных поверхностей, на образование и развитие процессов схватывания первого и второго рода при переменных скоростях относительного скольжения в пределах от 0,005 до 150 ж/се/с и удельных нагрузках в пределах от 1 до 300 кг/см . Испытания проводились в жидких средах — маслах МС-20, АМГ-10, гипоидном (ГОСТ 4003-53), вазелиновом, вазелином с добавкой 0,5% олеиновой кислоты, спирте и глицерине в условиях граничной смазки и в газовых средах — аргоне, углекислом газе и кислороде в условиях сухого трения на образцах, изготовленных из стали марок 45,У8, серого чугуна и бронзы Бр.АЖМц в паре с валами, изготовленными из стали марок 10,45 и У8. В результате проведенных испытаний установлено, что газовые и жидкие среды могут по-разному влиять на развитие процессов схватывания первого и второго рода. Одни газовые и жидкие среды тормозят развитие процессов схватывания, сужают [c.50]
Однако исследуемые детали — плита и опорное кольцо работают в условиях, несколько отличающихся от условий работы ранее исследованных деталей и лабораторных испытаний. В процессе изучения закономерностей развития процесса схватывания в конкретных условиях (удельные нагрузки 1000—1200 кг см температура 250° С возвратно-поступательное взаимное перемещение поверхностей трения в среде углекислого газа и т. п.) и разработки обоснованных, рациональных методов борьбы со схватыванием возникла необходимость пробедения специальных лабораторных исследований. [c.148]
Так как удельные нагрузки в исследуемых деталях в 10—12 раз превышают максимальные нагрузки в проведенных лабораторных исследованиях, возникла необходимость проведения дополнительных лабораторных исследований. Поэтому были проведены испытания образцов в среде углекислого газа при удельных нормальных нагрузках 1300 кг1см . [c.154] Объем камеры был выбран из такого расчета, чтобы ио условиям предельных концентраций кислорода и углекислого газа можно бьшо экспонировать 40 животных в аэрозольном облаке в течение 20 мип. после прекращения подачи аэрозоля. Аппарат бьш снабжен системой подачи воздуха от аспиратора с замером его объемной скорости. Объемная скорость припудительпой подачи аэрозоля составляла 4 л/мип., что обеспечивало 5-10-кратпый запас по отношению к суммарному дыхательному объему 40 мышей массой 15 г при удельном дыхательном объеме легких У=1,2 мл/г/мип. [c.253]Большие кусочки серы удаляют декантацией. или фильтрованием через стеклянную вату, а малые — фильтрованием через асбестовую прокладку тигля Гуча. Избыток сероводорода удаляют кипячением фильтрата до иочезяовения реакции на сероводород. Если необходимо, раствор снова фильтруют. Иодистоводородную кислоту перегоняют из перегонной колбы емкостью 250 мл, в которую помещают кусочки фарфора (кипятильники). Собирают дестиллат, кипящий при 125—127°. Выход постоянно кипящей кислоты составляет приблизительно ПО—120 мл, или 90%, при расчете на количество взятого иода. 57-процентная иодисто водородная кислота имеет удельный вес около 1,7. Если исходят из чистого иода и сероводорода, то приготовленная кислота не будет содержать никаких примесей, за исключением небольшого количества растворенного иода, получившегося в результате окисления иодистоводородной кислоты кислородом воздуха. Бесцветную иодистоводородную кислоту получают перегонкой в атмосфере водорода или углекислого газа. [c.153]
С. Во время ферментации среда интенсивно перемешивается и продувается газовой смесью. Процесс контролируется по изменению парциального давления кислорода и углекислого газа. Ферментация хорошо идет по непрерывной схеме культивирования, при этом не существует опасности загрязнения посторонней микрофлорой, так как Hydrogenomonas имеет большую скорость роста, а среда выращивания непригодна для гетеротрофных микроорганизмов. Удельная скорость роста а следова- [c.121]
К формамиду добавляют несколько кусочков бромтимола синего и точно нейтрализуют присутствующие кислоты едким натром. Нейтральную жидкость нагревают до 80 — 90° при пониженном давлении, после чего откачивают аммиак и воду и амид снова нейтрализуют. Эту операцию повторяют четыре или пять раз до тех пор, пока жидкость не станет нейтральной. В перегонную колбу, содержащую формамид, добавляют муравьинокислый натрий, после чего формамид перегоняют и отбирают фракцию, КИПЯЩУЮ в пределах между 80 и 90°. Дистиллат нейтрализуют и перегоняют так, как это описано выше, собирая последнюю четвертую или пятую часть его (температура плавления полученного описанным способом дистиллата составляла 2,2°, а удельная электропроводность была равна 5 х 10 ом ). Затем дистиллат подвергают дробной кристаллизации в атмосфере, не содержащей паров воды и углекислого газа (после этого удельная электропроводность составляла 1 — 2 х 10 ом ). Жидкость, полученную после кристаллизации, снова нейтрализуют, перегоняют и вновь подвергают дробной кристаллизации. [c.435]
На рис. 36 приведена зависимость удельной радио-активности акролеина и двуокиси углерода от времепп контакта на катализаторе, содержащем 0,1% Си на карборунде. Удельные радиоактивности акролеина и двуокиси углерода возрастают по мере увеличения времени контакта. Значение удельной радиоактивности двуокиси углерода больше соответствующего значения удельной радиоактивности акролеина, но меньше удельной радиоактивности пропилена (а иронплепа равна 340 имп]мин- мг). Если бы углекислый газ и акролеин образовались из пропилена независимо, то удельная радиоактивность СОг равнялась бы пропилена. Промежуточное значение [c.81]
После окисления смесп пропилена, меченного и акролеина с кислородом и азотом через катализатор, содержащий 1 % Си на Si , был нронущен очищенный от СО2 воздух нри 400°. Удельная радиоактивность углекислого газа, образующегося вследствие выжигания органической пленки, была равна 35 имп1мин-мг, что сравнимо с удельной радиоактивностью акролеина, полученного из пропилена. [c.83]
Над катализатором (0,1% Си на Si ) сначала была пропущена смесь (неактивного) акролепна с азотом при 400°, затем при той же температуре и том же времени контакта (2 сек.) смесь меченого пропилена с кислородом и азотом. Удельная радиоактивность углекислого газа составляла 70 имп/мин- мг. Следовательно, органическая пленка, образовавшаяся на поверхности катализатора при адсорбции акролеина, принимала участие в процессе образования углекислого газа, так как в противном случае его активность была бы равна удельной активности исходного пропилена, т. е. 320 имп/мин-м8. [c.83]
chem21.info
Углекислый газ определение молекулярного веса
| Рис. 48. Установка для определения молекулярного веса углекислого газа |  |
ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОГО ВЕСА УГЛЕКИСЛОГО ГАЗА [c.35]
Определение молекулярного веса углекислого газа. [c.69]
Для определения молекулярного веса углекислого газа им наполняют плоскодонную колбу с узким горлом емкостью 250 мл. Колбу предварительно моют, высушивают и подбирают пробку, плотно входящую в нее. Колбу с пробкой взвешивают на технохимических весах (с точностью до 0,01 г). Затем в колбу до дна вставляют газоотводную трубку и заполняют колбу углекислым газом из аппарата Киппа или из баллона. Для очистки и высушивания газа его пропускают последовательно через склянки с водой и серной кислотой. Колбу закрывают пробкой, взвешивают, снова пропускают в нее углекислый газ и еще раз взвешивают. По достижении постоянного веса (расхождение не более чем на 0,01 г) записывают этот вес и определяют объем колбы, заполнив ее водой и измерив затем объем воды мерным цилиндром. Отмечают температуру и давление воздуха и вычисляют мо- [c.70]
Для определения молекулярного веса углекислого газа собрать прибор по рис. 50. [c.63]
Для определения молекулярного веса углекислого газа взять сухую плоскодонную колбу емкостью 500 мл с хорошо пригнанной резиновой пробкой. При помоши резинового кольца или карандаша по стеклу сделать отметку на горлышке колбы в том месте, где кончается пробка. Взвесить с точностью до 0,01 г колбу с пробкой. При заполнении колбы углекислым газом газоотводную трубку аппарата Киппа или баллона с углекислым газом опустить до дна колбы. Когда колба заполнится углекислым газом (как это определить ), медленно вынуть газоотводную трубку, закрыть отверстие колбы пробкой и взвесить. Заполнение колбы углекислым газом производить несколько раз, до тех пор пока не будет получен постоянный вес. Определить объем колбы, наполнив ее водой до метки. Отметить температуру и давление. Вычислить молекулярный вес углекислого газа. [c.36]
Определение молекулярного веса углекислого газа Получение карбонатов и бикарбонатов и их взаимные [c.228]
Знания газовых законов учащихся молопределения молекулярного веса некоторых газов. Удобнее взять углекислый газ или кислород. Работу можно организовать так. [c.55]
Определение молекулярного веса хлора. Сущность метода та же, что и при определении молекулярного веса углекислого газа. Некоторое отличие заключается в том, что хлор собирают не в колбе, а в газовой пипетке. Газовая пипетка (рис. 17) представляет собой стеклянный баллон объемом 150—200 мл, снабженный двумя кранами для впуска и выпуска газа. К пипетке прикрепляется проволока с петлей на конце, которая позволяет подвешивать пипетку к крючку серьги весов при взвешивании. [c.33]
Определение молекулярного веса углекислого газа................34 [c.3]
В качестве газов-носителей могут применяться водород, азот и углекислый газ. Найдено, что средняя ошибка при определениях молекулярного веса составляет около 4%. [c.270]
Определение молекулярного веса углекислого газа. На техно-химических весах взвесить сухую колбу с воздухом, заключенным в ней, и с пробкой (вес вг). Пробка должна быть вдвинута в горло колбы до метки (резиновое кольцо). Опустить в колбу стеклянную трубочку, подводящую углекислый газ из аппарата Киппа через промывные склянки (с раствором соды и с концентрированной серной кислотой). Открыть кран аппарата Киппа и медленно пропускать углекислый газ в течение 7—8 мин. Закрыть колбу пробкой до метки и взвесить (вг). Вновь пропускать углекислый газ 3—4 мин., а затем взвесить (вз). Если два последних веса равны или отличаются друг от друга не более чем на 0,01 г, то наполнение колбы следует считать законченным. В противном случае повторить наполнение и добиться постоянного веса колбы. Отметить температуру по комнатному термометру и давление — по барометру. [c.27]
Составить уравнение реакции получения углекислого газа. Почему СО,, получающийся в аппарате Киппа, промывается сначала раствором гидрокарбоната натрия, а потом серной кислотой Что означает довести до постоянного веса Какие опытные данные необходимы для определения молекулярной массы газа [c.33]
Оборудование, приборы четырехгорлая колба на 500 мл механическая мешалка с затвором ловушка Дина — Старка шариковый холодильник термометр со шкалой от О до 300 С прибор для подвода углекислого газа приборы для определения молекулярного веса криоскопическим или эбуллиоскопическим методами штатив с пробирками колбы конические на 250 мл (3 шт.). [c.50]
Опыт. Определение молекулярного веса углекислого газа. Определение молекулярного веса углекислого газа производится в том же приборе, что и определение химического эквивалента металлов. [c.42]
Определение молекулярного веса углекислого газа. На техно-химических весах взвесить сухую колбу с воздухом, закрытую пробкой (вес 65). Пробка должна быть вдвинута в горло колбы до метки (резиновое кольцо). Опустить в колбу стеклянную трубочку, подводящую углекислый газ из аппарата Киппа (см. рис. 19). Для промывки и осушки газ пропускают через промывные [c.30]
Выбор истинного числа делался на основании закона Авогадро. Так как в молекуле любого углеродного соединения не может содержаться меньше одного атома углерода, наименьшая доля этого элемента в молекулярном весе и должна соответствовать его атомному весу. Нужно было, следовательно, определить молекулярные веса различных летучих углеродных соединений, вычислить по их процентному составу в каждом случае долю углерода и выбрать из всех полученных чисел наименьшее. Такие определения давали число 12. Поэтому атомный вес углерода и следовало принять равным двенадцати. В качестве примера приведены расчетные данные для метана, эфира, спирта и углекислого газа [c.21]
Для определения количественного состава органических соединений пользуются особыми методами анализа, например сжигают вещество в специальном приборе и по массе выделившегося углекислого газа вычисляют содержание углевода, а по массе воды — содержание водорода в сожженном веществе. Затем по количественному составу и молекулярному весу определяют молекулярную формулу органического соединения Некоторые органические соединения содержат кислород, азот, серу, галогены и др. [c.286]
Наблюдая изменение высоты пика за определенный промежуток времени, можно вычислить скорость натекания данного газа. Проведя подобные определения для каждого из компонентов смеси, находят отношение их молекулярных весов. Если значение молекулярного веса одного из компонентов известно, можно определить абсолютные значения молекулярных весов и других газов. В качестве такого стандартного газа с известным молекулярным весом используют кислород, углекислый газ и др. [c.237]
Обратная задача — определение атомных весов — требует знания молекулярного состава и данных химического анализа. Например, если известно, что в молекуле углекислого газа на один атом углерода приходится два атома кислорода, а химический анализ дает 27,3% углерода и 72,7% кислорода, то, очевидно, [c.37]
Молекулярный вес фракций определялся криоскопическим методом, элементарный состав—сжиганием над окисью меди. Раствор углекислого калия (из кали-аппарата), полученный при определении элементарного состава, использовался для приготовления препаратов ВаС Од [осаждением раствором Ва(0Н)21, необходимых для радиометрических измерений. [c.123]
Одно очень важное исследование ясно показало, каковы бывают ошибки при определении такой легко выделяющейся воды. Было найдено, что некоторые цеолиты, будучи сильно обезвожены (но не нагреты до разрушения их молекулярной структуры), могли затем поглощать вместо воды различные сухие газы, в атмосферу которых их помещали, например углекислый газ, аммиак, сероуглерод.и др., даже воздух в больших количествах, а также некоторые жидкости. На основании этого наблюдения можно полагать, что упомянутое выше большое прибавление в весе (в 1,5%) у частично обезвоженного минерала происходило за счет воздуха, который был поглощен из эксикатора, а не от поглощения влаги, как полагали прежде. Отсюда следует, что опасно принимать потерю в весе за меру количества выделенной воды, а также, что во многих случаях этот способ определения воды совершенно непригоден. Какой метод необходимо применить в каждом отдельном случае, должно быть полностью предоставлено выбору работающего в этом выборе он часто будет руководствоваться [c.829]
Некоторые области применения газоволюметрии известны уже давно, например, определение карбоната кальция по объему углекислого газа, выделяющегося при взаимодействии карбоната соляной кислотой определение азота по Дюма определение молекулярного веса жидких и твердых веществ, которые могут быть без разложения переведены в парообразное состояние и т. п. Однако области возможного применения этого метода значительно шире, и поэтому газоволюметрии заслуживает большого внимания. Преимуществами ее, по сравнению со многими другими методами анализа, являются скорость и простота определений, большая точность отсчета благодаря значительному объему выделяющихся газов при малых навесках, несложность аппаратуры, возможность автоматизации измерений. [c.244]
Определение молекулярного веса криоскопическим методом показало, что молекулярный вес окрашенного вещества (Б) не отличается от молекулярного веса, предполагаемого для бесцветного соединения (А), содержащего свободную альдегидную группу. Следовательно, при образовании окрашенного соединения не происходит полимеризации. Вместе с исчезновением альдегидной группы у вещества (А) образуется новое окрашенное вещество (Б). Поскольку окрашенное соединение (Б) легко образовывало медную соль при кипячении с углекислой медью, наличие свободной карбоксильной группы у вещества можно считать доказанным. С другой стороны, прямое титрование щелочью не удавалось, вещество обладало буферными свойствами, что исключает простое окисление альдегидной группы с образованием дикарбоновой кислоты. Кроме того, при подобном течении реакции оставалось бы необъяснимым происхождение окраски. Повидимому, в данном случае наиболее вероятно образование циклической группировки по метиленовой группе [c.1549]
Аргоновый детектор Ловелокка проявляет одинаковую чувствительность ко всем веществам с молекулярным весом выше 100, поскольку чувствительность и линейность его реакции являются, главным образом, функциями напряжения на электродах. С газом-носителем аргоном этот детектор нечувствителен к тем веществам, потенциал ионизации которых выше 11,6 эв. Так, СН4, О2, N2, СО и вода почти не поддаются определению, за исключением того случая, когда кислородсодержащие молекулы дают отрицательный сигнал, соответствующий понижению фонового тока за счет захвата электронов. Нечувствительность детекторов ионизационного типа к воздуху и углекислому газу с успехом используется при анализе запахов, загрязнений воздуха и т. д. без применения обычных практически нежелательных операций концентрирования. [c.327]
Для точного определения очень малых количеств углерода в железе и стали по баритовому спосо б у—образовавшуюся во время сожжения углекислоту поглощают едким баритом и получившийся углекислый барий переводят после растворения в соляной кислоте в сернокислый барий путем осаждения серной кислотой. По этому способу определение углерода происходит в форме соединения с высоким молекулярным весом, что способствует повышению точности (1 атом С = 1 молекуле BaSO ). [c.112]
Продукт присоединения, получающийся при взаимодействии сернокислого серебра с ацетобромглюкозой или обработкой смеси кислого сульфата-1-тетраацетилглюкозы и ацетобромглю-козы в пиридине углекислым серебром, содержит одну молекулу пиридина в виде четвертичного аммониевого соединения как показывает формула, в это соединение входят две молекулы глюкозы [ЗОО]. Можно объяснить его образование, полагая, что средний сульфат тетраацетилглюкозы присоединяется к вири дину таким же образом, как присоединялся бы диметилсульфат в этих же условиях. Четвертичная аммониевая соль образует нейтральный водный раствор, в котором она полностью ионизирована кажущийся молекулярный вес соли при определении его в этом растворе равен 400, тогда как в уксусной кислоте о приблизительно вдвое больше. Реакция образования продуктов такого типа очень характерна и имеет место лишь в случае ацилиро-ванных 1-галоидзамещенных сахаров пираноидного типа. Галоид-производные глюкозы фураноидного типа дают сиропообразные [c.54]
Уксусная кислота — бесцветная прозрачная жидкость с резким запахом. Безводная, или ледяная, кислота представляет собой похожую на лед кристаллическую массу. Техническая кислота может быть окрашена в желтый цвет. Смешивается с водой, спиртом, эфиром во всех отношениях. Пары уксусной кислоты при зажигании на воздухе горят светло-голубым пламенем, образуя воду и углекислый газ, поэтому при наличии концентрированных паров кислоты необходима предосторожность. Уксусная кислота — одна из самых стойких органических соединений. На нее почти не действуют сильные окислители К2СГ2О7 и КМПО4. Этим свойством пользуются при очистке кислоты в производстве. Уксусная кислота и ее соли находят широкое применение в синтезе ряда лекарственных препаратов. Концентрированная кислота вызывает ожоги на коже. Концентрированные растворы кислоты содержат частично ассоциированные молекулы двойного состава (СНзСООН)г. Явление ассоциации подтверждают данные молекулярных весов, определенных при различных температурах. С возрастанием температуры увеличивается распад ассоциированных молекул (табл. 9), о чем говорит понижение степени ассоциации [c.212]
В 1901 г. Сорэ [57 подтвердил это сообщение, показав, что ряд веществ в обычных условиях выделяет при кристаллизации одну модификацию. Так, растворы углекислого гуанидина выделяют избыток /-соли, а калиевая соль кремневольфрамовой кислоты выделяет всегда -модификацию. На эту внутреннюю связь физической и молекулярной асимметрии указывали также Киппинг и Поп [38] в 1898 г. определенная энантиоморфная модификация хлората натрия при кристаллизации из оптически активной среды, например, из 20%-ного водного раствора декстрозы, всегда преобладает как по весу, так и по числу кристаллов, составляя около 68%. В следующем году эти авторы доказали, что при кристаллизациях в обычных условиях из оптически неактивного растворителя хотя и выделяется один или другой энантиоморф в преобладающем количестве, но при очень больщом числе опытов вес и число кристаллов обеих модифи каций в средйем оказались одинаковыми. [c.162]
chem21.info
Углекислый газ,тяжелее или легче воздуха???
Плотность воздуха - 1,2041 кг/м³, (при н. у. ) Плотность углекислого газа - 1,9769 кг/м³, значит, углекислый газ тяжелее воздуха в 1,9769 : 1,2041 = 1, 64 раза
Конечно тяжелее.
Тяжелее воздуха. Иначе его бы не использовали при тушении пожаров...
А откуда тогда глобальное потепление ?!!
Все зависит от его температуры, но при равных температурах - тяжелее.
Да углекислый газ тяжелее воздуха
touch.otvet.mail.ru