Уникальные свойства металла титан: плотность и температура плавления. Температура плавления титана
низкая плотность, высокая температура плавления и коррозионная стойкость
Космический металл, материал будущего, превращающий мечту в реальность — всё это о титане, серебристо-белом, прочном и лёгком. Занимая девятое место по распространённости в природе, он отлично зарекомендовал себя в аэрокосмической и нефтехимической промышленности, машиностроении и медицине. Чудо-металл даже открыт был необычно, а изучение его свойств помогло человечеству выйти на новый уровень развития.
История открытия металла
Всё началось в 1791 году, когда, независимо друг от друга, одновременно У. Грегор (Англия) и М. Г. Клапрот (Германия) получили двуокись титана, но не сумели выделить из неё чистое вещество. Минералог и, по совместительству, сельский священник Грегор изучал чёрный железистый песок, найденный в окрестностях своего прихода. Результатом стало извлечение соединения титана — блестящих крупиц, которые названием «менакин» (от минерала менаканит) увековечили родные места англичанина.
Примерно в это же время химик Клапрот, изучая красные пески, привезённые из Венгрии, нашёл в минерале рутиле новое вещество и назвал его «титан». А, спустя несколько лет, доказал, что рутил и менакеновая земля — одинаковые соединения. В 1825 году шведским химиком Берцелиусом был получен первый образец металлического титана, но это не позволило продвинуться в исследовании свойств, так как примеси делали образец хрупким и неподходящим для механической обработки.
Только в 1925 году голландские химики ван Аркел и де Бур, применив термическое разложение иодида титана, не нашедшее широкого использования, получили вещество с 99,9% чистотой. Такой металл обладал пластичностью, его можно было раскатывать в листы, проволоку и фольгу. Это позволило начать полномасштабное изучение физических и химических свойств, привлечь внимание инженеров и строителей, наметить сферы применения. А уже в 1940 году появился кролловский процесс восстановления четырёххлористого титана магнием, успешно используемый и до сих пор.
Теории происхождения названия
Существует две теории возникновения наименования:
- Первая, подчёркивающая основные свойства металла титана — лёгкость и прочность, связана с именем персонажа германской легенды — эльфийской царицы Титании.
- Другая теория отсылает к древнегреческой мифологии, где титанами называли могучих братьев — божеств второго поколения, детей богов Урана и Геи. Отголоски этого слышатся и в названии элемента урана.
Нахождение титана в природе
Титан занимает почётное четвёртое место по содержанию в земной коре среди важных для человека металлов, уступая только железу, магнию и алюминию. Максимальное его количество сосредоточено в нижнем, базальтовом слое, немного меньше — в гранитном. Принимая во внимание высокую химическую активность, найти титан в чистом виде не представляется возможным. Наиболее распространены четырёхвалентные оксиды, которые концентрируются в рудах коры выветривания и в морской глине.
Сегодня насчитывают до 75 титановых минералов, а учёные периодически заявляют об открытии всё новых форм и соединений. Для промышленной переработки наибольшее значение имеют:
- Ильменит.
- Лейкоксен (продукт изменения ильменита).
- Рутил.
- Титанит (сфен).
- Перовскит.
- Анатаз.
- Титаномагнетит.
- Брукит.
Титан — слабый мигрант, он может переноситься только в виде механических обломков каменной породы или при перемещениях коллоидных илистых слоёв водоёмов. Для биосферы характерно содержание максимальных количеств этого металла в морских водорослях, у животных он обнаружен в шерсти и роговых тканях, в организме человека присутствует в щитовидной железе, селезёнке, надпочечниках и плаценте.
Месторождения космического материала
Самыми распространёнными являются залежи ильменита, они составляют порядка 800 млн тонн. Запасы рутиловых руд значительно меньше, но при сохранении роста добычи все они могут обеспечить человечество ещё на 100 лет. По запасам титана Россия уступает только Китаю и насчитывает 20 разведанных месторождений. Большинство из них — комплексные, где добывают также железо, фосфор, ванадий и цирконий. Сегодня крупнейшим мировым производителем титана считается российская металлургическая компания «ВСМПО-АВИСМА».
Обширные залежи располагаются на территории ЮАР, Украины, Канады, США, Бразилии, Австралии, Швеции, Норвегии, Египта, Казахстана, Индии и Южной Кореи. Они различаются содержанием металла в рудах и объёмами добычи, геологические изыскания не прекращаются. Даже на Луне были обнаружены запасы титаносодержащих руд, некоторые из них в десятки раз богаче крупных месторождений Земли. Это позволяет надеяться на снижение рыночных цен металла и расширение сферы использования.
Физические свойства элемента
Titanium — химический элемент периодической таблицы Менделеева, находится в IV группе четвёртого периода. Имеет атомный номер 22, молярную массу 47,867, обозначается символом Ti и проявляет степени окисления от 2 до 4, наиболее устойчивы его четырёхвалентные соединения. При нормальном давлении температура плавления титана равна 1670 ± 2 °C, он относится к цветным тугоплавким металлам и по внешнему виду напоминает сталь.
Твёрдость, пластичность и предел текучести — важные параметры для любого металла, которые определяют сферу применения. Титан в 12 раз прочнее алюминия, в 4 раза меди и железа. А ещё он гораздо легче их всех (плотность титана всего 4,54 г/см 3) и свободно обрабатывается методами сварки, клёпки, ковки и проката. К важным особенностям относятся низкие показатели теплопроводности и электропроводности, которые остаются неизменными даже при высоких температурах.
Титан проявляет парамагнитные свойства: не намагничивается в магнитном поле, подобно никелю и железу, и не выталкивается, как серебро и золото. Его плохие антифрикционные свойства обусловлены налипанием на многие материалы. Уникальны показатели коррозионной стойкости и сопротивления механическому воздействию: пластины из титана, десять лет пролежавшие на дне моря, не претерпят изменений внешнего вида и состава, а железо за это время разложится полностью.
Химические свойства
Высокая коррозийная стойкость объясняется тем, что в нормальных условиях на поверхности металла присутствует оксидная плёнка. Однако в виде порошка, тонкой стружки или проволоки он способен самовоспламеняться и взрываться. Титан устойчив к водным растворам хлора и многим разбавленным щелочам и кислотам, кроме плавиковой, ортофосфорной и серной. Сварку и плавку производят в вакууме, потому что при даже незначительном нагреве проявляется одно из главных свойств титана — активное поглощение газов окружающей атмосферы.
Реакция с водородом, которая начинается при 60 °C, обратима, полученные гидриды при нагревании снова разлагаются. На воздухе при температуре 1200 °C титан пылает ярким белым пламенем, и только он способен гореть в атмосфере азота при температуре выше 400 °C с образованием нитридов. Для взаимодействия с галогенами необходимыми условиями являются отсутствие влаги и наличие катализатора — высокой температуры. При реакции с углеродом получается сверхтвёрдый карбид. С большинством металлов титан образует высокопрочные конструкционные или жаростойкие сплавы и интерметаллические соединения, часто применяется в качестве важного легирующего компонента.
Способ получения из сырья
Исходное сырьё — двуокись титана, содержащая мало посторонних примесей. Для этого нужен рутиловый концентрат, получаемый обогащением руды. Но его мировые запасы невелики, и чаще применяют титановый шлак (синтетический рутил), который получают термической обработкой — обогащением ильменитовых концентратов в электродуговой печи. В результате железо в виде чугуна собирается на дне специальной ванны, и остаётся порошок серого цвета — шлак, содержащий оксид титана. Его измельчают, смешивают с углём, брикетируют и хлорируют в печах, где при 800 °C в присутствии углерода образуются пары четырёххлористого титана.
Потом их очищают и в специальных реакторах восстанавливают магнием при 950 °C. На стенках образуется спёкшаяся пористая масса, титановая губка, которую для сепарации от соединений магния прокаливают в вакууме. Чтобы изготовить слитки титана используют плавку полученной губки в вакуумно-дуговых печах. Это предохраняет металл от окисления и способствует окончательному освобождению от примесей. Готовые слитки с чистотой до 99,7% используют для обработки давлением (прокатка, штамповка, ковка).
Основные сферы применения
Сложно описать все области жизни, где нашлось место титану, но среди основных направлений можно отметить:
- Главные потребители — аэрокосмическая отрасль и ракетостроение. Высокая температура плавления и лёгкость являются неоценимыми преимуществами титана при использовании в качестве «летающего» конструкционного материала. Для самолёта, например, это элероны и лонжероны, поворотные узлы крыльев, трубопроводы и шпангоуты. Глубоко символично, что в 1980 году установленный в Москве памятник Ю. А. Гагарину сделан из этого космического металла.
- Судостроение тоже нуждается в лёгких и коррозионно-стойких материалах. В конце 70-х годов ХХ века практически весь годовой объем выпуска титана в Советском Союзе пошёл на создание ядерной подводной лодки, где он служил основным конструкционным материалом. Результатом стали снижение на одну треть веса субмарины, её парамагнетизм, максимальные показатели глубины погружения и скорости под водой.
- Титановые пластины применяют в бронежилетах. Вес лёгкого бронежилета — 4 кг, тяжёлого — 10,5 кг. Даже одна такая полоса толщиной всего 5 мм надёжно защищает от пистолетных и ружейных пуль.
- Металл незаменим для нужд химической промышленности ввиду антикоррозийной стойкости в большинстве агрессивных сред и при высоких температурах: приборы и трубопроводы, ёмкости хранения и перегонки, фильтры и запорная арматура.
- Для придания сталям твёрдости и жаропрочности его используют как легирующую добавку.
- Сплавы титана служат для изготовления режущих и хирургических инструментов, ювелирных изделий. Металл не отторгается человеческим телом, поэтому его применяют в медицине для создания имплантатов.
- Издавна здания в европейских городах покрывались цинковыми листами. В ХХ веке для этих нужд был создан экологически чистый и долговечный материал цинк-титан. Его отличная пластичность помогает изготавливать кровли практически всех контуров и формировать любые нестандартные конструкции фасадов.
- Производство стройматериалов, красок, резины, пластмасс, бумаги и пищевых добавок трудно представить без соединений титана. Они востребованы в электротехнике, их можно найти в составе тугоплавких стёкол и керамических деталей, в опорах буровых платформ, работающих в экстремальных морских условиях, и корпусах домашних компьютеров.
Сфера применения титана постоянно расширяется, её сдерживают сложность и энергоёмкость процесса получения чистого вещества. Отчасти поэтому традиционные железо и алюминий сегодня ещё прочно удерживают позиции. Титан — дорогое удовольствие. Цена металла в виде концентрата в сотни раз меньше стоимости готовой продукции, например, листового проката. Сегодня такие расходы доступны далеко не всем, поэтому применение титана определяет уровень экономического развития и обороноспособности государства.
tokar.guru
Двоякость свойств металла титан
Многих интересует немного загадочный и не до конца изученный титан — металл, свойства которого отличаются некоторой двоякостью. Металл и самый прочный, и самый хрупкий.

Самый прочный и самый хрупкий металл
Его открыли двое ученых с разницей в 6 лет — англичанин У. Грегор и немец М. Клапрот. Название титана связывают, с одной стороны, с мифическими титанами, сверхъестественными и бесстрашными, с другой стороны, с Титанией — королевой фей.Это один из самых распространенных в природе материалов, но процесс получения чистого металла отличается особой сложностью.
Свойства титана
22 химический элемент таблицы Д. Менделеева Titanium (Ti) относится к 4 группе 4 периода.
Цвет титана серебристо-белый с выраженным блеском. Его блики переливаются всеми цветами радуги.
Это один из тугоплавких металлов. Он плавится при температуре +1660 °С (±20°). Титан отличается парамагнитностью: он не намагничивается в магнитном поле и не выталкивается из него.Металл характеризуется низкой плотностью и высокой прочностью. Но особенность этого материала заключается в том, что даже минимальные примеси других химических элементов кардинально изменяют его свойства. При наличии ничтожной доли других металлов титан теряет свою жаропрочность, а минимум неметаллических веществ в его составе делают сплав хрупким.Эта особенность обуславливает наличие 2 видов материала: чистого и технического.
- Титан чистого вида используют там, где требуется очень легкое вещество, выдерживающее большие нагрузки и сверхвысокие температурные диапазоны.
- Технический материал применяется там, где ценятся такие параметры, как легкость, прочность и устойчивость к коррозии.
Вещество обладает свойством анизотропности. Это означает, что металл может изменять свои физические характеристики, исходя из приложенных усилий. На эту особенность следует обращать внимание, планируя применение материала.

Титан теряет прочность при малейшем присутствии в нем примесей других металлов
Проведенные исследования свойств титана в нормальных условиях подтверждают его инертность. Вещество не реагирует на элементы, находящиеся в окружающей атмосфере.Изменение параметров начинается при повышении температуры до +400°С и выше. Титан вступает в реакцию с кислородом, может воспламеняться в азоте, впитывает газы.Эти свойства затрудняют получение чистого вещества и его сплавов. Производство титана основано на применении дорогостоящей вакуумной аппаратуры.
Титан и конкуренция с другими металлами
Этот металл постоянно сравнивают с алюминием и сплавами железа. Многие химические свойства титаназначительно лучше, чем у конкурентов:
- По механической прочности титан превосходит железо в 2 раза, а алюминий в 6 раз. Прочность его увеличивается при снижении температуры, чего не отмечается у конкурентов.Антикоррозионные характеристики титана значительно превышают показатели других металлов.
- При температурах окружающей среды металл абсолютно инертен. Но при повышении температуры свыше +200°С вещество начинает поглощать водород, изменяя свои характеристики.
- При более высоких температурах титан вступает в реакции с другими химическими элементами. Он обладает высокой удельной прочностью, что в 2 раза превосходит свойства лучших сплавов железа.
- Антикоррозионные свойства титана значительно превышают показатели алюминия и нержавеющей стали.
- Вещество плохо проводит электричество. Титан имеет удельное электросопротивление в 5 раз выше, чем у железа, в 20 раз, чем у алюминия, и в 10 раз выше, чем у магния.
- Титан характеризуется низкой теплопроводностью, это обусловлено низким коэффициентом температурного расширения. Она меньше в 3 раза, чем у железа, и в 12, чем у алюминия.
Какими способами получают титан?
Материал занимает 10 место по распространению в природе. Существует около 70 минералов, содержащих титан в виде титановой кислоты или его двуокиси. Наиболее распространенные из них и содержащие высокий процент производных металла:
- ильменит;
- рутил;
- анатаз;
- перовскит;
- брукит.
Основные залежи титановых руд находятся в США, Великобритании, Японии, большие месторождения их открыты в России, Украине, Канаде, Франции, Испании, Бельгии.

Добыча титана — дорогой и трудозатратный процесс
Получение металла из них стоит очень дорого. Ученые разработали 4 способа производства титана, каждый из которых рабочий и эффективно используется в промышленности:
- Магниетермический способ. Добытое сырье, содержащее титановые примеси, перерабатывают и получают диоксид титана. Это вещество подвергается хлорированию в шахтных или солевых хлораторах при повышенном температурном режиме. Процесс очень медленный, ведется в присутствии углеродного катализатора. При этом твердый диоксид переводится в газообразное вещество — тетрахлорид титана. Полученный материал восстанавливается магнием или натрием. Сплав, образовавшийся при реакции, подвергают нагреванию в вакуумной установке до сверхвысоких температур. В результате реакции происходит испарение магния и его соединений с хлором. В конце процесса получают губкоподобный материал. Его плавят и получают титан высокого качества.
- Гидридно-кальциевый способ. Руду подвергают химической реакции и получают гидрид титана. Следующий этап — разделение вещества на составляющие. Титан и водород выделяют в процессе нагревания в вакуумных установках. По окончании процесса получают оксид кальция, который отмывают слабыми кислотами. Первые два способа относятся к промышленному производству. Они позволяют получать в кратчайшие сроки чистый титан с относительно небольшими издержками.
- Электролизный метод. Титановые соединения подвергают воздействию током большой силы. В зависимости от исходного сырья, соединения разделяются на составляющие: хлор, кислород и титан.
- Йодидный способ или рафинирование. Полученный из минералов диоксид титана обдают парами йода. В результате реакции образуется йодид титана, который нагревают до высокой температуры — +1300…+1400°С и воздействуют на него электрическим током. При этом из исходного материала выделяются составляющие: йод и титан. Металл, полученный данным способом, не имеет примесей и добавок.
Области применения
Применение титана зависит от степени его очистки от примесей. Наличие даже небольшого количества других химических элементов в составе сплава титана кардинально меняет его физико-механические характеристики.
Титан с некоторым количеством примесей называется техническим. Он имеет высокие показатели коррозийной стойкости, это легкий и очень прочный материал. От этих и других показателей зависит его применение.
- В химической промышленности из титана и его сплавов изготавливают теплообменники, различного диаметра трубы, арматуру, корпуса и детали для насосов различного назначения. Вещество незаменимо в местах, где требуются высокая прочность и стойкость к кислотам.
- На транспорте титан используют для изготовления деталей и агрегатов велосипедов, автомобилей, железнодорожных вагонов и составов. Применение материала уменьшает вес подвижных составов и автомобилей, придает легкость и прочность велосипедным деталям.
- Большое значение титан имеет в военно-морском ведомстве. Из него изготавливают детали и элементы корпусов для подводных лодок, пропеллеры для лодок и вертолетов.
- В строительной промышленности применяется сплав цинк-титан. Он используется как отделочный материал для фасадов и кровель. Этот очень прочный сплав имеет важное свойство: из него можно изготавливать архитектурные детали самой фантастической конфигурации. Он может принимать любую форму.
- В последнее десятилетие титан широко применяют в нефтедобывающей отрасли. Сплавы его применяют при изготовлении оборудования для сверхглубокого бурения. Материал используется для изготовления оборудования для добычи нефти и газа на морских шельфах.

У титана очень широкая область применения
Чистый титан имеет свои области применения. Он нужен там, где необходима стойкость к высоким температурам и при этом должна сохраняться прочность металла.
Его применяют в:
- авиастроении и космической отрасли для изготовления деталей обшивки, корпусов, элементов крепления, шасси;
- медицине для протезирования и изготовления сердечных клапанов и других аппаратов;
- технике для работы в криогенной области (здесь используют свойство титана — при снижении температуры усиливается прочность металла и не утрачивается его пластичность).
В процентном соотношении использование титана для производства различных материалов выглядит так:
- на изготовление краски используется 60 %;
- пластик потребляет 20 %;
- в производстве бумаги используют 13 %;
- машиностроение потребляет 7 % получаемого титана и его сплавов.
Сырье и процесс получения титана дорогостоящие, затраты на его производство компенсируются и окупаются сроком службы изделий из этого вещества, его способностью не менять свой внешний вид за весь период эксплуатации.
Похожие статьи
ometallah.com
свойства и применение материала и его сплавов
Титан и сплавы на его основе широко используются в самых разных сферах. Прежде всего, титановые сплавы нашли широкое применение в строительстве различной техники благодаря своей высокой коррозийной стойкости, механической прочности, небольшой плотности, жаропрочности и множеству других характеристик. Рассматривая свойства и применение титана, нельзя не отметить его довольно высокую стоимость. Однако она в полной мере компенсируется характеристиками и долговечностью материала.

Титан имеет высокую прочность и температуру плавления, отличается от других металлов долговечностью.
Основные свойства титана
Титан находится в IV группе четвертого периода периодической системы химических элементов. В самых устойчивых и наиболее важных соединениях элемент является четырехвалентным. Внешне титан напоминает сталь. Является переходным элементом. Температура плавления достигает почти 1700°, а кипения — 3300°. Что касается такого свойства, как скрытая теплота плавления и испарения, то у титана она практически в 2 раза превышает аналогичный показатель для железа.
Имеет 2 аллотропические модификации:
- Низкотемпературную, которая способна существовать до температуры в 882,5°.
- Высокотемпературную, устойчивую от температуры в 882,5° до температуры плавления.
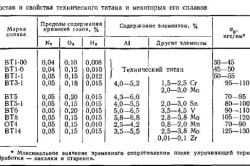
Таблица характеристик титана и его сплавов.
Такие свойства, как удельная теплоемкость и плотность, располагают титан между двумя материалами с наиболее широким конструкционным использованием: железом и алюминием. Механическая прочность титана почти в 2 раза превышает эту характеристику у чистого железа и практически в 6 раз у алюминия. Однако свойства титана таковы, что он способен поглощать в больших количествах водород, кислород и азот, что негативно отражается на пластических характеристиках материала.
Материал характеризуется очень низкой теплопроводностью. Для сравнения, у железа она выше в 4 раза, а у алюминия в 12. Что касается такого свойства, как коэффициент термического расширения, то при комнатной температуре он имеет относительно низкое значение и возрастает с увеличением температуры.
Титан имеет малые модули упругости. При повышении температуры до 350° они начинают уменьшаться практически по линейному закону. Именно этот момент является существенным недостатком материала.
Титан характеризуется довольно большим значением удельного электросопротивления. Оно может колебаться в достаточно широких пределах и зависит от содержания примесей.
Титан является парамагнитным материалом. Для таких веществ характерно снижение магнитной восприимчивости в процессе нагревания. Однако титан является исключением — при повышении температуры его магнитная восприимчивость значительно возрастает.
Сферы применения титана
Медицинские инструменты из титанового сплава отличаются высокой коррозионной прочностью, биологической стойкостью и пластичностью.
Свойства материала обеспечивают довольно широкий спектр сфер его применения. Так, в больших объемах сплавы титана используются в строении судов и различной техники. Налажено применение материала в качестве легирующей добавки к сталям высокого качества и в качестве раскислителя. Сплавы с никелем нашли применение в технике и медицине. Такие соединения имеют уникальные свойства, в частности, они обладают памятью формы.
Налажено применение компактного титана в производстве деталей электровакуумных приборов, использующихся в условиях высоких температур. Свойства технического титана позволяют использовать его в производстве клапанов, трубопроводов, насосов, арматуры и других изделий, создаваемых для эксплуатации в агрессивных условиях.
Сплавы характеризуются недостаточной теплопрочностью, однако имеют высокую коррозийную стойкость. Это позволяет использовать различные сплавы на основе титана в химической сфере. К примеру, материал применяется в изготовлении насосов для прокачки серной и соляной кислоты. На сегодняшний день только сплавы на основе этого материала можно использовать в производстве разного рода оборудования для хлорной промышленности.
Использование титана в транспортной промышленности
Сплавы на основе этого материала используются при изготовлении бронетанковой части. А замена разнообразных конструкционных элементов, которые используются в транспортной промышленности, позволяет снижать расход топлива, увеличивать полезную грузоподъемность, повышать предел усталости изделий и улучшать множество других характеристик.

При производстве оборудования для химической промышленности из титана самое важное свойство — коррозионная стойкость металла.
Материал хорошо подходит для использования в строительстве железнодорожного транспорта. Одна из главных задач, которую нужно решить на железных дорогах, связана со снижением мертвого груза. Использование прутков и листов из титана позволяет существенно снизить общую массу состава, уменьшить размеры букс и шеек, сэкономить в тяге.
Вес имеет довольно существенное значение и для прицепного транспорта. Использование титана вместо стали при производстве колес и осей тоже позволяет существенно повысить полезную грузоподъемность.
Свойства материала делают возможным его использование в автомобилестроении. Материал характеризуется оптимальным сочетанием прочностных и весовых свойств для систем отведения отработанных газов и витых пружин. Применение титана и его сплавов позволяет существенно снизить объем отработанных газов, уменьшить затраты топлива и расширить применение лома и производственных отходов путем их переплава. Материал и содержащие его сплавы имеет множество преимуществ по сравнению с прочими используемыми решениями.
Главной задачей разработки новых деталей и конструкций является уменьшение их массы, от которой в той или иной степени зависит движение самого транспортного средства. Снижение веса движущихся узлов и частей делает потенциально возможным сокращение затрат топлива. Детали из титана неоднократно доказывали свою надежность. Они довольно широко применяются в авиакосмической промышленности и конструкциях гоночных автомобилей.
Использование этого материала позволяет не только уменьшить вес деталей, но и решить вопрос снижения объема отработанных газов.
Использование титана и его сплавов в сфере строительства
В строительстве широко используется сплав титана с цинком. Этот сплав характеризуется высокими механическими показателями и устойчивостью к коррозии, отличается высокой жесткостью и пластичностью. В составе сплава содержится до 0,2% легирующих добавок, выполняющих функции модификаторов структуры. Благодаря алюминию и меди обеспечивается требуемая пластичность. Кроме того, использование меди позволяет повысить предельную прочность материала на растяжение, а сочетание химических элементов способствует снижению коэффициента расширения. Сплав применяется и для производства длинных лент и листов с хорошими эстетическими характеристиками.

Титан часто используется в космических технологиях благодаря его легкости, прочности и тугоплавкости.
Среди главных качеств сплава титана с цинком, важных конкретно для строительства, можно отметить такие химические и физические свойства, как высокая устойчивость к коррозии, хороший внешний вид и безопасность для человеческого здоровья и окружающей среды.
Материал отличается хорошей пластичностью, без проблем поддается глубокой вытяжке, что позволяет использовать его в кровельных работах. У сплава нет никаких проблем с пайкой. Именно поэтому различные объемные конструкции и нестандартные архитектурные элементы вроде куполов и шпилей изготавливаются из цинк-титана, а не меди или оцинкованной стали. В решении подобных задач данный сплав является незаменимым.
Сфера использования сплава очень широка. Его применяют в фасадных и кровельных работах, из него изготавливаются изделия различной конфигурации и практически любой сложности, он широко применяется в производстве разнообразных декоративных изделий типа водостоков, отливов, кровельных коньков и т.д.
Этот сплав отличается очень продолжительным сроком службы. Более столетия он не будет требовать покраски и частых текущих ремонтных работ. Также среди существенных преимуществ материала следует выделить его способность восстанавливаться. Несущественные повреждения в виде царапин от веток, птиц и т.п. через какое-то время устраняются сами по себе.
Требования к строительным материалам становятся все более серьезными и строгими. Исследовательские компании ряда стран изучали почву вокруг зданий, построенных с использованием сплава цинка и титана. Результаты исследований подтвердили, что материал является полностью безопасным. Он не имеет канцерогенных свойств и не вредит человеческому здоровью. Цинк-титан является негорючим стройматериалом, что дополнительно повышает безопасность.
С учетом всех перечисленных положительных характеристик такой строительный материал в эксплуатации приблизительно в 2 раза дешевле, чем кровельная медь.
У сплава две степени окисления. С течением времени он меняет цвет и теряет металлический блеск. Сначала цинк-титан становится светло-серым, а еще через некоторое время приобретает благородный темно-серый оттенок. В настоящее время материал намеренно подвергается химическому старению.
Использование титана и его сплавов в медицине
Титан отлично совместим с человеческой тканью, поэтому активно применяется в области эндопротезирования.
Титан нашел широкое применение и в медицинской сфере. Среди преимуществ, которые позволили ему стать таким популярным, нужно отметить высокую прочность и устойчивость к коррозии. Кроме того, ни у одного из пациентов не было выявлено аллергии на титан.
В медицине применяются коммерчески чистый титан и сплав Ti6-4Eli. С его использованием изготавливаются хирургические инструменты, разнообразные внешние и внутренние протезы, вплоть до сердечных клапанов. Из титана производятся инвалидные коляски, костыли и прочие приспособления.
Ряд исследований и экспериментов подтверждает отличную биологическую совместимость материала и его сплавов с живой человеческой тканью. Мягкие и костные ткани срастаются с этими материалами без проблем. А низкий модуль упругости и высокий показатель удельной прочности делают титан очень хорошим материалом для эндопротезирования. Он заметно легче, чем жесть, сталь и сплавы на основе кобальта.
Таким образом, свойства титана позволяют активно использовать его в самых разнообразных сферах — от изготовления труб и кровли до медицинского протезирования и построения космических аппаратов.
moyasvarka.ru
Титан плавления - Справочник химика 21
Простые вещества. Физические и химические свойства. В компактном состоянии все три элемента V—КЬ—Та представляют собой металлы светло-серого цвета, хорошо поддающиеся механической обработке в чистом состоянии. Все эти металлы характеризуются кристаллическими структурами с координационным числом 8 (ОЦК). Для металлов это сравнительно неплотная упаковка. В сочетании с более высокими температурами плавления элементов подгруппы ванадия по сравнению с титаном и его аналогами факт неплотной упаковки указывает иа возрастание ковалентного вклада в химическую связь. Это обусловлено увеличением числа иеспаренных электроиов на заполняющейся дефектной (п—1) -оболочке. Закономерность изменения параметров кристаллических решеток хорошо коррелирует с величинами атомных радиусов. [c.301]
Химические свойства. Титан, цирконий и гафний представляют очень большой интерес в связи С тем, что их восстановительная активность весьма сильно зависит от температуры. При обычных температурах титан, цирконий и гафний имеют чрезвычайно низкую восстановительную активность и обладают высокой коррозионной устойчивостью в большинстве агрессивных сред. С повышением температуры восстановительная активность металлов растет и у титана при температуре его плавления является одной из самых высоких среди металлов. [c.79]
Как уже было указано, титан, цирконий и гафний (особенно в расплавленном виде) способны интенсивно реагировать с азотом при высоких температурах с образованием рядов твердых растворов, а также нитридов, из которых преимущественную роль играют мононитриды МеЫ. Нитриды титана, циркония и гафния — кристаллические очень твердые и тугоплавкие металлоподобные вещества. Температуры их плавления соответственно равны 2930, 2950, 3310° С. [c.85]
Из двойных металлических систем с образованием непрерывных твердых растворов рассмотрим систему титан — цирконий. -титан образует непрерывный ряд твердых растворов с р-цирконием, а а-ти-тан — непрерывный ряд твердых растворов с а-цирконием. На диаграмме состояния системы (рис. 16) нижние кривые соответствуют превращению твердых растворов Р-титана с р-цирконием в твердые растворы а-титана с а-цирконием. Кривые превращения проходят через минимум (68% циркония. 540 С). Верхние кривые соответствуют плавлению твердых растворов р-титана с р-цирконием. Кривые плавления проходят через минимум (46% циркония, 1560 С). [c.86]
Во многих случаях в системах, образованных титаном, цирконием или гафнием с другими металлами, возникают интерметаллические соединения. Как правило, они сравнительно непрочны. С некоторыми металлами только а-видоизменения образуют интерметаллиды, а р-видоизменения образуют с этими металлами только твердые растворы. Интерметаллические соединения титана, циркония и гафния с этими металлами существуют только при сравнительно низких температурах и разлагаются при температурах полиморфных превращений а р. Большинство интерметаллических соединений титана, циркония и гафния нацело разлагаются при плавлении, и только некоторые из них остаются частично неразложенными. С титаном, цирконием и гафнием образуют соединения металлы, расположенные в периодической системе правее У1В-группы, т. е. сравнительно мало активные. [c.86]
Фазы внедрения образуются и при взаимодействии титана, циркония и гафния с углеродом и азотом. Растворимость этих элементов в титане и его аналогах значительно меньше, чем водорода, хотя они также образуют твердые растворы внедрения. Поскольку атомные радиусы углерода и азота больше, чем водорода, предельный состав фаз внедрения в этом случае отвечает формуле ЭС и ЭЫ, т. е. заполняются только октаэдрические пустоты в ГЦК решетке. Эти фазы относятся к наиболее тугоплавким. Ниже приводим температуры плавления карбидов и нитридов в сопоставлении с температурами плавления металлов [c.243]
Плотность титана 4,54 г/сж , температура плавления 1668° С, температура кипения около 3260° С. По внешнему виду титан похож на сталь. Титан имеет переменную валентность, но основная валентность его равна 4. На воздухе при нормальной температуре компактный титан устойчив. При нагревании выше 400° С он окисляется и растворяет азот и водород, отчего становится хрупким. Хрупкость металлу придают также примеси. [c.326]
Таким образом, механизм дуги можно представить себе следующим. Из катода в результате высокой степени его разогрева (термоэлектронная эмиссия) или наличия около его поверхности больших напряженностей электрического поля (10 —10 в см — автоэлектронная эмиссия) вырывается поток электронов. Первый случай имеет место для материалов катода с высокой температурой плавления и испарения металла (уголь, графит, вольфрам, молибден), благодаря чему температура на их поверхности может достигать в катодных пятнах значений 2 500—3 000° С и выше, когда начинается заметная термоэлектронная эмиссия. Второй случай соответствует материалам с низкой температурой кипения и испарения (ртуть, титан, медь). В области катодного падения поток электронов разгоняется настолько, что за ее пределами происходит интенсивная ионизация частиц газа в дуговом промежутке, причем здесь, по-видимому, весьма существенна роль ступенчатой ионизации. Образовавшиеся положительные ионы под действием поля направляются к катоду и разогревают его вторичные и первичные электроны направляются через столб дуги в направлении анода. На их пути происходят новые соударения (главным образом термическая ионизация) и образование новых заряженных частиц, что компенсирует их исчезновение в более холодных частях столба путем рекомбинации и диффузии. При попадании на анод отрицательные частицы нейтрализуются, выбивая из него некоторое количество положительных ионов, устремляющихся через столб дуги к катоду. Плазма столба в целом нейтральна, т. е. концентрация положительных и отрицательных частиц одинакова, но из-за того, что подвижность электронов по [c.29]
Прочность металлической связи возрастает с ростом числа валентных электронов, участвующих в ее образовании, о чем можно судить по температурам плавления. Титан, цирконий и гафний имеют по 4 валентных электрона (хотя точно не известно, сколько электронов они отдают на образование металлической связи), их температуры плавления выше температур плавления, например, металлов третьей группы, но ниже температур плавления металлов V и VI групп, имеющих большее число валентных электронов. [c.211]
Титан, цирконий и гафний наиболее заметно различаются по плотности, температуре плавления и температуре кипения. Кроме того, у гафния высокое эффективное поперечное сечение поглощения тепловых нейтронов, равное 105 барн у циркония оно 0,18 0,02 барн. [c.212]
Химическая активность компактных Ti, Zr, Hf зависит от чистоты металла и температуры. При обычной температуре они исключительно инертны по отношению к атмосферным газам их поверхность неограниченное время остается блестящей. Высокая стойкость к окислению обусловлена рядом факторов высокими температурами плавления самих металлов и их двуокисей, обладающих малой летучестью, образованием окисных или окисно-нитридных пленок, защищающих поверхность металла. Взаимодействие компактных металлов с кислородом начинается при 200—250°, однако скорость окисления ничтожна, более того, со временем она уменьшается, так как образующаяся тонкая и плотная окисная пленка, обладающая высокой адгезией к металлам, защищает их от дальнейшего окисления. Защитные свойства пленки сохраняются до 500—600°. При более высокой температуре скорость окисления увеличивается из-за того, что окисная пленка теряет защитные свойства. С ростом ее толщины уменьшается адгезия к металлу, в ней развиваются трещины, она частично осыпается. Тем не менее титан в интервале 600—1200° более стоек к окислению, чем нержавею-ш,ая сталь. [c.212]
Титан можно вводить в электролит в виде различных соединений. Электролиз ведут ниже температуры плавления титана, поэтому он получается в виде небольших кристаллов. Процесс сопровождается образованием на катоде продуктов неполного восстановления, которые могут перемещаться к аноду и окисляться на нем, что снижает выход по току. Уменьшить образование соединений низших степеней окисления можно подбором режима электролиза, состава электролита и отделением анодного пространства пористой диафрагмой [45, 57, 58]. [c.276]
Другой причиной, препятствующей определению р и а двойных сплавов на основе железа, является высокая химическая активность ряда элементов. Нет пока материалов, которые могли бы контактировать, не взаимодействуя, с жидким титаном, цирконием, ванадием и рядом лантанидов. Изучение р и сг двойных систем на основе железа во всем концентрационном интервале также ограничено высокой температурой плавления одного из компонентов (бор, гафний, ниобий, тантал, молибден, вольфрам, рений, рутений, родий, осмий, иридий). [c.39]
Г фиий, а также искусственно полученный элемент курчатовин (№ 104). Конфигурация электронной оболочки атомов этих элементов такая же, как у титана, — d s . Аналоги титана цирконий и гафний являются тяжелыми металлами — их плотности соответственно 6,45 и 13,31 г/см температуры их плавления также выше, чем у титана 1852 и 2225°С. Цирконий и гафний образуют разнообразные соединения, в устойчивых и наиболее характерных из которых цирконий и гафний четырехвалентны. Устойчивость соединений, в которых эти элементы трех- и двухвалентны, невелика п убывает в направлении Ti—Zr — Hf. В этом же направлении возрастает металлическая активность этих элементов. Цирконий и гафний, подобно титану, существуют в двух полиморфных видо-измеР ениях — а и р. Также подобно титану цирконий и гафпин при обычных температурах химически неактивны и коррозионноустойчивы, а при высокой температуре реагируют с кислородом, азотом н другими элементарными окислителями. [c.275]
Металлический титан обладает очень высокой прочностью он легок (плотность 4,44 г-см" ), огнеупорен (т. пл. 1800°С) и коррозионноустойчив. С 1950 г. начат промышленный выпуск металлического титана, который применяют всюду, где необходим легкий и прочный металл с высокой температурой плавления так, он служит конструкционным материалом для обшивки тех участков крыла самолета, на которые попадают выбрасываемые мотором раскаленные газы. [c.574]
Магиий медлеппо реагирует с сухим хлором вплоть до температуры плавления металла. Серебро в хлоре и хлористом водороде не разрушается при температурах до 425° С. Титан, обладая прекрасной стойкостью во влажном газообразном хлоре, подвергается сильному разрушению в сухом хлоре, что приводит да> [c.157]
Как указано выше, титан способен интенсивно реагировать с азотом при высоких температурах с образованием ряда тверлых растворов, а также нитридов, из которых преимущественную роль играет нитрид T N. Нитрид титана — кристаллическое, очень твердое (по твердости приближается к алмазу) металлоподобное вещество с температурой плавления 2930°С. Этот нитрид проводит электрический ток, причем электрическая проводимость его уменьшается с повышением температуры, что указывает па его металлический характер. Химически нитрид титана д0В0Л1зН0 инертен. С элементарным титаном образует фазы переменного состава, в основном состоящие из TiзN (субнитрид) и ограниченных твердых растворов. [c.270]
Как уже указывалось, титан способен взаимодействовать с углеродом лишь при высоких температурах. В системе титан — углерод при этих условиях образуются очень твердые сплавы, содержащие карбид титана Т1С — кристаллическое металлоподобное вещество с температурой плавления 3140°С, и ряд твердых растворов. Карбид титана проводит электрический ток, легко сплавляется с металлами и другими карбидами, образуя при этом иногда чрезвычайно твердые тугоплавкие сплавы. При обычной температуре карбид титана довольно инертен, при высоких же температурах ведет себя подобно элементарному титану — реагирует с галогенами, кислородом, серой, азотом, а таклсе с кислотами и солями — окислителями с образованием продуктов, аналогичных получающимся при действии на элементарный титан. Подобные карбиду соединения титан образует с фосфором (фосфиды), кремнием (силиды), бором (бориды). [c.270]
Диоксид титана ТЮ2 известен в виде трех модификаций рутила, анатаза и брукита. Наиболее стабильная фаза — рутил. Температура плавления его 1870°. Во всех этих формах титан находится в шестерной координации. В структуре рутила октаэдры [Т10б] соединяются между собой вершинами и двумя ребрами, в бруките — [c.118]
Резкий скачок в промышленном производстве А1 произошел в 80-х годах прошлого столетия, когда было технически освоено получение алюминия электролизом расплавленного раствора глинозема в криолите. Теория электрометаллургии была создана П. П. Фе-дотьевым. Отечественные ученые разработали метод получения глинозема нз нефелина. Глинозем — тугоплавкий материал, температура плавления чистого А1 0з 2072 °С, и для ее понижения добавляют преимущественно криолит Мал[А1Рг,1. При этом температура плавления понижается до 960 °С. Получение А ведут в специальных электрических печах. Продажный металл содержит примерно 99% А1. Главными примесями являются железо, кремний, титан, натрий, углерод, фториды и др. Для получения алюминия высокой степени чистоты его подвергают электролитическому рафинированию. Используют также процесс нагревания А1 в парах А1Рз (транспортную реакцию) [c.271]
Скандий широкого применения в технике пока не находит, но является перспективным. Скандий при почти равной плотности с алюминием имеет температуру плавления примерно на 750 выше. В связи с этим он мог бы представить интерес как конструкционный материал в авиа- и ракетостроении (для ядерного авиационного двигателя), представляют интерес и сплавы скандия с титаном, обладающие высокой прочностью. Сплавы скандия с висмутом или сурьмой являются сверхпроводящими материалами. Светотехника располагает возможностью резко повысить чувствительность к инфракрасным лучам цинкосульфидных фосфоров добавлением скандия. [c.70]
Титан входит в состав многих сплавов. Добавляемый к рас плавленной стали (получение ферротитана), он соединяется с со держаш,пмнся в ней кислородом и азотом и предотвраш,ает образе вание пустот, литье получается однородным (тнтан как дегазант) [c.193]
Металлохимия элементов подгруппы титана. Физико-химические характеристики титана и его аналогов дефектность -электронной оболочки, средние по величине значения потенциалов ионизации и атомных радиусов, высокие температуры плавления и типичные для металлов плотноупаковапные структуры — обусловливают многообразие металлохимических возможностей этих элементов. Титан, цирконий и гафний образуют непрерывные твердые растворы друг с другом в обеих модификациях. Тройная система Ti—Zr—Hf является единственным примером системы, в которой реализуются два вида непрерывных твердых трехкомпонентных растворов в двух модификациях (рис. 47). Со многими переходными металлами они [c.242]
С кислородом воздуха титан и цирконий энергично образуют диоксиды титан при 1200°, цирконий —при 650° С. В атмосфере азота оба горят, образуя нитриды типа 3N. Это очень твердые вещества переменного состава, с металлической проводимостью, температура плавления порядка 3000° С. Нитрид циркония — один из самых прочных в термодинамическом отношении нитридов. Состав его ZrNi изменяется от д = О до л = 0,42, энтальпия образования соответственно изменяется от —90,7 до —56,1 ккал ф.вес, а свободная энергия образования Д бивариантной системе — в зависимости от температуры и давления азота [49, стр. 251 ) [c.330]
Закись ТЮ, окись TI2O3 и промежуточные фазы можно получить, действуя на TIO2 восстановителями титаном, магнием, цинком, углеродом и водородом, Повыщение температуры способствует получению соединений с меньшим содержанием кислорода. Так, при восстановлении титаном в интервале 900—1000° образуется преимущественно TI2O3, а при 1400—1500° — ТЮ. Все окислы титана имеют высокую температуру плавления (табл. 54). Закись, окись и промежуточные фазы сравнительно устой- [c.216]
Восстанавливают Ti в герметичном стальном реакторе (реторте) в атмосфере аргона или гелия (рис. 82). В реактор заливают расплавленный магний и при 800° сверху подают жидкий Ti li. Температурный интервал, в котором проводится восстановление, невелик нижний предел— температура плавления Mg (714°), верхний предел обусловлен следующим. Титан, взаимодействуя с материалом реторты — железом, образует эвтектический сплав с т. пл. 1085°. При 1085° реактор проплавляется, выше 900° усиливается загрязнение титана железом, которое переносится через газовую фазу хлоридом железа (II), образующимся при взаимодействии Ti l со стенками реторты и расплавленным магнием, растворяющим металлическое железо. При 900° растворимость железа в магнии равна 0,17%. Вследствие экзотермич-ности реакций температура повышается до 1400°. Такая температура допустима только в центральной зоне реактора, у стенок же не должна превышать намного 900°. Поэтому реактор охлаждают воздухом. [c.270]
Для электролиза удобен гексафторотитанат калия K2TiFg. Его электролизом получен титан, не уступающий по качеству лучшим сортам магниетермического титана. Недостаток процесса — увеличение вязкости и температуры плавления электролита вследствие накопления в нем КЕ [34, 45, 58]. [c.277]
Свойства титана, циркония и гафиия. Титан, шрконий и гафний — сеоебристо-белые тугоплавкие металлы. Они образуют по две аллотропических модификации а-форма устойчива при комнатной температуре, а р-(зЬоржа —при высоких температурах. Плотность, теМ пературы плавления и кипения, а также электрическая проводимость возрастают от титана к гафнию, причем последняя для гафния в 3 раза выше, чем для титана. [c.460]
Характерной особенностью элементов подгруппы титана является образование твердых растворов и фаз внедрения с легкими неметаллами (Н, В, С, N1 О). Это обстоятельство накладывает заметный отпечаток на металлохимию этих элементов. Титан и его аналоги обладают способностью сильно поглощать водород. Фазам внедрения отвечают номинальные составы ЭН и ЭН2(Т1Н2, 2гН и 2гН2, НШ и НШг)- Для этих фаз характерна ГЦК-решетка. Фазы внедрения образуются и при взаимодействии титана, циркония и гафния с тлеродом и азотом. Растворимость этих элементов в титане и его аналогах значительно меньше, чем водорода, хотя они также образуют твердые растворы внедрения. Поскольку атомные радиусы углерода и азота больше, чем водорода, предельный состав фаз внедрения в этом случае отвечает формуле ЭС и ЭК, т.е. заполняются только октаэдрические пустоты в ГЦК-решетке. Эти фазы относятся к наиболее тугоплавким. Ниже приведены температуры плавления карбидов и нитридов металлов подгруппы титана [c.396]
Титан — серебристо-белый металл. Его плотность равна 4,5 г/см а температура плавления составляет 1668 °С, Чистьп титан прочен и пластичен. [c.261]
По коррозионной стойкости Мо значительно превосходит высоконикелевые сплавы и титан. Согласно приведенным выше данным, в Н2 SO4, как и в дрзггих кислотах (НС1, h3SO4), по коррозионной стойкости молибден занимает промежуточное положение между ниобием и танталом (см. рис. 41, 42). Необходимо отметить, что ни различие в химическом составе молибденового сплава, ни технология его изготовления (вакуум-плавлен-ный, спеченный), ни структурное состояние (наклепанный, рекристаллизованный) не влияют на скорость общей коррозии, определяемую весовым методом. В связи с этим все промышленные сплавы, если их рассматривать как коррозионностойкие, можно объединить под общим названием — молибден. Несмотря на одинаковую скорость общей коррозии, [c.90]
Возможно и другое объяснение несоответствия имеющихся экспериментальных данных и ожидаемых результатов. Титан с железом образует прочный интерметаллид TiFej с температурой плавления 1530° С. Здесь вероятна такая же ситуация, как и в случае системы Fe — В. Решать этот вопрос можно только постановкой корректных экспериментов. [c.41]
chem21.info
Свойства и применение титана и его сплавов, технические характеристики
Титан занимает 4-е место по распространению в производстве, но эффективная технология его извлечения была разработана только в 40-х гг прошлого века. Это металл серебристого цвета, характеризующийся небольшой удельной массой и уникальными характеристиками. Для анализа степени распространения в промышленности и других сферах необходимо озвучить свойства титана и области применения его сплавов.
Основные характеристики
Металл обладает малой удельной массой – всего 4.5 г/см³. Антикоррозийные качества обусловлены устойчивой оксидной пленкой, образующейся на поверхности. Благодаря этому качеству титан не изменяет своих свойств при длительном нахождении в воде, соляной кислоте. Не возникают поврежденные участки из-за воздействия напряжения, что является основной проблемой стали.

В чистом виде титан обладает следующими качествами и характеристиками:
- номинальная температура плавления — 1 660°С;
- при термическом воздействии +3 227°С закипает;
- предел прочности при растяжении – до 450 МПа;
- характеризуется небольшим показателем упругости – до 110,25 ГПа;
- по шкале НВ твердость составляет 103;
- предел текучести один из самых оптимальных среди металлов – до 380 Мпа;
- теплопроводность чистого титана без добавок – 16,791 Вт/м*С;
- минимальный коэффициент термического расширения;
- этот элемент является парамагнитом.
Для сравнения, прочность этого материала в 2 раза больше, чем у чистого железа и в 4 раза такого же показателя алюминия. Также титан имеет две полиморфные фазы – низкотемпературную и высокотемпературную.

Для производственных нужд чистый титан не применяется из-за его дороговизны и требуемых эксплуатационных качеств. Для повышения жесткости в состав добавляют оксиды, гибриды и нитриды. Реже изменяют характеристики материала для улучшения стойкости к коррозии. Основные виды добавок для получения сплавов: сталь, никель, алюминий. В некоторых случаях он выполняет функции дополнительного компонента.
О технологии сварки титана читайте здесь.
Области применения
Благодаря небольшой удельной массе и прочностным параметрам титан широко используется в авиационной и космической промышленности. Его применяют в качестве основного конструкционного материала в чистом виде. В особых случаях за счет уменьшения жаропрочности делают более дешевые сплавы. При этом его сопротивление коррозии и механическая прочность остаются неизменными.

Кроме этого, материал с добавками титана нашел применение в следующих областях:
- Химическая промышленность. Его стойкость практически ко всем агрессивным средам, кроме органических кислот, позволяет изготавливать сложное оборудование с хорошими показателями безремонтного срока службы.
- Производство транспортных средств. Причина – небольшая удельная масса и механическая прочность. Из него делают каркасы или несущие элементы конструкций.
- Медицина. Для особых целей применяется специальный сплав нитинол (титан и никель). Его отличительное свойство – память формы. Для уменьшения нагрузки пациентов и минимизации вероятности негативного воздействия на организм многие медицинские шины и подобные им устройства делают из титана.
- В промышленности металл применяется для изготовления корпусов и отдельных элементов оборудования.
- Ювелирные украшения из титана обладают уникальным внешним видом и качествами.

В большинстве случаев материал обрабатывается в заводских условиях. Но есть ряд исключений – зная свойства этого материала, часть работ по изменению внешнего вида изделия и его характеристик можно выполнять в домашней мастерской.
Особенности обработки
Для придания изделию нужной формы необходимо использовать специальное оборудование – токарный и фрезерный станок. Ручное резание или фрезеровка титана невозможна из-за его твердости. Помимо выбора мощности и других характеристик оборудования необходимо правильно подобрать режущие инструменты: фрезы, резцы, развертки, сверла и т.д.

При этом учитываются такие нюансы:
- Титановая стружка легко воспламеняется. Необходимо принудительное охлаждение поверхности детали и работа на минимальных скоростях.
- Гибка изделия выполняется только после предварительного разогрева поверхности. В противном случае велика вероятность появления трещин.
- Сварка. Обязательно соблюдение особых условий.
Титан – уникальный материал с хорошими эксплуатационными и техническими качествами. Но для его обработки следует знать специфику технологии, а главное – технику безопасности.
ismith.ru
Титан. Характеристики физико-механических свойств титана - «Тиком-М»
Основные сведения о титане
Титан - химический элемент с порядковым номером 22, атомный вес 47,88, легкий серебристо-белый металл. Плотность 4,51 г/см3, Tпл=1668+(-)5 °С, Tкип=3260 °С. Титан и титановые сплавы сочетают легкость, прочность, высокую коррозионную стойкость, низкий коэффициент теплового расширения, возможность работы в широком диапазоне температур.
История открытия титана
Оксид титана TiO2 впервые был обнаружен в 1789 году английским ученым, специалистом в области минералогии У. Грегором, который при исследовании магнитного железистого песка выделил окись неизвестного металла, назвав ее менакеновой. Первый образец металлического титана получил в 1825 году шведский химик и минераловед Й. Я. Берцелиус.
Свойства титана
В периодической системе элементов Д. И. Менделеева титан расположен в IV группе 4-го периода под номером 22. В важнейших и наиболее устойчивых соединениях металл четырехвалентен. По внешнему виду похож на сталь. Титан относится к переходным элементам. Данный металл плавится при довольно высокой температуре (1668±4 °С) и кипит при 3300 °С, скрытая теплота плавления и испарения титана почти в два раза больше, чем у железа.
Известны две аллотропические модификации титана (две разновидности титана, имеющие одинаковый химический состав, но различное строение и свойства). Низкотемпературная альфа-модификация, существующая до 882,5 °С и высокотемпературная бетта-модификация, устойчивая от 882,5 °С и до температуры плавления.
По плотности и удельной теплоемкости титан занимает промежуточное место между двумя основными конструкционными металлами: алюминием и железом. Стоит также отметить, что его механическая прочность примерно вдвое больше, чем чистого железа, и почти в шесть раз выше, чем алюминия. Но титан может активно поглощать кислород, азот и водород, которые резко снижают пластические свойства металла. С углеродом титан образует тугоплавкие карбиды, обладающие высокой твердостью.
Титан обладает низкой теплопроводностью, которая в 13 раз меньше теплопроводности алюминия и в 4 раза - железа. Коэффициент термического расширения при комнатной температуре сравнительно мал, с повышением температуры он возрастает.
Модули упругости титана невелики и обнаруживают существенную анизотропию. Модули упругости характеризуют способность материала упруго деформироваться при приложении к нему силы. Анизотропия заключается в различии свойств упругости в зависимости от направления действия силы. С повышением температуры до 350 °С модули упругости уменьшаются почти по линейному закону. Небольшое значение модулей упругости титана - существенный его недостаток, т.к. в некоторых случаях для получения достаточно жестких конструкций приходится применять большие сечения изделий по сравнению с теми, которые следуют из условий прочности.
Титан имеет довольно высокое удельное электросопротивление, которое в зависимости от содержания примесей колеблется в пределах от 42·10-8до 80·10-6 Ом·см. При температурах ниже 0,45 К он становится сверхпроводником.
Титан - парамагнитный металл. Обычно у парамагнитных веществ магнитная восприимчивость при нагревании уменьшается. Магнитная восприимчивость характеризует связь между намагниченностью вещества и магнитным полем в этом веществе. Титан составляет исключение из этого правила - его восприимчивость существенно увеличивается с температурой.
Характеристики физико-механических свойств титана (ВТ1-00)
Плотность r , кг/м3 Температура плавления Тпл, ° С Коэффициент линейного расширения a × 10–6, град–1 Теплопроводность l , Вт/(м × град) Предел прочности при растяжении s в, МПа Условный предел текучести s 0,2, МПа Удельная прочность (s в/r × g)× 10–3, км Относительное удлинение d , % Относительное сужение Y , % Модуль нормальной упругости Е´ 10–3, МПа Модуль сдвига G´ 10–3, МПа Коэффициент Пуассона m , Твердость НВ Ударная вязкость KCU, Дж/см2| 4,5 × 10–3 |
| 1668± 4 |
| 8,9 |
| 16,76 |
| 300–450 |
| 250–380 |
| 7–10 |
| 25–30 |
| 50–60 |
| 110,25 |
| 41 |
| 0,32 |
| 103 |
| 120 |
Титан имеет две полиморфные модификации: a -титана с гексагональной плотноупакованной решеткой с периодами а = 0,296 нм, с = 0,472 нм и высокотемпературную модификацию b -титана с кубической объемно-центрированной решеткой с периодом а = 0,332 нм при 900 ° С. Температура полиморфного a « b -превращения составляет 882 ° С.
Механические свойства титана существенно зависят от содержания примесей в металле. Различают примеси внедрения — кислород, азот, углерод, водород и примеси замещения, к которым относятся железо и кремний. Хотя примеси повышают прочность, но одновременно резко снижают пластичность, причем наиболее сильное отрицательное действие оказывают примеси внедрения, особенно газы. При введении всего лишь 0,003 % Н, 0,02 % N или 0,7 % О титан полностью теряет способность к пластическому деформированию и хрупко разрушается.
Особенно вреден водород, вызывающий водородную хрупкость титановых сплавов. Водород попадает в металл при плавке и последующей обработке, в частности при травлении полуфабрикатов. Водород малорастворим в a -титане и образует пластинчатые частицы гидрида, снижающего ударную вязкость и особенно отрицательно проявляющегося в испытаниях на замедленное разрушение.
Поэтому содержание примесей, особенно газов, в титане и титановых сплавах (табл. 17.1, 17.2) строго ограничено.
Промышленный способ производства титана состоит в обогащении и хлорировании титановой руды с последующим его восстановлением из четыреххлористого титана металлическим магнием (магнийтермический метод). Полученный этим методом титан губчатый (ГОСТ 17746–79) в зависимости от химического состава и механических свойств выпускают следующих марок: ТГ-90, ТГ-100, ТГ-110, ТГ-120, ТГ-130, ТГ-150, ТГ-ТВ (см. табл. 17.1). Цифры означают твердость по Бринеллю НВ, ТВ — твердый.
Для получения монолитного титана губка размалывается в порошок, прессуется и спекается или переплавляется в дуговых печах в вакууме или атмосфере инертных газов.
Механические свойства титана характеризуются хорошим сочетанием прочности и пластичности. Например, технически чистый титан марки ВТ1-0 имеет: s в = 375–540 МПа, s 0,2 = 295–410 МПа, d ³ 20 %, и по этим характеристикам не уступает ряду углеродистых и Cr—Ni коррозионностойких сталей.
Высокая пластичность титана по сравнению с другими металлами, имеющими ГПУ- решетку (Zn, Mg, Cd), объясняется большим количеством систем скольжения и двойникования благодаря малому сотношению с/а = 1,587. По-видимому, с этим связана высокая хладостойкость титана и его сплавов (подробнее см. гл. 13).
При повышении температуры до 250 ° С прочность титана снижается почти в 2 раза. Однако жаропрочные Ti-сплавы по удельной прочности в интервале температур 300–600 ° С не имеют себе равных; при температурах выше 600 ° С сплавы титана уступают сплавам на основе железа и никеля.
Титан имеет низкий модуль нормальной упругости (Е = 110,25 ГПа) — почти в 2 раза меньше, чем у железа и никеля, что затрудняет изготовление жестких конструкций.
Титан относится к числу химически активных металлов, однако он обладает высокой коррозионной стойкостью, так как на его поверхности образуется стойкая пассивная пленка TiO2, прочно связанная с основным металлом и исключающая его непосредственный контакт с коррозионной средой. Толщина этой пленки обычно достигает 5–6 нм.
Благодаря оксидной пленке, титан и его сплавы не корродируют в атмосфере, в пресной и морской воде, устойчивы против кавитационной коррозии и коррозии под напряжением, а также в кислотах органического происхождения.
Производство изделий из титана и его сплавов имеет ряд технологических особенностей. Из-за высокой химической активности расплавленного титана его плавку, разливку и дуговую сварку производят в вакууме или в атмосфере инертных газов.
При технологических и эксплуатационных нагревах, особенно выше 550–600 ° С, необходимо принимать меры для защиты титана от окисления и газонасыщения (альфированный слой) (см. гл. 3).
Титан хорошо обрабатывается давлением в горячем состоянии и удовлетворительно в холодном. Он легко прокатывается, куется, штампуется. Титан и его сплавы хорошо свариваются контактной и аргонодуговой сваркой, обеспечивая высокую прочность и пластичность сварного соединения. Недостатком титана является плохая обрабатываемость резанием из-за склонности к налипанию, низкой теплопроводности и плохих антифрикционных свойств.
Основной целью легирования титановых сплавов является повышение прочности, жаропрочности и коррозионной стойкости. Широкое применение нашли сплавы титана с алюминием, хромом, молибденом, ванадием, марганцем, оловом и др. элементами. Легирующие элементы оказывают большое влияние на полиморфные превращения титана.
Таблица 17.1
Марки, химический состав (%) и твердость титана губчатого (ГОСТ 17746–79)
Марка Ti, не менее Не болееТвердость НВ,
10/1500/30, не более
Fe Si Ni C Cl N O| ТГ-90 | 99,74 | 0,05 | 0,01 | 0,04 | 0,02 | 0,08 | 0,02 | 0,04 | 90 |
| ТГ-100 | 99,72 | 0,06 | 0,01 | 0,04 | 0,03 | 0,08 | 0,02 | 0,04 | 100 |
| ТГ-110 | 99,67 | 0,09 | 0,02 | 0,04 | 0,03 | 0,08 | 0,02 | 0,05 | 110 |
| ТГ-120 | 99,64 | 0,11 | 0,02 | 0,04 | 0,03 | 0,08 | 0,02 | 0,06 | 120 |
| ТГ-130 | 99,56 | 0,13 | 0,03 | 0,04 | 0,03 | 0,10 | 0,03 | 0,08 | 130 |
| ТГ-150 | 99,45 | 0,2 | 0,03 | 0,04 | 0,03 | 0,12 | 0,03 | 0,10 | 150 |
| ТГ-Тв | 99,75 | 1,9 | – | – | 0,10 | 0,15 | 0,10 | – | – |
Таблица 17.2
Марки и химический состав (%) деформируемых титановых сплавов (ГОСТ 19807–91)
Обозначениямарок Ti Al V Mo Sn Zr Mn Cr Si Fe O H N C| ВТ1-00 | Основа | – | – | – | – | – | – | – | 0,08 | 0,15 | 0,10 | 0,008 | 0,04 | 0,05 |
| ВТ1-0 | То же | – | – | – | – | – | – | – | 0,10 | 0,25 | 0,20 | 0,010 | 0,04 | 0,07 |
| ВТ1-2 | То же | – | – | – | – | – | – | – | 0,15 | 1,5 | 0,30 | 0,010 | 0,15 | 0,10 |
| ОТ4-0 | То же | 0,4–1,4 | – | – | – | 0,30 | 0,5–1,3 | – | 0,12 | 0,30 | 0,15 | 0,012 | 0,05 | 0,10 |
| ОТ4-1 | То же | 1,5–2,5 | – | – | – | 0,30 | 0,7–2,0 | – | 0,12 | 0,30 | 0,15 | 0,012 | 0,05 | 0,10 |
| ОТ4 | То же | 3,5–5,0 | – | – | – | 0,30 | 0,8–2,0 | – | 0,12 | 0,30 | 0,15 | 0,012 | 0,05 | 0,10 |
| ВТ5 | То же | 4,5–6,2 | 1,2 | 0,8 | – | 0,30 | – | – | 0,12 | 0,30 | 0,20 | 0,015 | 0,05 | 0,10 |
| ВТ5-1 | То же | 4,3–6,0 | 1,0 | – | 2,0 –3,0 | 0,30 | – | – | 0,12 | 0,30 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ6 | То же | 5,3–6,8 | 3,5–5,3 | – | – | 0,30 | – | – | 0,10 | 0,60 | 0,20 | 0,015 | 0,05 | 0,10 |
| ВТ6с | То же | 5,3–6,5 | 3,5–4,5 | – | – | 0,30 | – | – | 0,15 | 0,25 | 0,15 | 0,015 | 0,04 | 0,10 |
| ВТ3-1 | То же | 5,5–7,0 | – | 2,0–3,0 | – | 0,50 | – | 0,8–2,0 | 0,15–0,40 | 0,2–0,7 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ8 | То же | 5,8–7,0 | – | 2,8–3,8 | – | 0,50 | – | – | 0,20–0,40 | 0,30 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ9 | То же | 5,8–7,0 | – | 2,8–3,8 | – | 1,0–2,0 | – | – | 0,20–0,35 | 0,25 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ14 | То же | 3,5–6,3 | 0,9–1,9 | 2,5–3,8 | – | 0,30 | – | – | 0,15 | 0,25 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ20 | То же | 5,5–7,0 | 0,8–2,5 | 0,5–2,0 | – | 1,5–2,5 | – | – | 0,15 | 0,25 | 0,15 | 0,015 | 0,05 | 0,10 |
| ВТ22 | То же | 4,4–5,7 | 4,0–5,5 | 4,0–5,5 | – | 0,30 | – | 0,5–1,5 | 0,15 | 0,5–1,5 | 0,18 | 0,015 | 0,05 | 0,10 |
| ПТ-7М | То же | 1,8–2,5 | – | – | – | 2,0–3,0 | – | – | 0,12 | 0,25 | 0,15 | 0,006 | 0,04 | 0,10 |
| ПТ-3В | То же | 3,5–5,0 | 1,2–2,5 | – | – | 0,30 | – | – | 0,12 | 0,25 | 0,15 | 0,006 | 0,04 | 0,10 |
| АТ3 | То же | 2,0–3,5 | – | – | – | – | – | 0,2–0,5 | 0,20–0,40 | 0,2–0,5 | 0,15 | 0,008 | 0,05 | 0,10 |
Примечание. Сумма прочих примесей во всех сплавах составляет 0,30 %, в сплаве ВТ1-00 — 0,10 %.
ticom-m.ru
Температура плавления хлоридов титана - Справочник химика 21
На кривых охлаждения имеются остановки, соответствуюш,ие кристаллизации из расплава твердых растворов хлористого алюминия и хлорного железа (или твердого раствора пентахлоридов ниобия и тантала), и остановки, соответствующие затвердеванию тройной эвтектики. Температура плавления эвтектики не отличается заметно от температуры плавления чистого четыреххлористого титана. Растворимость хлорного железа в четыреххлористом титане заметно повышается в присутствии хлористого алюминия растворимость их смеси является средней величиной между растворимостью чистых хлоридов железа и алюминия и зависит от соотношения между содержанием этих хлоридов в растворе. [c.164]
Хоном [22] предложено вести восстановление смесью амальгам натрия и кальция в таком соотношении, чтобы образовавшаяся в результате реакции смесь хлоридов имела эвтектический состав с низкой температурой плавления. Это позволяет вести отделение расплавленных солей от металлического титана при более низкой температуре. Расчет, проведенный Хоном [22], показывает, что применение амальгам для получения такого ценного продукта, как титан, является экономически оправданным. [c.170]Восстанавливают Ti в герметичном стальном реакторе (реторте) в атмосфере аргона или гелия (рис. 82). В реактор заливают расплавленный магний и при 800° сверху подают жидкий Ti li. Температурный интервал, в котором проводится восстановление, невелик нижний предел— температура плавления Mg (714°), верхний предел обусловлен следующим. Титан, взаимодействуя с материалом реторты — железом, образует эвтектический сплав с т. пл. 1085°. При 1085° реактор проплавляется, выше 900° усиливается загрязнение титана железом, которое переносится через газовую фазу хлоридом железа (II), образующимся при взаимодействии Ti l со стенками реторты и расплавленным магнием, растворяющим металлическое железо. При 900° растворимость железа в магнии равна 0,17%. Вследствие экзотермич-ности реакций температура повышается до 1400°. Такая температура допустима только в центральной зоне реактора, у стенок же не должна превышать намного 900°. Поэтому реактор охлаждают воздухом. [c.270]
Нами было установлено, что смеси хлоридов тантала, ниобия, алюминия с четыреххлористым титаном можно нагревать в запаянных стеклянных сосудах до температур плавления чистых хлоридов (200—220°С), растворимость которых изучалась. Более того, при изучении системы Ti U—Fe U установлено, что смеси четыреххлористого титана с хлорным железом можно нагревать несколько выше температуры плавления последнего (303°С). [c.156]
Взаимодействие соединений с четыреххлористым титаном изучалось методом термического анализа. В результате исследования установлено, что соединения NHiTa lg, Nh5Fe l4 и Nh5AI I4 не растворяются в четыреххлористом титане. При нагревании смесей этих соединений с четыреххлористым титаном в запаянных стеклянных сосудах наблюдается расслаивание во всем изученном интервале концентраций. Слой четыреххлористого титана совершенно бесцветен. Температуры плавления соединений и четыреххлористого титана в смеси практически не отличаются от температур плавления чистых исходных хлоридов — на кривых нагревания и охлаждения имеется только по две остановки. [c.172]
chem21.info
- Ворота из профильной трубы

- Компрессор винтовой воздушный

- Воздушный винтовой компрессор

- Классификация сталей

- Распределительный настенный шкаф

- Трансформатор повышающий

- Контроль сварных соединений

- Блок бесперебойного питания для компьютера

- Компрессор из холодильника

- Маркировка сталей

- Повышающий трансформатор









