Температура плавления. Температура плавления кислорода
Кислород температура плавления - Справочник химика 21
Озон. Аллотропическое видоизменение кисло-рода, молекулы которого состоят из трех атомов кислорода (Оз), называется озоном. Озон —/Светло-голубой газ с характерным запахом он тяжелее кислорода в 1,5 раза. Растворимость его в воде гораздо больше, чем кислорода. Температура плавления озона —192 °С, темпера- тура кипения —112°С. В. жидком состоянии озон — темно-синий, в твердом — почти черный. [c.258]
Содержание кислорода Температура плавления Содержание кислорода Температура плавления [c.186]Температуры плавления (—218,9°С) и кипения (—183°С) кислорода очень низкие. Он плохо растворяется в воде (5 объемов О2 в 100 объемах Н2О при 0°С). Жидкий и твердый кислород притягивается магнитом. [c.310]
В табл. 55 дана сравнительная характеристика жидких металлов, воды, дифенильной смеси и расплава солей. Весьма эффективным теплоносителем с точки зрения значений коэффициента теплоотдачи, температуры плавления и кипения, удельной теплоемкости, а также стоимости перекачки является натрий. Недостатком натрия является высокая активность по отношению к кислороду. Он является очень опасным горючим и взрывчатым веществом. [c.329]
В результате полимеризации этилена при температурах 110—120° С и давлении 200—300 ат в присутствии раствора перекиси бензоила в метаноле образуется твердый продукт с температурой плавления 105 — 110° С, молекулярным весом 2000—3000 и содержанием кислорода 0,7-1,3%. Инициирование цепи может быть представлено следующим образом [c.229]
На заводах в качестве сырья для получения синтетических жирных кислот используются твердые парафины с температурой плавления 52—54° С. Окисление парафина осуществляется кислородом воздуха при температуре 105—120° С в присутствии катализатора [74]. В качестве катализатора применяется перманганат калия в количестве 0,2% от веса исходного парафина. Процесс окисления периодический. Единовременная загрузка окислительной колонны — 30 т смеси свежего и возвратного парафина, [c.149]
Температура загорания порошков углеродистых сталей при нагревании в потоке кислорода зависит от содержания углерода в стали и находится ниже температуры плавления данной стали, но выше соответствующей температуры равновесного состояния аустенита. В исследованных сталях сна менялась от 740 до 980° С. Температура в значительной степени зависит также от размеров частиц порошка, понижаясь с их уменьшением. Например, для стали У8 она меняется до 740° С для порошка с зернами размером 0,5 мм и до 940° С для порошка с зернами 3—4 мм. [c.83]
Вещество Формула Т емпература кипения при нормальном давлении, К Температура плавления °К Плотность при 90 К Э / Z Растворимость в жидком кислороде При 90 К. Давление насыщенного пара kh-Im - (мм рт. ст.) при разных температурах, К [c.96]
Вещество Формула Температура кипения при нормальном Температура плавления Плотность при 90 К г/см Растворимость в жидком кислороде при 90 К. Давление насыщенного пара KH M мм рт. ст.) при разных температурах, К [c.98]
Температура плавления некоторых углеводородов ниже температуры кипения жидкого кислорода (пропана — 84° К, пропилена—88° К и т.д.). При превышении пределов растворимости такие вещества находятся в жидком кислороде в виде капель, которые имеют тенденцию [c.101]
Ванадиевая коррозия в процессе эксплуатации и испытаний авиационных ГТД не отмечалась. Это обусловлено низким — не более 10 —10 (масс.)—содержанием ванадия в реактивных топливах. Пентаоксид ванадия имеет температуру плавления 685 °С и с конструкционными материалами образует легкоплавкие соединения. Кроме того, ванадий имеет переменную валентность, что делает его способным переносить кислород из газа к поверхности металла. [c.182]
Следует отметить, что определение температуры плавления с целью предварительной идентификации веществ дает надежные результаты лишь в тех слу чаях, когда вещества плавятся без разложения. Чтобы убедиться в устойчивости соединения при плавлении, ему дают закристаллизоваться и расплавляют еще раз. Если повторное плавление происходит при той же температуре, полученному результату можно доверять. Температура плавления веществ, нестойких при нагревании, не является постоянной величиной. Она в значительной степени зависит от условий определения — скорости нагревания, количества веществ, наличия кислорода воздуха и пр. Практически разложение вещества начинается еще до того, как оно расплавится. Продукты разложения дают депрессию с основным веществом, вследствие чего определяемая температура плавления оказывается ниже истинной. [c.182]
При строгом соблюдении постоянства условий определения можно добиться удовлетворительного воспроизведения результатов. В таких случаях допускается использовать температуру плавления с разложением для характеристики вещества. Следует только иметь в виду, что точность полученных цифр весьма относительна и они справедливы только для выбранных конкретных условий определения. Если разложение обусловлено окислением вещества кислородом воздуха, температуру плавления определяют в атмосфере инертного газа или в вакууме. [c.182]
Печи для сжигания жидких отходов наиболее удобны в эксплуатации и требуют минимальных затрат рабочей силы. Основное требование к исходному сырью для такой печи — вязкость менее 2200 сСт. Иногда вместе с жидкими отходами в печах такого типа сжигают некоторые виды твердых отходов. С этой целью их нагревают до температуры плавления, перекачивают насосом и распыляют в горелках печи. Поскольку жидкие отходы сжигаются в основном в горелках, предназначенных для суспензий, полное и эффективное сгорание достигается в том случае, когда отходы равномерно распределены или распылены и перемешаны с кислородом. Отходы распыляют обычно механическим способом с помощью вращающихся колпачков, либо систем распыления под давлением, либо через газовые форсунки, использующие сжатый воздух или пар высокого давления. Для более равномерного распыления в горелочных соплах вязкость жидких отходов не должна превышать 165 сСт. Для достижения необходимой вязкости отходы нагревают, либо получают из них одно- или двухфазные эмульсии, либо растворяют в жидкости с низким показателем вязкости. Горелку устанавливают на одном конце футерованной огнеупором камеры сгорания, а отходящие газы из противоположного конца камеры выводят в систему очистки. [c.142]
Наряду с термодинамической применяется также международная практическая (стоградусная) температурная шкала. Она определяется посредством ряда реперных точек, расположенных в разных областях температуры (тройная точка воды, температуры плавления серебра, золота, нормальные температуры кипения кислорода, воды, серы и др.). Величина градуса в ней принимается равной /юо интервала температуры между точками плавления льда (0°С) и кипения воды (100° С), причем обе точки определяются при нормальном давлении и для воды нормального изотопного состава. Величина градуса этой шкалы практически совпадает с величиной градуса термодинамической шкалы. [c.214]
Обычными примесями в техническом никеле являются кобальт, железо, кремний, медь. Эти примеси не оказывают вредного влияния, так как образуют с никелем твердые растворы. При содержании углерода свыше 0,4% но границам зерен выделяется графит, что вызывает снижение прочности металла. Сера является вредной примесью, образующей с никелем сульфид N 382, который дает с никелем эвтектику с температурой плавления 625°С. Кислород, присутствующий в металле в виде N 0, при малом его содержании не сказывается на свойствах металла. [c.256]
Известно около 300 видов самых различных восков. По сравнению с жирами воски еще богаче углеродом и водородом (см. стр. 25). Они содержат 80—82% углерода, 13—14% водорода и 4—7% кислорода. Воски характеризуются, как и жиры, температурой плавления, а также кислотным числом, числом омыления и йодным числом. Воски некоторых растений, растущих в странах с более теплым климатом, имеют и техническое значение. Таким является карнаубский воск, который плавится при 83—91 °С, имеет кислотное число 4 до 8, число омыления 79 и 95 и йодное число 10 до 13. [c.29]
Печн производства желтого и красного пигментов. Общие сведения. Свинец образует с кислородом два окисла РЬО п РЬО,. Окись свинца РЬО называется в технике глетом ее молекулярная масса составляет 223,22 она содержит 92,83% РЬ и 7,17% кислорода. Температура плавления окпси свинца 880— 890 С, температура кипения 1470 "С, но уже при 1000 "С РЬО заметно испаряется. Существует РЬО в виде двух энантиотропных модификаций тетрагональной красно-коричневого цвета и ромбической желтого цвета. Переход одной модификации в другую происходит при 489 °С. [c.158]
Когда энергия связи падает с ростом порядкового номера элемента в подгруппе, то температура плавления фаз, имеющих однотипную структуру, уменьшается. И, наоборот, если энергия связи возрастает, температура плавления однотипных фаз увеличивается. С этих позиций, например, в подгруппе кислорода температуру плавления полония и теллура сопоставлять не имеет смысла, так как их структура резко различается. Мы смогли обнаружить, в сущности, лишь два отклонения от указанной связи между Т л и АЯма- Температура плавления бария на 60 К ниже температуры плавления стронция, а стандартная энтальпия бария АЯзэв на 10,1 кДж больше, чем стронция. Но у стронция в отличие от бария при 862 К происходит аллотропное превращение с уменьшением объема на 2,3%. о означает, что вблизи температуры плавления энтальпия образования твердой фазы и энергия связи стронция могут быть выше, чем у бария. То же самое наблюдается для лантана и актиния. Лантан плавится при более высокой температуре, чем актиний, хотя стандартная энтальпия лантана на 26,7 кДж/моль ниже, чем у актиния. У лантана подобно стронцию при 595 С происходит аллотропное превращение с уменьшением объема на 0,5%. Таким образом, отклонение бария и лантана от упомянутой закономерности, по-видимому, кажущееся. [c.281]
Двуокись селена ЗеОг — бесцветные иглообразные кристаллы (пл. 3,954 г/см ). Получается при сгорании селена на воздухе или в кислороде. Можно получить, обезвоживая НгЗеОд. Кристаллизуется в тетрагональной решетке, построенной бесконечными цепочками из чередующихся атомов селена и кислорода, причем каждый атом селена связан еще с одним атомом кислорода. Температура плавления ЗеОг 389°, температура возгонки 337°. Давление пара двуокиси селена [14] [c.96]
Озон представляет собой криогенную жидкость с более высокой степенью криогенности, чем кислород. Температура плавления 22 К (—25ГС), а кипения 161,9 К (—111,Г С). Это жидкость темно-синего цвета, без запаха, очень токсична, обладает значительной плотностью, равной 1,46 г/см при температуре кипения. [c.88]
ТШг образуется при нагревании металлического тория в кислороде. Температура плавления 3150°С. Отличается высокой жаростойкостью. Не разлагается разбавленными минеральными кислотами и щелочами даже при сплавлении. Переводят в раствор нагреванием с концентрированной h3SO4 или сплавлением с KHS04- При растворении тория в концентрированной НС1 без доступа воздуха за счет побочной реакции Th- -+h30=Th0+h3 образуется окисел ThO. Температура плавления 1900°С [c.270]
Полимер Темпе] разложе в азоте затура ния, °С в кислороде Температура плавления, С [c.23]
Получение полиэтилена нри высоком давлении. Полиэтилен впервые был получен при высоком давлении английской фирмой Империал Кемикалс Индастри [59]. Способ получения заключается примерно в том, что этилен при температуре 120—130° и давлении 1000— 20ОО ат полимеризуется в присутствии небольших количеств чистого кислорода. Молекулярный вес полимернзата получается тем больше, чем ниже температура полимеризации. Практически, однако, оптимальной рабочей температурой признана 120—130°, потому что уже при этих условиях температура плавления нолимеризата составляет около 110°. Полимеризация проводится при полном отсутствии растворителя. Содержание кислорода лежит практически в пределах 0,05—0,1%, считая на этилен. Время пребывания этилена в установке составляет 2—6 мин. при 10—15%-ном превращении этилена за один проход через печь. Схема работы при получении полиэтилена представлена на рис. 137. [c.222]
Недавно был разработан новый процесс термокаталитического хлорирования газообразных парафиповых углеводородов, в частности метана, пропусканием углеводорода через расплав хлорной меди (двухвалентной) при температуре около 400°. При этом протекает хлорирование с превращением хлорной меди в полухлористую медь, которая под действием кислорода и хлористого водорода снова регенерируется в хлорную медь. Этот процесс может быть осуществлен в непрерывном варианте. Для снижения температуры плавления хлорной меди к ней добавляют хлористый калий [46]. Этот процесс аналогичен реакции фторирования при помощи трехфтористого кобальта. Применение указанного процесса предотвращает сгорание углеводородного сырья, так как хлорирование проводят в отсутствие кислорода. Благодаря этому значительно упрощаются проведение процесса и дальнейшая переработка продуктов хлорирования [47]. [c.154]
Декаборан (В1дН14) — твердое вещество, плотность — 0,92, температура плавления — 99° С, кипения — 213° С. В твердом виде он вполне стабилен, заметное самопроизвольное разложение его начинается при температуре 170° С. Твердый декаборан при обычной температуре с кислородом не реагирует, но жидкий при температуре 100° С самовоспламеняется на воздухе. Теплота сгорания декаборана (при образовании жидкого борного ангидрида) равна 15 310 ккал/кГ, объемная теплота сгорания его ввиду большой плотности примерно в 1,5 раза выше, чем у пентаборана, и на 65—70% выше, чем у керосина. Вследствие малой летучести декаборан значительно менее опасен в обращении, чем пентаборан. [c.92]
Метилпирролидон — горючая бесцветная жидкость со слабым специфическим запахом относительная плотность по воде 0,28 температура плавления —24°С, кипения 205°С, самовоснламене ния 255 °С, вспышки 85 °С. С воздухом и кислородом пары обра зуют взрывоопасные смеси. Пределы взрываемости смеси с воз духом составляют 2,3—10,2% (об.) пределы воспламенения ниж ний 86 °С, верхний 179 °С. [c.29]
Водород (Нг)—при нормальных условиях газ без цвета, вкуса и запаха. Легко воспламеняется в воздухе и кислороде, горит бледным голубоватым пламенем, плохо растворяется в воде. Смесь водорода с кислородом способна взрываться при содержании в ней от 4,1 до 967о (об.) водорода, а смесь с воздухом— при содержании водорода от 4 до 75% (об.). Температура самовоспламенения— 510°С, температура плавления — 259,2°С, температура кипения — 252,8°С. Молекуля рная масса 2,016, плотность 0,0899 кг/м , плотность по воздуху 0,0695, растворимость в воде незначительная. Ток-сическо го действия на организм человека водород не оказывает и лишь в больших концентрациях может вызвать удушье вследствие уменьшения концентрации кислорода в воздухе. В качестве индивидуальной меры защиты применяют изолирующие противогазы. [c.20]
Сероводород (Н25) — бесцветный газ с запахом тухлых яиц. Молекулярная масса 34,08, плотность 1,54 кг/м при 0°С и 760 мм рт. ст., температура плавления минус 85,6°С, температура кипения минус 59,5°С, плотность по воздуху 1,191, хорошо растворяется в воде. В больших концентрациях сероводород сильный яд, по-ражаюший центральную нервную систему. Содержание 0,7 мг/л сероводорода в воздухе вызывает отравление средней тяжести, 0,2 мг/л — легкое отравление, 0,02 мг/л — воспаление слизистой оболочки глаз (при длительном воздействии). Особая опасность заключается в том, что малые концентрации сероводорода ощутимы по запаху, а при больших концентрациях обоняние притупляется и газ можно ие обнаружить. Действие сероводорода на организм человека выражается в нарушении внутритканевого дыхания, в результате чего перестает усваиваться кислород. В качестве индивидуального средства защиты от действия смеси сероводорода и аммиака применяют противогаз марки КД (серая коро бка). [c.21]
Водородная связь. Еще в XIX веке было замечено, что соединения, в которых атом водорода непосредственно связан с атомами фтора, кислорода и азота, обладают рядом аномальных свойств. Это проявляется, например, в значениях температур плавления и кипения подобных соединений. Обычно в ряду однотипных соединений элементов данной подгруппы температуры плавления и кипения с увеличением атомной массы элемента возрастают, Это объясняется усилением взанмиога притяжения молекул, чтб связано с увеличением размеров атомов и с ростом дисперсионного взаимодействия между ними (см. 48). Так, в ряду H I—НВг—HI температуры плавления равны, соответственно, [c.154]
Окисление, как оказалось, ускоряется в данной операции при замене воздуха кислородом или при употребл1е(нии сжатого воздуха. Грюн и Ульрих обрабаты- вали 100 г парафина (температура плавления 52° С) при 160° в течение 12 часов. 17олучекные ими результаты представлены в верхней таблице на Tp. 83. [c.82]
Типические элементы образуют оксиды, формулы которых можно предсказать на основании положения элементов в периодической таблице например, элементы третьего периода образуют следующие оксиды НагО, МяО, А12О3, ЗЮз, Р2О5 63 и С12О7. Оксиды элементов, находящихся в левой части таблицы, являются сильными основаниями. Для них характерно наличие больщого отрицательного заряда на атомах кислорода, и по типу связи они принадлежат к ионным соединениям. Температуры плавления этих ионных оксидов, как правило, достигают 2000°С, но многие из них разлагаются уже при более низких температурах. Они реагируют с водой с образованием основных растворов [c.321]
Наиболее примечательными свойствами цинка, Zn, кадмия, Сс1, и ртути, Hg, является их слабое сходство с остальными металлами. Все эти металлы мягкие и имеют низкие температуры плавления и кипения. Ртуть-единственный металл, представляющий собой при комнатной температуре жидкость. Цинк и кадмий напоминают по химическим свойствам щелочно-земе льные металлы. Ртуть более инертна и похожа. на Си, А и Аи. Ддя всех трех элементов, 2п, Сс1 и Н , характерно состояние окисления -Ь 2. Ртуть также имеет состояние окисления + 1 в таких соединениях, как Н 2С12. Но ртуть(1) всегда обнаруживается в виде димерного иона причем рентгеноструктурные и магнитные исследования показывают, что два атома Hg связаны друг с другом ковалентной связью. Таким образом, ртуть имеет в Hg2 l2 степень окисления -I- 1 лищь в том же формальном смысле, в каком кислород имеет степень окисления — 1 в пероксиде водорода Н—О О—Н. [c.449]
Г рану лированные ПАА отечественного производства представляют собой водорастворимые гранулы с максимальным размером частиц до 8 мм белого, зеленого или коричневатого цвета с температурой плавления 120 С. Скорость растворения в воде при температуре 40 °С не превышает 48 ч. При этом содержание нерастворимого осадка не превышает 5 %. Реагент выпускают двух сортов. Товарный ПАА сорта А в своем составе содержит не менее 50 % полимера акриламида и не более 38 % сульфата аммония. В реагенте сорта Б содержание полимера должно быть более 45 %, а сульфата аммония менее 40 %. Влажность продукта обоих сортов не более 16—20 %. Реагент практически не обладает химической активностью по отношению к металлам, кислороду воздуха и воде. При измельчении, растворении и движении процессы электризации не проявляются. Гранулированные ПАА — непожаро-, невзрывоопасные и неядовитые вещества. [c.108]
Как уже указывалось, титан способен взаимодействовать с углеродом лишь при высоких температурах. В системе титан — углерод при этих условиях образуются очень твердые сплавы, содержащие карбид титана Т1С — кристаллическое металлоподобное вещество с температурой плавления 3140°С, и ряд твердых растворов. Карбид титана проводит электрический ток, легко сплавляется с металлами и другими карбидами, образуя при этом иногда чрезвычайно твердые тугоплавкие сплавы. При обычной температуре карбид титана довольно инертен, при высоких же температурах ведет себя подобно элементарному титану — реагирует с галогенами, кислородом, серой, азотом, а таклсе с кислотами и солями — окислителями с образованием продуктов, аналогичных получающимся при действии на элементарный титан. Подобные карбиду соединения титан образует с фосфором (фосфиды), кремнием (силиды), бором (бориды). [c.270]
Оксид никеля (II) получается при непосредственном взаимодействии никеля с кислородом (АЯ==— 239,7,, G = --—211,6 кДж/моль), а также при прокаливании гидроксидов и некоторых солей — комплексатов никеля. Этот оксид никеля представляет собой серо-зеленую кристаллическую массу. Температура плавления 1955°С, плотность 7,45 г/см , энтропия 37,99 Дж/(моль-К), в воде нерастворим с кислотами взаимодействует с образованием солей никеля (II). Оксид никеля N 203 — черный кристаллический порошок, очень неустойчив при нагревании выше 300°С разлагается, переходя сначала в N 364, а затем в NiO. [c.316]
Сильновыраженным ненасыщенным характером некоторых смол объясняются те изменения, которые они претерпевают в различных условиях. Так, под влиянием кислорода воздуха ненасыщенные компоненты начинают окисляться, образуя оксисоедине-ния. Благодаря непредельности соединений, входящих в состав смол, они склонны к полимеризации. При этом значительно изменяется их растворимость в органических растворителях и повышается температура плавления. Примером таких нерастворимых и неплавких полимеризатов являются природные ископаемые смолы (янтарь, копал и др.), которые раньше были растворимыми и плавкими. [c.31]
chem21.info
Кислород. Кислород, состав его молекулы, физические свойства
При дальнейшем изучении химии будут рассматриваться свойства некоторых химических элементов. Одним и из важнейших химических элементов является кислород. Кислород является неметаллическим элементом, который входит в состав шестой группы главной подгруппы периодической системы. Однако он обнаруживает постоянную валентность два. Относительная атомная масса кислорода равна шестнадцати.
Название элемента кислород был дан А. Лавуазье, хотя вещество кислород, образованную этим элементом, был открыт несколькими годами ранее. Согласно теории Лавуазье кислород является основным функциональным компонентом кислот, в связи с чем этот элемент получил свое название как «тот, что рождает кислоты».
Кислород является самым распространенным химическим элементом на Земле. Массовая доля кислорода в земной коре составляет 47,2%. Он входит в состав всех важнейших веществ, образующих литосферу: как в состав веществ, образующих породы (красный железняк, кварц, гипс, полевой шпат и другие), так и в состав веществ, которые отвечают за плодородие почв (минеральные соли).
Кислород входит в состав двух простых веществ: кислорода и озона. В атмосфере Земли содержится 23,1% по массе кислорода, что составляет 20,9% по объему. Кислород входит в состав огромного количества сложных веществ: оксидов, кислот, оснований, солей. Распространенной сложной соединением, в состав которой входит кислород, является вода. На Земле есть огромные массы воды в виде морей и океанов, образуют гидросферу Земли. Вместе с растворенными в воде веществами гидросфера содержит примерно 86-89% атомов кислорода по массе. Живые организмы также содержат большое количество кислорода. В составе углеводов, жиров и белков кислород составляет примерно 60% массы тела человека.
Молекула кислорода О2 состоит из двух атомов кислорода. Относительная молекулярная масса о-два равняется тридцать два. Рассмотрим физические свойства кислорода. При стандартных условиях кислород является бесцветным газом, без запаха и вкуса, немного тяжелее воздуха (средняя относительная молекулярная масса воздуха двадцать девять). Кислород мало растворим в воде (в ста объемах воды при температуре двадцать градусов по Цельсию растворяется три целых одна десятая объема кислорода). При температуре -183 ° С газообразный кислород превращается в голубую жидкость проявляет магнитные свойства. Окраска жидкого кислорода обусловлено взаимодействием соседних молекул, и поэтому газообразный кислород не имеет цвета. Магнитные свойства кислорода (жидкий кислород можно привлечь магнитом) используются для определения содержания кислорода в искусственной атмосфере, например, в инкубаторах для выхаживания недоношенных малышей. В таких случаях измеряют магнитные характеристики газовой смеси и по результатам измерений вычисляют концентрацию кислорода. Температура плавления твердого кислорода составляет -218 ° С.
xn----7sbfhivhrke5c.xn--p1ai
Температура плавления кислорода или серы
Наряду с термодинамической применяется также международная практическая (стоградусная) температурная шкала. Она определяется посредством ряда реперных точек, расположенных в разных областях температуры (тройная точка воды, температуры плавления серебра, золота, нормальные температуры кипения кислорода, воды, серы и др.). Величина градуса в ней принимается равной /юо интервала температуры между точками плавления льда (0°С) и кипения воды (100° С), причем обе точки определяются при нормальном давлении и для воды нормального изотопного состава. Величина градуса этой шкалы практически совпадает с величиной градуса термодинамической шкалы. [c.214]
ВОДОРОДНАЯ СВЯЗЬ — соединение посредством атома водорода двух атомов разных молекул или одной молекулы. В. с. возникает между атомами кислорода, азота, фтора, реже—хлора, серы и др. С наличием В. с. связаны такие свойства веществ, как ассоциация молекул и обусловленное ею повы-ш епие температуры плавления и кипения, особенности в колебательных и электронных спектрах, аномалии в растворимости и др. (см. Вода). Благодаря [c.57]
Обычными примесями в техническом никеле являются кобальт, железо, кремний, медь. Эти примеси не оказывают вредного влияния, так как образуют с никелем твердые растворы. При содержании углерода свыше 0,4% но границам зерен выделяется графит, что вызывает снижение прочности металла. Сера является вредной примесью, образующей с никелем сульфид N 382, который дает с никелем эвтектику с температурой плавления 625°С. Кислород, присутствующий в металле в виде N 0, при малом его содержании не сказывается на свойствах металла. [c.256]
Получение чистых металлов из руд очень затруднено вследствие высокой температуры плавления этих металлов и чрезвычайной химической активности при высоких температурах. В этих условиях металлы подгруппы титана легко соединяются с кислородом, галогенами, серой, углеродом, азотом, образуют сплавы почти со всеми металлами. [c.126]
Кальций, легкий щелочноземельный серебристо-белый металл. Плотность кальция при 20°С—1,55-10 кг/м , температура плавления 842°С, температура кипения 1495°С. Это довольно химически активный металл. Он способен воспламеняться в сухом воздухе при 300 °С, в присутствии влаги активно взаимодействует с кислородом воздуха, с хлором и бромом. Кальций энергично вступает в реакции с большинством кислот за исключением концентрированных серной и азотной а при нагревании-— с фтором, серой, водородом, азотом, углеродом, фосфором, сульфидами, оксидами, галогенами. С рядом металлов образует интерметаллические соединения. [c.240]
Отрицательное влияние низкой концентрации кислорода в продуктах сгорания и существования восстановительных зон выражается в следующем. Со снижением концентрации кислорода в продуктах сгорания затягивается процесс окисления соединений серы и могут возникнуть условия, когда сера совместно с газами выносится из топки в виде сульфидных соединений. Следовательно, со снижением концентрации кислорода увеличивается вероятность появления низкоплавких эвтектических смесей FeS-FeO, FeS-Fe и других, что способствует интенсификации загрязнения как экранных, так и конвективных поверхностей нагрева. Общеизвестно, что в востановительной среде из-за образования FeO температура плавления золы ниже, чем в окислительной. Это в свою очередь способствует возникновению связанно-шлаковых отложений. [c.292]
Возможно также, что не менее важное значение имеет увеличение объема атома, соединяющего ароматические ядра бисфенола. Так, Ус (объем, занимаемый атомом углерода) ароматические ядра, так же как и при увеличении объема заместителей у центрального атома углерода, приводит к понижению температуры плавления полимера, если межмолекулярное взаимодействие не возрастает. Для поликарбоната на основе ди (4-оксифенил) амина высокая температура плавления связана с образованием [c.144]
Вследствие того, что строение решетки оказывает сильное конститутивное влияние, аддитивность в температурах плавления отходит на второй план. Введение кислорода почти всегда сопровождается повышением температуры плавления замещение водорода на метильную группу при кислороде, азоте и сере большей частью сопровождается понижением температуры плавления. [c.203]
Если один и тот же элемент может существовать в виде различных простых веществ, то такое явление называется аллотропией. Общеизвестным примером может служить I и лopoд, который образует два простых вещества — обычный, атмосферный кислород Ог и озон Оз. У кристаллических простых веществ аллотропия обычно является частным случаем полиморфизма. Например, сера имеет ромбическую форму, устойчивую до 95,5°, и моноклинную — устойчивую в пределах от 95,5° до точки плавления (120°). Между обеими модификациями серы существует обратимый переход Зромб. Змон.. Каждая из модификаций имеет свою температуру плавления. Так, сера ромбическая плавится при 114°, а моноклинная при 120°. [c.61]
Сероводород (Н25) — бесцветный газ с запахом тухлых яиц. Молекулярная масса 34,08, плотность 1,54 кг/м при 0°С и 760 мм рт. ст., температура плавления минус 85,6°С, температура кипения минус 59,5°С, плотность по воздуху 1,191, хорошо растворяется в воде. В больших концентрациях сероводород сильный яд, по-ражаюший центральную нервную систему. Содержание 0,7 мг/л сероводорода в воздухе вызывает отравление средней тяжести, 0,2 мг/л — легкое отравление, 0,02 мг/л — воспаление слизистой оболочки глаз (при длительном воздействии). Особая опасность заключается в том, что малые концентрации сероводорода ощутимы по запаху, а при больших концентрациях обоняние притупляется и газ можно ие обнаружить. Действие сероводорода на организм человека выражается в нарушении внутритканевого дыхания, в результате чего перестает усваиваться кислород. В качестве индивидуального средства защиты от действия смеси сероводорода и аммиака применяют противогаз марки КД (серая коро бка). [c.21]
Как уже указывалось, титан способен взаимодействовать с углеродом лишь при высоких температурах. В системе титан — углерод при этих условиях образуются очень твердые сплавы, содержащие карбид титана Т1С — кристаллическое металлоподобное вещество с температурой плавления 3140°С, и ряд твердых растворов. Карбид титана проводит электрический ток, легко сплавляется с металлами и другими карбидами, образуя при этом иногда чрезвычайно твердые тугоплавкие сплавы. При обычной температуре карбид титана довольно инертен, при высоких же температурах ведет себя подобно элементарному титану — реагирует с галогенами, кислородом, серой, азотом, а таклсе с кислотами и солями — окислителями с образованием продуктов, аналогичных получающимся при действии на элементарный титан. Подобные карбиду соединения титан образует с фосфором (фосфиды), кремнием (силиды), бором (бориды). [c.270]
В атоме кислорода внещний слой является вторым т ядра, в атоме серы — третьим, в атоме селена — четвертым, в атоме теллура — пятым и в атоме полония — шестым. Вышеуказанные различия между элементами в подгруппе О — 5 — 5е — Те — Ро приводят к закономерному изменению физических и химических свойств их элементов уменьшается сверху вниз сродство к электрону, т. е. понижается окислительная активность нейтральных атомов, растут восстановительные свойства, увеличиваются температуры плавления и кипения. При переходе от кислорода к полонию уменьшаются неметаллические свойства и возрастают металлические. [c.81]
Олово — металл светло-серого цвета с атомной массой 118,7, валентностью 2 и 4, плотностью 7,3 г/сы удельное электросопротивление олова ОД 15 Ом-ым, температура плавления 232 °С. Для олова характерны высокие пластичность и вязкость, твердость оловянных покрытий колеблется от 120 до 200 МПа. Олово устойчиво в воде, не корродирует во влажном воздухе, даже содержащем сернистые соединения В минеральных кислотах скорость коррозии олова в значительной степени зависит от наличия Б растиорах кислорода, который резко увеличивает ее. Примеси с низким перенагряжекием водорода также усиливают коррозию олова. Стандартный электродный потенциал олова —0.14 В по отношению к его двухвалентным нонам и -1-0.01 В н четырехвалентиым. Относительно железа олово электроположительно, поэтому оно не защищает железо от атмосферной коррозии. Электрохимическую защиту от коррозии оловянные покрытия обеспечивают изделиям из медн. Оловянные покрытия — эффективный барьер для серы н азота [22, 31. 37, 44]. [c.83]
Оксид никеля (II) получается при непосредственном взаимодействии никеля с кислородом (АЯ==— 239,7,, G = --—211,6 кДж/моль), а также при прокаливании гидроксидов и некоторых солей — комплексатов никеля. Этот оксид никеля представляет собой серо-зеленую кристаллическую массу. Температура плавления 1955°С, плотность 7,45 г/см , энтропия 37,99 Дж/(моль-К), в воде нерастворим с кислотами взаимодействует с образованием солей никеля (II). Оксид никеля N 203 — черный кристаллический порошок, очень неустойчив при нагревании выше 300°С разлагается, переходя сначала в N 364, а затем в NiO. [c.316]
В отсутствии влаги чистый металл химически стоек, не реагирует с кислородом, серой, галогенами, однако в высокодисперсном состоянии пирофорен. Техническое железо и его спла вы корродируют в атмосфере паров воды, оксида углерода (IV) и кислорода с образованием пористого слоя гидратированного оксида железа (II) ГеО пНаО. Не взаимодействует с щелочами. С углёродом при высоких температурах образует растворимый в металле карбид железа Feg (цементит) с содержанием угле-родаб,67% и температурой плавления 1550°С,атакже два типа твердых растворов. Железо так же образует многочисленные сплавы с другими металлами. [c.39]
Как энергетическая составная часть сырьевых материалов в цветной металлургии сера занимает особое место. Из-за низких температур плавления (112,4°С) и кипения (444,8°С) при отсутствии в газовой фазе окислителей (кислород, углекислота) сера еще при низких температурах начинает плавиться и испаряться, унося с собой, некоторое-количество тепла, которое теряется для зоны тех нологичеокого процесса. [c.163]
Водородная связь. В тех случаях, когда водород соединен с сильно электроотрицательным элементом, он может образовать водородную связь, которая является промежуточной между химической и меж-молекулярной. Эта связь обусловлена тем, что смещение электрона от атома водорода превращает его в частицу, не имеющую электронов, не отталкивающуюся электронами других частиц, т. е. испытывающую только притяжение. Водородная связь проявляется тем сильнее, чем больше электроотрицательность атома-партнера и чем меньше его размеры, поэтому она характерна для соединений фтора и кислорода, в меньшей степени — для азота и еще в меньшей степени — для хлора и серы. Соответственно меняется и энергия водородной связи. Благодаря водородным связям молекулы объединяются в димеры, полимеры и ассоциаты. Ассоциация приводит к повышению температуры плавления и температуры кипения, изменению растворяющей способности и т. д. Водородная связь образуется очень часто, и объясняется это тем, что молекулы воды встречаются повсеместно. Каждая из них, имея в своем составе два атома водорода и две необобществленные электронные пары, может образовать четыре водородные связи. [c.237]
В чистом виде гафний, подобно другим элементам подгруппы титана,— металл, по внешнему виду похожий на сталь. При низкой температуре устойчив. При высокой температуре, наоборот, химически очень активен. Это является общей чертой металлов Ti, 2г и Ш при нагревании они энергично соединяются с галоидами, кислородом, серой, углеродом и азотом. Карбид Н1С очень тугоплавок (/ л 3890°). Карбиды металлов подгруппы титана общей формулы ЭС (Т1С, 2гС и НГС) — очень твердые кристаллы металлического вида, применяются при изготовлении твердых сплавов. Сплав, состоящий нз 80%ДЮ и 20% НГС, отличается высокой тугоплавкостью 4215°). Высокая температура плавления характерна и для двуокиси гафния Н10а (2770°). [c.464]
Нитрат калия KNO3 (минерал калийная селитра)-белые кристаллы, очень горькие на вкус, низкоплавкие (г л = 22g °с). Хорошо растворим в воде (гидролиз отсутствует). При нагревании выше температуры плавления разлагается на нитрит калия KNO2 и кислород О2, проявляет сильные окислительные свойства. Сера и древесный уголь загораются [c.167]
Хорошо изученным соединением переменного состава является и оксид железа РеО. Как и для моносульфида, в оксиде железа (2- -) наблюдается недостаток атомов железа по сравнению со сте. хиометрическим составом. Поэтому формулу оксида железа (2-[-) следует изображать Ре1 0. Нестехиометричность оксида железа в-сторону недостатка железа понятна, если учесть химическую анало-гию кислорода и серы. Для оксида железа (2+) впервые установлен факт повышения температуры плавления с нарушением стехиометрического состава. Так, для Рео.эзО (л = 0,07) т.пл. 1378°С. Рео,910 (л = 0,09) и Рео,8эО (л = 0,11) плавятся соответственно при 1382 и 1387°С. Для координационных кристаллов температура плавления характеризует прочность соединения. Таким образом, до определенного предела устойчивость оксида железа растет вместе со степенью нарушения стехиометрического состава. Кроме того, оксид железа (2-1-) как соединение эквиатомарное (1 атом Ре на 1 атом О) просто не существует, так как область нестехиометрии на самом деле не включает стехиометрический состав. [c.22]
Темно-серое с металлическим блеском вещество. Склонен присоединять кислород, образуя оксикарбиды примерного состава S 2 2O. Растворяет углерод образует твердые растворы с карбидами других металлов. Так, в [22] описано получение сплавов на основе Ti -8 . Сплавы на основе Ti отличаются высокой микротвердостью (5400 кг/мм ), значительно превышающей микротвердость карбида титана (3000 кг/мм ). Такое резкое возрастание твердости фазы на основе Ti — следствие высокой незаполненности -электронной оболочки скандия, являющегося наиболее акцепторноспособным среди переходных металлов. Эти сплавы характеризуются также высокими температурами плавления. [c.13]
В o iais большинства алкалоидов входят углерод, водород, азот II Кислород. Кроме того, некоторые алкалоиды содержат в своем состгше еше и серу (алкалоиды кубышки желтой). Алкалоиды, и состав которых входит кислород, обычно кристаллические веществ . Некоторые алкалоиды не содержат кислорода и представляют собой чаще всего летучие маслянистые жидкости. Большинство алкалоидов оптически активные вещества, без запаха, горького вкуса, с четкой температурой плавления или кипения. [c.131]
СоедЬнения с водородом Простые соединения с водородом НгЭ — ядовитые газы, кроме НгО и НгРо, с неприятным запахом Температуры плавления и кипения повышаются в ряду НгЗ—НгРо (табл 18 1) Термическая устойчивость молекул в ряду НгО—НгРо падает, реакции разложения обратимы Температуры плавления и кипения, плотность воды ле подчиняются общей закономерности изменения этих свойств в ряду Нг5—НгРо Аномальные свойства воды связаны с малым размером молекул НгО и образованием водородных связей между ними Известны высшие водородные соединения для серы — сульфаны (полисульфиды водорода) состава НгЗя ( = = 2 — 9, чаще 2), для кислорода — пероксид водорода НгОг Все сульфаны — желтые маслянистые жидкости, вязкость которых возрастает с увеличением длины гомоцепи —5—5— Они весьма реакционноспособны Сведения об НгОг приведены в гл 19 [c.352]
Восстанавливают ККе04 обычно в два этапа. Сначала ведут процесс при низкой температуре — ниже температуры плавления соли (555°). Поданным [7, с. 37], оптимальная температура первого этапа 480—500°. Восстанавливают в серебряных или никелевых лодочках. Полученный после первого восстановления порошок рения склонен к самовозгоранию, поэтому после выгрузки из печи его сразу высыпают в воду. Порошок тщательно отмывают от щелочи сначала горячей водой, затем разбавленной (1 3) соляной кислотой, снова водой для удаления кислоты и, наконец, спиртом и эфиром. Высушенный порошок подвергают второму, высокотемпературному, восстановлению (при 1000°). Окончательно восстановленный рений обрабатывают концентрированной соляной кислотой для удаления примесей, промывают водой, спиртом, эфиром и высушивают. Получается темно-серый порошок рения (насыпная масса 1,5—1,7 г/см ), содержащий несколько десятых долей процента калия, 0,1—0,2% кислорода, / 0,01% же- [c.312]
Порошкообразный серо-черный германий можно сплавить в слиток в лодочке при температуре - 950—1000 °С. Сплавление лучше всего проводить трубчатой печи в потоке не водорода, а азота (если не требуется высокочистый материал), поскольку при высоких температурах германий взаимодействует с водородом и при охлаждении застывает в виде губчатой массы. Есл присутствие водорода в конечном продукте не мешает, германий можно также сплавить в пеглазурованном фарфоровом тигле с дырчатой крышкой (тигель Розе) в потоке водорода. При применении паяльной горелки необходимо к вдуваемому воздуху добавлять немного кислорода, чтобы достигнуть температуры плавления германия. Часто тигли лопаются в результате расширения германия при затвердевании. Поэтому практичнее пользоваться трубчатыми тиглями (тиглями Таммана), которые незадолго до затвердевания германия наклоняют почти горизонтально. Таким приемом предотвращают очень часто наблюдаемое растрескивание тиглей. Плавление германи можно осуществить также и под слоем хлорида натрия. [c.779]
В кварцевую трубку вдвигают фарфоровую лодочку с металлическим хромом в виде кусочков размером с горошину, а еще лучше в виде порошка. Через трубку пропускают ток сухого, не содержащего кислорода НС1 и одновременно доводят температуру металла до 1150—1200°С. Охлаждение ведут в токе НС1. В результате реакции в лодочке образуется асбестоподобная игольчатая кристаллическая масса белого (при наличии примесей — серого) r Is, которая так переплетена, что это затрудняет ее извлечение из лодочки. Тем не менее препарат следует быстро перенести в наполненную азотом или СОа пробирку и запаять. В противном случае безводный r lj сразу же гидратируется влагой воздуха, после чего он еще и окисляется кислородом. Из-за высокой температуры плавления СгСЬ некоторое количество металла может не прореагировать, будучи покрытым слоем хлорида. [c.1583]
Сильное влияние гибкости цепи на температуры плавления I-блюдается у простых полиэфиров. При замещении группы —СН, в цепи полимера на атом кислорода или серы температура плав ния понижается, несмотря на увеличение энергии когезии. Это более низкие Гпл по сравнению с полиметиленом, что с условлено незначительной величиной потенциального барьера В( щения вокруг направления связей С—О—С и С—5—С, и завис щей от этого повышенной гибкости цепей простых полиэфирбольшом содержании серы превалирующую роль начинг играть энергия когезии, и Тпл повышается. [c.140]
Сьфой уголь измельчается, смешивается с рециркули— руюшим растворителем, получаемым в самом процессе (фракции 200-450°С), и водородом, проходит через трубчатую печь для подогрева и поступает в реактор, где при температуре 430-485°С и давлении от 70 до 200 ат происходит растворение органической массы (растворяется до 90%). После реактора отводится избыточный водород, смесь жидких и твердых веществ поступает на фильтры, где отделяется зола и нерастворившаяся часть органической массы угля. Осадок промывается растворителем и сбрасывается в отвал, а смесь жидких продуктов поступает на вакуумную перегонку, в результате которой отбираются нафта, растворитель для про— мьшки фильтров и рециркулирующий растворитель осадок, представляющий собой твердое вещество с температурой плавления от 150 до 205°С, является целевым продуктом. Из 1 т угля получают 95 л нафты (11% на органическую массу) и 430 л продукта (60,4% на органическую массу). Нафта содержит 0,8% серы, 0,3% азота и 4,1% кислорода продукт -соответственно 0,8 1,8 и 3,7% и менее 0,1% золы. [c.103]
Значения рД для ароматических и алифатических меркаптанов составляет 6—14. При более кислотных меркаптанах, например фенилмеркап-тане, в лмеркаптид аммония [86] однако аммиак легко выделяется при стоянии. Было показано [54], что пиперидин, циклогексиламин и триамиламин образуют соли с фенилмер-каптаном в последующих работах с серией вторичных аминов в п-диокса-не и этаноле были получены соли фенилмеркаптанов с выходом 29—94% [55]. Недавно было показано [104], что образование аммонийных солей алкилмеркаптанов является общей реакцией для ароматических и алкилароматических меркаптанов с первичными, вторичными и третичными алифатическими аминами. Эти соли, образующиеся с выходом 75—95%, имеют отчетливо выраженную температуру плавления. Однако с алифатическими меркаптанами, например 1-октилмеркантаном, алкиламины солей не образуют. Очевидно, это объясняется iмeньшeй кислотностью алифатических меркаптанов но сравнению с ароматическими. С ароматическими меркаптанами комплексы, вероятно, образуются только через водородные связи. Аммонийные соли ароматических меркаптанов нестабильны на воздухе и в углеводородных растворах они легко окисляются молекулярным кислородом до дисульфидов, аминов и воды [104] [c.311]
chem21.info
Кислород (газ) - это... Что такое Кислород (газ)?
| Атомный номер | 8 |
| Внешний вид простого вещества | газ без цвета, вкуса и запахаголубоватая жидкость(при низких температурах) |
| Атомная масса(молярная масса) | 15,9994 а. е. м. (г/моль) |
| Радиус атома | 60 (48) пм |
| Энергия ионизации(первый электрон) | 1313,1 (13,61) кДж/моль (эВ) |
| Электронная конфигурация | [He] 2s² 2p4 |
| Ковалентный радиус | 73 пм |
| Радиус иона | 132 (-2e) пм |
| Электроотрицательность(по Полингу) | 3,44 |
| Электродный потенциал | 0 |
| Степени окисления | -2, −1, 0 ,+1, +2, -½ |
| Плотность | 0,00142897 г/см³ |
| Удельная теплоёмкость | 0,916 (O-O) Дж/(K·моль) |
| Теплопроводность | 0,027 Вт/(м·K) |
| Температура плавления | 54,8 K |
| Теплота плавления | ?? кДж/моль |
| Температура кипения | 90,19 K |
| Теплота испарения | 3,4099 кДж/моль кДж/моль |
| Молярный объём | 14,0 см³/моль |
| Структура решётки | кубическая |
| Период решётки | 6,830 Å |
| Отношение c/a | n/a |
| Температура Дебая | 155 K |
| O | 8 |
| 15,9994 | |
| 2s²2p4 | |
| Кислород | |
Кислород — химический элемент с атомным номером 8, обозначающийся символом О, а также простое вещество (газ при нормальных условиях), молекула которого состоит из двух атомов кислорода (O2). Кислород является самым лёгким элементом из группы халькогенов (6 группа периодической системы).
История открытия
Схема атома кислорода
Основная статья: открытие кислорода
Официально считается, что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
2HgO (t) → 2Hg + O2↑.Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 А. Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771-м) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Петра Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела громадное значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. [Лавуазье провел опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по весу сожженных элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теории флогистона.]
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке обязано М. В. Ломоносову — это калька термина «оксиген» (фр. l'oxygène), предложенного А. Лавуазье (греческое όξύγενναω от ὀξύς — «кислый» и γενναω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим окислы, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе
Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объёму) в воздухе массовая доля кислорода составляет 23,12 % . Элемент кислород входит в состав более 1500 соединений земной коры.
Получение
В настоящее время в промышленности кислород получают из воздуха. В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа. Важнейшим лабораторным способом его получения служит электролиз водных растворов щелочей. Небольшие количества кислорода можно также получать взаимодействием раствора перманганата калия с подкисленным раствором пероксида водорода. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной и азотной технологий.При нагревании перманганат калия KMnO4 разлагается до манганата калия K2MnO4 и диоксида марганца MnO2 с одновременным выделением газообразного кислорода O2:
2KMnO4 → K2MnO4 + MnO2 + O2↑
В лабораторных условиях получают также каталитическим разложением пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода).
Кислород можно также получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + O2↑
Катализатором также выступает MnO2.
Холодная вода содержит больше растворенного O2
Физические свойства
При нормальных условиях кислород это газ без цвета, вкуса и запаха. 1л его весит 1,429 г. Немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100г при 0 °C, 2,09 мл/100г при 50 °C) и спирте (2,78 мл/100г при 25 °C). Хорошо растворяется в расплавленном серебре (22 объема O2 в 1 объеме Ag при 961 °C). Является парамагнетиком.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы: при 2000 °C – 0,03%, при 2600 °C – 1%, 4000 °C – 59%, 6000 °C – 99,5%.
Жидкий кислород (темп. кипения -182,98 °C) это бледно-голубая жидкость.
Твердый кислород (темп. плавления -218,79 °C) – синие кристаллы. Известны 6 кристаллических фаз, из которых 3 существуют при давлении в 1 атм.:
- α-О2 температура ниже -249,35 °C, ярко-синие кристаллы, ромбическая сингония, параметры ячейки a=5,50Å, b=3,82Å, c=3,44Å;
- β-О2 температура от -249,35 до -229,35°C, бледно-синие кристаллы, при повышении давления цвет переходит в розовый, ромбоэдрическая сингония, a=6,19Å, α=99°6΄;
- γ-О2 температура от -229.35 до -218,79°C, бледно-синие кристаллы, кубическая сингония, a=6,83Å;
Еще три фазы образуются при высоких давлениях:
- δ-О2 интервал температур до 300 К и давление 6-10 GPa, оранжевые кристаллы;
- ε-О2 давление от 10 и до 96 GPa, цвет кристаллов от темно красного до черного, моноклинная сингония;
- ζ-О2 давление более 96 GPa, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства
- Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления -2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
4K + O2 = 2K2O
2Sr + O2 = 2SrO
- окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 = 2NO2
- окисляет большинство органических соединений:
Ch4Ch3OH + 3O2 = 2CO2 + 3h3O
- при определенных условиях можно провести «нежное» окисление органического соединения:
Ch4Ch3OH + O2 = Ch4COOH + h3O
- Кислород не окисляет Au и Pt, галогены и инертные газы.
- Кислород образует пероксиды со степенью окисления -1.
- например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 = Na2O2
-
- некоторые окислы поглощают кислород:
2BaO + O2 = 2BaO2
-
- по теории горения, разработанной А. Н. Бахом и Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:
h3 + O2 = h3O2
- Надпероксиды имеют степень окисления -1/2, т.е. один электрон на два атома кислорода (ион O2-). Получают взаимодействием пероксидов с кислородом при повышенных давлениям и температуре:
Na2O2 + O2 = NaO2
- Озониды содержат ион O3- со степенью окисления -1/3. Получают действием озона на гидроксиды щелочных металлов:
КОН(тв.) + О3 = КО3 + КОН + O2
- Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
PtF6 + O2 = O2PtF6
- Фториды кислорода
2F2 + 2NaOH = OF2 + 2NaF + h3O
-
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре -196°С.
- Пропуская тлеющий разряд через смесь фтора с кислородом при определенных давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
- поддерживает процессы дыхания, горения, гниения
- существует в двух аллотропных модификациях:O2 и O3 (Озон)
Применение
Широкое промышленное применение кислорода началось в середине ХХ века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии
Конвертерный способ производства стали связан с применением кислорода.
Сварка и резка металлов
Кислород в баллонах широко используется для газопламенной резки и сварки металлов.
Ракетное топливо
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине
Кислород используется для обогащения дыхательных газовых смесей (аэронетики) при нарушении дыхания, для лечения астмы, в виде кислородных коктейлей, кислородных подушек и т. д.
В пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[1], как пропеллент и упаковочный газ.
Биологическая роль кислорода
Живые существа дышат кислородом воздуха. Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях, для улучшения обменных процессов, в желудок вводят кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьезных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие как синглетный кислород, перекись водорода, супероксид, озон и гидроксильный радикал, являются высокотоксичными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), перекись водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Изотопы
Кислород имеет три устойчивых изотопа: 16О, 17О и 18О, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее легкого из них 16О связано с тем, что ядро атома 16О состоит из 8 протонов и 8 нейтронов. А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Имеются радиоактивные изотопы 11О, 13О, 14О (период полураспада 74 сек), 15О (Т1/2=2,1 мин), 19О (Т1/2=29,4 сек), 20О (противоречивые данные по периоду полураспада от 10 мин до 150 лет).
Интересные факты
- Молекулы кислорода при комнатной температуре движутся со сверхзвуковой средней скоростью, составляющей 480 метров в секунду.[2]
См. также
Ссылки
Растворимость кислорода в водеMathcad Application Server
Примечания
- ↑ http://www.food-info.net/uk/e/e948.htm Food-Info.net : E-numbers : E948 : Oxygen
- ↑ Телепортация: прыжок в невозможное / Дэвид Дарлинг. — Москва: Эксмо, 2008. — 300 с. — (Открытия, которые потрясли мир). — 3100 экз.
Wikimedia Foundation. 2010.
dic.academic.ru
Температура жидкого кислорода
Кислород – бесцветный газ, не имеющий запаха. Он немного тяжелее воздуха: масса 1 л кислорода при нормальных условиях равна 1,43 г, а 1л воздуха – 1,293 г. Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 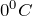 растворяют 4,9, а при
растворяют 4,9, а при 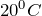 — 3,1 объема кислорода.Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при
— 3,1 объема кислорода.Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 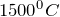 она становится заметной.Температуры плавления и кипения кислорода соответственно равны (
она становится заметной.Температуры плавления и кипения кислорода соответственно равны (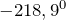 ) и (
) и (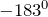 ). Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.Несмотря на низкую при обычном давлении температуру кипения, жидкий кислород можно довольно долго сохранять в сосудах Дьюара (температура жидкого кислорода равна
). Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.Несмотря на низкую при обычном давлении температуру кипения, жидкий кислород можно довольно долго сохранять в сосудах Дьюара (температура жидкого кислорода равна 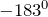 ) – стеклянных сосудах с двойными стенками, из пространства между которыми воздух откачан.Смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами называются оксиликвитами. Они обладают очень сильными взрывчатыми свойствами и применяются при подрывных работах.
) – стеклянных сосудах с двойными стенками, из пространства между которыми воздух откачан.Смеси жидкого кислорода с угольным порошком, древесной мукой или другими горючими веществами называются оксиликвитами. Они обладают очень сильными взрывчатыми свойствами и применяются при подрывных работах.
ru.solverbook.com
| АзотТемпература плавления азота | -210.1 (°C) |
| АктинийТемпература плавления актиния | 1050 (°C) |
| АлюминийТемпература плавления алюминия | 660.32 (°C) |
| АмерицийТемпература плавления америция | 1176 (°C) |
| АргонТемпература плавления аргона | -189.3 (°C) |
| АстатинТемпература плавления астатина | 302 (°C) |
| БарийТемпература плавления бария | 727 (°C) |
| БериллийТемпература плавления бериллия | 1287 (°C) |
| БерклийТемпература плавления берклия | 1050 (°C) |
| БорТемпература плавления бора | 2075 (°C) |
| БромТемпература плавления брома | -7.3 (°C) |
| ВанадийТемпература плавления ванадия | 1910 (°C) |
| ВисмутТемпература плавления висмута | 271.3 (°C) |
| ВодородТемпература плавления водорода | -259.14 (°C) |
| ВольфрамТемпература плавления вольфрама | 3422 (°C) |
| ГадолинийТемпература плавления гадолиния | 1313 (°C) |
| ГаллийТемпература плавления галлия | 29.76 (°C) |
| ГафнийТемпература плавления гафния | 2233 (°C) |
| ГерманийТемпература плавления германия | 938.3 (°C) |
| ГольмийТемпература плавления гольмия | 1474 (°C) |
| ДиспрозийТемпература плавления диспрозия | 1412 (°C) |
| ЕвропийТемпература плавления европия | 822 (°C) |
| ЖелезоТемпература плавления железа | 1538 (°C) |
| ЗолотоТемпература плавления золота | 1064.18 (°C) |
| ИндийТемпература плавления индия | 156.6 (°C) |
| ИридийТемпература плавления иридия | 2466 (°C) |
| ИттербийТемпература плавления иттербия | 819 (°C) |
| ИттрийТемпература плавления иттрия | 1526 (°C) |
| ЙодТемпература плавления йода | 113.7 (°C) |
| КадмийТемпература плавления кадмия | 321.07 (°C) |
| КалийТемпература плавления калия | 63.38 (°C) |
| КалифорнийТемпература плавления калифорния | 900 (°C) |
| КальцийТемпература плавления кальция | 842 (°C) |
| КислородТемпература плавления кислорода | -218.3 (°C) |
| КобальтТемпература плавления кобальта | 1495 (°C) |
| КремнийТемпература плавления кремния | 1414 (°C) |
| КриптонТемпература плавления криптона | -157.36 (°C) |
| КсенонТемпература плавления ксенона | -111.8 (°C) |
| КюрийТемпература плавления кюрия | 1345 (°C) |
| ЛантанТемпература плавления лантана | 920 (°C) |
| ЛитийТемпература плавления лития | 180.54 (°C) |
| ЛоуренсийТемпература плавления лоуренсия | 1627 (°C) |
| ЛютецийТемпература плавления лютеция | 1663 (°C) |
| МагнийТемпература плавления магния | 650 (°C) |
| МарганецТемпература плавления марганца | 1246 (°C) |
| МедьТемпература плавления меди | 1084.62 (°C) |
| МенделевийТемпература плавления менделевия | 827 (°C) |
| МолибденТемпература плавления молибдена | 2623 (°C) |
| МышьякТемпература плавления мышьяка | 817 (°C) |
| НатрийТемпература плавления натрия | 97.72 (°C) |
| НеодимТемпература плавления неодима | 1021 (°C) |
| НеонТемпература плавления неона | -248.59 (°C) |
| НептунийТемпература плавления нептуния | 644 (°C) |
| НикельТемпература плавления никеля | 1455 (°C) |
| НиобийТемпература плавления ниобия | 2477 (°C) |
| НобелийТемпература плавления нобелия | 827 (°C) |
| ОловоТемпература плавления олова | 231.93 (°C) |
| ОсмийТемпература плавления осмия | 3033 (°C) |
| ПалладийТемпература плавления палладия | 1554.9 (°C) |
| ПлатинаТемпература плавления платины | 1768.3 (°C) |
| ПлутонийТемпература плавления плутония | 640 (°C) |
| ПолонийТемпература плавления полония | 254 (°C) |
| ПразеодимТемпература плавления празеодима | 931 (°C) |
| ПрометийТемпература плавления прометия | 1.1×103 (°C) |
| ПротактинийТемпература плавления протактиния | 1572 (°C) |
| РадийТемпература плавления радия | 700 (°C) |
| РадонТемпература плавления радона | -71 (°C) |
| РенийТемпература плавления рения | 3186 (°C) |
| РодийТемпература плавления родия | 1964 (°C) |
| РтутьТемпература плавления ртути | -38.83 (°C) |
| РубидийТемпература плавления рубидия | 39.31 (°C) |
| РутенийТемпература плавления рутения | 2334 (°C) |
| СамарийТемпература плавления самария | 1072 (°C) |
| СвинецТемпература плавления свинца | 327.46 (°C) |
| СеленТемпература плавления селена | 221 (°C) |
| СераТемпература плавления серы | 115.21 (°C) |
| СереброТемпература плавления серебра | 961.78 (°C) |
| СкандийТемпература плавления скандия | 1541 (°C) |
| СтронцийТемпература плавления стронция | 777 (°C) |
| СурьмаТемпература плавления сурьмы | 630.63 (°C) |
| ТаллийТемпература плавления таллия | 304 (°C) |
| ТанталТемпература плавления тантала | 3017 (°C) |
| ТеллурТемпература плавления теллура | 449.51 (°C) |
| ТербийТемпература плавления тербия | 1356 (°C) |
| ТехнецийТемпература плавления технеция | 2157 (°C) |
| ТитанТемпература плавления титана | 1668 (°C) |
| ТорийТемпература плавления тория | 1750 (°C) |
| ТулийТемпература плавления тулия | 1545 (°C) |
| УглеродТемпература плавления углерода | 3550 (°C) |
| УранТемпература плавления урана | 1135 (°C) |
| ФермийТемпература плавления фермия | 1527 (°C) |
| ФосфорТемпература плавления фосфора | 44.2 (°C) |
| ФторТемпература плавления фтора | -219.6 (°C) |
| ХлорТемпература плавления хлора | -101.5 (°C) |
| ХромТемпература плавления хрома | 1907 (°C) |
| ЦезийТемпература плавления цезия | 28.44 (°C) |
| ЦерийТемпература плавления церия | 798 (°C) |
| ЦинкТемпература плавления цинка | 419.53 (°C) |
| ЦирконийТемпература плавления циркония | 1855 (°C) |
| ЭнштейнийТемпература плавления эйнштейния | 860 (°C) |
| ЭрбийТемпература плавления эрбия | 1497 (°C) |
www.fxyz.ru
Кислород теплоты плавления и испарения
Авторами [3] температура плавления трехокиси найдена рав-иой 296,5 К, температура кипения 447 К, теплоты плавления и испарения соответственно 14,3 и 43,6 кДж/моль. В атмосфере сухого разреженного кислорода трехокись фосфора окисляется при 313 К, во влажном кислороде окисление сухой трехокиси наблю далось при 403 К [4]. Отмечалось [1, с. 42], что сухая трехокись в сухом кислороде стабильна до 350—400 К. [c.21]
Критическая температура кислорода равна —118° С, критическое давление 50 атм. Жидкий кислород имеет плотность 1,14 е, см3 (при температуре кипения) и характеризуется теплотой испарений 1,63 ккал/моль. Плотность твердого кислорода (при температуре плавления) равна 1,27 г/см3, а его теплота плавления 0,11 ккал/моль. Для твердого кислорода характерны кристаллы трех различных типов, причем каждый из них устойчив в определенных пределах температур ниже —249° С, от —249° С до —229° С и от —229° С до температуры плавления. Пограничные значения температур между такими областями устойчивости (в данном случае —249° С и —229° С) носят название точек перехода. [c.49]
Величина энергии разрыва связи С—С (а также теплота сгорания г свободного атома углерода) не может быть определена из этих расчетов, всегда сводящихся к двум уравнениям с четырьмя неизвестными. Лишь в том случае, если каким-нибудь независимым способом будет найдена теплота возгонки твердого углерода с образованием одноатомного пара, окажется возможным определить теплоту возгонки алмаза 2у, а тем самым величину у. Правда, алмаз не может испаряться, так как уже начиная с температуры 1000° он превращается в графит. Попытки непосредственного экспериментального определения теплоты испарения графита до сих пор не увенчались успехом вследствие наличия источников различного рода ошибок, ПОЭТОМУ полученные таким путем результаты отличаются малой достоверностью. Фаянс [13] на основании имевшихся к 1920 г. наблюдений установил, что теплота плавления графита составляет 150 ккал это значение он сам считал только приблизительным, указывающим лишь порядок величины. Позднее методом равновесий [14] была найдена величина 130 ккал, а по скорости испарения [15] — 177 ккал. Вследствие возможных ошибок при использовании этих прямых методов было предпринято много попыток вычислить теплоту возгонки углерода косвенным путем при помощи таких экспериментально полученных величин, как теплоты диссоциации углерода и кислорода, работа отрыва атома водорода от СН4 (и других соединений), а также на основе вычисленных из спектроскопических данных теплот диссоциации соединений углерода. В качестве примера такого расчета можно привести вычисление теплоты возгонки углерода из спектроскопически найденной энергии диссоциации окиси углерода с использованием также спектроскопически полученной величины энергии диссоциации кислорода [16] [c.14]
Из остальных частей труда проф. М. П. Славинского сохранились только черновые наброски раздела Физико-химические свойства элементов периодической системы . В результате тщательного ознакомления с этими материалами установлено, что проф. М. П. Славинский в первой части своего труда предполагал описать основные физические и химические свойства, играющие важную роль в процессах приготовления сплавов всех известных элементов периодической системы (плотность, температура плавления и кипения, скрытая теплота испарения и плавления, теплоемкость, теплопроводность, взаимодействие с водородом, кислородом, серой, фосфором, азотом и углеродом). [c.3]
Жидкий к и с л о р о д по энергетическим данным является весьма ценным окислителем, так как все 100% его используются для сгорания. Применение кислорода, естественно, возможно только в жидком виде и основные трудности его использования связаны с хранением и перевозкой. Температура плавления кислорода равна —219° С, а температура кипения —183 °С. Жидкий кислород прозрачен, имеет голубоватый оттенок. Плотность его в жидком состоянии равна 1,14. Скрытая теплота испарения 51 ккал/кг. [c.191]
Критическая температура озона равна —5° С, критическое давление 92 атм. Плавление твердого озона сопровождается заметным уменьшением плотности (от 1,73 до 1,61 г/см1). Плотность жидкого озона при температуре кипения составляет 1,46 г/см3, а теплота испарения равна 2,96 ккал/моль. С жидким кислородом озон смешивается в любых отношениях лишь выше — 180° С (под давлением)1, тогда как ниже этой температуры происходит разделение жидкости на два слоя. [c.52]
Этот принцип, известный под названием принципа Ле Шателье, можно иллюстрировать простыми примерами. Пусть имеем систему вода —пар. Сообщим системе некоторое количество теплоты. Прямым результатом этого будет повышение температуры. Однако в системе усиливается процесс испарения, требующий затраты теплоты. Если бы этот процесс протекал без подвода теплоты извне, он привел бы к охлаждению системы. Система, таким образом, отвечает на внешнее воздействие процессом, который в какой-то мере нейтрализует это воздействие. Тот же результат получим при рассмотрении плавления льда или смещения химического равновесия. В последнем случае нагревание системы усиливает процессы, сопровождающиеся поглощением теплоты, т. е. повышает равновесную концентрацию эндотермических продуктов, а охлаждение, наоборот, благоприятствует повышению концентраций веществ, образующихся с выделением теплоты. Если бы это было иначе и внешнее воздействие вызвало бы в системе ответную реакцию, действующую в том же направлении, то в системе, очевидно, развился бы некоторый процесс. Это не согласуется с предположением о равновесном исходном состоянии. При нагревании смеси водорода и кислорода могут начаться реакции между ними, сопровождающиеся выделением теплоты, за счет которой скорость процесса увеличится. Смесь этих газов, вообще говоря, не находится в равновесии, и принцип в этом случае неприменим. [c.134]
Двуокись теллура образует бесцветные кристаллы, плавящиеся при 733° С, переходя в темно-красную жидкость ДЯ испарения ее 55 ккал/моль, а теплота плавления 3 ккал/моль. Получается двуокись теллура при обезвоживании теллуристой кислоты, при сжигании Те в кислороде и при разложении 2Те0г НЫОз при 400° С. В воде ТеОг хорошо растворяется при 500° С ТеОг окисляет уголь, алюминий, цинк. [c.217]
Теплота плавления сурьмы равна 4,8 ккал г-атом, а теплота испарения 12 ккал г-атом. В отношении аллотропии она похожа на мышьяк. Ее желтая форма может быть получена окислением 5ЬНз озонированным кислородом при —90° С. Она всегда содержит значительную (порядка 10 атомных %) примесь химически связанного водорода. Повышение температуры сопровождается отщеплением ЗЬНз и переходом в черную сурьму (с плотностью 5,3 г/сл , которую можно получить и быстрой конденсацией паров 5Ь. Черная форма уже при слабом нагревании переходит в обычную серую. При электролизе сильно охлажденных концентрированных растворов 5ЬС1з на катоде осаждается похожая на графит аморфная масса (плотность [c.456]
Открыл (1904) правило, выражающее зависимость высоты капиллярного поднятия жидкости при т-ре кипения от молекулярной массы (правило Кистяковского), и вывел ф-лу, связывающую упругость пара в капиллярах с поверхностным натяжением и мол. м. жидкости. Установил соотношения а) между молярной теплотой испарения и объемом пара при т-ре кипения (1916) б) между коэффициентом сжимаемости жидкостей и внутренним давлением (1918) в) между теплотой испарения неассоциированной жидкости и т-рой ее кипения (1922) г) между теплотой плавления и числом атомов в молекуле (1922). Предложил ур-ние для вычисления скрытой теплоты испарения. Разработал оригинальные методы и приборы для изучения электрохимических процессов. Составил и теоретически обос1ювал (1910) таблицу электродных потенциалов и провел исследования в обл. электрохимии различных металлов. Создал (1925) новое направление — коллоидо-электрохимию. Развил представления о процессах коррозии металлов и электрокристаллизации металлов с образованием на их поверхности тонкой защитной пленки, появляющейся в результате электрохимических процессов и непроницаемой для атмосферного кислорода. Исследовал (1929—1939) явления коррозии при полифаз ном контакте (на границе нескольких фаз). Результаты всех этих исследований нашли применение в практике защиты металлов от коррозии, в гальваностегии и при рафинировании металлов. [c.205]
Теплота образования РиОг, вычисленная различными авторами из теплоты сгорания металлического плутония, равна 252,4 1,1 ккал1моль [184, 237]. Найденные значения температуры плавления колеблются около 2240° [237]. Рентгенограммы после плавления были двухфазными вследствие инкогруэнтного (с потерей кислорода) испарения РиОг вблизи точки плавления. Наблюдаемая температура плавления соответствует двухфазной системе РиОг— кубическая РигОз. Поэтому температуру плавления стехиометрической РиОг необходимо определять при равновесном давлении кислорода [237]. Такие данные в литературе не опубликованы. [c.106]
chem21.info












