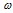Na2CO3 -> CO2 уравнение реакции. Разложение co2
CO2 -> CO уравнение реакции
Оксид углерода (II) из диоксида углерода (CO2 -> CO) можно получить двумя способами. Во-первых, если нагревать углекислый газ до температуры выше 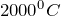 , то он будет разлагаться на монооксид углерода и кислород. Молекулярное уравнение реакции имеет вид:
, то он будет разлагаться на монооксид углерода и кислород. Молекулярное уравнение реакции имеет вид:
![Rendered by QuickLaTeX.com \[2CO_2 \rightarrow 2CO + O_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c9424a66919d074bf0457db1f13e564a_l3.png)
Во-вторых, монооксид углерода является продуктом восстановления углекислого газа углем. Молекулярное уравнение реакции имеет вид:
![Rendered by QuickLaTeX.com \[CO_2 + C \rightarrow 2CO.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-39157828c053c73b409295dac6ea6972_l3.png)
Диоксид углерода (углекислый газ) при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Под давлением диоксид углерода при комнатной температуре превращается в жидкость. А при быстром выливании его из баллона он превращается в твердую белую снегообразную массу.Углекислый газ проявляет кислотные свойства: реагирует со щелочами, гидратом аммиака. Восстанавливается активными металлами, водородом, углеродом.
![Rendered by QuickLaTeX.com \[CO_2 + NaOH_dilute \rightarrow NaHCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d61c4265649d62b0c2c4149f0d25fc74_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + 4H_2 \rightarrow CH_4 + 2H_2O;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1b36791a2bf18480ab1a320fff230308_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + C \rightarrow 2CO.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-39157828c053c73b409295dac6ea6972_l3.png)
В промышленных условиях углекислый газ получают из дымовых газов или в качестве побочного продукта многих химических реакций, например при разложении природных карбонатов – известняка и доломита.
ru.solverbook.com
Na2CO3 -> CO2 уравнение реакции
В результате нагревания карбоната натрия до температуры выше 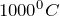 происходит его разложение на углекислый газ и оксид натрия (Na2CO3 -> CO2). Молекулярное уравнение реакции имеет вид:
происходит его разложение на углекислый газ и оксид натрия (Na2CO3 -> CO2). Молекулярное уравнение реакции имеет вид:
![Rendered by QuickLaTeX.com \[Na_2CO_3 \rightarrow Na_2O + CO_2.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7f1ec5f06e9c8a0a204299815bb13a1b_l3.png)
Диоксид углерода (углекислый газ) при обычных условиях представляет собой бесцветный газ, который в 1,5 раза тяжелее воздуха, что позволяет переливать его, как жидкость, из одного сосуда в другой. Растворимость диоксида углерода в воде невелика.Под давлением диоксид углерода при комнатной температуре превращается в жидкость. А при быстром выливании его из баллона он превращается в твердую белую снегообразную массу.Углекислый газ проявляет кислотные свойства: реагирует со щелочами, гидратом аммиака. Восстанавливается активными металлами, водородом, углеродом.
![Rendered by QuickLaTeX.com \[CO_2 + NaOH_dilute \rightarrow NaHCO_3;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d61c4265649d62b0c2c4149f0d25fc74_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + 4H_2 \rightarrow CH_4 + 2H_2O;\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1b36791a2bf18480ab1a320fff230308_l3.png)
![Rendered by QuickLaTeX.com \[CO_2 + C \rightarrow 2CO.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-39157828c053c73b409295dac6ea6972_l3.png)
В промышленных условиях углекислый газ получают из дымовых газов или в качестве побочного продукта многих химических реакций, например при разложении природных карбонатов – известняка и доломита.
ru.solverbook.com
§ 4. Разложение углекислых соединений
Основными видами углекислых соединений — карбонатов, поступающих в доменную печь, являются известняк CaCO3 и доломит CaCO3-MgCO3. При нагреве карбонаты диссоциируют с выделением углекислого газа по реакциям CaCO3=CaO-I-CO2; MgCO3=MgO+CO2. Эти реакции эндотермические, т. е. протекают с поглощением тепла.
Интенсивное разложение известняка в доменной печи протекает при температуре ~ 1000°С. Разложение крупных кусков заканчивается при более высокой температуре. Применение флюсов в доменной печи приводит к повышенному расходу кокса, так как требуется дополнительное тепло на разложение карбонатов. Образующаяся при разложении карбонатов CO2 взаимодействует с углеродом кокса по реакции С02-(-С=2С0, протекающей с поглощением тепла. Эта реакция требует также расхода кокса. Восстановительная способность доменных газов понижается вследствие разбавления их диоксидом углерода CO2. В связи с этим применяют офлюсованный агломерат, при производстве которого происходит основное разложение карбонатов. Так, замена в доменной печи 1 кг известняка позволяет экономить 0,4 кг кокса. При агломерации процесс разложения известняка обеспечивается сжиганием низкосортного топлива — коксика, а не высококачественного металлургического кокса. Известняк или доломит загружают в печь в незначительных количествах для поддержания необходимой основности шлака, т. е. необходимого содержания в шлаке извести.
§ 5. Восстановление оксидов железа
Восстановлением называют процесс отнятия кислорода от оксида и получение из него элемента или оксида с меньшим содержанием кислорода. При этом кислород переходит к веществу, которое окисляется. Такое вещество называется восстановителем. В процессе восстановления одно вещество восстанавливается (теряет кислород), другое окисляется (приобретает кислород). Оба процесса идут параллельно по уравнению: МеО-\-B = =Me-|-ВО, где В — восстановитель, MeO — оксид, Me — восстановленный металл, ВО — оксид восстановителя. Восстановителем может> быть элемент или вещество, обладающее большим сродством к кислороду, чем металл оксида, например углерод или кремний по отношению к железу. Чем большим сродством к кислороду обладает элемент, тем более сильным восстановителем является. В доменной печи восстановителями служат углерод кокса, оксид углерода — СО и водород. Рассмотрим основные процессы, связанные с восстановлением оксидов железа.
По теории академика А. А. Байкова, восстановление оксидов протекает ступенчато: от высших к низшим. При температуре >570 0C восстановление проходит следующие стадии: Fe203->-Fe304->-Fe0->-Fe; при температуре <570 °С: Fe2O3-^Fe3O4-VFe.
Восстановление твердым углеродом называется прямым, а восстановление газами — косвенным. Прямое восстановление состоит из двух стадий: косвенного восстановления и реакции взаимодействия CO2 с углеродом:
Mf?0+C0=A1<?+C02
+
С02+С = 2С0 Mf?0+C=Mf?+C0
Под прямым восстановлением следует понимать не только восстановление оксидов благодаря непосредственному контакту кусков агломерата или руды с кусками кокса, а вообще участие твердого углерода и его расходование на восстановление оксидов.
О) (2) (3)
С развитием реакций прямого восстановления количество углерода, достигающего зоны фурм, уменьшается. Косвенное восстановление оксидов железа оксидом углерода СО при температуре >5700C протекает по следующим реакциям:
3Fe2Os + СО = 2Fe304 + CO2 — 53740 Дж; Fe3O4 + СО = 3FeO + CO2 + 36680 Дж; FeO + СО = Fe + CO2 — 16060 Дж.
Реакции (1) и (3) протекают с выделением тепла, а реакция (2) — с поглощением тепла. При температуре <570 0C имеет место реакция (1) и реакция Fe3O4+ +4C0=3Fe+4C02—11480 Дж, также протекающая с выделением тепла.
Наиболее’легко восстановимым оксидом железа является Fe2O3. При нагреве кусков руды или агломерата до 300—350 0C Fe2O3 восстанавливается до Fe3O4. Поскольку в современном доменном процессе используется агломерат, не содержащий Fe2O3, то реакция (1) в доменной печи практически не имеет места. Магнитный оксид железа также легко восстанавливается в доменной печи. Расчеты показывают, что Fe3O4 должна была бы восстанавливаться газами еще на колошнике печи. Однако процесс восстановления требует времени, поэтому восстановление Fe3O4 продолжается на более низких горизонтах печи, при опускании проплавляемых материалов в зоны с более высокой температурой и более высоким содержанием СО в газе. По лабораторным данным, восстановление химически чистого магнитного железняка в чистом СО начинается при 450 °С. В доменной печи эта температура. должна быть выше, так как СО смешан с CO2 и парциальное давление СО невысокое. Кроме того, реакция (2), по которой протекает восстановление Fe3O4, эндотермич- на. После восстановления магнитного оксида железа начинается восстановление FeO. Этот процесс сопровождается выделением тепла. Образование металлического железа в результате взаимодействия FeO с СО в условиях доменной печи начинается при 750—800 0C или ранее, ¦когда куски руды или агломерата оказываются в нижней части шихты. Но восстановление FeO не успевает завершиться в шахте доменной печи и продолжается в области распара при более высокой температуре. На уровне распара и даже несколько выше его в восстановлении FeO участвует раскаленный кокс. При этом протекают одновременно реакции FeO-I-CO=Fe-I-CO2; CO2+- + С=2С0.
При температуре >900 0C взаимодействие CO2 с углеродом кокса приводит к тому, что весь диоксид углерода, появляющийся в ходе восстановления FeO оксидом углерода СО, реагирует с твердым углеродом и вновь превращается в оксид углерода СО. Поскольку оба процесса идут одновременно, то их можно представить в виде суммарной реакции FeO + C=Fe-|-CO, которую называют реакцией прямого восстановления. Как уже было сказано, для восстановления FeO углеродом не требуется прямого контакта частиц оксидов и кокса. Отнятие кислорода от FeO может совершаться оксидом углерода внутри кусков агломерата, а выделяющийся при этом CO2 будет реагировать затем с коксом вне куска агломерата или РУДЫ.
Восстановление FeO твердым углеродом сопровождается поглощением теплоты. Чем выше температура кусков агломерата и кокса, чем больше тепла к ним подводится, тем активнее будут проходить реакции восстановления. На основании опытных данных можно сказать, что восстановление FeO твердым углеродом, начавшееся на уровне распара, заканчивается в верхней части заплечиков или несколько ниже. К этому моменту материалы нагреваются до 1200—1300 0C. Большую роль в развитии теории доменного процесса сыграли работы академика М. А. Павлова, который впервые установил количественные соотношения между прямым и косвенным восстановлением оксидов железа. Прямым восстановлением в доменной печи получается 20—50 % железа. Прямое восстановление железа углеродом менее желательно, чем косвенное, так как требует большего расхода кокса. Для развития реакций косвенного восстановления необходимо использовать в доменной печи природный газ, повышать равномерность распределения материалов и газов в печи, соответствующим образом подготавливать шихту, в этом случае степень прямого — восстановления может быть снижена до 20—30 %. В восстановлении оксидов железа принимает участие и водород. Водород в доменной печи образуется в результате разложения метана и паров воды, содержащейся в шихте и в дутье. Восстановление оксидов железа водородом протекает при температуре >570 0C по реакциям
TOC \o "1-3" \h \z 3Fe203 + h3 = 2Fe304 + h3O-12890 Дж; (4)
Fe3O4 + h3 = 3FeO + h3O + 77540 Дж; (5)
FeO 4- h3 = Fe + h3O + 24790 Дж; (6)
При температуре <570 0C имеет место реакция
Fe3O4 = 4Н2 = 3Fe + 4Н20 + 149560 Дж. (7)
При этом только реакция (4) является экзотермической, остальные эндотермические. Сравнение восстановительной способности водорода и СО показывает, что до 810 0C сродство к кислороду у водорода слабее, чем у СО, и он обладает меньшей восстановительной способностью, поэтому СО может взаимодействовать с водяным паром, образующимся при восстановлении, и суммарная реакция будет соответствовать уравнению (6):
FeO + h3 = Fe + h3O h3O + СО = h3 + CO2 FeO + СО = Fe + CO2
При температурах >810° оксид углерода имеет меньшее химическое сродство к кислороду, чем водород. Однако взаимодействие водорода с CO2 не получает развития, так как при 900—IOOO0C водяной пар и диоксид углерода активно взаимодействует с углеродом, превращаясь в водород и оксид углерода. Водород в доменной печи принимает активное участие в восстановлении, являясь промежуточным реагентом или переносчиком кислорода от оксидов железа к оксиду углерода СО или к углероду. Содержание водорода в газе в начале и в конце процесса может и не изменяться.
К моменту завершения восстановления оксидов железа вещество агломерата находится еще в твердом виде. Оно становится все более пористым и ноздреватым, содержит уже значительное количество металла и принимает форму губки. Железо, содержащееся в губчатом продукте восстановения агломерата, еще не успело сплавиться с углеродом, марганцем, кремнием, серой и фосфором. Его зерна еще тесно перемешаны с частицами пустой породы, не претерпевшими химических и физических превращений. Поскольку температура плавления ¦чистого железа 1540 °С, то после своего образования металлическое железо остается твердым и продолжает продвигаться с шихтой в нижнюю часть доменной печи— в зону более высоких температур. Степень восстановления железа достигает 99 %. Лишь 1 % железа переходит в шлак.
mitalolom.ru