Плотность углекислого газа. Плотность углекислого газа
Плотность углекислого газа (CO2), значение и примеры
Плотность углекислого газа и другие его физические свойства
Он плохо растворяется в воде, частично реагируя с ней.
Основные константы углекислого газа приведены в таблице ниже.
Таблица 1. Физические свойства и плотность углекислого газа.
|
Плотность, кг/м3 |
1,9768 |
|
Удельная теплота плавления, кДж/моль |
25,13 |
|
Динамическая вязкость, Па×с |
8,5×10-5 |
|
Молярная масса, г/моль |
44,01 |
Углекислый газ играет важную роль в биологических (фотосинтез), природных (парниковый эффект) и геохимических (растворение в океанах и образование карбонатов) процессах. В больших количествах он поступает в окружающую среду в результате сжигания органического топлива, гниения отходов и др.
Химический состав и строение молекулы углекислого газа
Химический состав молекулы углекислого газа выражается эмпирической формулой CO2. Молекула диоксида углерода (рис. 1) линейная, что соответствует минимальному отталкиванию связывающих электронных пар, длина связи С=Щ равна 0,116 нм, а её средняя энергия – 806 кДж/моль. В рамках метода валентных связей две σ-связи С-О образованы sp-гибридизованнойорбиталью атома углерода и 2pz – орбиталями атомов кислорода. Не участвующие в sp-гибридизации 2px— и 2py-орбитали атома углерода перекрываются с аналогичными орбиталями атомов кислорода. При этом образуются две π-орбитали, расположенные во взаимно перпендикулярных плоскостях.
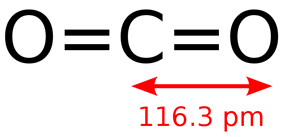
Рис. 1. Строение молекулы углекислого газа.
Благодаря симметричному расположению атомов кислорода молекула CO2 неполярная, поэтому диоксид мало растворим в воде (один объем CO2 в одном объеме h3O при 1 атм и 15oС). Неполярность молекулы приводит к слабым межмолекулярным взаимодействия и низкой температуре тройной точки: t = -57,2oС и P = 5,2 атм.
Краткое описание химических свойств и плотность углекислого газа
Химически углекислый газ инертен, что обусловлено высокой энергией связей O=C=O. С сильными восстановителями при высоких температурах диоксид углерода проявляет окислительные свойства. Углем он восстанавливается до угарного газа CO:
C + CO2 = 2CO (t = 1000oC).
Магний, зажженный на воздухе, продолжает гореть и в атмосфре углекислого газа:
CO2 + 2Mg = 2MgO + C.
Оксид углерода (IV) частично реагирует с водой:
CO2(l) + h3O = CO2×h3O(l) ↔ h3CO3(l).
Проявляет кислотные свойства:
CO2 + NaOHdilute = NaHCO2;
CO2 + 2NaOHconc = Na2CO3 + h3O;
CO2 + Ba(OH)2 = BaCO3↓ + h3O;
CO2 + BaCO3(s) + h3O = Ba(HCO3)2(l).
При нагревании до температуры свыше 2000oС углекислый раз разлагается:
2CO2 = 2CO + O2.
Примеры решения задач
Химические и физические свойства углекислого газа.
Углекислый газ (двуокись углерода), называемый также углекислотой, - важнейший компонент в составе газированных напитков. Он обусловливает вкус и биологическую стойкость напитков, сообщает им игристость и освежающие свойства.
Химические свойства. В химическом отношении углекислый газ инертен. Образовавшись с выделением большого количества тепла, он, как продукт полного окисления углерода, весьма стоек. Реакции восстановления двуокиси углерода протекают только при высоких температурах. Так, например, взаимодействуя с калием при 230° С, углекислый газ восстанавливается до щавелевой кислоты:

Вступая в химическое взаимодействие с водой, газ, в количестве не более 1% от содержания его в растворе, образует угольную кислоту, диссоциирующую на ионы Н+, НСО3-, СО23-. В водном растворе углекислый газ легко вступает в химические реакции, образуя различные углекислые соли. Поэтому водный раствор углекислого газа обладает большой агрессивностью по отношению к металлам, а также разрушающе действует на бетон.
Физические свойства. Для сатурации напитков используется углекислый газ, приведенный в жидкое состояние сжатием до высокого давления. В зависимости от температуры и давления углекислый газ может находиться также в газообразном и твердом состоянии. Температура и давление, соответствующие данному агрегатному состоянию, приведены на диаграмме фазового равновесия (рис. 13).

Рис. 13. Диаграмма фазового равновесия углекислого газа.
При температуре минус 56,6° С и давлении 0,52 Мн/м2 (5,28 кГ/см2), соответствующих тройной точке, углекислый газ может одновременно находиться в газообразном, жидком и твердом состоянии. При более высоких температуре и давлении углекислый газ находится в жидком и газообразном состоянии; при температуре и давлении, которые ниже этих показателей, газ, непосредственно минуя жидкую фазу, переходит в газообразное состояние (сублимирует). При температуре, превышающей критическую температуру 31,5° С, никакое давление не может удержать углекислый газ в виде жидкости.
В газообразном состоянии углекислый газ бесцветен, не имеет запаха и обладает слабовыраженным кислым вкусом. При температуре 0° С и атмосферном давлении плотность углекислого газа составляет 1,9769 кг/ж3; он в 1,529 раз тяжелее воздуха. При 0°С и атмосферном давлении 1 кг газа занимает объем 506 л. Связь между объемом, температурой и давлением углекислого газа выражается уравнением:

где V - объем 1 кг газа в м3/кг; Т - температура газа в ° К; Р - давление газа в н/м2; R - газовая постоянная; А - дополнительная величина, учитывающая отклонение от уравнения состояния идеального газа;

Ожиженный углекислый газ - бесцветная, прозрачная, легкоподвижная жидкость, напоминающая по внешнему виду спирт или эфир. Плотность жидкости при 0° С равна 0,947. При температуре 20°С ожиженный газ сохраняется под давлением 6,37 Мн/м2 (65 кГ/см2) в стальных баллонах. При свободном истечении из баллона жидкость испаряется с поглощением большого количества тепла. При снижении температуры до минус 78,5° С часть жидкости замерзает, превращаясь в так называемый сухой лед. По твердости сухой лед близок к мелу и имеет матово-белый цвет. Сухой лед испаряется медленнее жидкости, при этом он непосредственно переходит в газообразное состояние.
При температуре минус 78,9° С и давлении 1 кГ/см2 (9,8 Мн/м2) теплота сублимации сухого льда составляет 136,89 ккал/кг (573,57 кдж/кг).
www.comodity.ru
Физические и химические свойства углекислого газа: формула,плотность
Применение углекислого газа в сварочной области является очень распространенной. Это один из основных вариантов, которые применяются для различных видов соединения металла. Физические свойства углекислого газа определяют его как универсальную субстанцию для газовой сварки, соединения газовой и электродуговой и так далее. Это относительно недорогое сырье, которое используется здесь на протяжении многих лет. Есть более эффективные варианты, но именно углекислота применяется чаще всего. Она находит применение как для обучения, так и для выполнения самых простых процедур.
Углекислота еще носит название диоксид углерода. Вещество не обладает запахом и бесцветно в обыкновенном состоянии. При нормальном атмосферном давлении, углекислота не состоит в жидком состоянии и из твердого сразу переходит в газообразное.
Область применения углекислого газа 
Химическое вещество используется не только для сварки. Физические свойства углекислого газа позволяют применять его как разрыхлитель или консервант в пищевой промышленности. Во многих системах пожаротушения, в частности в ручных огнетушителях. Его применяют для обеспечения питания аквариумных растений. Практически все газированные напитки содержат углекислый газ.
В сварочной сфере применение чистой углекислоты является не совсем безопасным для металла. Дело в том, что при воздействии высокой температуры он распадается и из него выделяется кислород. В свою очередь, кислород является опасным для сварочной ванны и чтобы ликвидировать его негативное воздействие, применяют разнообразные раскислители, такие как кремний и марганец.
Применение углекислоты встречается еще и в баллонах для пневматических пистолетов и винтовок. Как и в сварочных баллонах, углекислота здесь хранится в сжиженном состоянии под давлением.

Баллон с углекислотой для сварки
Химическая формула 
Химические свойства углекислого газа, а также его другие характеристики, напрямую зависят от элементов, которые входят в состав формулы. Формула углекислого газа в химии имеет вид CO2. Это означает, что углекислота содержит в себе один атом углерода и два атома кислорода.
Химические и физические свойства 
Рассмотрев, как обозначается химических газ в химии, стоит более внимательно рассмотреть его свойства. Физические свойства углекислого газа проявляются в различных параметрах. Плотность углекислого газа при стандартных атмосферных условиях составляет 1,98 кг/м3. Это делает его в 1,5 раза тяжелее, чем воздух в атмосфере. Диоксид углерода не имеет запаха и цвета. Если его подвергнуть сильному охлаждению, то он начинает кристаллизоваться в так называемый «сухой лед». Температура сублимации достигает -78 градусов Цельсия.
Химические свойства углекислого газа определяют его к кислотным оксидам, так как он может образовывать угольную кислоту, когда его растворяют в воде. При взаимодействии с щелочами, вещество начинает образовывать гидрокарбонаты и карбонаты. С некоторыми веществами, такими как фенол, диоксид углерода вступает в реакцию электрофильного замещения. С магнийорганическими вещество вступает в реакцию нуклеофильного присоединения. Использование углекислоты в огнетушителях обусловлено тем, что она не поддерживает процесс горения. Использование в сварке обусловлено тем, что в веществе горят некоторые активные металлы.
Преимущества 
- Использование углекислого газа является относительно недорогим, так как цена на данное вещество достаточно низкая, если сравнивать с другими газами;
- Это очень распространенное вещество, найти которое можно во многих местах;
- Углекислый газ удобен в хранении и не требует сверхсложных мер безопасности;
- Газ хорошо справляется с теми обязанностями, для которых он предназначается.
Недостатки 
- Во время использования на металле могут образовываться оксиды, которые выделяет вещество во время нагревания;
- Для нормальной работы нужно использовать дополнительные расходные материалы, которые бы помогли ликвидировать негативное воздействие оксидов;
- Существуют более эффективные газы, применяемые в сварочной сфере.
Применение углекислого газа при сварке 
Данное вещество применяется в области сваривания металлических изделий в качестве защитного газа. Он применяется как для автоматических, так и для полуавтоматических сварочных аппаратов. Зачастую его используют не в чистом виде а вместе с аргоном или кислородом в газовой смеси. В производственной сфере существует несколько вариантов снабжения постов. Среди них выделяют следующие методы:
- Поставка из баллона. Это очень удобно, когда речь идет об относительно небольших объемах вещества. Это обеспечивает мобильность, так как не всегда имеется возможность создать трубопровод к посту.
- Транспортная емкость для углекислоты. Это также отличный вариант для потребления вещества в небольших баллонах. Она обеспечивает поставку большего количества газа, чем в баллонах, но менее удобна в транспортировке.
- Стационарный сосуд накопитель. Он применяется для тех, кто использует углекислоту в больших объемах. Их используют при отсутствии на предприятии автономной станции.
- Автономная станция. Это наиболее широкий по объему метод поставки, так как может обслуживать пост практически для любых процедур, вне зависимости от объемов. Таким образом, пост получает вещество непосредственно с места его производства.
Автономная станция представляет собой специальный цех на предприятии, где получают диоксид углерода. Он может работать как исключительно для собственных нужд, так и на поставку другим цехам и организациям. Для обеспечения рабочих точек предприятия, газ поставляет по трубопроводам. В то время, когда на предприятии имеется необходимость в запасании углекислоты, ее перемещают в специальные накопители.
Меры безопасности
Хранение и использование вещества является относительно безопасным. Но для того, чтобы исключить вероятности несчастных случаев, следует придерживаться основных правил:
- Несмотря на то, что углекислота не отличается взрывоопасностью и токсичностью, если ее концентрация будет выше 5%, то человек будет чувствовать удушье и кислородную недостаточность. Не следует допускать утечки и хранения всего в закрытом не проветриваемом помещении.
- Если понизить давление, то жидкая углекислота превращается в газообразное состояние. В это время ее температура может составлять -78 градусов Цельсия. Это вредно для слизистых оболочек организма. Также это приводит к обморожению кожи
- Осмотр больших емкостей для хранения углекислоты следует проводить с использованием шлангового противогаза. Цистерна должна быть отогрета до температуры окружающей среды и быть хорошо проветренной.
Заключение
Физические свойства являются не единственным показателем, по которому подбирается газ для сварки. Совокупность всех параметров обеспечивает данному веществу уверенные позиции на современном рынке расходных материалов. Среди самых простых процедур это незаменимый газ, с которым сталкивался практически каждый профессиональный и начинающий сварщик.
svarkaipayka.ru
Углекислый газ - это... Что такое Углекислый газ?
| Другие названия | углекислый газ, углекислота,сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.;771 кг/м³, жидкий;1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | 0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Оксиды | COC3O2C2OCO3 |
| Если не указано иное, данные даны дляматериалов при стандартных условиях (25 °C, 100 кПа)Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин.Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
biograf.academic.ru
Углекислота плотность - Справочник химика 21
Найдем массовые и объемные расходы фаз. Плотность жидкой фазы ввиду малого содержания углекислоты можно принять постоянной, равной плотности воды, которая при 25 °С составляет 997 кг/м . Ввиду того, что коэффициент сжимаемости водорода — основного компонента газовой смеси — при давлении 2 МПа мало отличается от единицы, будем считать допустимым использование законов идеальных газов для расчета плотности. Тогда [c.49]
Углеводородный газ газовых месторождений состоит главным образом из метана с примесью этана, пропана, бутана, углекислоты и азота. Плотность этого газа составляет примерно 0,60—0,65. Плотность метана равна 0,55 по отношению к воздуху, плотность этана — около 1, пропана — 1,5, бутана — 2, углекислого газа — 1,5. Большей плотностью обладает нефтяной попутный газ, в котором содержание этана и других более тяжелых углеводородов часто бывает значительным, составляя 10—20% и более. Значительная часть добычи газа приходится на газовые месторождения, и среднюю величину его плотности, имея в виду как газовые месторождения, так и попутный газ, можно принять за 0,65. Отсюда следует, что 1 добываемого газа весит в среднем около 0,84 кг. Таким образом, вес 1,1 трлн. газа, добытого на земном шаре в 1967 г., составляет около 920 млн. т, и количество этого газа составляет по весу около половины от количества добытой нефти. [c.161]
Окись магния представляет собой белый рыхлый аморфный порошок с плотностью 3,2—3,7 При хранении на воздухе окись магния поглощает значительное количество влаги, взаимодействует с углекислотой с образованием углекислой соли, которая является инертным наполнителем. Окись магния применяется в [c.134]
Углекислота Плотность по воздуху Теплота сгорания, ккал/м, низшая [c.196]
Исследованиями установлено, что больше всего газа образуется при сбраживании жироподобных веществ, меньше всего — при распаде белковоподобных. Количественная оценка по выходу газа получена из следующих соображений. При сбраживании, например, жироподобных соединений ж выделяется 1250 мл газов с 1 г распавшихся веществ. В составе газов находится 68% метана и 32% углекислоты. Плотность газа указанного состава составляет 1,05 г/л. Следовательно, при распаде [c.136]
Углекислота — это бесцветный газ с едва ощутимым запахом. Плотность ее по отношению к воздуху при 0° и 760 мм рт. ст. составляет 1,524, т. е. углекислый газ почти в 1,5 раза тяжелее воздуха. Благодаря этому углекислый газ может вытеснять воздух из различных сосудов большой и малой емкости, заполняя их до краев. 1 м углекислого газа при нормальных условиях весит 1,97 кг. Давление, при котором углекислый газ превращается в жидкость, зависит от температуры и составляет при 5 " 35 атм, при 10° 44 атм, при 15° 52 атм и при 20° 56 атм. Критическое давление углекислоты равно 72,9 атм и критическая температура 31,3°. [c.394]
Атмосфера земли содержит азот и кислород с примесью других газов (Аг, СО2 и др.). Спектральные исследования атмосферы Венеры показали, что в ней много углекислого газа. В октябре 1967 г. это было подтверждено советской ракетной лабораторией Венера-4. Содержание углекислого газа оказалось около 90%. Метан не был обнаружен. Атмосфера Марса очень разрежена — ее плотность во много раз меньше плотности земной. В этой весьма разреженной атмосфере Марса установлено присутствие углекислоты. [c.78]
Баллоны для хранения жидкой двуокиси, углерода должны иметь черную окраску и желтую надпись Углекислота . При критической температуре двуокиси углерода (31 °С) она сжижается под давлением 73 ат. Плотность жидкой СОз равна 1,19 при —60 °С, 0,77 при 20 °С и 0,47 г/см при 31 °С. Интересно, что она почти не растворяет воду (растворимость менее 0,1 вес.%). Для твердой СОа известны две модификации, из которых строение обычной показано на рис. Х-13. Образующаяся прн высоких давлениях модификация способна, существовать и выше критической температуры (ср. IV 3 доп. 40). Под давлением 35 тыс. ат твердая СОз становится хорошим проводником электрического тока (причем по мере повышения температуры электропроводность ее возрастает). Обычная форма твердой СОз под давлением 5 ат плавится прц —57°С. Теплота ее возгонки составляет 6 ккал/моль. [c.507]
Через 1 дм" пленки полиэтилена плотностью 0,96, толщиной 0,025 лш при 20—25° нри 1 см рт. ст. перепада давления кислорода, азота и углекислоты за 24 часа проходит соответственно 10,6, 2,7 и 35 мл газа. [c.767]
Кровь представляет собой вязкую непрозрачную жидкость красного цвета со слабощелочной реакцией (pH 7,36) и удельной плотностью 1,050—1,0б0. Основная функция этой ткани — транспортная постоянно циркулируя в артериях, венах и капиллярах тела, кровь разносит в органы и ткани кислород и питательные вещества и освобождает их от углекислоты и конечных продуктов распада. Кровь выполняет также важную функцию защиты организма от возбудителей инфекций и их токсинов благодаря лейкоцитам и антителам. Кроме того, кровь имеет свертывающую систему, биологическое значение которой состоит в защите организма от потери крови при повреждении сосуда. [c.186]
Естественная тяга. К числу наиболее широко распространенных методов перемещения газов относится естественная тяга при помощи дымовой трубы. Движущая сила газового потока при естественной тяге определяется исключительно разностью плотностей газа в начальном и конечном пунктах газохода. Любой легкий газ, как, например, водород, находясь в вертикальной трубе, создает движущую силу, направленную снизу вверх, и, наоборот, любой тяжелый газ, как, например, углекислота, создает движущую силу, направленную сверху вниз. [c.159]
В процессе брожения гомогенная смесь изменяет свою плотность в результате накопления газов, выделяющихся вследствие жизнедеятельности микроорганизмов. Г азообразные продукты (углекислота, спирт, молочная кислота и др.) придают тесту специфические вкус и запах. [c.1073]
При анализе коксового газа, идущего на отопление коксовых печей, определяют теплоту сгорания, плотность газа и содержание в нем углекислоты, сероводорода, углеводородов, кислорода, окиси углерода, водорода, метана и азота. [c.123]
Определяют плотность, летучий аммиак, общий аммиак, сероводород, углекислоту. [c.242]
Увеличение плотности концентрированной аммиачной воды вызывается наличием в ней сероводорода и углекислоты. [c.245]
Дальнейшее увеличение плотности от до d (плотность исследуемой воды) вызывается тем, что в воде растворено еще х г/л углекислоты. [c.245]
Увеличение плотности за счет углекислоты равно d—d - [c.245]
Закись кобальта может быть получена восстановлением окиси при невысоких температурах (до 350Р) в водороде или нагреванием в слабых восстановителях, например, газообразно аммиаке. Это же соединение можно получить, разлагая углекислый кобальт или окись кобальта нагреванием до красного каления в атмосфере азота или углекислоты. Плотность закиси кобальта равна 5,68 г/см при получении разложением высших окислов и 6.7 г/см , когда ее приготовляют прокаливанием сернокислого кобальта при температуре 1250—1300°. Закись кобальта восстанавливается водородом до металлического кобальта при нагревании выше 250° и окисью углерода при нагревании выше 450°. [c.606]
В период монтажа наиболее технологичным способом защиты внутренних поверхностей оборудования из перлитных сталей зарекомендовал себя так называемый мокрый способ хранения с использованием водного раствора гидразина и аммиака с концентрацией 600—100 мг/л канГидразин-гидрат (М2Н4-Н20) — бесцветная жидкость, легко поглощающая из воздуха воду, углекислоту и кислород. Гидразин-гидрат хорошо растворим в воде. Температура кипения его 118° С, температура замерзания—51,7° С, относительная молекулярная масса—50, плотность—1,03г/см , теплота парообразования 125 ккал/кг, теплоемкость 0,05 ккал/(кг-° С), температура вспышки 73° С. Водные растворы его не огнеопасны, они легко разлагаются кислородом воздуха. Чтобы предотвратить разложение гидразина, его растворы хранят в атмосфере азота. Приготовленный водный раствор гидразина н аммиака заливается в емкости так, чтобы не оставалось воздушных мешков. [c.194]
Ж- Л. Гей-Люссак и Л. Ж. Тенар в 1810 г. усовершенствовали метод сжигания, разработанный Лавуазье, используя в качестве средства для сжигания бертоллетову соль. Они вносили последнюю в виде маленьких шариков вместе с исследуемым веществом в вертикальную раскаленную трубку и определяли объем оставшегося после сжигания свободного кислорода и образовавшейся углекислоты, плотность и процентный состав которой они незадолго перед этим установили. [c.23]
Плотность твердой углекислоты 1,65 г/см . В регенераторе откладывается рыхлая углекислота, плотность которой неизвестна. Снег Н О примерно в 20 раз легч льда, но в нашем случае сравнивать можно скорее с инеем, чем со льдом, поэтому можно принять плотность рыхлой углекислоты в 15 раз меньшей плотности твердой. Следовательно, продолжительность работы до остановки на размораживание будет [c.242]
Объемный эффект. Связан с заметным ростом объема нефти при смешивании ее с углекислотой. Увеличение объема нефти при растворении в ней СО2 способствует более эффективному первичному вытеснению, а также доотмыву остаточной нефти. Хотя точное вычисление прироста нефтеотдачи невозможно, эффект растет с ростом количества растворенного в нефти СО2. Объемный эффект будет сказываться при большой кратности объемов фильтруемой через зоны остаточной нефти углекислого газа в чистом виде или растворенном в воде состоянии. Величина прироста нефтеотдачи зависит от степени растворимости углекислого газа в водной и углеводородной среде. Одновременно с ростом объема раствора углекислоты в нефти происходит его уплотнение, что объясняется снижением суммарного объема составляющих (нефти и СО2) при их взаимном растворении. Это увеличение плотности также способствует более равномерному вытеснению нефти вследствие уменьшения разности плотностей нефти и воды. [c.150]
Для дальнейших определений собирают прибор, как показано на рис. XXIV. 19. В коническую колбу 1 вводят 100 мл насыщенного раствора двухромовокислого калия в 70%-ной серной кислоте, а в колбу 2 вводят 100 мл. насыщенного раствора серв окислого серебра. Затем заполняют U-образную трубку 3 — натронной известью аппарат Гейслера 4 — концентрированной серной кислотой с плотностью 1,84 U-образную трубку 5 — хлористым кальцием U-образную трубку 6 — натронной известью. Весь прибор линией 7 соединяют с водоструйным насосом через трубку 6. Для очистки прибора от углекислоты через прибор до начала опыта проса- [c.742]
По А. Н. Несмеянову и И. Ф. Луценко, углекислота реагирует с неио-ннзнрованным фенолятом натрня и карбоксильная группа вступает по месту повышенной плотности электронного облака, обусловленной гиперкоиъю-(ацней о-связи (о-сопряженис) по схеме [c.168]
Удельная электропроводимость Н-катионированной пробы питательной воды на отечественных блоках 300 МВт в настоящее время находится на уровне 0,17— 0,30 мкСм/см. При достигнутой на ряде электростанций (Троицкая, Конаковская ГРЭС) плотности тракта ПНД и налаженной работе деаэраторов содержание углекислоты в питательной воде всегда ниже, чем в обессоленном конденсате, и составляет не более 50 мкг/кг. Случаи превышения содержания углекислоты в питательной воде над ее концентрацией в обессоленном конденсате турбины следует рассматривать как нарушение режима эксплуатации блока. К ним следует отнести, например, сброс конденсата дробеочистки в деаэратор, подвод конденсата дренажных баков в деаэратор и т. п. [c.120]
Вещественный состав классов крупности измельченных сланцев исследован путем определения зольности Л и содержания углекислоты карбонатов (С02) к в ситовых фракциях дробленых и размолотых сланцев. На основе Л и (С02) к определялись соотношение Т//С,. теплота сгорания (2-23) и платность. Соотнршение Т/К V. плотность, г/см, были рассчитаны по формулам [c.36]
Наиболее хорошо изучена планета Марс. На небе ее можно видеть в виде оранжево-красного светила, быстро перемещающегося между созвездиями. Марс находится от Солнца на расстоянии 228 млн. км. По размерам он в два раза меньше Земли, средняя плотность его вещества составляет 3,9 г/сж . Поверхность Марса покрыта пылью, гор не найдено. В 1909 г. русский астроном Г. А. Тихов установил, что атмосфера Марса менее плотная, чем на Земле. В атмосфере Марса обнаружено большое количество пылеобразного вещества. Предполагается, что это частицы пыли, поднятые ветром с поверхности, кристаллы воды и углекислоты, а также метеорная пыль. [c.66]
Используют пикнометр подходящей формы емкостью не менее 5 мл. Точно взвешивают пустой сухой цикнометр и заполняют его испытуемой жидкостью, температура которой предварительно доведена примерно до 20 °С. Выдерживают заполненный пикнометр в течение примерно 30 мин при температуре 20 1 °С, доводят объем жидкости до отметки, используя, если необходимо, небольшую полоску фильтровальной бумаги для удаления избытка жидкости и для протирания входного отверстия изнутри, и точно взвешивают. Вычисляют массу жидкости в пикнометре. Удаляют жидкость, очищают и высушивают пикнометр, повторяют измерение с водой, свободной от углекислоты, Р также при 20 1 °С и вычисляют массу воды в пикнометре. Отношение массы испытуемой жид-Jio ти к массе воды дает относительную плотность ( м). [c.32]
Раствор ацетата свинца основного. Свинцовый уксус (Solutio Plumbi suba etatis). Представляет собой водный раствор ацетата свинца основного с содержанием металлического свинца 16,7—17,4% и плотностью 1,225—1,230. При стоянии на воздухе раствор мутнеет вследствие интенсивного поглощения углекислоты воздуха. Препарат получают -взаимодействием ацетата свинца и окиси свинца при нагревании. [c.382]
О—150° и вычисленными по этим данным величинами свободной энергии углекислоты под давлением [117]. Была проведена экстраполяция данных ] 1ихельса в область более высоких температур и давлений. При этом, в частности, оказалось, что изохоры двуокиси углерода при О—150° и плотностях 0,9—1,2 г см весьма близки к прямым это позволило легко экстраполировать данные о сжимаемости при высоких давлениях в область более высоких температур по формуле [c.72]
S) Отношение хинонов к электролитическому окислению. При электролитическом окислении бензохинона иа вращающемся свинцовом катоде при небольшой плотности тока в суспензии разбауленной серной кислоты при охлаждении получаются малеиновая кислота, винная кислота, муравьиная кислота, окись углерода, углекислота и вероятно еще неизвестная малеинглицидная кислота [c.314]
NaOH. ГОСТ 4328-77, ч. Белые чешуйки, кускн или цилиндрические палочки с кристаллической структурой на изломе сильно гигроскопичен, хорошо растворим в воде и спирте быстро поглощает из воздуха углекислоту и воду и постепенно переходит в углекислый натрий. Растворимость в воде при 20 °С— 1070 г/л. Плотность — [c.160]
Аппаратура и реактивы. рН-метр ЛПУ-О ( о работе см. стр. 36) стеклянные электроды (НСТ, УСТ или ЭСЛ-11 Г-04) перемещивающее устройство (см. рис. 2) прибор для сульфирования (рис. 45) установка для сульфирования (рис, 46) термометр ртутный на 360°С с ценой деления 1 град колбонагреватель термометр ртутный палочный на 150°С для бани с ценой деления 1 град воронка капельная на 25—50 мл с отводн.)й трубкой длиной не более 15 мм от крана колба на 50.ил конструкции ВУХИНа (см. рис. 56) холодильник воздушный длиной 800 мм, диаметром 12—14 мм микробюретка на 5 с хлоркальциевой трубкой стаканы на 50 мл пипетка на 1 мл кислота серная плотностью 1,84 четыреххлористый углерод, ч. ацетон, ч. (по ГОСТ 2603—63) 1,3,5-ксиленол, ч., свежеперегнанный натр едкий 0,2-н. водный и 0, 1-н. спиртоводный растворы, не содержащие углекислоты спирт этиловый, ректификат или гидролизный высокой степени очистки вода дистиллированная, прокипяченная, для анализов и приготовления растворов (хранить в герметично закрытой посуде). [c.117]
Тщательно отмытые от питательного раствора водоросли помещают в сосудик с 5—7 мл 0,1 М карбонатно-бикарбонатного буфера, который создает в манометрическом сосудике насыщающую фотосинтез концентрацию углекислоты 78,7X10 жл в водной фазе и около 0,3% в воздушной. Известно, что насыщающей для большинства растений является концентрация СО2, равная 0,3%, и что pH 9,4 и осмотическая сила буфера не изменяют интенсивности фотосинтеза (Рабинович, 1953). Таким образом, буфер представляет собой достаточно благоприятную среду для того, чтобы на время опыта помещать водоросли непосредственно в буфер. Плотность суспензии водорослей не должна превышать 20 млн. кл/мл при толщине слоя 1,0 см. Испытываемые вещества вносятся или непосредственно перед измерением в сосудик, или в опытные колбы с водорослями, откуда отбирается определенное количество водорослевых клеток, которые отмываются от питательного раствора и помещаются в буфер. Для установления темнературного равновесия, т. е. [c.229]
Исследования, проведенные автором [30, 54], позволи.пи установить, что повышение интенсивности смешения воды с раствором коагулянта вплоть до значений G, вызывающих диспергирование коагуляционных структур в момент их возникновения (период скрытой коагуляции), приводит к увеличению плотности структур, отделению углекислоты и ускорению седиментации образующихся хлопьев. Возможность создания благоприятных кинетических условий хлопьеобразования за счет увеличения степени дисперсности частиц коагулята интенсивным перемешиванием обрабатываемой воды показана Печниковым и Хайловым [55]. Но, как мы уже знаем, чрезмерно интенсивное и длительное неремешивапне воды может привести к необратимому разбиванию микрохлопьев, резкому ухудшению адгезионных свойств взвеси и замедлению нос.тедующего хлопьеобразования. Поэтому интенсивность быстрого перемешивания должна быть ограничена. На практике в смесительных устройствах значения скоростного градиента поддерживают обычно в пределах 300—350 сек [56], а перемешивание осуществляют в течение 1—2 мин. Увеличение G до 500—1000 сек позволяет сократить период быстрого пере- [c.262]
ИЛИ величина прозоров в днище принимается равной 20 мм, расстояние от дна дегазатора до промежуточного днища — 600 мм. В месте выхода воды из дегазатора устраивается гидравлический затвор, высота которого на 20% больше максимального напора, создаваемого вентилятором. Вода, поступающая на дегазацию, распределяется по сечению аппарата с помощью размещенной над насадкой на высоте 150 мм распределительной плиты, в которой укреплено 48 патрубков для отвода воды, возвышающихся над поверхностью плиты на 100 мм, и 8 патрубков высотой 400 мм для выхода воздуха. Патрубки для выхода воздуха снабжаются отражательными колпаками. Расстояние от распределительной плиты до крышки дегазатора принимается равным 500 мм. Штуцер для подвода воды находится в центре крышки. Диаметр трубы для отвода воздуха определяется из скорости движения в ней воздуха, равной 5—бм . В качестве насадки в дегазаторах применяют кольца Рашига 25x25x3 мм (ГОСТ 748—67), гравий и кокс. Плотность орошения насадки водой принимают равной 60 мЗ/(м2. ч) при глубоком удалении из воды свободной углекислоты или свободного сероводорода и 90 м /(м ч) при частичном удалении свободной углекислоты в процессе обезжелезивания воды. Расход воздуха на 1 м воды составляет 15 м при глубоком, 4 м при частичном удалении свободной углекислоты и 12 при глубоком удалении свободного сероводорода. [c.969]
chem21.info
Формула Углекислого газа структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: CO2
Химический состав Углекислого газа
| C | Углерод | 12.011 | 7 | 27,3% |
| O | Кислород | 15.999 | 1 | 72,7% |
Молекулярная масса: 44.009
Диокси́д углеро́да (углеки́слый газ, двуо́кись углеро́да, окси́д углеро́да (IV), у́гольный ангидри́д) — бесцветный газ (в нормальных условиях), без запаха, с химической формулой CO2. Плотность при нормальных условиях 1,98 кг/м³ (тяжелее воздуха). При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения. Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,04 %. Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Оксид углерода(IV) — углекислый газ, газ без запаха и цвета, тяжелее воздуха, при сильном охлаждении кристаллизуется в виде белой снегообразной массы — «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации −78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Растворим в воде (1 объём углекислого газа в одном объёме воды при 15 °С).
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует с щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения (например, с магнийорганическими соединениями). Оксид углерода(IV) не поддерживает горения. В нём горят только некоторые активные металлы. Взаимодействует с оксидами активных металлов. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов.
Организм человека выделяет приблизительно 1 кг (2,3 фунта) углекислого газа в сутки. Этот углекислый газ переносится от тканей, где он образуется в качестве одного из конечных продуктов метаболизма, по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, и уменьшается в капиллярной сети лёгких, и мало в артериальной крови. Содержание углекислого газа в пробе крови часто выражают в терминах парциального давления, то есть давления, которое бы имел содержащийся в пробе крови в данном количестве углекислый газ, если бы весь объём пробы крови занимал только он. Углекислый газ (CO2) транспортируется в крови тремя различными способами (точное соотношение каждого из этих трёх способов транспортировки зависит от того, является ли кровь артериальной или венозной).
- Большая часть углекислого газа (от 70 % до 80 %) преобразуется ферментом карбоангидразой эритроцитов в ионы гидрокарбоната.
- Около 5 % — 10 % углекислого газа растворено в плазме крови.
- Около 5 % — 10 % углекислого газа связано с гемоглобином в виде карбаминосоединений (карбогемоглобин).
Гемоглобин, основной кислород-транспортирующий белок эритроцитов крови, способен транспортировать как кислород, так и углекислый газ. Однако углекислый газ связывается с гемоглобином в ином месте, чем кислород. Он связывается с N-терминальными концами цепей глобина, а не с гемом. Однако благодаря аллостерическим эффектам, которые приводят к изменению конфигурации молекулы гемоглобина при связывании, связывание углекислого газа понижает способность кислорода к связыванию с ним же, при данном парциальном давлении кислорода, и наоборот — связывание кислорода с гемоглобином понижает способность углекислого газа к связыванию с ним же, при данном парциальном давлении углекислого газа. Помимо этого, способность гемоглобина к преимущественному связыванию с кислородом или с углекислым газом зависит также и от pH среды. Эти особенности очень важны для успешного захвата и транспорта кислорода из лёгких в ткани и его успешного высвобождения в тканях, а также для успешного захвата и транспорта углекислого газа из тканей в лёгкие и его высвобождения там. Углекислый газ является одним из важнейших медиаторов ауторегуляции кровотока. Он является мощным вазодилататором. Соответственно, если уровень углекислого газа в ткани или в крови повышается (например, вследствие интенсивного метаболизма — вызванного, скажем, физической нагрузкой, воспалением, повреждением тканей, или вследствие затруднения кровотока, ишемии ткани), то капилляры расширяются, что приводит к увеличению кровотока и соответственно к увеличению доставки к тканям кислорода и транспорта из тканей накопившейся углекислоты. Кроме того, углекислый газ в определённых концентрациях (повышенных, но ещё не достигающих токсических значений) оказывает положительное инотропное и хронотропное действие на миокард и повышает его чувствительность к адреналину, что приводит к увеличению силы и частоты сердечных сокращений, величины сердечного выброса и, как следствие, ударного и минутного объёма крови. Это также способствует коррекции тканевой гипоксии и гиперкапнии (повышенного уровня углекислоты). Ионы гидрокарбоната очень важны для регуляции pH крови и поддержания нормального кислотно-щелочного равновесия. Частота дыхания влияет на содержание углекислого газа в крови. Слабое или замедленное дыхание вызывает респираторный ацидоз, в то время как учащённое и чрезмерно глубокое дыхание приводит к гипервентиляции и развитию респираторного алкалоза. Кроме того, углекислый газ также важен в регуляции дыхания. Хотя наш организм требует кислорода для обеспечения метаболизма, низкое содержание кислорода в крови или в тканях обычно не стимулирует дыхание (вернее, стимулирующее влияние нехватки кислорода на дыхание слишком слабо и «включается» поздно, при очень низких уровнях кислорода в крови, при которых человек нередко уже теряет сознание). В норме дыхание стимулируется повышением уровня углекислого газа в крови. Дыхательный центр гораздо более чувствителен к повышению уровня углекислого газа, чем к нехватке кислорода. Как следствие этого, дыхание сильно разрежённым воздухом (с низким парциальным давлением кислорода) или газовой смесью, вообще не содержащей кислорода (например, 100 % азотом или 100 % закисью азота) может быстро привести к потере сознания без возникновения ощущения нехватки воздуха (поскольку уровень углекислоты в крови не повышается, ибо ничто не препятствует её выдыханию). Это особенно опасно для пилотов военных самолётов, летающих на больших высотах (в случае попадания вражеской ракеты в кабину самолёта и разгерметизации кабины пилоты могут быстро потерять сознание). Эта особенность системы регуляции дыхания также является причиной того, почему в самолётах стюардессы инструктируют пассажиров в случае разгерметизации салона самолёта в первую очередь надевать кислородную маску самим, прежде чем пытаться помочь кому-либо ещё — делая это, помогающий рискует быстро потерять сознание сам, причём даже не ощущая до последнего момента какого-либо дискомфорта и потребности в кислороде. Дыхательный центр человека пытается поддерживать парциальное давление углекислого газа в артериальной крови не выше 40 мм ртутного столба. При сознательной гипервентиляции содержание углекислого газа в артериальной крови может снизиться до 10-20 мм ртутного столба, при этом содержание кислорода в крови практически не изменится или увеличится незначительно, а потребность сделать очередной вдох уменьшится как следствие уменьшения стимулирующего влияния углекислого газа на активность дыхательного центра. Это является причиной того, почему после некоторого периода сознательной гипервентиляции легче задержать дыхание надолго, чем без предшествующей гипервентиляции. Такая сознательная гипервентиляция с последующей задержкой дыхания может привести к потере сознания до того, как человек ощутит потребность сделать вдох. В безопасной обстановке такая потеря сознания ничем особенным не грозит (потеряв сознание, человек потеряет и контроль над собой, перестанет задерживать дыхание и сделает вдох, дыхание, а вместе с ним и снабжение мозга кислородом восстановится, а затем восстановится и сознание). Однако в других ситуациях, например, перед нырянием, это может быть опасным (потеря сознания и потребность сделать вдох наступят на глубине, и в отсутствие сознательного контроля в дыхательные пути попадёт вода, что может привести к утоплению). Именно поэтому гипервентиляция перед нырянием опасна и не рекомендуется.
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя (спиртовое брожение). Смесь полученных газов промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать CO2, содержащийся в дымовом газе, а при нагреве отдавать его; таким образом отделяется готовый продукт от других веществ. Также углекислый газ получают на установках разделения воздуха как побочный продукт получения чистого кислорода, азота и аргона. В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой, используя, например, аппарат Киппа. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты. Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290. Жидкая углекислота широко применяется в системах пожаротушения и в огнетушителях. Автоматические углекислотные установки для пожаротушения различаются по системам пуска, которые бывают пневматическими, механическими или электрическими. Устройство для подачи углекислого газа в аквариум может включать в себя резервуар с газом. Простейший и наиболее распространенный метод получения углекислого газа основан на конструкции для изготовления алкогольного напитка браги. При брожении, выделяемый углекислый газ вполне может обеспечить подкормку аквариумных растений. Углекислый газ используется для газирования лимонада и газированной воды. Углекислый газ используется также в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в инертной среде. Углекислота в баллончиках применяется в пневматическом оружии (в газобаллонной пневматике) и в качестве источника энергии для двигателей в авиамоделировании. Хранение углекислоты в стальном баллоне в сжиженном состоянии выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру +31°С. В стандартный 40-литровый баллон заливают около 30 кг сжиженного углекислого газа, и при комнатной температуре в баллоне будет находиться жидкая фаза, а давление составит примерно 6 МПа (60 кгс/см²). Если температура будет выше +31°С, то углекислота перейдёт в сверхкритическое состояние с давлением выше 7,36 МПа. Стандартное рабочее давление для обычного 40-литрового баллона составляет 15 МПа (150 кгс/см²), однако он должен безопасно выдерживать давление в 1,5 раза выше, то есть 22,5 МПа,— таким образом, работа с подобными баллонами может считаться вполне безопасной. Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле, при ремонте оборудования (например: охлаждение одной из сопрягаемых деталей при посадке внатяг) и т. д. Для сжижения углекислого газа и получения сухого льда применяются углекислотные установки.
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта. Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф. Для измерения низких концентраций CO2 (а также CO) в технологических газах или в атмосферном воздухе можно использовать газохроматографический метод с метанатором и регистрацией на пламенно-ионизационном детекторе.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария. Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосы суши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан). Поэтому с марта по сентябрь вследствие фотосинтеза содержание CO2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемого топлива (угля, нефти, газа), заметно увеличивающееся в зимний сезон. Большое количество углекислоты растворено в океане. Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Углекислый газ нетоксичен, но по воздействию его повышенных концентраций в воздухе на воздуходышащие живые организмы его относят к удушающим газам (англ.)русск.. Незначительные повышения концентрации до 2—4 % в помещениях приводят к развитию у людей сонливости и слабости. Опасными концентрациями считаются уровни около 7—10 %, при которых развивается удушье, проявляющее себя в головной боли, головокружении, расстройстве слуха и в потере сознания (симптомы, сходные с симптомами высотной болезни), в зависимости от концентрации, в течение времени от нескольких минут до одного часа. При вдыхании воздуха с высокими концентрациями газа смерть наступает очень быстро от удушья. Хотя, фактически, даже концентрация 5—7 % CO2 не смертельна, уже при концентрации 0,1 % (такое содержание углекислого газа наблюдается в воздухе мегаполисов) люди начинают чувствовать слабость, сонливость. Это показывает, что даже при высоких содержаниях кислорода большая концентрация CO2 сильно влияет на самочувствие. Вдыхание воздуха с повышенной концентрацией этого газа не приводит к долговременным расстройствам здоровья и после удаления пострадавшего из загазованной атмосферы быстро наступает полное восстановление здоровья.
formula-info.ru
Двуокись углерода высшего сорта. Применение углекислого газа в промышленности, добыча углекислого газа.
Газообразный
Жидкий
Двуокись углерода (диоксид углерода, СО2) во всех своих состояниях широко используется практически во всех отраслях промышленности и агропромышленного комплекса.
На долю СО2 приходится 10 % всего рынка технических газов, что ставит этот продукт в один ряд с основными продуктами разделения воздуха.
Оксид углерода (углекислый газ, диоксид углерода, двуокись углерода, угольный ангидрид, углекислота) — CO2, бесцветный газ, без запаха, со слегка кисловатымвкусом.
Концентрация углекислого газа в атмосфере Земли составляет в среднем 0,038 %
Физические
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно изтвёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода длярастений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В пищевых целях используется газ, образующийся при спиртовом брожении. После предварительной обработки газ закачивается в баллоны.
Так же углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в ледниках. Жидкая углекислота используется в качестве хладагента и рабочего тела в теплоэнергетических установках (в холодильниках, морозильниках, солнечных электрогенераторах и т. д.).
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Углекислый газ в атмосфере
Изменения концентрации атмосферной углекислоты (кривая Килинга). Измерения на обсерватории Мауна-Лоа.
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Вегетация в тропиках практически не зависит от сезона, сухой пояс пустынь 20—30° (обоих полушарий) дает малый вклад в круговорот углекислоты, а полосысуши, наиболее покрытые растительностью, расположены на Земле асимметрично (в Южном полушарии в средних широтах находится океан).Поэтому с марта по сентябрь вследствие фотосинтеза содержание СО2 в атмосфере падает, а с октября по февраль — повышается. Вклад в зимний прирост дают как окисление древесины (гетеротрофное дыхание растений, гниение, разложение гумуса, лесные пожары), так и сжигание ископаемых топлив (угля, нефти, газа), заметно увеличивающееся в зимний сезон.
xn--c1aomn.xn--p1ai