Как получают ацетилен из метана. Метан используется для получения ацетилена
Как получают ацетилен из метана
Ацетилен представляет собой вещество, относящееся к классу алкинов. Иными словами, это углеводород, который имеет в каждой молекуле тройную связь. При этом химическая формула ацетилена выглядит следующим образом: С2Н2. Само по себе это вещество является бесцветным газом, который значительно легче воздуха. Получают ацетилен из метана. Вещество является химически активным и взрывоопасным.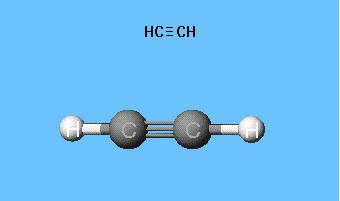
Как получить ацетилен
Из метана в домашних условиях получить ацетилен очень сложно. Самый простой метод выделения данного газа – это реакция воды с карбидом кальция. Многие из вас, наверное, помнят, как бросали в лужи кусочки этого вещества и какая происходила реакция. При этом отмечалось бурное шипение. Что касается карбида кальция, то он постепенно таял, образовывая большое количество пены. Подобную реакцию можно записать так:
СаС2+2Н2О=С2Н2+Са(ОН)2.
Многие используют технический карбид кальция, который содержит большое количество примесей. В результате этого при реакции с водой вещество выделяет неприятный запах. Возникает он из-за образования вместе с ацетиленом незначительного количества паров ядовитых газов. Чаще всего это фосфин, сероводород и так далее. Этот способ считается самым распространенным, так как получить ацетилен из метана можно только при помощи специального оборудования.
Получение в промышленности
Как получают ацетилен из метана в промышленных условиях? В настоящее время применяется только один метод – крекинг. В процессе получения ацетилена осуществляется разрыв связей -С-С. Происходит это в присутствии катализаторов и при воздействии достаточно высоких температур. Для получения используется метан – природный газ. Это недорогое и легкодоступное сырье. Именно по этой причине крекинг является наиболее обоснованным методом как в экономическом плане, так и в техническом.
Как осуществляется крекинг
Осуществить превращения "метан - ацетилен" можно несколькими способами. В первом случае природный газ пропускают через предварительно раскаленные электроды. При этом температура может доходить до 1600 °С. После нагрева происходит быстрое охлаждение. Второй способ основан на использовании тепла, которое образуется в результате частичного сгорания ацетилена.
Уравнения реакций "метан - ацетилен" записываются следующим образом:
- В I случае: 2СН4 = С2Н2 + 3Н2.
- Во II случае: 6СН4 + 4О2 = С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О.
Специалисты не рекомендуют использовать для хранения ацетилена баллоны, оснащенные вентилями из бронзы. Ведь в состав этого сплава входит медь. Так как ацетилен химически активен, он может вступить в реакцию с металлом. В результате этого образуются взрывоопасные соли.
Применение ацетилена
Ацетилен – это вещество, которое широко применяется в различных промышленных отраслях. Чаще всего этот газ используют при изготовлении этилового спирта в качестве основного сырья. Помимо этого, ацетилен применяют для получения определенных видов каучука, уксусной кислоты и пластмассы.
Активно используется данный газ и при проведении сварочных работ, а также при резке различных металлов. Стоит отметить, что при окислении кислородом ацетилена образуется сильное пламя. Газ является источником достаточно яркого света в светильниках автономного типа. На основе ацетилена производят взрывчатые вещества, которые в дальнейшем применяются как детонаторы.
fb.ru
Как из метана получить ацетилен
Для того чтобы из метана получить ацетилен, необходимо провести реакцию дегидрирования. Прежде чем приступать к ее рассмотрению, проанализируем некоторые особенности углеводорода.
Характеристика ацетилена
Это газообразное вещество, являющееся первым представителем класса непредельных углеводородов (алкинов). Оно легче воздуха, плохо растворимо в воде. Молекулярная формула С2Н2, общая для всего класса СпН2п-2. Ацетилен считается активным химическим веществом, к тому же весьма взрывоопасным. Для того чтобы избежать чрезвычайных ситуаций, его хранят в герметичных стальных емкостях, добавляя к нему древесный уголь.
Получение из алканов
При разложении метана получен ацетилен. Данная химическая реакция осуществляется с использованием катализатора, происходит при повышенной температуре. Исходным веществом выступает первый представитель класса парафинов. При дегидрировании, помимо ацетилена, образуется водород.
Отвечая на вопрос о том, как из метана получить ацетилен, уравнение реакции представим в виде:
2СН4=С2Н2+3Н2

Карбидный способ
Можно из метана получить ацетилен или в качестве исходного вещества взять карбид кальция. Процесс протекает при обычных условиях. При взаимодействии карбида кальция с водой образуется не только ацетилен, но и гидроксид кальция (гашеная известь). Признаками протекания химического процесса будет выделение газа (шипение), а также изменение окраски раствора при добавлении фенолфталеина на малиновый цвет.
При применении в качестве исходного вещества технического карбида, имеющего различные примеси, в процессе взаимодействия наблюдается неприятный запах. Он объясняется присутствием в продуктах реакции таких ядовитых газообразных веществ, как фосфин, сероводород.

Крекинг нефтепродуктов
В настоящее время можно не только из метана получить ацетилен. Основным промышленным методом производства этого представителя алкинов считается крекинг (расщепление) углеводородов. Если из метана получить ацетилен, то энергетические затраты будут минимальными. Помимо недорогого и доступного сырья, такая технология привлекает производителей углеводородного сырья простотой технологического оборудования, применяемого в процессе дегидрирования метана.
Существует два варианта проведения подобного химического процесса. Первый способ базируется на пропускании метана через электроды, раскаленные до 1600 градусов по Цельсию. Технология предполагает резкое охлаждение полученного продукта. Второй вариант дегидрирования метана с получением ацетилена предполагает применение энергии, которая образуется при частичном горении этого алкина.
Баллоны, в которых содержится ацетилен, не могут комплектоваться бронзовыми вентилями, так как в составе бронзы содержится медь. Взаимодействие данного металла с ацетиленом сопровождается получением взрывоопасной соли.

Заключение
Ацетилен применяют в настоящее время в различных производственных областях. Он является ценным сырьем для синтеза этанола, пластмасс, каучуков, уксусной кислоты. Востребован этот представитель класса алкинов при резке и сварке металлов, в качестве яркого света в индивидуальных светильниках.
На базе ацетилена осуществляется синтез взрывчатых веществ, применяемых в виде детонаторов. В реакции окисления этого алкина в кислороде воздуха наблюдается сильное пламя. Не меньшую ценность имеет в химической промышленности и метан. Помимо применения его в качестве исходного вещества для производства ацетилена, он в больших количествах потребляется в качестве природного углеводорода в топливной промышленности. При его сгорании выделяется существенное количество теплоты.
fb.ru
Как получить из метана ацетилен
Ацетилен – примитивный поверенный класса алкинов, т.е. углеводородов, имеющих в своей молекуле тройную связь. Его химическая формула C2h3. Это бесцветный газ, легче воздуха, крайне взрывоопасный и химически энергичный. Хранят ацетилен в стальных герметичных емкостях, отменнее – с древесным углем.

Инструкция
1. Самый примитивный метод приобретения ацетилена – реакция карбида кальция с водой. Наверно многие дети помнят, как бросали ломтики карбида в лужи. Тут же же начиналось безумное шипение, и карбид дословно «таял» в образующейся пене. Эта реакция идет дальнейшим образом: СаС2 + 2Н2О = С2Н2 + Са(ОН)2
2. Если применяется технический карбид, запачканный примесями, реакция сопровождается неприятным запахом из-за образования наравне с ацетиленом маленьких чисел ядовитых газов сероводорода, фосфина и т.д.
3. В текущее время стержневой индустриальный способ приобретения ацетилена – крекинг (обрыв связей -С-С- под действием высоких температур и в присутствии катализаторов) природного газа метана. Он особенно обоснован экономически и технологически ввиду наличия легкодоступного и недорогого сырья. Осуществляется двумя путями: либо пропуском метана через раскаленные электроды (температура реакционного объема порядка 1600 градусов), с дальнейшим стремительным охлаждением, либо с применением тепла, образующегося при частичном сгорании ацетилена.
4. В первом случае реакция идет таким образом: 2СН4 = С2Н2 + 3Н2Во втором случае: 6СН4 + 4О2 = С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О
Сероводород – это горючий газ, не имеющий цвета, но владеющий неприятным запахом (тухлых яиц). Данный газ нехорошо растворяется в воде, также он достаточно ядовит. Сероводород образуется в процессе гниения белковых веществ, но его дозволено получить и другими методами.

Вам понадобится
- Сера, парафин, соляная кислота, серная кислота, сульфид железа, сульфид алюминия, цинк, йодид калия, сульфид кадмия.
Инструкция
1. Возьмите немножко серы и смешайте ее с небольшим числом парафина. После этого разместите эту смесь в пробирку и с поддержкой спиртовой горелки нагрейте ее. При нагревании этой смеси произойдет реакция с выделением сероводорода.
2. Возьмите какую-нибудь кислотостойкую емкость и разместите в нее малое число сульфида железа. Позже этого добавьте туда разбавленную соляную кислоту. Произойдет реакция, при которой будет образовываться хлорид железа и сероводород.
3. В какой-нибудь сосуд налейте дистиллированную воду. Дальше разместите в нее немножко сульфида алюминия. Начнется реакция с выделением сероводорода и образованием гидроксида алюминия. При этой реакции образуется дюже чистый сероводород.
4. Возьмите пробирку и разместите в нее немножко серы. После этого возьмите вторую пробирку и налейте в нее разбавленную соляную кислоту. Подберите к пробирке с соляной кислотой крышку с газоотводной трубкой.
5. Позже этого, пробирку с серой нагрейте, температурный диапазон в котором должна находиться сера, должен быть от 150 до 200 градусов. После этого в пробирку с соляной кислотой разместите ломтик цинка, начнется выделение водорода.
6. Пробирку из которой выдается водород закройте крышкой с газоотводной трубкой, а иной конец трубки разместите в пробирку с расплавленной серой. При данной температуре водород и сера будут взаимодействовать между собой с образованием сероводорода.
7. Налейте в стеклянную емкость концентрированную серную кислоту. Позже этого разместите в нее немножко йодида калия, начнется реакция, при которой будет образовываться сульфат калия, вода, йод, тот, что выпадет в осадок и сероводород.
8. Налейте в сосуд разбавленную серную кислоту и нагрейте ее. Позже этого, разместите в нее малое число сульфида кадмия. При этом будет образовываться сульфат кадмия и выдаваться сероводород.
Видео по теме
Обратите внимание! Эксперименты с сероводородом проводите на открытом воздухе либо в отлично проветриваемом помещении.
Ацетилен – самый примитивный поверенный класса алкинов, имеет химическую формулу С2Н2. Бесцветный газ, горюч, в смеси с воздухом взрывоопасен. Вследствие наличию тройной связи в своей молекуле, крайне энергичен с химической точки зрения, легко вступает в реакции присоединения. При сгорании выделяет огромное число тепла, что может быть использовано, скажем, многим знаменитая «ацетиленовая горелка». Как же его синтезировать?

Инструкция
1. При хранении ацетилена следует рассматривать его особенности. Скажем, его невозможно удерживать в баллонах, имеющих бронзовый вентиль, от того что газ реагирует с медью, входящей в состав бронзы, образуя исключительно взрывоопасное вещество – ацетиленид меди.
2. Самый ветхий, испытанный временем способ приобретения ацетилена – реакция карбида кальция с водой. Вероятно, многие мальчишки в детстве развлекались, бросая ломтики карбида в лужу, здесь же начиналось гневное шипение, карбид дословно «бурлил», исчезая на глазах, и в воздухе ясно пахло чем-то крутым, «острым». Эта реакция протекает таким образом: СаС2 + 2Н2О = С2Н2 + Са(ОН)2 Для того дабы она протекала не слишком буйно, дозволено применять не примитивную воду, а интенсивный раствор хлорида натрия, скажем.
3. Если данный навык планируется показать на уроке химии, следует подобрать реакционную колбу подходящего размера. Если она будет слишком крошечной, то образующая при растворении карбида пена может быть «выброшена» давлением ацетилена в отводную трубку, и дальше – в приемный сосуд. В случае же с чрезмерно крупной колбой, придется длинно ожидать, пока образующийся ацетилен не вытеснит каждый воздух из прибора.
4. Воду, а отменнее интенсивный раствор хлорида натрия, следует добавлять в колбу с ломтиками карбида медлительно, по каплям, регулируя скорость реакции, не допуская, дабы она протекала чрезмерно буйно.
Полезный совет Применяется ацетилен в самых различных областях. Скажем, как сырье для приобретения целого ряда химических веществ (уксусной кислоты, пластмасс, некоторых ароматических углеводородов, некоторых видов синтетического каучука, этилового спирта и т.д.). На его основе синтезируют некоторые дюже крепкие взрывчатые вещества, используемые в качестве зачинателей, т.е. для детонации. Повсюду используется при резке и сварке металлов, при приобретении блестящего света в самостоятельных светильниках.
Обратите внимание! Ни в коем случае невозможно комплектовать баллоны с ацетиленом бронзовыми вентилями, от того что в состав бронзы входит медь, а с этим металлом ацетилен реагирует, образуя дюже взрывоопасную соль.
Полезный совет Ацетилен находит широкое использование в разных областях производства. Он применяется в качестве сырья при синтезе этилового спирта, уксусной кислоты, некоторых видов каучука и пластмасс. Повсюду используется при сварочных работах и при резке металлов, при окислении ацетилена кислородом образуется дюже крепкое пламя. Служит источником дюже блестящего света в самостоятельных светильниках. На его основе синтезируют взрывчатые вещества (ацетилениды), которые применяют в качестве детонаторов.
jprosto.ru
Метан, ацетилен используются в самых различных реакциях, имеющих промышленное значение
В перечне углеводородов метан, ацетилен играют важную роль в самых различных направлениях химической промышленности. Изначально метан не представлял никакого практического интереса. Его называли и болотный, и рудничный газ по месту, где он наиболее часто встречался в природе. Как правило, это соединение доставляло массу неприятности из-за своих физических и химических свойств. Без цвета и без запаха метан мог вызвать у человека и лёгкое недомогание, и даже серьёзное отравление. Но особо много хлопот доставлял газ своей способностью в смеси с воздухом образовывать легко воспламеняющийся коктейль с большими разрушительными способностями.
Несмотря на то, что метану нашлось много способов применения, производство этого вещества промышленным путём не имеет никакой ценности. Дело в том, что это соединения не только часто встречается в природе, но и является сопутствующим (побочным) продуктом в различных технологических процессах современной химической промышленности.
Вертело в 1860 году смог осуществить реакцию, которая в последствии получила важное промышленное значение. Но в те времена процесс, позволяющий осуществить химический переход метан > ацетилен, не получил особого восторга. Дело в том, что для обеспечения потребности в ацетилене было достаточно и карбидного способа его получения.
Современная химическая промышленность нашла массу способов применения ацетилена. Это и газорезка, и использование его в ярких химических светильниках, и применение в производстве самых различных химических веществ. Ацетилен востребован при получении самых различных взрывчатых соединений и уксусной кислоты, этилового спирта и растворителей, каучука и ароматических углеводородов. Проявлением достижений двадцатого века стало использование ацетилена в производстве полимеров.
Наступило благоприятное время, чтобы вспомнить химическое превращение метан - ацетилен. Электрокрекинг и термоокислительный крекинг – название современных технологических процессов, в результате которых получают ацетилен из метана. В первом случае газ метан струёй проходит через электроды под температурой 1600° С и быстро охлаждается. Осуществлению второго способа превращения метан – ацетилен, неполному окислению, благоприятствует выделение теплоты от частичного сгорания ацетилена.
В производственной цепочке метан, ацетилен, уксусный альдегид последний элемент появился благодаря реакции гидратации ацетилена, получившей впоследствии название реакция Кучерова. Промышленное применение уксусный альдегид нашёл при производстве уксусной кислоты, альдегидных полимеров, бутадиена, ряда органических веществ.
Но вещество само по себе небезопасно, ацетальдегид достаточно токсичен даже при действии на кожу. Выступает серьёзным загрязнителем воздуха, куда попадает при горении, к примеру, при курении или из автомобильных выхлопах. Огромное его количество образуется при термообработке различных полимеров и пластиков.
Следующая цепочка метан, ацетилен, бензол, хлорбензол является дополнительным подтверждением активного использования в современной химической промышленности болотного или рудничного газа. Мы уже знакомы с реакциями получения из него ацетилена. Осталось только осуществить тримеризацию этого газа, пропуская С2Н2 над активированным углём при температуре в 400 градусов по Цельсию. Полученный промышленным способом бензол идёт на производство этилбензола, кумола, циклогексана и нитробензола. Около трёх процентов этого вещества расходуется на получение линейных алкилбензолов. И только один процент бензола расходуют на синтез хлорбензола. Для этого используется реакция его хлорирования. Условиями её осуществления является температура в 80-85 °C и наличие железа или хлорида железа.
fb.ru
Как из метана получить ацетилен
Для того чтобы из метана получить ацетилен, необходимо провести реакцию дегидрирования. Прежде чем приступать к ее рассмотрению, проанализируем некоторые особенности углеводорода.
Характеристика ацетилена
Это газообразное вещество, являющееся первым представителем класса непредельных углеводородов (алкинов). Оно легче воздуха, плохо растворимо в воде. Молекулярная формула С2Н2, общая для всего класса СпН2п-2. Ацетилен считается активным химическим веществом, к тому же весьма взрывоопасным. Для того чтобы избежать чрезвычайных ситуаций, его хранят в герметичных стальных емкостях, добавляя к нему древесный уголь.
Получение из алканов
При разложении метана получен ацетилен. Данная химическая реакция осуществляется с использованием катализатора, происходит при повышенной температуре. Исходным веществом выступает первый представитель класса парафинов. При дегидрировании, помимо ацетилена, образуется водород.
Отвечая на вопрос о том, как из метана получить ацетилен, уравнение реакции представим в виде:
2СН4=С2Н2+3Н2

Видео по теме
Карбидный способ
Можно из метана получить ацетилен или в качестве исходного вещества взять карбид кальция. Процесс протекает при обычных условиях. При взаимодействии карбида кальция с водой образуется не только ацетилен, но и гидроксид кальция (гашеная известь). Признаками протекания химического процесса будет выделение газа (шипение), а также изменение окраски раствора при добавлении фенолфталеина на малиновый цвет.
При применении в качестве исходного вещества технического карбида, имеющего различные примеси, в процессе взаимодействия наблюдается неприятный запах. Он объясняется присутствием в продуктах реакции таких ядовитых газообразных веществ, как фосфин, сероводород.

Крекинг нефтепродуктов
В настоящее время можно не только из метана получить ацетилен. Основным промышленным методом производства этого представителя алкинов считается крекинг (расщепление) углеводородов. Если из метана получить ацетилен, то энергетические затраты будут минимальными. Помимо недорогого и доступного сырья, такая технология привлекает производителей углеводородного сырья простотой технологического оборудования, применяемого в процессе дегидрирования метана.
Существует два варианта проведения подобного химического процесса. Первый способ базируется на пропускании метана через электроды, раскаленные до 1600 градусов по Цельсию. Технология предполагает резкое охлаждение полученного продукта. Второй вариант дегидрирования метана с получением ацетилена предполагает применение энергии, которая образуется при частичном горении этого алкина.
Баллоны, в которых содержится ацетилен, не могут комплектоваться бронзовыми вентилями, так как в составе бронзы содержится медь. Взаимодействие данного металла с ацетиленом сопровождается получением взрывоопасной соли.

Заключение
Ацетилен применяют в настоящее время в различных производственных областях. Он является ценным сырьем для синтеза этанола, пластмасс, каучуков, уксусной кислоты. Востребован этот представитель класса алкинов при резке и сварке металлов, в качестве яркого света в индивидуальных светильниках.
На базе ацетилена осуществляется синтез взрывчатых веществ, применяемых в виде детонаторов. В реакции окисления этого алкина в кислороде воздуха наблюдается сильное пламя. Не меньшую ценность имеет в химической промышленности и метан. Помимо применения его в качестве исходного вещества для производства ацетилена, он в больших количествах потребляется в качестве природного углеводорода в топливной промышленности. При его сгорании выделяется существенное количество теплоты.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
Query failed: connection to localhost:9312 failed (errno=111, msg=Connection refused).
monateka.com
Как получают ацетилен из метана
Ацетилен представляет собой вещество, относящееся к классу алкинов. Иными словами, это углеводород, который имеет в каждой молекуле тройную связь. При этом химическая формула ацетилена выглядит следующим образом: С2Н2. Само по себе это вещество является бесцветным газом, который значительно легче воздуха. Получают ацетилен из метана. Вещество является химически активным и взрывоопасным.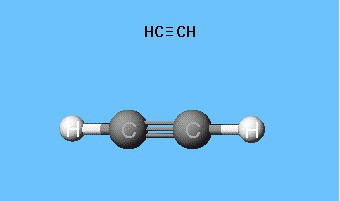
Как получить ацетилен
Из метана в домашних условиях получить ацетилен очень сложно. Самый простой метод выделения данного газа – это реакция воды с карбидом кальция. Многие из вас, наверное, помнят, как бросали в лужи кусочки этого вещества и какая происходила реакция. При этом отмечалось бурное шипение. Что касается карбида кальция, то он постепенно таял, образовывая большое количество пены. Подобную реакцию можно записать так:
СаС2+2Н2О=С2Н2+Са(ОН)2.
Многие используют технический карбид кальция, который содержит большое количество примесей. В результате этого при реакции с водой вещество выделяет неприятный запах. Возникает он из-за образования вместе с ацетиленом незначительного количества паров ядовитых газов. Чаще всего это фосфин, сероводород и так далее. Этот способ считается самым распространенным, так как получить ацетилен из метана можно только при помощи специального оборудования.
Получение в промышленности
Как получают ацетилен из метана в промышленных условиях? В настоящее время применяется только один метод – крекинг. В процессе получения ацетилена осуществляется разрыв связей -С-С. Происходит это в присутствии катализаторов и при воздействии достаточно высоких температур. Для получения используется метан – природный газ. Это недорогое и легкодоступное сырье. Именно по этой причине крекинг является наиболее обоснованным методом как в экономическом плане, так и в техническом.
Видео по теме
Как осуществляется крекинг
Осуществить превращения "метан - ацетилен" можно несколькими способами. В первом случае природный газ пропускают через предварительно раскаленные электроды. При этом температура может доходить до 1600 °С. После нагрева происходит быстрое охлаждение. Второй способ основан на использовании тепла, которое образуется в результате частичного сгорания ацетилена.
Уравнения реакций "метан - ацетилен" записываются следующим образом:
- В I случае: 2СН4 = С2Н2 + 3Н2.
- Во II случае: 6СН4 + 4О2 = С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О.
Специалисты не рекомендуют использовать для хранения ацетилена баллоны, оснащенные вентилями из бронзы. Ведь в состав этого сплава входит медь. Так как ацетилен химически активен, он может вступить в реакцию с металлом. В результате этого образуются взрывоопасные соли.
Применение ацетилена
Ацетилен – это вещество, которое широко применяется в различных промышленных отраслях. Чаще всего этот газ используют при изготовлении этилового спирта в качестве основного сырья. Помимо этого, ацетилен применяют для получения определенных видов каучука, уксусной кислоты и пластмассы.
Активно используется данный газ и при проведении сварочных работ, а также при резке различных металлов. Стоит отметить, что при окислении кислородом ацетилена образуется сильное пламя. Газ является источником достаточно яркого света в светильниках автономного типа. На основе ацетилена производят взрывчатые вещества, которые в дальнейшем применяются как детонаторы.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
Query failed: connection to localhost:9312 failed (errno=111, msg=Connection refused).
monateka.com
Получение ацетилена из метана - Справочник химика 21
из "Технология нефтехимических производств"
Основной целью термического разложения метана в промышленности является производство ацетилена и сажи. Получение этих продуктов в нефтехимии основано на частичном сжигании метана, при котором термическое разложение одной части газа происходит за счет тепла сгорания другой его части (аналогично автотермическому крекингу в нефтяной промышленности). [c.99] В прошлом были попытки провести пиролиз метана и для производства жидких углеводородов и водорода (одновременно с сажей), но эти работы не были осуществлены в промышленном масштабе. [c.99] Рост химической промышленности во всем мире и, в особенности, производство пластических масс стимулируют соответствующее увеличение производства ацетилена. [c.99] Выбор конкретного процесса получения ацетилена зависит от капиталовложений, себестоимости энергетических затрат, уровня производительности труда и требует изучения многих факторов. [c.99] В самом деле, в последние 10 лет постоянно проводились исследования и поиски новой технологии как для традиционного метода получения ацетилена (из карбида кальция), так и для процессов, основанных на метане, высших углеводородах и нефтяных фракциях. [c.99] Делаются попытки усовершенствовать производство карбида кальция, однако это связано с большим расходом электроэнергии и сырья, высокими капиталовложениями и себестоимостью кроме того, подобные установки технологически трудноуправляемы. Было предложено, например, для получения необходимого тепла сжигать (в присутствии кислорода) часть кокса для уменьшения расхода электроэнергии. При этом образуется много окиси углерода, использование которой в процессе также может снизить себестоимость ацетилена. В настоящее время, однако, большую часть ацетилена получают старым методом (из карбида кальция). Карбид кальция обладает тем преимуществом, что из него получается ацетилен 97— 98%-ной концентрации, поэтому дальнейшая его очистка очень проста его легко транспортировать. Ацетилен же, полученный из ме-. тана (и других углеводородов), требует трудоемкой операции выделения его из газовых смесей и транспортирования в резервуарах под давлением. Критерием выбора конкретного процесса получения ацетилена из метана (или его гомологов) служат его основные характеристики (термодинамика, кинетика, механизм реакции). [c.99] Термодинамика термического разложения метана. Общее представление о термической стабильности метана и его гомологов, по сравнению с термической стабильностью ацетилена, можно получить, рассмотрев зависимость стандартной свободной энергии образования углеводородов из простых веществ, отнесенной к одному атому углерода, от температуры (рис. 33). [c.100] Ацетилен термодинамически неустойчив в широком интервале температур (до 3923 °С). Интересно, что величина свободной энергии образования ацетилена имеет положительные значения до 3923 °С и уменьшается с увеличением температуры, в то время как- для многих других углеводородов характер этой зависимости обратный (рис. 34). [c.100] Эти зависимости приведены в табл. 19. [c.101] Уменьшение давления способствует образованию ацетилена, так как реакция протекает с увеличением числа молей, однако влияние этого фактора на степень конверсии относительно невелико. Поэтому в промышленных условиях часто давление повышают, благодаря чему увеличивается производительность незначительным эффектом некоторого снижения конверсии при этом пренебрегают. [c.102] Очевидно, получение этилена из метана неэкономично, так как метан термодинамически более стабилен, чем этилен, почти до 1427 °С, но по сравнению с ацетиленом метан стабильнее лишь мак-сим м до 1250 °С. С другой стороны, конверсия этана в этилен проходит заметью от 977 °С и в ацетилен — от 1000 °С (АО = 0), т. е. образовавшийся из метана этилен превращается также в ацетилен. [c.102] Оптимальная температура для этого типа реакций 1000—1100 °С. [c.103] Продукты пиролиза метана (например, ацетилен) могут разлагаться до углерода н водорода (табл. 20), поэтому применяют небольшое время контакта и быстрое охлаждение (закалку) реакционной смеси. [c.103] Кинетика пиролиза метана долгое время являлась предметом многочисленных исследований. Большая часть результатов не совпадает, так как применялись различные методы экспериментов (в динамической или статической системах, аналитические и т. д.) и рабочие условия различные материалы и соотношения поверхности и объема реакторов. При изучении опубликованных данных ио кинетике пиролиза необходимо учитывать все эти факторы. [c.103] Значения к, рассчитанные по этим соотношениям, характеризуют общую скорость разложения метана в широком интервале температур (900—1600 °С) и при различной степени конверсии. [c.104] Энергии активации для этой реакции при 800—1200 °С в статической и динамической системах по некоторым данным составляют 73 300 — 87 250 кал моль. [c.104] В ходе исследований было установлено, что водород служит ингибитором разложения метана. Влияние индукционного периода следующее длительность его возрастает с уменьшением соотношения поверхности и объема реактора. Этот факт вероятнее всего связан с зависимостью скорости передачи тепла от соотношения поверхности и объема реактора. [c.104] При термическом разложении метана образуются, с одной стороны, промежуточные продукты (СаНе, С2Н4, С2Н2, СеНе) с малым временем существования и, с другой стороны, углерод и водород. Образование углерода и водорода — результат преимущественно последовательных реакций (разложения промежуточных продуктов) н, в меньшей степени, параллельных реакций разложения метана на элементы. [c.104] Недавно это было подтверждено экспериментально при использовании аналитического, а не традиционного —манометрического метода. Измеряли количество метана, превращенного в продукты реакции, при различных температурах в статической и динамической системах. [c.104]Вернуться к основной статье
chem21.info