Как хромировать металл. Металл хромированный
| Основные Продукции: | Машины Вакуумные Покрытия, Плазмы Шлифовальные Машины, Многофункциональный Ионный Покрытие Машины, Магнетронного Распыления Покрытие Машины, Испарения Вакуума Покрытие Машины |
ru.made-in-china.com
Характеристика и качества хрома
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда. Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr2O3) считается основным соединением хрома. Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются. Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода. Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С - +3500С. Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
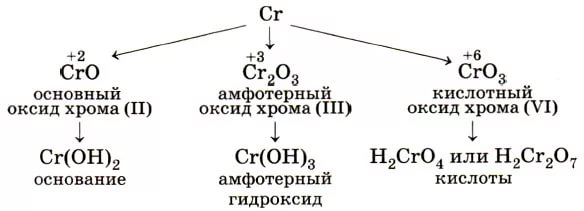
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению. Хром с валентностью, равной +3, является активным участником синтеза глюкозы. Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ. Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
|
+3 |
Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный |
Cr3+ (зеленые или лиловые соли)[Cr(OH)4]- (зелёный) |
|
| +4 | CrO2 | не существует | Несолеобразующий | - |
Встречается редко, малохарактерна |
| +6 | CrO3 (красный) |
h3CrO4h3Cr2O7 |
Кислотный |
CrO42- (хроматы, желтые)Cr2O72- (дихроматы, оранжевые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
mining-prom.ru
«Космическое» сияние хромированных ограждений
Пожалуй, самое привлекательное в лестницах – их ограждения. Сам пролет может быть выполнен из неприметных материалов, но красивые фигурные балясины или тонкие стойки заставят конструкцию заиграть. Поручни придают динамику, они ведут за собой, а стройный ряд столбиков рождает ритмичность. Сегодня мы хотим описать современные балясины из металла: хромированные перила и ограждения из нержавейки. Поговорим о сборке: блестящая труба для ограждения легко монтируется в пазы. Такие балясины продаются в комплекте с крепежными деталями. Немного углубимся в химические процессы и проведем сравнительный анализ хромированных и нержавеющих изделий.
Замечательное изобретение – нержавейка
Нержавеющая сталь потому так называется, что не подвергается коррозии, поскольку имеет низкое содержание углерода. Прочность и стойкость к ржавчине, а также «фирменный» стальной блеск придает металлу химический элемент хром. Для повышения коррозионных свойств этот сплав дополнительно легируют титаном, никелем и молибденом, которые тоже выполняют свою роль в обеспечении защиты от ржавления и повышения прочности. При эксплуатации деталей на их поверхности образуется тончайшая пленка окислов, которая и является защитным слоем.
Как хромируют детали
Хромированная труба для перил выглядит нарядно и блистательно. Натертые до торжественного блеска, поручни и ограждения из хромированной стали делают лестницу феерической космической гостьей. Как же достигается такая сверкающая гладкость? Что такое хромирование?
Практикуется два способа хромирования:
- Диффузионный способ: во время процесса хромирования происходит насыщение поверхности металла мельчайшими частичками хрома.
- Электролитический способ: под воздействием тока частички хрома из хромового электролита оседают на металл.
Примечание:
Покрытые хромом поверхности приобретают дополнительную твердость и надежно защищены от коррозии.
Сам процесс включает в себя несколько этапов:
- глубокая и тонкая очистка детали;
- подготовка к процессу;
- погружение в емкость с раствором электролита;
- выравнивание температуры;
- подключение электрического тока;
- выдержка до нужного состояния.
Некоторые умельцы сами пытаются хромировать металл. Но поскольку этот процесс чрезвычайно опасен, нужно очень внимательно соблюдать технологию.
Хром и нержавейка: различия между ними
Люди, далекие от химии и металловедения, обычно не различают хромированную и нержавеющую сталь. Но отличить их не трудно. Хромированные поручни сильно и ярко блестят с красивым зеркальным отливом. А если смотреть исходя из состава, эксплуатационных и физических качеств, то хромирование уступает нержавейке. Хромируют, в основном, черную сталь и разные сплавы. Стальная труба, покрытая одним слоем хрома, на открытом воздухе может со временем заржаветь. На ней образуется пористая поверхность, которая чувствительна к высокой влажности и к перепадам температур.


Такие изделия подходят в основном для внутренних помещений. Вообще хромированный предмет крайне чувствителен к воздействиям, ударам, царапинам. Места сколов и повреждений могут заржаветь. Лестничные поручни – это такие поверхности, которые постоянно «наглаживаются» руками. Со временем тонкий слой хрома на сверху перил истирается. Восстановить его невозможно. Тогда как нержавеющая сталь в этом смысле вечна, она не сотрется. Ее трудно поцарапать и повредить. Но даже поврежденные места перил легко восстановить шлифовкой.
Сборка модных поручней: легко!
Стальные лестничные балясины очень быстро и легко собираются. Их не надо сваривать, как другие металлические детали. Одна труба вставляется в другую и закрепляется винтами и клепками. Оставшиеся неприкрытыми стыки прячутся и декорируются декоративными металлическим кольцами.
Посмотрите видео, в котором показывается, как установить хромированные ограждения на лестницу. Узнали ли вы что-то новое? Напишите нам.
Оцените статью: Поделитесь с друзьями!7lestnic.com
| Основные Продукции: | Машины Вакуумные Покрытия, Плазмы Шлифовальные Машины, Многофункциональный Ионный Покрытие Машины, Магнетронного Распыления Покрытие Машины, Испарения Вакуума Покрытие Машины |
ru.made-in-china.com
Как хромировать металл » VripMaster
Процесс хромирования заключается в получении электролитическим методом тонкого поверхностного слоя хрома на детали, изготовленной обычно из металла с низкой коррозионной стойкостью. Хром - довольно распространенный металл, который, однако, почти не используется в чистом виде. Вы не найдете предметы, изготовленные из хрома, однако хромирование широко распространено. Этот процесс позволяет получить очень яркие, глянцевые, зеркальные металлические поверхности деталей автомобилей и мотоциклов, сантехники, многих других бытовых и промышленных объектов. Обладая высоким сопротивлением к окислению, хром защищает металлы и уменьшает поверхностное трение. Хромирование - высокоспециализированный процесс с использованием высокотоксичных, летучих и канцерогенных веществ (таких как хромовая и серная кислоты), с очень вредными отходами производства. Если вы заинтересовались этим процессом, обязательно соблюдайте все меры безопасности.
Метод 1 из 4: Использование хрома для декоративных целей
- Хром можно наносить в декоративных целях на такие подверженные коррозии металлы, как сталь, латунь, медь, алюминий, нержавеющая сталь.
- Хром хорошо отражает свет, имеет более эстетичный и гладкий вид по сравнению с другими покрытиями, например краской.
- При декоративном электролитическом хромировании никель и хром наносятся на металлический объект, например на обод колеса или капот автомобиля.
- Никель обеспечивает гладкость, блеск поверхности и повышает сопротивление коррозии.
- Очень тонкий слой хрома поверх никеля предохраняет его от потускнения, царапин и ржавчины.
Метод 2 из 4: Используйте покрытие "твердый хром" для крупных деталей
- Покрытие "твердый хром", также известное как "промышленный" или "инженерный" хром, используется для нагруженных деталей (например стальных) крупных механизмов с целью уменьшить их трение и износ.
- Покрытие "твердый хром" не тверже других хромовых покрытий, оно просто достаточно толстое для того, чтобы можно было измерить его твердость.
- Покрытия типа "твердый хром" толще декоративных покрытий на три порядка.
Метод 3 из 4: Раствор шестивалентного хрома
- Для получения 3,79 литра (1 галлона) раствора смешайте 936 грамма (33 унции) хромовой кислоты и 9,36 грамма (0,33 унции) дистиллированной воды.
- Пропорции могут быть несколько другими, в зависимости от площади хромируемой поверхности.
- Размешайте раствор в иммерсионной ванне, используемой для опытов или химической обработки.
- Обезжирьте и тщательно очистите детали перед нанесением на них покрытия.
- При приготовлении раствора осторожно доливайте ингредиенты, избегая их разбрызгивания.
- Помните, что раствор канцерогенно опасен.
- Соблюдайте предельную осторожность, поскольку раствор склонен к возгоранию, а также может взаимодействовать со множеством других веществ, что небезопасно.
Метод 4 из 4: Система электролиза
-
Растворите никелевые пластины в хромовой/серной кислоте.
-
Подсоедините положительный полюс источника питания к раствору.
- Подсоедините отрицательный полюс к детали и погрузите ее в раствор.
- Отрицательно заряженная деталь будет притягивать к себе положительно заряженные ионы металла.
- Толщина покрытия определяется продолжительностью процесса электролиза.
- Поддерживайте температуру раствора в интервале 35-46 градусов Цельсия (95-115 градусов Фаренгейта) для получения декоративного покрытия.
- Для получения покрытия типа "твердый хром" поддерживайте температуру раствора в пределах 49-66 градусов Цельсия (120-150 градусов Фаренгейта).
- При работе с реактивами обязательно используйте респиратор и другие средства защиты.
-
После нанесения покрытия промойте деталь в проточной воде несколько раз.
Советы
- Для получения однородного покрытия подогрейте деталь до температуры раствора, прежде чем погрузить ее в ванну.
- Хромовая кислота очень едкая, тем не менее ее можно хранить в плотно закрытой стеклянной посуде, фильтруя перед очередным использованием.
Предупреждения
- Правила утилизации растворов кислот жестко регулируются законодательством; следуйте правилам, установленным в вашей местности.
- При работе с кислотами обязательно используйте средства защиты, такие как защитные очки, фартук, респираторная маска, плотные резиновые перчатки.
- Хромовая и серная кислота вступают в опасные реакции с ацетоном, спиртами, натрием, калием, аммиаком, мышьяком, сероводородами, фосфором, пиридином, селеном, серой и многими другими веществами.
- Избегайте любого контакта кислот с кожей.
- Перед началом работы запаситесь аптечкой, легко доступной для всех учасников эксперимента.
- Раствор хромовой кислоты вступает в быструю реакцию со многими материалами, включая распространенные виды топлива, что может привести к возгоранию и пожару.
- Избегайте вдыхания любых паров.
- Помните, что раствор хромовой кислоты является канцерогеном.
Что вам понадобится
- Кристаллы хромовой кислоты
- Жидкая серная кислота
- Дистиллированная вода
- Никелевые пластинки
- Источник питания
- Средства безопасности: защитные очки, фартук, маска, резиновые перчатки
- Устройство электролиза
- Химическая посуда (ванна)
vripmaster.com
Металлы хромирование - Справочник химика 21
Защита металлов и их сплавов от коррозии путем электроосаждения на их поверхности тонкого слоя другого металла (хромирование, никелирование, оцинкование и др.) позволяет ежегодно экономить. многие тысячи тонн металла и одновременно удлинять срок службы металлических изделий. [c.307]
Применение хрома, его сплавов и соединений. Вследствие легкой пассивируемости хром применяют для получения покрытий на металлах - хромирование, а также для получения различных сплавов, так как придает сталям жаропрочность, твердость, кислотоупорность и коррозионную стойкость. Хром содержат все нержавеющие стали. [c.246]
Хромированные металлы — хромированные ме [c.195]
Одновременно с эти-,ми связями подвергались диффузионному хромированию и образцы на изгиб. На фиг. 140 показаны образцы из этой же стали, испытанные на изгиб. При изгибе образцов почти на 180° С хромированный слой сохранялся, и при тщательном осмотре трещин на поверхности не обнаружено. Хромированный слой вязкий, удлиняется вместе с основным. металлом. Хромированные связи 218 [c.218]
Наибольшее распространение электрохимические методы получили в металлургии цветных и редких металлов и в производстве ряда других минеральных веществ. В настоящее время большое значение приобрели электрохимические методы защиты металлов и их сплавов от коррозии путем гальваностегического покрытия их тонким слоем другого стойкого металла (хромирование, никелирование, меднение, серебрение, золочение, цинкование, кадмирование, свинцевание, лужение и т. п.). Благодаря применению этих методов защиты удается ежегодно сохранить тысячи тонн дорогостоящих цветных металлов и одновременно удлинить срок службы металлических изделий., [c.551]
Ситаква (ТУ 38.401819-90) — пожаро- и экологически безопасный ПИНС, предназначен для защиты от коррозии окращенных и неокращенных запасных частей из черных и цветных металлов, хромированных поверхностей, подкапотного пространства автомобилей. Наносят окунанием, кистью или пневмораспылением. Выпускают в виде концентрата и перед применением разбавляют водой. Образует на поверхности металла необратимую пленку, не смываемую водой. [c.395]
После наполнения препаратом тубы укупориваются одним из трех методов герметизащ1и туб сварка ультразвуком, токами высокой частоты и эле ктронагревательными колодками. После сварки концы туб обрезаются и туба кодируется. В дальнейшем технология упаковки туб ничем не отличается от технологии упаковки алюминиевых туб. Кроме туб (речь о которых шла выше), в промьшшенности широко применяются различные кольца, крышки, корпуса для декоративной косметики, колпачки, а также пеналы (для губных помад и декоративных препаратов) внутренние и наружные, изготовленные из алюминия с последующей отделкой (полировкой, анодированием и декорированием) металлические изделия, изготовленные из сплавов металлов (хромированные, декорированные) и с более сложной обработкой и отделкой, в дорогих и сувенирных изделиях декоративной косметики (губные [c.225]
Для защиты сталей от окисления используются термодиффузиоыные способы упрочнения поверхности металлов (хромирование, алитирование, силицирова-ние) [50]. [c.138]
Борьбу с ржавлением люди начали вести с получением первых железных изделий. Каких только аредств ни придумывали — терли металл песком, тряпками, покрывали его толстым слоем жи,ра, масла, воронили ... Способом предохранения металла от 1ржавления является масляная окраска,, но и она не всегда надежно защищает металл. Хромирование, никелирование и даже серебрение также не всегда предотвращали ржавление. Инолда химикам приходилось применять по рытия металлических поверхностей пленкой из металла палладия, который значительно дороже золота, но и это не всегда приводило к успеху. [c.42]
При парофазном способе диффундирующий металл (хром) переносится к по крьюаемой поверхности посредством паровой фазы, образующейся в процесс нагр>ева металла. Хромирование ю паровой фазы может осуществляться кон тактньп , неконтактньп или вакуумным способами. При хромировании кон тактным способом юделия и хромсодержащее вещество (чистый хром, ферро хром и др.) помещают в герметически закрытые контейнеры. Испарение металла происходит в реакционном пространстве в непосредственной близости от мес соприкосновения кусочков или порошка хрома с поверхностью изделия. Режи процесса выбирают таким образом, чтобы получить диффузионный слой опре деленной толщины с необходимой концентрацией хрома на его поверхности. [c.501]
chem21.info
Как хромировать металл
Вам понадобится
- - мелкозернистая наждачная бумага на тканевой основе;
- - серная кислота;
- - стеклянная или эмалированная емкость;
- - ангидрид хромовый;
- - аккумуляторная батарея;
- - свинцовые пластины;
- - гашеная известь;
- - едкий калий;
- - жидкое стекло.
Инструкция
- Приготовьте металлическую поверхность к хромированию. Удалите окислы и ржавчину, образовавшиеся со временем под воздействием окружающей среды. Затрите металл мелкозернистой наждачной бумагой.
- Теперь поверхность металла нужно обезжирить. Используйте специальную смесь на основе гашеной извести: на 1 литр воды – 35г гашеной извести, 3г жидкого стекла и 10г едкого калия. Температура смеси 90оС. Обезжиривайте в течение 1 часа.
- Промойте после обезжиривания теплой водой.
- Приготовьте в эмалированной посуде электролитическую ванну следующего состава: на 1л воды – 300г хромовой кислоты и 3г концентрированной серной кислоты. Нагрейте до 50оС и налейте немного больше половины емкости дистиллированной воды. Всыпьте хромовый ангидрид и перемешайте. Затем долейте воду до нужного объема.
- Разместите по обе стороны хромируемой металлической детали две свинцовые пластины, содержащие до 7% сурьмы или олова. Если свинцовых пластин больше, то разместите их вокруг металла. По размеру они должны быть в 2 раза больше, чем хромируемая деталь. Свинец послужит анодом, в то время как хромируемый металл – катодом. Температура ванны - 60оС. Время устанавливайте, ориентируясь на то, какого результата хотите достигнуть. Аккумуляторную батарею автомобиля используйте для подачи тока. Сила тока должна быть 1.60 – 3.10 кА / кв. м. DC.
- После того как металл будет извлечен вами из ванны, промойте деталь водой и насухо протрите кусочком мягкой ткани. Если надо, отполируйте ее.
- Если вы заметили, что хром на металлической детали не оседает, проверьте контакт у катода или анода. Возможно, что поверхность анода покрыта пленкой окислов. Измерьте температуру электролита, уменьшите ее, если она выше указанных значений. Убедитесь, что количество серной кислоты не превышает допустимого.
completerepair.ru