Кислород: состав молекулы, физические и химические свойства, аллотропия. Кислорода хим свойства
Химические свойства кислорода – взаимодействие (8 класс, химия), физические особенности
Кислород – самый распространенный химический элемент на планете. Его массовая доля в земной коре составляет 47,3%, объемная доля в атмосфере – 20,95%, а массовая доля в живых организмах – около 65%. Что представляет из себя этот газ, и какими физическими и химическими свойствами кислород обладает?

Кислород: общая информация
Кислород – неметалл, в нормальных условиях не имеющий цвета, вкуса и запаха.

Рис. 1. Формула кислорода.
Практически во всех соединениях, кроме соединений с фтором и пероксидов, он проявляет постоянную валентность II и степень окисления -2. Атом кислорода не имеет возбужденных состояний, так как на втором внешнем уровне нет свободных орбиталей. Как простое вещество кислород существует в виде двух аллотропных видоизменений – газов кислорода O2 и озона O3.
при определенных условиях кислород может находится в жидком или твердом состоянии. они в отличие от газа имеют цвет: жидкий – светло-голубого цвета, а твердый кислород имеет светло-синий оттенок.

Рис. 2. Твердый кислород.
Кислород в промышленности получают с помощью сжижения воздуха с последующим отделением азота за счет его испарения (имеется разница в температурах кипения: -183 градуса для жидкого кислорода и -196 градусов для жидкого азота).
Химические свойства взаимодействия кислорода
Кислород является активным неметаллом. Кислород способен вступать в реакцию со всеми элементами кроме неона, гелия и аргона. обычно реакции этого газа с другими веществами экзотермичны. Процесс окисления, идущий при одновременном выделении энергии в виде тепла и света, называется горением. Очень важно использование органических соединений, в частности, алканов, в качестве топлива, так как при свободно-радикальной реакции горения выделяется большое количество тепла:
Ch5 +2O2 = CO2 +2h3O +880 кДж.
С неметаллами кислород обычно вступает в реакцию при нагревании, образуя при этом оксид. Так, реакция с азотом начинается лишь при температуре выше 1200 градусов или в электрическом разряде:
N2 + O2 =2NO.
Кислород также реагирует с металлами:
3Fe + 2O2= Fe3O4 (в результате реакции образуется соединение – оксид железа)
в природе существует еще более сильный окислитель, чем кислород, это – озон. Он способен окислять золото и платину. В естественных условиях озон образуется из кислорода воздуха во время грозовых разрядов, а в лаборатории – пропусканием электрического разряда через кислород: 3О2 = 2О3 – 285 кДж (эндотермическая реакция)

Рис. 3. Озон.
Самое значительное соединение кислорода – вода. Около 71% земной поверхности занимает водная оболочка. Угловые молекулы воды полярны, каждая из них образует четыре водородные связи: две – как донор протонов и две – как акцептор протонов. Образуются ассоциаты (h3O)x, где x меняется от 2 до 5. В водяном паре присутствуют димеры (h3O)2, а в конденсированных фазах молекула воды может находиться в тетраэдрическом окружении четырех других молекул. если бы молекулы воды не были ассоциированы, то ее температура кипения составляла бы не 100 градусов, а около 80 градусов.
Что мы узнали?
Кислород – сильный окислитель и активный неметалл, поэтому его изучение начинается уже в 8 классе. Он является бесцветным газом без запаха, но также при определенных условиях может находится в жидком и твердом состояниях. Он взаимодействует с металлами и неметаллами, образуя оксиды, а также реагирует с большинством простых веществ.
Тест по теме
состав молекулы, физические и химические свойства, аллотропия
Молекула кислорода O2 состоит из двух атомов кислорода, связанных ковалентной неполярной связью.
Представление о наличии в молекуле кислорода двух ковалентных связей не соответствует, в частности, её магнитным свойствам (жидкий кислород притягивается магнитом), поэтому лучше не останавливаться на этом моменте. В высшей школе изучается метод Молекулярных орбиталей о наличии в молекуле кислорода двух неспаренных электронов.
Кислород — бесцветный прозрачный газ, без вкуса, без запаха. Немного тяжелее воздуха, сравнительно мало растворим в воде (в 1 литре воды при 20°C растворяется около 0,03 л кислорода).
Химические свойства:
Кислород активный окислитель. Многие вещества взаимодействуют с кислородом с выделением теплоты и света. Такие реакции называются горением:
- S + O2 = SO2 (образуется оксид серы (IV), или серни́стый газ)
- C + O2 = CO2 (образуется оксид углерода (IV), или углекислый газ)
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе, так как выделяющаяся теплота не тратится на нагревание азота воздуха. Температура горения в чистом кислороде значительно выше.
Галогены, золото и платина не соединяются с кислородом напрямую, но можно получить их оксиды, в которых они проявляют положительную степень окисления, например, оксид хлора (VII) Cl2O7.Фторид кислорода O+2F2−1 — соединение, в котором кислород проявляет положительную степень окисления.
- Железо горит в кислороде с образованием железной окалины (представляет из себя смешанный оксид Fe+2O•Fe2+3O3):3Fe + 2O2 = Fe3O4
- При пропускании через воздух электрических разрядов, или во время грозы кислород превращается в озон — аллотропное видоизменение, состоящее из трех атомов кислорода:3O2 2O3
- Пропитанные жидким кислородом угольный порошок, древесная мука и другие горючие материалы обладают взрывчатыми свойствами, используются при подрывных работах.
- При участии кислорода в природе совершается важнейший процесс — дыхание. Транспорт кислорода из легких человека в ткани осуществляет гемоглобин крови, образующий комплекс с кислородом.
Кислород применяется
- в медицине при затрудненном дыхании,
- в металлургии,
- для газовой сварки и резки металлов и т. д.
Аллотропия — образование одним элементом нескольких простых веществ.
Элемент кислород образует аллотропные видоизменения кислород O2 и озон O3.
Озон — газ, образуется в природе во время грозы и при окислении смолы хвойных деревьев. Придает воздуху запах свежести. Растворяется в воде гораздо лучше кислорода. Сильный окислитель. Спирт и некоторые другие вещества в озоне самовоспламеняются. Это связано с самопроизвольным распадом озона на молекулу кислорода и атоммарный кислород, обладающий большой окислительной активностью:O3 O2 + O
Озон можно получить пропусканием через воздух электрических разрядов:3O2 2O3
Применяется в озонаторах для уменьшения содержания в воздухе болезнетворных бактерий, для обеззараживания водопроводной воды на станциях водоочистки.
Озоновый слой в верхних слоях атмосферы (так называемый, озоновый экран) задерживает жесткое ультрафиолетовое излучение, без чего жизнь на поверхности суши была бы невозможна.
автор: Владимир Соколов
staminaon.com
Физические и химические свойства кислорода

Разделы: Химия
Цели - учащиеся должны получить сведения об открытии кислорода, познакомиться с планом характеристики элемента и простого вещества, изучить свойства кислорода; развивать умения составлять простые уравнения реакций и соответствующие практические умения при выполнении лабораторных опытов; воспитывать чувство уважения к ученым - химикам.
Оборудование - газометр с кислородом, прибор для собирания газов методом вытеснения воды и воздуха, цилиндры, стеклянные пластинки, ложки для сжигания веществ, колокол; реактивы - сера (крист), фосфор, стальное перо, песок, уголь, оксид фосфора, известковая вода; таблицы: "Способы собирания газов", "Распространение элементов в природе"
Ход урока
I. Организационный момент.
II. Краткий анализ контрольной работы (Существенные ошибки).
III. Изучение нового материала.
1. Открытие кислорода. (Вещество, спасшее мышонку жизнь). Опыт Пристли (рассказ учителя или сообщение ученика)
В конце 18 века англ. ученый Д. Пристли занимался нагреванием разных веществ, собирая солнечные лучи при помощи увеличительного стекла. Когда он накалил так оксид ртути, то выделилось много газа, Пристли подумал, что это воздух. Но когда он опустил в сосуд с собранным газом горящую свечу, то свеча горела блестящим пламенем. Д. Пристли поместил одну мышь в сосуд с обыкновенным воздухом , а другую в такой же сосуд с полученным им газом. Первая мышь быстро задохнулась, а вторая в это время ещё чувствовала себя хорошо.
2. Нахождение в природе . (комментированное чтение).
Кислород - самый распространенный химический элемент в земной коре Рисунок 23 учебника Г.Е. Рудзитиса. Воздух содержит 20,9 процента кислорода, что составляет примерно одну пятую по объёму. Кислород входит в состав почти всех окружающих нас веществ -песка, воды, белков, жиров,углеводов .
3. Характеристика элемента и простого вещества. (Беседа)
Сегодня на уроке мы познакомимся с физическими и химическими свойствами самого распространенного элемента на земле - кислорода. Для полной характеристики мы составим план изучения вещества.
План изучения: элемента простого вещества
1. Химический знак - О 1.Химическая формула - О2
2. Относит.атомная масса-А r(О)-16 2.Относит. мол. масса Мr -32
3. Нахождение в природе 3. Физические свойства
4. Валентность -2 4.Химические свойства
5. Применение
6. Способы получения
4. Выполните задание. (Чтение учителя и ответы уч-ся.) В каком из ниже перечисленных случаев кислород выступает как химический элемент, а в каком как простое вещество?
А). Поддерживает дыхание и горение (простое в-во)
Б). Является одним из составных частей воздуха (простое в-во)
В). Входит в состав воды и оксида углерода (элемент)
Г). Взаимодействует со многими простыми и сложными веществами (простое в-во).
5. Беседа по вопросам:
1). Какие свойства относят к физическим? (Агрегатное состояние, цвет, запах, вкус, температура кипения и температура плавления).
2). Что вам известно о физических свойствах кислорода? (Газ без цвета и запаха, поддерживает горение).
6. Физические свойства кислорода ( Самостоятельная работа с учебником). Прочитайте в параграфе 20 о физических свойствах кислорода, выпишите темп. сжижения ( -183 С), темп. затвердевания (-218,8 С) кислорода.
7. Получение кислорода нагреванием перманганата калия в стакан путем вытеснения воздуха. Демонстрация получения кислорода
8. Химические свойства кислорода (хим. св-ва - это способность вещества при определенных условиях превращаться в другие вещества)
Опыт № 1 "Горение угля в кислороде". Кусочек древесного угля поместить в ложечку для сжигания веществ. Нагреть до тления и внести в стакан с кислородом. Углерод сгорает ослепительно.
1) Какие признаки реакции вы наблюдали? - Выделение света и тепла. Ложечку вынуть, а в сосуд влить известковую воду.
2) Что вы видите? - Помутнение известковой воды.
3) О чем это говорит? - О присутствии углекислого газа.
4) Какие условия необходимы для реакции? Нагревание и соприкосновение веществ.
Запишем уравнение реакции: С + О2=СО2
Опыт № 2 "Горение серы в кислороде" Серу нагреть над пламенем спиртовки, затем поместить в кислород.
1) Где горение происходит быстрее в воздухе или в кислороде? - В кислороде. В воздухе лишь пятая часть кислорода, поэтому горение происходит медленнее.
Запись уравнения реакции: S + O2=SO2, горению подвергаются многие вещества, например, фосфор и железо. Рисунок в учебнике.
Уравнения реакций:
4Р + 5О2 = Р2О5,
Fe + О2 =FeO Fe2O3 (Fe3O4)
Что такое горение? Какие вещества образовались в результате реакций горения? - Оксиды. Запись определений в тетрадь)
Горение - это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
IV. Закрепление
1. Рассмотрите рис 25 .Собирание кислорода методом вытеснения воды. На чём основан этот метод? (кислород растворяется в воде). Почему кислород можно получать путем вытеснения воздуха? (Кислород тяжелее воздуха)
2. Составьте уравнения реакций соединения кислорода с кальцием, кремнием, натрием, бериллием, магнием.
3. Можно ли собрать кислород в пустой стакан, стоящий на столе? (Да)
Домашнее задание: Рудзитис - параграф 18, 20. Упр. 4, 7 стр.53
xn--i1abbnckbmcl9fb.xn--p1ai
V. физические и химические свойства кислорода.
V. Физические и химические свойства кислорода.
Химический элемент кислород образует два простых вещества - кислород О2 и О3 различные по физическим свойствам.
Кислород О2— газ, не имеющий цвета и запаха. Молекула его О2. Она парамагнитна (притягивается магнитом), так как в ней содержатся два неспаренных электрона. Строение молекулы кислорода можно представить в виде следующих структурных формул:
О — О или О — О
Атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух -разрыхляющих орбиталей находится по одному неспаренному электрону.
Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль.
Молекула кислорода О2 довольно инертна. Устойчивость молекулы кислорода и высокая энергия активации большинства реакций окисления обусловливают то, что при низкой и комнатной температурах многие реакции с участием кислорода протекают с едва заметной скоростью. Только при создании условий для появления радикалов — О — или R—О—О—, возбуждающих цепной процесс, окисление протекает быстро. В этом случае применяют, например, катализаторы, которые способны ускорить окислительные процессы.
При нормальных условиях плотность газа кислорода 1,42897 кг/мЗ. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) -182,9°С. При температурах от -218,7°С до -229,4°С существует твердый кислород с кубической решеткой (-модификация), при температурах от -229,4°С до -249,3°С — -модификация с гексагональной решеткой и при температурах ниже -249,3°С — кубическая -модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода.
При 20°С растворимость газа О2: 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая.
Высокая прочность химической связи между атомами в молекуле О2приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином крови, что обеспечивает перенос кислорода от органов дыхания к другим органам.
Со многими веществами кислород вступает во взаимодействие без нагревания, например, с щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2O, CaO и др., пероксиды типа Na2О2, BaO2 и др. и супероксиды типа КО2, RbО2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами.
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует со взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ.
Обычный атмосферный кислород состоит из смеси трех изотопов: 16О(99,7%), 17О(0,01%), 18О(0,2%). Ввиду того что содержание изотопов 17О и 18О в кислороде небольшое по сравнению с изотопом 16О, атомная масса кислорода принята равной 15,9994 у. е.
В зависимости от природных условий изотопный состав кислорода может изменяться, то обогащаясь тяжелыми изотопами, то обедняясь ими. Так, молекулы воды Н216О переходят в парообразное состояние относительно легче, чем молекулы Н217О и Н218О. Поэтому в состав водяных паров, испаряющихся из моря, входит кислород с относительно меньшим содержанием тяжелых изотопов, чем кислород, остающийся в морской воде.
С помощью атомов тяжелого изотопа кислорода 18О удалось выяснить «происхождение» кислорода, выделяемого растениями в процессе фотосинтеза. Раньше считали, что это кислород, высвобожденный из молекул оксида углерода, а не воды. В настоящее время стало известно, что растения связывают кислород оксида углерода, а в атмосферу возвращают кислород из воды.
Кислород образует соединения со всеми элементами, кроме некоторых благородных газов (гелия, неона, аргона). Так, с большинством металлов кислород реагирует уже при комнатной температуре, например:
2Na° + О2° = Na2+102-2
Na° -1(ё) Na+1 2восстановитель
O2° +2(ё) 2 2O-2 окислитель
2Zn° + O2° = 2Zn+2O-2
Zn° -2(ё) Zn+2 восстановитель
O2° +2(ё) 2 2O-2 окислитель
С неметаллами кислород реагирует, как правило, при нагревании. Так, с фосфором кислород активно реагирует при температуре 60°С:
4Р° + 502° = 2Р2+505-2
P° -5(ё) P+5 2 восстановитель
O2° +2(ё) 2 2O-2 5 окислитель
с серой — при температуре около 250°С:
S° + 02° = S+402-2
S° -4(ё) S+4 восстановитель
O2° +2(ё) 2 2O-2 2 окислитель
с углеродом (в виде графита) — при 700—800°С:
С° + О2° = С+4О2-2
C° -4(ё) C+4 восстановитель
O2° +2(ё) 2 2O-2 2 окислитель
Взаимодействие кислорода с азотом начинается лишь при 1200°С или в электрическом разряде:
N2 + О2 2NO - Q.
Кислород реагирует и со многими сложными соединениями, например, с оксидами азота он реагирует уже при комнатной температуре:
2N+2O + О2° = 2N+4О2-2
N+2 -2(ё) N+4 1 восстановитель
O2° +2(ё) 2 2O-2 2 окислитель
Сероводород, реагируя с кислородом при нагревании, дает серу:
2h3S-2 + О2° = 2S° + 2Н2О-2
S-2 -2(ё) S° восстановитель
O2° +2(ё) 2 2O-2 окислитель
или оксид серы (IV)
2h3S + ЗО2 = 2SO2 + 2Н2О
в зависимости от соотношения между кислородом и сероводородом.
В приведенных реакциях кислород является окислителем. В большинстве реакций окисления с участием кислорода выделяется тепло и свет — такие процессы называются горением.
Аллотропной модификацией кислорода является озон. Молекула его трехатомна — О3. Строение ее можно представить следующей структурной формулой:
О
О
О
Всякое изменение числа или расположения одних и тех же атомов в молекуле влечет за собой появление качественно нового вещества с иными свойствами. Озон по своим свойствам отличается от кислорода. В обычных условиях это газ синего цвета, с резким раздражающим запахом. Название его происходит от греческого слова «озейн», что означает запах. Он токсичен. В отличие от кислорода молекула озона характеризуется большой молекулярной массой, поляризуемостью и полярностью. Поэтому озон имеет более высокую температуру кипения (—111,9°С), чем кислород (— 182,9°С), интенсивную окраску и лучшую растворимость в воде.
В естественных условиях озон образуется из кислорода при грозовых разрядах, а на высоте 10—30 км — при действии ультрафиолетовых солнечных лучей. Он задерживает вредное для жизни ультрафиолетовое излучение Солнца. Кроме этого, озон поглощает инфракрасные лучи Земли, препятствуя ее охлаждению. Следовательно, аллотропная форма кислорода — озон — играет большую роль в сохранении жизни на Земле.
Образование озона сопровождается выделением атомного кислорода. Это в основном цепные реакции, в которых появление активной частицы (она обозначается обычно знаком *) вызывает большое число (цепь) последовательных превращений неактивных молекул, например O2. Цепную реакцию образования озона из кислорода можно выразить следующей схемой:
О2 + hv — О2*
*O2 + O2 = O3 + O
О + О2 = О3 ,
или суммарно:
3О2 = 2О3
В технике озон получают при электрических разрядах в озонаторах.
Молекула О3 неустойчива, и при большой концентрации озон распадается с взрывом:
2О2 = 3О2
Окислительная активность озона намного выше, чем у кислорода. Например, уже в обычных условиях озон окисляет такие малоактивные простые вещества, как серебро и ртуть с образованием их оксидов и кислорода:
8Ag + 2O3 = 4Ag2O + O2
Как сильный окислитель, озон используется для очистки питьевой воды, для дезинфекция воздуха. Воздух хвойных лесов считается полезным, так как в нем содержится небольшое количество озона, который образуется при окислении смолы хвойных деревьев.
Еще более сильным окислителем, чем кислород О2, является озон О3 (аллотропическая модификация кислорода). Он образуется в атмосфере при грозовых разрядах, чем объясняется специфический запах свежести после грозы.
В лабораториях озон получают пропусканием разряда через кислород (реакция эндотермическая):
302 203 - 284 кДж.
При взаимодействии озона с раствором иодида калия выделяется иод, тогда как с кислородом эта реакция не идет:
2KI + 03 + Н20 = I2 + 2КОН + 02.
Реакция часто используется как качественная для обнаружения ионов I- или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся иодом. Реакция качественная еще и потому, что озон не окисляет ионы Cl- и Br-
Имеется еще одна модификация кислорода - четырехатомная (О4):
O — O
O — O
Эта модификация образуется при слабом взаимодействии двух молекул кислорода. Содержание четырехатомных молекул в газообразном кислороде в обычных условиях составляет всего лишь 0,1% от общего числа молекул, в жидком и твердом кислороде — до 50%. Существует равновесие:
2О2 — О4
При низких температурах оно смещено вправо, т. е. в сторону образования молекул О4. Структурные изменения молекул вызывают различия в свойствах веществ. Так, жидкий и твердый кислород в отличие от газообразного окрашены в синий цвет.
Кислород при нагревании взаимодействует с водородом с образованием воды. При поджигании смеси обоих газов в объемных пропорциях 2:1 (гремучий газ) реакция протекает со взрывом. Но она может протекать и спокойно, если эту смесь привести в соприкосновение с очень малым количеством мелкораздробленной платины, играющей роль катализатора:
2Н2 + О8 = 2 Н20 + 572,6 кдж/моль
Кислород непосредственно может окислять все металлы. Если металл обладает высокой летучестью, то процесс окисления обычно идет в виде горения. Горение же малолетучих металлов в кислороде может осуществляться при условии высокой летучести образующегося оксида. Эффективность этого процесса зависит от восстановительной активности металла и характеризуется величиной теплоты образования получающегося продукта. Продукты взаимодействия металлов с кислородом (оксиды) могут быть основным, кислотными и амфотерными.
При горении некоторых активных металлов в кислороде иногда образуются не их оксиды, а надпероксиды и пероксиды. Так, при горении калия и рубидия образуются надпероксиды этих металлов:
K + O2 = KO2
Связано это с тем, что молекула кислорода может присоединять или терять электроны с образованием молекулярных ионов типа О2-2, O2- и O2+. Присоединение одного электрона к кислороду вызывает образование надпероксид-иона O2:
О — О + ё = [ О — О ]-
Наличие непарного электрона в ионе О2- обусловливает парамагнетизм надпероксидов.
Присоединяя два электрона, молекула кислорода превращается в пероксид-ион О2-2, в котором атомы связаны одной двухэлектронной связью, и поэтому он диамагнитен:
О — О + 2ё = [ О — О ]-2
Например, взаимодействие бария с кислородом идет с образованием пероксида BaO2:
Ва + О2 = ВаО2
VI. Получение кислорода.
Многообразие химических соединений, содержащих кислород, и их доступность позволяют получать кислород различными способами. Все способы получения кислорода можно разделить на две группы: физические и химические. Большинство из них относится к химическим, т. е. в основе получения кислорода лежат те или иные реакции. Например, когда необходим особо чистый кислород, его получают из воды путем разложения ее. Рассмотрим этот способ.
В сосуд, наполненный электролитам (дистиллированная вода, подкисленная серной кислотой), опускают электроды, чаще всего платиновые, и пропускают электрический ток. Положительно заряженные ионы водорода перемещаются к отрицательно заряженному электроду (катоду), а отрицательно заряженные гидроксид-ионы ОН- и сульфат-ионы SO42- направляются к положительно заряженному электроду (аноду). На электродах ионы разряжаются. Следует заметить, что разряд ионов Н+ и ОН- происходит намного легче, чем сульфат-ионов SO42- Таким образом, на катоде выделяется водород, а на аноде — кислород:
4Н++ 4ё — 2Н2
4ОН- - 4ё — 2Н2О + О2
Выделяющиеся газы собирают в разные сосуды или непосредственно используют.
В условиях школьной лаборатории в качестве электролита удобнее воспользоваться раствором щелочи. Тогда электроды можно изготовить из железной проволоки или листа. В щелочной среде разрядке на катоде подвергаются непосредственно молекулы воды:
Н2О + ё — Н° + Н-
Н° + Н° — h3
Для опыта используют лабораторный электролизер. Это U-образная трубка из стекла, в которую впаяны электроды. При электролитическом способе получают достаточно чистый кислород (0,1% примесей).
Рассмотрим еще один химический способ получения кислорода. Если нагревать оксид бария ВаО до 540СС, то он присоединяет атмосферный кислород с образованием пероксида бария ВаО2. Последний при нагревании до 870°С разлагается, и выделяется кислород:
2ВаО + О2 = 2ВаО2
2ВаО2 = 2ВаО + О2
Пероксид бария выполняет роль переносчика кислорода.
В прошлом столетии были разработаны установки для получения кислорода этим способом. Они включали в себя вертикально расположенные емкости, которые имели систему подогрева. Через нагретый до 400 — 500°С оксид бария пропускали ток воздуха. После образования пероксида бария подачу воздуха прекращали, а емкости нагревали до 750°С (температура разложения ВаО2).
С развитием техники получения низких температур был разработан физический способ получения кислорода из атмосферного воздуха. Он основан на глубоком охлаждении воздуха и использовании различия в температурах кипения газов, входящих в состав воздуха.
Жидкий воздух, получаемый в холодильных установках, представляет собой смесь, состоящую из 79% азота и 21 % кислорода по объему. Жидкий азот кипит при температуре — 195,8°С, а жидкий кислород — при температуре — 182,9°С. На разности температур кипения азота и кислорода основано их разделение. Для полного разделения жидкого кислорода и газообразного азота применяют многократное испарение жидкого воздуха, сопровождающееся конденсацией его паров. Этот процесс носит название фракционной перегонки или ректификации. В настоящее время этот способ стал основным способом получения технического кислорода (дешевое сырье и большая производительность установок). Жидкий кислород хранят и перевозят в специально приспособленных для этого емкостях-цистернах и танках, снабженных хорошей теплоизоляцией.
Поскольку физический способ получения кислорода широко используют в промышленности, химические способы получения практически утратили свое техническое значение и служат для получения кислорода в лаборатории.
В связи с развивающимся научно-техническим прогрессом людей всего мира начинает тревожить судьба кислорода и загрязненность атмосферы. Во многих городах уже сейчас становится трудно дышать. По данным мировой статистики, все автомобили только за час работы выбрасывают в воздух до 600 тыс. т ядовитого оксида углерода СО. При сгорании 1 т бензина в автомашине образуется 600 кг оксида углерода СО. В настоящее время мировой автомобильный парк насчитывает 190 млн. машин. По прогнозам специалистов в 1980 г. их число превысит 200 млн. Эти цифры заставляют задуматься.
Отравление воздуха автомобильными выхлопными газами приняло угрожающий характер в таких городах, как, Токио, Лондон, Нью-Йорк, Париж, Рим, Москва. Кроме этого, атмосферу загрязняют и другие вредные газы (SO2, h3S), зола, дым, выбрасываемые многими предприятиями. В результате за последние 100 лет количество солнечных дней вокруг промышленных центров уменьшилось на четверть: там, где их было 200, стало 150. Во всех крупных городах мира в результате густых грязных туманов солнечное освещение уменьшилось по сравнению с началом XX в. на 10—30%. В Лондоне в 1952 г. за несколько дней, пока в воздухе стоял грязный и непригодный для дыхания туман, погибло около 4000 человек. Поэтому борьба за чистоту воздуха стала одной из актуальных проблем современной гигиены.
Известно, что зеленые растения — непревзойденные очистители и санитары земной атмосферы. Фотосинтез — единственный процесс, который уже около 2 млрд. лет поддерживает круговорот кислорода в атмосфере Земли. Зеленые растения — это исполинская лаборатория, вырабатывающая кислород и поглощающая оксид углерода СО2. Ученые подсчитали, что растения земного шара ежегодно поглощают около 86,5 млрд. т оксида СО2. В связи с этим создание зеленых парков вокруг больших городов, устройство садов, разбивка скверов и цветников — составная часть современного градостроительства, столь же необходимая, как устройство водопровода и уличного освещения. Подсчитано, что в зоне зеленых насаждений Москвы, Ленинграда, Харькова запыленность воздуха в 2—3 раза меньше, чем на прилегающих улицах.
В течение последних лет в России остро стоит проблема лесных пожаров. Тысячи гектаров лесных насаждений гибнут в огне. Я считаю, что если не будут приняты чрезвычайные меры по тушению пожаров, восстановлению лесных массивов в ближайшее время нас ждет экологическая катастрофа. Горят заповедники, леса, гибнут уникальные растения, животные. В теплое время года города, села… окутаны дымом. Вредные вещества в большом количестве содержаться в воздухе, которым мы дышим. В связи, с чем возникают или обостряются различные хронические заболевания у людей, снижается иммунитет. Рождаются дети с врожденными пороками развития, иммунодефицитом, поражением центральной нервной системы…
Охрана природы, заповедников существует давно. Но вероятно, на данном этапе развития нашей страны этот вопрос остался на последнем месте. Необходимо всем людям одуматься и бережно относиться к нашей природе. Ведь 95% всех лесных пожаров возникают по их вине.
VII. Применение кислорода.
Применение любых веществ связано с их физическими и химическими свойствами, а также распространением их в природе. Количество металла, производимого на душу населения, является одной из мер уровня развития промышленности в каждой стране. Выплавка же черных и цветных металлов невозможна без кислорода.
Сейчас в нашей стране только черная металлургия поглощает свыше 60% получаемого кислорода. Но кислород используется еще и в цветной металлургии.
Кислород интенсифицирует не только пирометаллургические процессы, но и гидрометаллургические, где основной процесс извлечения металлов из руд или их концентратов основан на воздействии специальных реагентов на водные растворы. Так, в настоящее время основным способом извлечения золота из руд является цианирование. Оно позволяет извлекать из золотоносных руд до 95% золота и поэтому применяется даже при переработке руд с низким содержанием золота. Процесс растворения золота, содержащегося в рудах, очень трудоемкая операция. Оказалось, что растворение этого металла можно значительно ускорить, если вместо воздуха использовать чистый кислород. Золото в цианистых растворах образует комплексное соединение Na[Au(CN)2], которое далее обрабатывают цинком, и в результате выделяется золото:
4Аu + 8NaCN + 2h3O + O2 = 4Na [Au(CN)2] + 4NaOH
2Na [Аu(CN)2] + Zn = Na2 [Zn (CN)4] + 2Аu
Данный метод извлечения золота из руд был разработан русским инженером П. Р. Багратионом, родственником героя Отечественной войны 1812г.
Кислород находит широкое применение в химической промышленности. На нужды этой отрасли в нашей стране расходуется около 30% производимого кислорода. Замена воздуха на кислород в процессе производства серной кислоты контактным способом повышает производительность установки в пять-шесть раз. Но не только в этом заключается выгода от применения кислорода вместо воздуха. Чистый кислород позволяет получить 100-процентный оксид серы без проведения дополнительных трудоемких операций, которые необходимы при использовании воздуха в качестве окислителя.
При получении азотной кислоты способом каталитического окисления аммиака в качестве окислителя также используется кислород. Если содержание его в воздухе повысить до 25%, то производительность установки возрастает в два раза.
При участии кислорода в процессе термоокислительного крекинга в больших масштабах получают ацетилен, который широко используется для резки и сварки металлов и для синтезов органических веществ:
6СН4 + 4О2 = С2Н2 + 8Н2 + 3СО + СО2 + 3Н2О
Кислород применяется для получения высоких температур. Если сжигать водород в токе кислорода, то при образовании 1 моль воды выделяется 286,3 кдж, а 2 моль — 572,6 кдж. Это же колоссальная энергия! Высокие температуры, достигаемые в пламени таких горелок (до 3000°С), используются для резки и сварки металлов.
Кислород служит и в космосе. Так, в двигателе второй ступени американской космической ракеты «Центавр» окислителем служил жидкий кислород. Кислород широко применяется и в ракетах для различных высотных исследований.
Жидкий кислород входит в состав взрывчатых веществ. Длительное время для различных взрывных работ применяли аммониты и другие азотсодержащие взрывчатые вещества. Их использование представляло определенные трудности, например сложность и опасность транспортировки, необходимость строительства складов. В настоящее время взрывчатые вещества с жидким кислородом можно изготовить на месте употребления. Любое пористое горючее вещество (опилки, торф, сено, солома), будучи пропитанным жидким кислородом, становится взрывчатым. Такие вещества называются оксиликвитами и при необходимости могут заменить динамит при разработке рудных месторождений. При взрыве применяют оксиликвитный патрон — простой длинный мешочек, наполненный горючим материалом, в который вставляют электронный запал. Его заряжают непосредственно перед закладкой в шпур путем погружения в жидкий кислород. Шпур — это круглое отверстие, которое бурят обычно в горных породах и наполняют взрывчатым веществом. Если взрыва оксиликвитного патрона в шпуре почему-либо не произойдет, патрон разряжается сам в результате испарения из него жидкого кислорода. Действие оксиликвитов основано на чрезвычайно быстром сгорании органических веществ в чистом кислороде. Кратковременный процесс сгорания сопровождается интенсивным выделением больших количеств тепла и газов, что обуславливает применение оксиликвитов в качестве мощных взрывчатых веществ, обладающих бризантным (дробящим) действием.
Кислород применяется в медицине, в авиации. В лечебной практике при легочных и сердечных заболеваниях, когда затруднено дыхание, больным дают кислород из кислородных подушек, помещают их в специальные палаты, в которых поддерживается необходимая концентрация кислорода. Один вдох кислорода человеком равносилен пяти вдохам воздуха. Таким образом, при вдыхании этот газ не только поступает в организм больного в достаточном количестве, но и сберегает силы для самого процесса дыхания. Кроме этого, подкожное введение кислорода оказалось эффективным при лечении некоторых заболеваний, например гангрены, тромбофлебита, слоновости и тропических язв.
Явление «кислородного голодания» в организме может наступить и от недостатка кислорода в окружающей среде. Например, на высоте 10000 м барометрическое давление воздуха снижается до 217 мм рт. ст. и абсолютное содержание кислорода в воздухе уменьшается в четыре раза. Этого количества газа слишком мало для нормального процесса дыхания. Поэтому на больших высотах летчики пользуются баллонами с кислородом.
VIII. Озоновый слой над Землей.
Озон — «родной брат» кислорода. Его молекула образована тремя атомами этого химического элемента: О3. Там, где бывает электрическая искра, появляется своеобразный запах свежести, потому что электрический разряд — это условие для превращения кислорода воздуха в озон:
ЗО2 = 2О3
кислород озон
Запах озона мы ощущаем в воздухе после грозы. Озон есть в хвойных лесах, особенно в сосновых. При разложении древесной смолы образуется немного озона.
Озон нижнего слоя воздуха рассеян, содержание его небольшое. Этот газ недолговечен, потому что вновь превращается в кислород:
2О3 = ЗО2
озон кислород
Даже в небольших количествах озон выполняет роль окислителя многих веществ. Озоном обеззараживают водопроводную воду, очищают воздух от болезнетворных бактерий. Из-за своей активности озон может стать опасным для здоровья человека и животных, если будет превышен предел его допустимого содержания в воздухе. Однако этого в природе не происходит.
Высоко над Землей, в стратосфере на высоте до 30 км (над уровнем моря) постоянно находится тонкий слой озона, защищающий жизнь на нашей планете от губительного действия коротковолнового ультрафиолетового излучения Солнца. Озон поглощает солнечное ультрафиолетовое излучение, и на Землю проникает лишь часть его, не причиняющая особого вреда ее обитателям. Задерживаются вредные для всего живого короткие волны, пропускаются на Землю длинные ультрафиолетовые волны, которые безвредны.
В стратосфере озона больше, чем в приземном воздухе, однако, это не значит, что слой образован только озоном. Лишь 1 молекула озона в озоновом слое приходится на 100000 молекул других газов. Но этого озона достаточно для защиты жизни на планете от действия ультрафиолетового излучения.
Чем же опасны ультрафиолетовые лучи? Они изменяют структуру молекул белков — носителей жизни. От них страдают, прежде всего, простейшие микроорганизмы и водоросли. Их гибель в водах Мирового океана может привести к тому, что прервутся цепи питания, и тогда пострадают многие крупные обитатели морских вод. Сухопутные организмы по-разному воспринимают эти лучи. Одни животные и растения их выдерживают, другие заболевают и гибнут. Воздействие сильного ультрафиолетового излучения может нарушить соотношение численности хищных и травоядных животных, паразитов и их хозяев. Понятно, что последствия таких изменений пагубно скажутся на экологии Земли.
Длинноволновые ультрафиолетовые лучи воздействуют на кожу человека, появляется загар. Но на коротковолновое излучение клетки кожи могут болезненно отреагировать, появятся разного рода опухоли. Утрафиолетовое излучение вредно и для зрения.
Вот почему так важно, что над Землей есть защитный озоновый слой!
В стратосфере озон существует довольно долго, ему там не приходится часто встречаться с веществами-восстановителями, но если они туда проникают, то озон реагирует с ними и его количество уменьшается. Такое явление снижения концентрации озона в каких-то участках стратосферы называют образованием «озоновых дыр». В последнее время зафиксировали снижение концентрации озона в стратосфере почти на 40% над Антарктидой. Этот плоский континент окружен океаном, над Южным полюсом образуется как бы воронка из ветров, циркулирующих вокруг материка и приносящих вещества, с которыми реагирует озон. Какие это вещества?
Это искусственно полученные и очень ценные в практическом отношении вещества — хлорфторуглеводороды разного состава, например такие:Эти вещества получают при реакциях замещения галогенами атомов водорода в углеводородах. Хлорфторуглеводороды — стойкие вещества, не растворяются в воде, неядовиты, не горят, не вызывают коррозии, отличные изоляторы. Из них делают утеплители для стен зданий, одноразовую посуду для горячих напитков. Жидкие вещества из этой группы (фреоны) — хорошие растворители, эффективные хладоагенты в холодильниках и кондиционерах. Их применяют в аэрозольных баллончиках как безвредные растворители специальных веществ, в системах автоматического пожаротушения (CBrF3).
Производство этих веществ развивалось ускоренными темпами до тех пор, пока не обнаружили, что они, попадая в стратосферу, разрушают озон (Сейчас стараются заменить фреоны на менее летучие вещества. Например, в качестве хладоагентов используют фторхлорметан, а для аэрозольных баллонов применяют сжиженные газообразные предельные углеводороды).
До стратосферы эти вещества доходят без изменений. Ведь они химически устойчивы. А в стратосфере, где много ультрафиолетового излучения, их молекулы разрушаются, при этом отщепляются активные атомы галогена, в частности хлора:
Одноатомный хлор-радикал реагирует с озоном:
03 + Сl = О2 + СlOозон хлор кислород оксид
(радикал) хлора (II)
Под действием ультрафиолетовых лучей из озона образуется кислород, который в момент выделения также бывает в активном одноатомном состоянии:
03 = 02 + О
озон кислород атомарныйкислород
Оксид хлора (II) реагирует с атомарным кислородом, и тогда вновь образуется хлор-радикал, который опять разрушает озон; происходит, цепная реакция, повторяющаяся многократно:
СlO + О = Сl + О2
оксид атомарный хлор кислород
хлора (II) кислород (радикал)
О3+ С1= О2+ СlO
Один атом хлора участвует в серии таких реакций и может разрушить до 100000 молекул озона. Хлор может «выйти из игры» тогда, когда ему встретится молекула метана. Тогда он, присоединив к себе один атом водорода из метана, образует хлороводород, который при растворении в воде образует соляную кислоту. Так хлор-разрушитель возвращается на Землю в виде кислотного дождя:
СН4 + 2С1 — СН3С1 + НС1
метан хлор хлор хлороводород
(радикал) метан (в растворе — соляная кислота)
Даже если производство хлорфторуглеводородов будет повсеместно сокращено, процесс разрушения озонового слоя над всей планетой будет продолжаться. Обедненный озоном воздух постепенно рассеивается, газы в атмосфере перемешиваются, содержащиеся в воздухе хлорфторуглеводороды будут еще очень долго, не менее чем 100 лет, продолжать свою работу, разрушающую озон.
В 1990 г. представители правительства 92 стран в Лондоне подписали соглашение о полном прекращении производства хлорфторуглеводородов к 2000 г. Соблюдение этого соглашения будет условием постепенного восстановления природного содержания озона в цтратосфере, потому что концентрация уже попавшего в атмосферу хлора должна со временем уменьшаться, однако это время — столетие.
IX. Заключение.
Итак, мы получили различные сведения из области химии элементов VI группы и в большей степени о кислороде, узнали о том, где и как применяют и получают кислород, также узнали о воздействии кислорода на нашу жизнь, народное хозяйство и культуру.
Если после чтения моего реферата у вас возникло желание поближе познакомиться с необъятной областью той науки, откуда почерпнуты сведения по элементам VI группы периодической системы Д. И. Менделеева, то я выполнила свою задачу.
X. Литература.
1. Химия. Для школьников ст. классов и поступающих в вузы: Учеб. Пособие / Н. Е. Кузьменкою, В. В. Еремин, В. А. Попков — 4-е изд., стереотип. — М.: Дрофа, 2001. — 544 с.:ил.
2. Книга для чтения по неорганической химии. Кн. для учащихся. В 2 ч. Ч. 1 / сост. В. А. Крицман — 3-е изд. — М.: Просвещение, 1993. — 192 с., 8 л ил.: ил. — ISBN 5-09-002972-5
3. Химия. Учеб. для 9 кл. сред. шк. / Ф. Г. Фельдман, Г. Е. Рудзитис — М.: Просвещение, 1990. — 176 с.: ил. ISBN 5-09-002624-6
4. Химия: Учеб. для 8-9 кл. общеобразоват. Учреждений / Р. Г. Иванова. — 3-е изд., М.: Просвещение, 2001. — 270 с.: ил. — ISBN 5-09-010278-3
5. Путешествие по шестой группе. Элементы VI группы периодической системы Д. И. Менделеева. Пособие для учащихся. / Г. Л. Немчанинова — М., «Просвещение», 1976 — 128 с.: ил.
refdb.ru
Вопрос № 4 Охарактеризуйте физические и химические свойства кислорода. Составьте уравнения соответствующих химических реакций. Под формулами веществ напишите их названия, над формулами проставьте валентность элементов в соединениях.
Решебник по химии за 8 класс (Г.Е. Рудзитис, Ф.Г. Фельдман, 1999 год),задача №4 к главе «Глава II. Кислород. Горение Задачи к §§ 18-21 (стр. 53)».
Все задачи >
Вопрос № 4 Охарактеризуйте физические и химические свойства кислорода. Составьте уравнения соответствующих химических реакций. Под формулами веществ напишите их названия, над формулами проставьте валентность элементов в соединениях.
Ответ:
1. Физические свойства
— бесцветный газ, без вкуса и запаха, относительно малорастворим в воде, немного тяжелее воздуха; кипения — замерзания —2. Химические свойства
При нагревании реагирует с многими веществами, часто это реакция горения (с выделением теплоты и света). В атмосфере кислорода при нагревании горят многие простые и сложные вещества, при этом образуются оксиды.
← Вопрос № 3 Что такое катализаторы и каково их значение в химических процессах? Какие выводы вы можете сделать о значении катализаторов в каталитических процессах в производстве некоторых продуктов химической промышленности? Вопрос № 5 Какие процессы относятся к процессам окисления? Какие вещества называются оксидами? Напишите уравнения химических реакций, в результате которых образуются оксиды следующих химических элементов: а) кремния; б) цинка; в) бария; г) водорода; д) ал →- Вконтакте
5terka.com
Химические свойства кислорода - Справочник химика 21
Химические свойства. Кислород образует соединения со всеми элементами, кроме гелия, неона и аргона. Практически со всеми простыми веществами ои взаимодействует непосредственно (из металлов с ним пе реагируют только золото и платина, из неметаллов — галогены), правда, скорости взаимодействия кислорода с тем или иным веществом различны и зависят как от природы вещества, так и от температуры процессов. Так, с большинством металлов кислород реагирует уже при комнатной температуре, например [c.290]
Опишите химические свойства кислорода. Какие из. них являются ценными в лечебной практике [c.84]
Химические свойства кислорода. Химические свойства кислорода следуют из структуры электронной оболочки атома. Имея во внешнем слое шесть электронов, атом кислорода стремится приобрести еще два электрона, проявляя окислительные свойства. Реакции, в которых кислород проявлял бы восстановительные свойства и переходил в состояние положительного иона, пока неизвестны , что может быть связано с высоким значением ионизационного потенциала. [c.557]
Химические свойства. Кислород образует соединения со всеми химическими элементами, кроме легких инертных газов (Не, Ые, Аг), причем со всеми простыми веществами, кроме фтора, хлора, золота и платиновых металлов, он взаимодействует непосредственно. [c.357]
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА И СЕРЫ [c.444]
Физические и химические свойства кислорода. Кислород — газ без запаха и цвета. Вследствие плохой деформируемости электронной оболочки кислород имеет низкие температуры плавления и кипения. Жидкий кислород светло-голубого цвета, а твердый — кристаллы синего цвета. Во всех агрегатных состояниях кислород парамагнитен. Он мало растворим в воде в 100 объемах воды при 20° С растворяется 3 объема кислорода. Но эта небольшая растворимость имеет огромное значение для жизнедеятельности живущих в воде организмов, [c.433]
Важнейшее химическое свойство кислорода — способность образовывать окислы со всеми элементами (для трех инертных элементов они не получены). При этом с большинством элементов он реагирует непосредственно, особенно при повышенных температурах. Например, [c.221]
Химические свойства Кислород обладает высокой химической активностью Он взаимодействует непосредственно со всеми простыми веществами, кроме галогенов, благородных металлов Ад, Аи, Р1 и благородных газов, образуя оксиды Наиболее активные щелочные металлы (К, КЬ, Сз) образуют при этом надпероксиды ЭОг, а Ма — пероксид МагОг Кислород окисляется только при взаимо действии с р2 [c.350]
Каковы химические свойства кислорода Напишите уравнения взаимодействия кислорода с железом, медью, серой, водородом, фосфором. [c.225]
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА [c.251]
Химические свойства кислорода 251 [c.515]
Химические свойства. Кислород в реакциях со всеми элементами (кроме фтора) является окислителем. [c.209]
Химические свойства. Кислород образует соединения со всеми элементами, кроме некоторых благородных газов (гелия, неона, аргона). Так, с большинством металлов кислород реагирует уже при комнатной температуре, например [c.192]
Принцип действия кислородных поршневых компрессоров такой же, как и аналогичных машин для сжатия других газов, однако химические свойства кислорода и его ценность обусловили следующие особенности конструкции кислородных поршневых компрессоров. [c.44]
По химическим свойствам кислород весьма активен он способен соединяться почти со всеми известными простыми веществами. Важнейшее свойство кислорода—его способность поддерживать горение различных веществ. Тлеющая лучинка, опущенная в кислород, вспыхивает и горит ярким пламенем. Это является отличительным признаком кислорода. Свеча, уголь, сера, фосфор и т. д. сгорают в кислороде очень энергично. Целый ряд металлов таюке сгорает в кислороде. Например, железная проволока, раскаленная иа воздухе и внесенная в кислород, сгорает с треском, разбрасывая во все стороны яркие искры. [c.50]
Домашняя подготовка. Распространение кислорода в природе Получение кислорода в лабораторных условиях и в промышленное ти. Физические и химические свойства кислорода. Применение [c.177]
Резко выраженная способность соединяться с другими веществами, т. е. производить окисление, является основным химическим свойством кислорода. [c.67]
Наиболее важным химическим свойством кислорода является его способность соединяться с большинством простых веществ с выделением теплоты и света. Чтобы вызвать горение веществ в кислороде, часто приходится нагревать их до определенной температуры — температуры воспламенения, так как при обычной температуре кислород является довольно инертным веществом (связь между атомами кислорода характеризуется значительной прочностью). Наряду с горением известны многочисленные процессы медленного окисления при участии кислорода дыхание живых организмов, ржавление металлов, гниение, тление и др. Выделяющаяся при [c.256]
Если эти реакции протекают быстро, с выделением тепла и света, то их называют горением. Соединения элементов с кислородом называют окислами. Резко выраженная способность соединяться с другими веществами, т. е. производить окисление, является основным химическим свойством кислорода. [c.41]
Перечислите физические и химические свойства кислорода. [c.44]
Химические свойства кислорода. Окисление. Горение [c.28]
Кислород — активный химический элемент. Он соединяется почти со всеми элементами, за исключением золота (Ли), серебра (Ад) и платины (Pt). Химические свойства кислорода можно наблюдать на таких опытах [c.28]
Получение и химические свойства кислорода. В лаборатории кислород получают чаще всего разложением некоторых оксидоа или солей кислородных кислот (НдО, КМпО- , КСЮз, КМОз и пр.) при их нагревании, иногда в присутствии катализаторов. Подобные реакции относятся к реакциям внутримолекулярного окисления-восстановления и характеризуются переходом электронов внутри молекулы от одной составной части к другой. Например [c.135]
По химическим свойствам кислород весьма активен известны его соединения почти со всеми элементами. Поддерживает горение различных веществ. Тлеющая лучинка, опущенная в кислород, вспыхивает и горит ярким пламенем. Это характерно для кислорода. При сжигании горючих газов (например, ацетилена С2Н2) в токе кислорода достигается высокая температура. На этом основано [c.495]
Химические свойства. Кислород, как и фтор, образует соединения со всеми элементами, кроме гелия, неона и аргона. Достаточно большая энергия связи между атомами в молекуле О2 проявляется в высоких значениях энергии активации (см. рис. 40) реакций с участием кислорода, что требует предварительного нагревания или введения катализатора для их осуществления. Так, фосфор сгорает в кислороде (с образованием РгРз) прн нагревании до 60°С, сера (в SO2) — до 250, водород (в Н2О) —выше 300 и графит (в СО2) — до 750°С. Но некоторые вещества (многие металлы, N0, гемоглобин крови) взаимодействуют с кислородом и при комнатной температуре. [c.231]
Важнейшее химическое свойство кислорода — способность обра-зоЕывать оксиды почти со всеми элементами (для первых трех благородных газов оксиды пе получены). При этом с большинством веществ кислород реагирует непосредственно, особенно при нагревании. Например [c.175]
Наиболее важное химическое свойство кислорода — его способность соединяться с большинством простых веществ с выделением теплоты и света. Чтобы вызвать горение веществ в кислороде, часто приходится нагревать их до определенной температуры — температуры воспламенения, так как при обычной температуре кислород является довольно инертным веществом (связь между атомами кислорода характеризуется значительной прочностью). Наряду с горением известны многочисленные процессы медленного окисления при участии кислорода дыхание живых организмов, ржавление металлов, гниение, тление и др. Выделяющаяся при этом теплота рассеивается в окружающее пространство, но в определенных условиях она может скапливаться и тогда происходит воспламенение. Так, самовоспламе [c.272]
Химическая активность кислорода высока. Она увеличивается при нагревании. Рассмотрим валснейшие химические свойства кислорода. [c.128]
По химическим свойствам кислород весьма активен известны его соединения почти со всеми элементами. Поддерживает горение различных веществ. Тлеющая лучинка, опущенная в кислород, вспыхивает и горит ярким пламенем. Это характерно для кислорода. При сжигании горючих газов (например, ацетилена С2Н2) в токе кислорода достигается высокая температура. На этом основано применение кислорода для резки и сварки металлов (автогенная или газовая резка и сварка металлов). [c.461]
Химические свойства кислорода и озона. Озон значительно более сильный окислитель, чем кислород. Он реагирует со многими веществами в условиях, когда кислород Оа не вступает в реакг цию. Реакция с К1 протекает количественно и может быть использована для анализа [c.358]
По химическим свойствам кислород замечателен тем, что весьма легко и химически сильно реагирует со множеством веществ, образуя разнообразные соединения. Впрочем, только немногие тела и смеси тел (напр., фосфор, медь с аммиаком, гниющие органические вещества, алдегид, пирогаллин со щелочью и др.) соединяются с кислородом (поглощают его) непосредственно и быстро при обыкновенной температуре, зато множество тел в накаленном состоянии легко соединяются с кислородом, и часто это соединение составляет быстро идущую химическую реакцию, сопровождаемую отделением большого количества теплоты. Всякая быстро совершающаяся реакция называр тся гореяием, если она сопровождается столь большим отделением тепла, что происходит накаливание. Так, многие металлы горят в хлоре, окись натрия или бария горит в углекислом газе, порох горит от искры и т. п. Очень многие тела горят в кислороде, а от его присутствия и в воздухе. Для начала горения необходимо обыкновенно [131] накалить горючее вещество или только некоторую часть его. Для продолжения горения нет нужды в новом накаливании, потому что при самом горении отделяется такое количество тепла, которое достаточно для надлежащего накаливания дальнейших частей горючего вещества. Примеры этого известны каждому из ежедневного опыта. Горение в чистом кислороде совершается с большею скоростью и сопровождается более сильным накаливанием, чем горение в обыкновенном воздухе. Это можно показать многими опытами. В стклянку, [c.113]
chem21.info
Кислород - Химические свойства
Химия - Кислород - Химические свойства
01 марта 2011Оглавление:1. Кислород2. История открытия3. Происхождение названия4. Получение5. Физические свойства6. Химические свойства7. Применение8. Биологическая роль кислорода9. Изотопы
Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
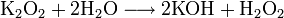
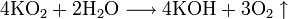
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
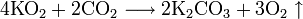
Окисляет большинство органических соединений:

При определённых условиях можно провести мягкое окисление органического соединения:
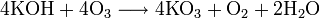
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
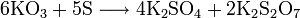
- Некоторые оксиды поглощают кислород:

- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется перекись водорода:

Надпероксиды имеют степень окисления −1/2, то есть один электрон на два атома кислорода. Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:

- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:

Озониды содержат ион O3 со степенью окисления −1/3. Получают действием озона на гидроксиды щелочных металлов:

Ион диоксигенил O2 имеет степень окисления +1/2. Получают по реакции:

Фториды кислорода
- Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
- Монофторид кислорода, O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C.
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре получаются смеси высших фторидов кислорода O3F2, О4F2, О5F2 и О6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифторгидроксония OF3. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях:O2 и O3.
Просмотров: 9210
4108.ru



















