Популярная химия. Кислород в твердом состоянии
кислород « Интереcно о науке
 Кислород – это неметаллический химический элемент, который содержится в воздухе, воде, земной коре и во всех формах жизни. При обычной температуре, свободный молекулярный кислород – это газ без запаха, вкуса и цвета. Сжиженный кислород или в твердом состоянии становится бледно голубым. Все животные и большинство растений использует кислород в своей жизнедеятельности.
Кислород – это неметаллический химический элемент, который содержится в воздухе, воде, земной коре и во всех формах жизни. При обычной температуре, свободный молекулярный кислород – это газ без запаха, вкуса и цвета. Сжиженный кислород или в твердом состоянии становится бледно голубым. Все животные и большинство растений использует кислород в своей жизнедеятельности.
Кислород был открыт в 1774 году шведским химиком Карлом Вильгельмом Шееле. Название этого химического элемента было предложено в 1787 году французским физиком Антуаном-Лоран Лавуазье и раскрывает его суть – «рождающий кислоту». Действительно кислород – важнейшая составляющая многих кислот.
Подробнее »
Фев2
 Фотосинтез – это реакция преобразования световой энергии в химическую в клетках, которые содержат зеленый пигмент – хлорофилл. Фотосинтез происходит в большинстве растений и водорослей, а также в некоторых бактериях и простейших. Итоговым продуктом этой реакции являются углеродные соединения, которые содержат химическую энергию, необходимую для роста клеток. Эти соединения в большей своей массе – сахар и крахмал, общее название которых углеводы. Они, в свою очередь, служат строительным материалом для более сложных продуктов, таких как жиры и белки. Для протекания фотосинтеза необходимы вода, углекислый газ, хлорофилл и свет.
Фотосинтез – это реакция преобразования световой энергии в химическую в клетках, которые содержат зеленый пигмент – хлорофилл. Фотосинтез происходит в большинстве растений и водорослей, а также в некоторых бактериях и простейших. Итоговым продуктом этой реакции являются углеродные соединения, которые содержат химическую энергию, необходимую для роста клеток. Эти соединения в большей своей массе – сахар и крахмал, общее название которых углеводы. Они, в свою очередь, служат строительным материалом для более сложных продуктов, таких как жиры и белки. Для протекания фотосинтеза необходимы вода, углекислый газ, хлорофилл и свет.
Подробнее »
Янв1
 Воздух – это смесь газов, которая окружает Землю и формирует ее атмосферу. Воздух невидим и безвкусен и обычно не имеет запаха. Воздух имеет вес, он может быть расширен или сжат, а при экстремально низких температурах может быть превращен в жидкость или даже твердое вещество. Воздух в движении мы называем ветром. Он обладает силой, достаточной, чтобы вращать лопасти мельниц и перемещать корабли по морю.
Воздух – это смесь газов, которая окружает Землю и формирует ее атмосферу. Воздух невидим и безвкусен и обычно не имеет запаха. Воздух имеет вес, он может быть расширен или сжат, а при экстремально низких температурах может быть превращен в жидкость или даже твердое вещество. Воздух в движении мы называем ветром. Он обладает силой, достаточной, чтобы вращать лопасти мельниц и перемещать корабли по морю.
Состав воздуха достаточно сложен, хотя основными его составляющими являются азот – около 78 % и кислород – около 21 %. Воздух также содержит аргон, углекислый газ, водяной пар, неон, гелий, метан, криптон и озон.
Подробнее »
Янв1
 Озон, который содержится в выбрасываемых предприятиями газообразных отходах – это опасный химикат. Он является очень активным элементом и может привести к коррозии элементов конструкций различных сооружений. Однако в атмосфере озон превращается в неоценимого по своей пользе друга, жизнь без которого на Земле возможно так и не было бы жизни.
Озон, который содержится в выбрасываемых предприятиями газообразных отходах – это опасный химикат. Он является очень активным элементом и может привести к коррозии элементов конструкций различных сооружений. Однако в атмосфере озон превращается в неоценимого по своей пользе друга, жизнь без которого на Земле возможно так и не было бы жизни.
Стратосфера – это слой атмосферы, следующий за тем, в котором мы живем. На верхней его части содержится тонкий озоновый слой. Концентрация озона в этом слое около 3=х молекул на 10 миллионов других молекул воздуха. Не смотря на очень низкую его концентрацию, он выполняет важную функцию. Озон может задерживать ультрафиолетовые лучи, поступающие из космоса вместе с солнечным светом. Ультрафиолет разрушает структуру клеток живых организмов и может повлечь такие заболевания как рак, катаракта глаза и другие смертельные болезни.
Подробнее »
Янв1
coolsci.ru
|
Кислород: расширяем знания о главном химический элементе жизни. Процессы горения и дыхания издавна привлекали внимание ученых. Первые указания на то, что не весь воздух, а лишь "активная" его часть поддерживает горение, обнаружены в китайских рукописях VIII века. Много позже Леонардо да Винчи рассматривал воздух как смесь двух газов, лишь один из которых расходуется при горении и дыхании. Окончательное открытие двух главных составных частей воздуха - азота и кислорода, сделавшее эпоху в науке, произошло только в конце XVIII века. Кислород получили почти одновременно К. Шееле (1769-70) путем прокаливания селитр (KNO3, NaNO3), двуокиси марганца МnО2 и других веществ и Дж. Пристли (1774) при нагревании сурика Рb3О4 и оксида ртути HgO. В 1772 году Д. Резерфорд открыл азот. В 1775 году А. Лавуазье, произведя количественный анализ воздуха, нашел, что он "состоит из двух газов различного и, так сказать, противоположного характера", то есть из кислорода и азота. На основе широких экспериментальных исследований Лавуазье правильно объяснил горение и дыхание как процессы взаимодействия веществ с кислородом. Поскольку кислород входит в состав кислот, Лавуазье назвал его oxygene, то есть "образующий кислоты" (от греч. oxys - кислый и gennao - рождаю; отсюда и русское название "кислород"). Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород. Жидкий кислород имеет светло-голубой цвет, а твёрдый представляет собой кристаллы светло-синего цвета. Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3). Атомный номер 8 Атомная масса 15,999 Плотность, кг/м³ 1,429 Температура плавления, °С -218,8 Температура кипения, °С -183 Теплоемкость, кДж/(кг·°С) 0,913 Электроотрицательность 3,5 Кислород — самый распространённый на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47,4 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 % (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,12 % по массе. Более 1500 соединений земной коры в своём составе содержат кислород. Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %. Исключительно велика роль свободного кислород в биохимических и физиологических процессах, особенно в дыхании. За исключением некоторых микроорганизмов-анаэробов, все животные и растения получают необходимую для жизнедеятельности энергию за счет биологического окисления различных веществ с помощью кислорода. Вся масса свободного кислорода Земли возникла и сохраняется благодаря жизнедеятельности зеленых растений суши и мирового океана, выделяющих кислород в процессе фотосинтеза. На земной поверхности, где протекает фотосинтез и господствует свободный кислород, формируются резко окислительные условия. Напротив, в магме, а также глубоких горизонтах подземных вод, в илах морей и озер, в болотах, где свободный кислород отсутствует, формируется восстановительная среда. Окислительно-восстановительные процессы с участием кислорода определяют концентрацию многих элементов и образование месторождений полезных ископаемых - угля, нефти, серы, руд железа, меди и т. д. Кислород образует химические соединения со всеми элементами, кроме легких инертных газов. Будучи наиболее активным (после фтора) неметаллом, кислород взаимодействует с большинством элементов непосредственно; исключение составляют тяжелые инертные газы, галогены, золото и платина; их соединения с кислородом получают косвенным путем. Почти все реакции кислорода с других веществами - реакции окисления экзотермичны, то есть сопровождаются выделением энергии. Существует 3 основных способа получения кислорода: химический, электролизный (электролиз воды) и физический (разделение воздуха).
Химический способ изобретен ранее других. Кислород можно получать, например, из бертолетовой соли КClОз, которая при нагревании разлагается, выделяя О2 в количестве 0,27 м3 на 1 кг соли. Оксид бария ВаО при нагревании до 540°С сначала поглощает кислород из воздуха, образуя пероксид ВаО2, а при последующем нагревании до 870°С ВаО2 разлагается, выделяя чистый кислород. Его можно получать также из KMnO4, Ca2PbO4, К2Сг2О7 и других веществ при нагревании и добавлении катализаторов. Химический способ получения кислорода малопроизводителен и дорог, промышленного значения не имеет и используется лишь в лабораторной практике. Электролизный способ состоит в пропускании постоянного электрического тока через воду, в которую для повышения ее электропроводности добавлен раствор NaOH. При этом вода разлагается на кислород и водород. Кислород собирается около положительного электрода электролизера, а водород - около отрицательного. Этим способом кислород добывают как побочный продукт при производстве водорода.
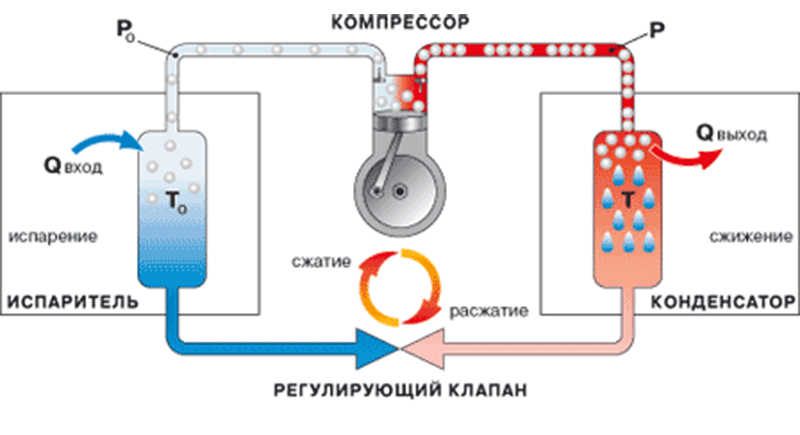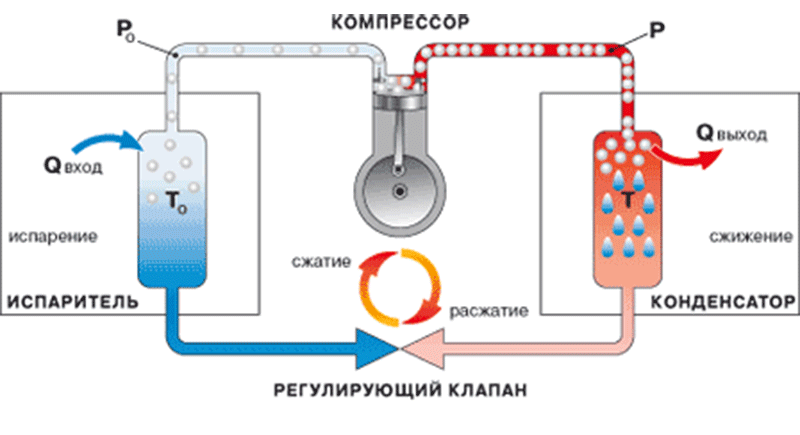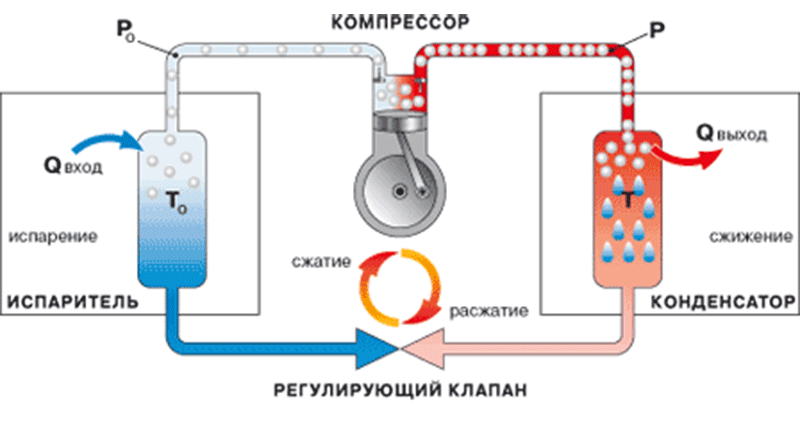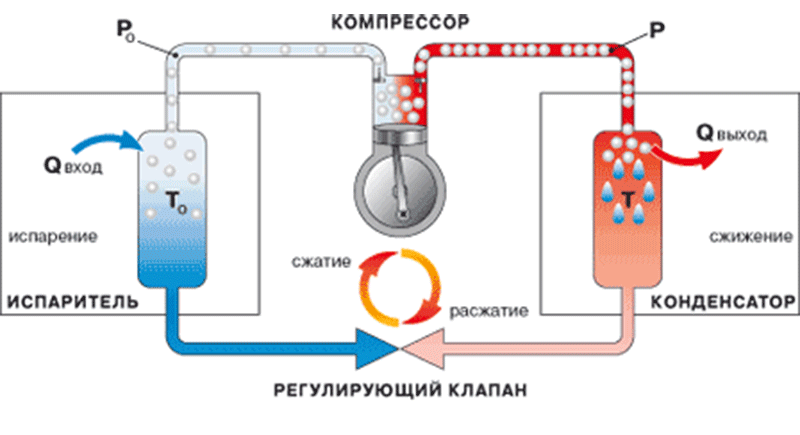
Разделение воздуха является основным способом получения кислорода в современной технике. Осуществить разделение воздуха в нормальном газообразном состоянии очень трудно, поэтому воздух прежде сжижают, а уже затем разделяют на составные части. Такой способ получения кислорода называется разделением воздуха методом глубокого охлаждения. Сначала воздух сжимается компрессором, затем, после прохождения теплообменников, расширяется в машине-детандере или дроссельном вентиле, в результате чего охлаждается до температуры 93 К (-180°С) и превращается в жидкий воздух. Дальнейшее разделение жидкого воздуха, состоящего в основном из жидкого азота и жидкого кислорода, основано на различии температуры кипения его компонентов. При постепенном испарении жидкого воздуха сначала выпаривается преимущественно азот, а остающаяся жидкость все более обогащается кислородом. Повторяя подобный процесс многократно на ректификационных тарелках воздухоразделительных колонн, получают жидкий кислород нужной чистоты (концентрации).
Газообразный кислород хранят и транспортируют в стальных баллонах и ресиверах при давлении 15 и 42 Мн/м2 (соответственно 150 и 420 бар, или 150 и 420 ат), жидкий кислород - в металлических сосудах Дьюара или в специальных цистернах-танках. Для транспортировки жидкого и газообразного кислорода используют также специальные трубопроводы. Кислородные баллоны окрашены в голубой цвет и имеют черную надпись "кислород". Технический кислород используют в процессах газопламенной обработки металлов, в сварке, кислородной резке, поверхностной закалке, металлизации и других, а также в авиации, на подводных судах и прочее. Технологический кислород применяют в химической промышленности при получении искусственного жидкого топлива, смазочных масел, азотной и серной кислот, метанола, аммиака и аммиачных удобрений, пероксидов металлов и других химических продуктов. Жидкий кислород применяют при взрывных работах, в реактивных двигателях и в лабораторной практике в качестве хладагента.
Заключенный в баллоны чистый кислород используют для дыхания на больших высотах, при космических полетах, при подводном плавании и т.д. В медицине кислород дают для вдыхания тяжело больным, применяют для приготовления кислородных, водяных и воздушных (в кислородных палатках) ванн, для внутримышечного введения и т. п. Кислород в металлургии широко применяется для интенсификации ряда пирометаллургических процессов. Полная или частичная замена поступающего в металлургические агрегаты воздуха кислородом изменила химизм процессов, их теплотехнические параметры и технико-экономические показатели. Кислородное дутье позволило сократить потери тепла с уходящими газами, значительная часть которых при воздушном дутье составлял азот. Не принимая существенного участия в химических процессах, азот замедлял течение реакций, уменьшая концентрацию активных реагентов окислительно-восстановительной среды. При продувке кислородом снижается расход топлива, улучшается качество металла, в металлургических агрегатах возможно получение новых видов продукции (например, шлаков и газов необычного для данного процесса состава, находящих специальное техническое применение) и др. |
ximik.biz
Проверь свои знания. Может ли кислород быть в твёрдом состоянии?
Кислород может быть твёрдым. При атмосферном давлении и температурах от –218,7°C до –229,4°C существует твердый кислород с кубической решеткой (a-модификация) , при температурах от –229,4°C до –249,3°C — b-модификация с гексагональной решеткой и при температурах ниже –249,3°C — кубическая g-модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода.
Может. В виде голубых или красных кристаллов. Это известно любому двоечнику
Вот он какой: <img alt="" src="//otvet.imgsmail.ru/download/u_dafcbb2cbc669404f3b351b9b6b9123e_800.jpg" data-big="1" data-lsrc="//otvet.imgsmail.ru/download/u_dafcbb2cbc669404f3b351b9b6b9123e_120x120.jpg">
Всякое физическое тело может находиться как в твёрдом, так и в жидком состоянии! А также - в газообразном! (М/Ф "На последней парте")
Есть и жидкий кислород, в этом нет ничего удивительного.
Твёрдыми могут быть все вещества, кроме гелия. У гелия температура отвердения равна абсолютному нулю
3 конечно, что ему жидким и твердым не быть-то?
touch.otvet.mail.ru