Магнитный коллапс в твердом кислороде. Кислород твердый фото
Факты о кислороде, которые должен знать каждый (8 фото)
Кислород является важнейшим элементом на нашей планете для подержания жизни в той форме, к которой мы привыкли. Он является составной частью атмосферы нашей планеты и содержится не только в воздухе, но и в воде, благодаря чему на Земле существует жизнь не только на суше, но и в воде.
Как элемент кислород был впервые открыт в 1773 году Карлом Вильгельмом Шеле, но поскольку он не спешил публиковать свою работу, долгое время первооткрывателем кислорода значился Джозеф Пристли.
Кислород является не только необходимым, но и любопытным элементом, вот интересные факты о кислороде, которых вы, возможно, еще не знаете.
Он ядовит

Этот газ необходим для дыхания как животных, так и растений. Интересно, но несмотря на то, что без него не было бы жизни, слишком большое его количество может привести к отравлению и даже смерти. Симптомы отравления кислородом включают в себя потерю зрения, кашель, мышечные спазмы и судороги. При нормальном атмосферном давлении отравление кислородом наступает, если его содержание в воздухе превышает 50 % (обычное содержание кислорода в атмосфере — 21 %).
Чистый газ
Чистый кислород без примесей не имеет ни цвета, ни вкуса, ни запаха. Однако чистый кислород редко существует в природе без примесей.
Твердая и жидкая форма

В твердой и жидкой форме кислород отличается голубоватым цветом. Под влиянием пониженных температур и повышенного давления голубые кристаллы кислорода меняют цвет на оранжевый, красный, черный и серый.
Проводимость

Кислород — неметаллический элемент. У него низкая термальная и электрическая проводимость, однако высокая ионизация. Этот газ в чистом виде плохо проводит электричество, однако очень быстро формирует химические связи с другими элементами.
Валентность

В природе этот газ чаще всего встречается в двухвалентной молекуле O2 и трехвалентной молекуле O3 (озон). Синглетный кислород встречается в верхних слоях атмосферы, однако его атомы быстро формируют химические связи с другими элементами.
Горение

Процесс возгорания и горения невозможен без кислорода, однако этот газ не горит сам по себе.
Магнетизм
Кислород является парамагнетиком, то есть он отвечает на воздействие магнитного поля (притягивается магнитом только при наличии сильного магнитного поля), обладает положительной магнитной восприимчивостью, однако очень слабой.
Тело человека

Практически две трети массы человека составляет кислород. Это делает его самым изобильным элементом в организме. Большая часть кислорода в нашем организме является частью молекулы воды. Несмотря на то что молекул водорода в нашем теле почти в два раза больше, они значительно легче. Однако по массе во Вселенной водород значительно превышает кислород.
Северное сияние
Молекулы кислорода, находящиеся в движении, в ответе за яркие красные, желтые и зеленые цвета полярного сияния.
Молекулярная масса

До 1961 года масса атома кислорода являлась стандартом для атомной массы других элементов. После того как наука расширила свое понимание изотопов, в качестве стандарта атомной массы на место кислорода встал углерод.
Другие статьи:
nlo-mir.ru
кислород Фотографии, картинки, изображения и сток-фотография без роялти
#40119284 - Oxygen tube in the patients nose
Похожие изображения
Добавить в Лайкбокс
#44953005 - Peoridic symbol and electron diagram of Oxygen illustrationВектор
Похожие изображения
Добавить в Лайкбокс
#51852988 - Nasal cannula held by nurse with oxygen tubing.
Похожие изображения
Добавить в Лайкбокс
#43938592 - Many oxygen bubbles flowing in a wineglas
Похожие изображения
Добавить в Лайкбокс
#54660745 - smiling young woman with bare shoulders touching her face over..
Похожие изображения
Добавить в Лайкбокс
#41514537 - The illustration of beautiful water drop, water molecules and..Вектор
Похожие изображения
Добавить в Лайкбокс
#41514531 - The illustration of bio infographics background with water molecule..Вектор
Похожие изображения
Добавить в Лайкбокс
#52702092 - Girl having asthma using the asthma inhaler for being healthy..
Похожие изображения
Добавить в Лайкбокс
#52911873 - beauty, people, moisturizing, skin care and health concept -..
Похожие изображения
Добавить в Лайкбокс
#42203040 - a patient with an oxygen mask in the hospital
Похожие изображения
Добавить в Лайкбокс
#61052440 - Facial Skin Care. Closeup Of Beautiful Woman Receiving Face Oxygen..
Похожие изображения
Добавить в Лайкбокс
#41084078 - Older ill man with nasal cannula sleeping in hospital bed
Похожие изображения
Добавить в Лайкбокс
#60887336 - Facial Beauty Treatment. Closeup Of Beautiful Woman Getting Oxygen..
Похожие изображения
Добавить в Лайкбокс
#41514532 - The illustration of bio infographics background with water molecule..Вектор
Похожие изображения
Добавить в Лайкбокс
#50420842 - Flat design surgery operating room illustration vectorВектор
Похожие изображения
Добавить в Лайкбокс
#44088939 - MOSCOW - MAY 28, 2011: Air hostess Yulia of Aeroflot shows how..Похожие изображения
Добавить в Лайкбокс
#58386941 - coenzyme q10 Serum and Background Concept Skin Care Cosmetic.Вектор
Похожие изображения
Добавить в Лайкбокс
ru.123rf.com
Магнитный коллапс в твердом кислороде
Коллапс антиферромагнетизма в твердом кислороде, долгое время остававшийся неуловимым, наконец-то обнаружен экспериментально и нанесен на фазовую диаграмму кислорода.
Хорошо знакомый нам газ кислород при повышении давления меняется до неузнаваемости, проявляя чрезвычайно интересные свойства. Сначала он сжижается, а потом затвердевает, превращаясь (при не слишком высоких температурах) в изолятор-антиферромагнетик — альфа-кислород. Это одно из немногих простых веществ (ферромагнетиком может быть и углерод; см. [2]), обладающих сильным магнетизмом в твердом состоянии.
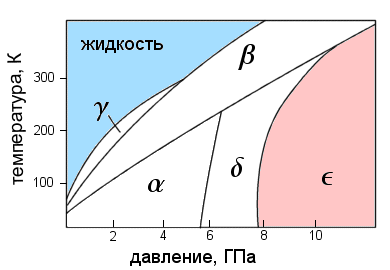
При дальнейшем повышении давления кислород испытывает ряд фазовых переходов, сопровождающихся перестройкой кристаллической решетки. При давлении около 6 ГПа (60 тысяч атмосфер) он превращается в дельта-фазу, сохраняя свой антиферромагнетизм, а при давлении выше 8 ГПа — в совершенно замечательную эпсилон-фазу. Ее также называют красным кислородом из-за насыщенного кроваво-красного цвета (подробнее см. [3]). Наконец, при очень высоком давлении в 96 ГПа (уже за пределами рис. 1) кислород переходит в дзета-фазу и становится сверхпроводником.
Сверхпроводимость, как известно, редко уживается с магнетизмом, ведь сильное магнитное поле разрушает сверхпроводимость (что, впрочем, не исключает некоторые курьезы; см. [4]). И действительно, эксперименты показали, что дзета-кислород уже не обладает магнитной упорядоченностью. Тогда возникает вопрос: на каком именно этапе пропадает магнетизм? Где именно на фазовой диаграмме расположена линия магнитного коллапса?
Казалось бы, есть три возможности: при переходе из дельта-фазы в эпсилон, из эпсилон в дзета или же где-то внутри эпсилон-фазы. Однако и теория, и эксперимент долгое время блуждали в этих трех соснах. Теоретические вычисления вначале предсказывали магнитный коллапс при эпсилон-дзета-переходе, затем предпочтения сместились внутрь эпсилон-фазы, и наконец, совсем недавние вычисления указывают на то, что вся эпсилон-фаза уже должна быть немагнитной, т. е. магнитный коллапс должен произойти при еще более низких давлениях. На последнюю возможность косвенно указывали также и экспериментальные данные.
Однако и здесь есть подвох. Если магнетизм пропадает при переходе из дельта-фазы в эпсилон, значит он появляется при обратном переходе из эпсилон в дельта-фазу. Но особенность фазовой диаграммы кислорода такова (см. рис. 1), что этот переход можно осуществить нагревом образца при постоянном давлении. А в физике еще никогда не наблюдалось такого, чтоб нагревание приводило к возникновению магнитной упорядоченности: ведь магнетизм плохо уживается также и с высокой температурой.
Недавняя статья [1] ставит точку в этом запутанном вопросе. Автор статьи докладывает результаты экспериментальных наблюдений намагниченности образца твердого кислорода при различных давлениях и температурах. Изменяя эти параметры, можно «путешествовать» по фазовой диаграмме вещества, пересекая линии фазовых переходов. Использованная в эксперименте магнитная дифракция нейтронов позволяла одновременно следить за наличием намагниченности и за структурными превращениями образца.
В первом эксперименте исследовались магнитные свойства при низкой температуре (не выше 4 К) при постепенном повышении давления. Как только давление достигало 8 ГПа, кислород переходил в эпсилон-фазу, и магнитный пик в угловом распределении нейтронов пропадал. Это доказывало, что эпсилон-фаза действительно немагнитна. Затем фазовая диаграмма сканировалась «сверху вниз»: образец держался при постоянном давлении, но изменялась температура (красные стрелки на рис. 2).
При давлении 6,2 ГПа, понижая температуру и «спускаясь» из бета-фазы в дельта-фазу, экспериментаторы обнаружили возникновение магнитного порядка при 200 К — именно там, где и лежит граница между этими двумя фазами. Повторив этот эксперимент при чуть более высоком давлении (7,6 ГПа), исследователи выяснили, что магнитный порядок наступает при более низкой температуре — около 150 К, хотя граница раздела двух фаз смещается в сторону более высоких температур.
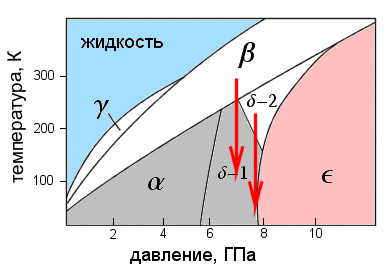
Это означает, что дельта-фаза существует в двух модификациях: магнитной и немагнитной (на рис. 2 они обозначены дельта-1 и дельта-2). При переходе из одной модификации в другую структурных превращений не происходит, а исчезает лишь внутренний магнетизм.
Таким образом, этот эксперимент кладет конец спорам о том, где именно на фазовой диаграмме происходит магнитный коллапс: он происходит внутри дельта-фазы. Интересно, что результат оказался в полном согласии с самыми последними теоретическими расчетами. Кроме того, он дает еще одно косвенное подтверждение того, что в эпсилон-фазе кислород объединяется в молекулы O4, которые имеют нулевой спин и не могут проявлять магнетизма.
См. также:[1] I. Goncharenko, Phys. Rev. Lett. 94, 205701 (23 May 2005)[2] Ферромагнитный углерод — популярная заметка о том, что и из одного только углерода можно сделать магнит.[3] Твердый кислород при сверхбольших давлениях: образование молекул O4 и Жидкий кислород становится металлом — популярные статьи о том, что происходит с кислородом при большом давлении, и о физике высоких давлений вообще.[4] Сверхпроводимость, появляющаяся в очень высоких магнитных полях — популярная заметка о противоестественном сосуществовании сверхпроводимости и магнетизма.[5] Физика высоких давлений — статья С. Е. Ицкевича из «Соросовского образовательного журнала», популярное введение в экспериментальные методики.
Игорь Иванов
См. также опубликованную вскоре после этой заметки новость на Physicsweb.org "Oxygen loses its magnetism under pressure"
elementy.ru
Твердый кислород • ru.knowledgr.com
Твердый кислород формируется при нормальном атмосферном давлении при температуре ниже 54.36 K (−218.79 °C, −361.82 °F). Твердый кислород O, как жидкий кислород, является прозрачным веществом со светло-лазурным цветом, вызванным поглощением в красной части видимого светового спектра.
Кислородные молекулы привлекли внимание из-за отношений между молекулярным намагничиванием и кристаллическими структурами, электронными структурами и сверхпроводимостью. Кислород - единственная из простых двухатомных молекул (и одна из нескольких молекул в целом), чтобы нести магнитный момент. Это делает твердый кислород особенно интересным, поскольку это считают 'управляемым вращением' кристаллом, который показывает необычный магнитный заказ. В очень высоком давлении твердый кислород изменяется от изолирования до металлического государства; и при очень низких температурах, это даже преобразовывает к сверхпроводящему состоянию. Структурные расследования твердого кислорода начались в 1920-х и, в настоящее время, шесть отличных кристаллографических фаз установлены однозначно.
Плотность твердого кислорода колеблется от 21 см/молекулярной массы в α-phase к 23,5 см/молекулярным массам в γ-phase.
Фазы
В общей сложности шесть различных фаз твердого кислорода, как известно, существуют:
- α-phase: голубой — формируется в на 1 атм ниже 23.8 K, моноклинической кристаллической структуры.
- β-phase: упадите в обморок синие к розовому — формируется в на 1 атм ниже 43.8 K, rhombohedral кристаллическая структура, (при комнатной температуре, и высокое давление начинает преобразование к tetraoxygen).
- γ-phase: слабый синий - формируется в на 1 атм ниже 54.36 K, кубической кристаллической структуры.
- δ-phase: оранжевый — формируется при комнатной температуре, оказывая давление 9 Гпа
- ε-phase: темно-красный к черному — формируется при комнатной температуре при давлениях, больше, чем 10 Гпа
- ζ-phase: металлический — формируется при давлениях, больше, чем 96 Гпа
Было известно, что кислород укреплен в государство, названное β-phase при комнатной температуре, оказав давление, и с дальнейшим увеличивающимся давлением, β-phase подвергается переходам фазы к δ-phase в 9 Гпа и ε-phase в 10 Гпа; и, из-за увеличения молекулярных взаимодействий, цвет изменений β-phase розового, оранжевого цвета, тогда красного (стабильная octaoxygen фаза), и красный цвет далее, темнеют черному с увеличивающимся давлением. Было найдено, что металлический ζ-phase появляется в 96 Гпа, когда ε-phase кислород далее сжат.
Красный кислород
Поскольку давление кислорода при комнатной температуре увеличено через 10 Гпа, это подвергается драматическому переходу фазы к различному allotrope. Его объем уменьшается значительно, и это изменяет цвет от синего до темно-красного. Этот ε-phase был обнаружен в 1979, но структура была неясна. Основанный на его инфракрасном спектре поглощения, исследователи предположили в 1999, что эта фаза состоит из молекул в кристаллической решетке. Однако в 2006 было показано кристаллографией рентгена, что эта стабильная фаза, известная как ε кислород или красный кислород, фактически. Никто не предсказал структуру теоретически: ромбическая группа, состоящая из четырех молекул.
В этой фазе это показывает темно-красный цвет, очень сильное инфракрасное поглощение и магнитный крах. Это также стабильно по очень большой области давления и было предметом многочисленной дифракции рентгена, спектроскопических и теоретических исследований. У этого, как показывали, была моноклиническая симметрия C2/m, и ее инфракрасное поглотительное поведение было приписано ассоциации кислородных молекул в большие единицы.
- Жидкий кислород уже используется в качестве окислителя в ракетах, и он размышлялся, что красный кислород мог сделать еще лучший окислитель из-за его более высокой плотности энергии.
- Исследователи думают, что эта структура может значительно влиять на структурное расследование элементов.
- Это - фаза, которая формируется выше 600 K при давлениях, больше, чем 17 Гпа.
- В 11 Гпа длина связи внутригруппы группы составляет 0,234 нм, и расстояние межгруппы составляет 0,266 нм. (Для сравнения внутримолекулярная длина связи кислородной молекулы составляет 0,120 нм.)
- Механизм формирования группы, найденной в работе еще, не ясен, и исследователи думают, что у передачи обвинения между кислородными молекулами или магнитный момент кислородных молекул есть значительная роль в формировании.
Металлический кислород
ζ-phase появляется в 96 Гпа, когда ε-phase кислород далее сжат. Эта фаза была обнаружена в 1990, герметизируя кислород к 132 Гпа. ζ-phase с металлической группой, как было известно, показал сверхпроводимость при низкой температуре.
ru.knowledgr.com
Твердый источник кислорода
Изобретение относится к получению газообразного кислорода из твердых пиротехнических источников. Твердый источник кислорода содержит, мас.%: перхлорат лития 10-60; супероксид натрия 13,2-45; перхлорат магния - остальное. Температура горения состава 420-490°С, выход кислорода 360-380 л/кг, длительность хранения - более 5 лет. Технический результат состоит в улучшении эксплуатационных характеристик состава твердого источника кислорода за счет обеспечения возможности длительного хранения и повышения выхода кислорода с единицы веса. 2 табл.
Изобретение относится к получению газообразного кислорода из твердых пиротехнических источников типа кислородной свечи, генерирующих кислород за счет самораспространяющейся химической реакции между компонентами в режиме горения. Твердые источники кислорода могут быть использованы в качестве аварийного источника кислорода для пассажирских самолетов, кабин космических кораблей, подводных аппаратов, шахт, убежищ и т.п.
Известны составы твердых источников кислорода, предназначенных для использования в самолетах и подводных аппаратах, в которых в качестве кислородоносителя используется перхлорат лития. Составы содержат также перекисное соединение щелочного или щелочноземельного металла в качестве катализатора и горючее (бор, железо или марганец (1, 2). Выход кислорода у этих составов составляет 320-340 л/кг, что несколько выше, чем у источников на основе хлоратов щелочных металлов. В то же время эти составы характеризуются высокой температурой горения - 700-800oC, что существенно ухудшает их эксплуатационные характеристики. Известен состав твердого источника кислорода, содержащий в качестве кислородоносителя перхлорат магния, в качестве катализатора - супероксид натрия и воду (11-18%) (3). Этот состав выбран заявителем за прототип. Средняя скорость выделения кислорода этим составом составляет 1,4-7,82 см3 (мин г), температура разложения не более 530oC. При горении состав не искрит. Однако удельный выход кислорода для него не более 330 л/кг. Кроме того, из-за большого содержания воды в составе он не может храниться длительное время (продолжительность его хранения не превышает одного года), в то время как длительный срок хранения является необходимым условием эксплуатации твердых источников кислорода. Задачей изобретения является улучшение эксплуатационных характеристик состава твердого источника кислорода за счет обеспечения возможности длительного хранения и повышения выхода кислорода с единицы веса. Задача решается предлагаемым изобретением, согласно которому состав твердого источника кислорода содержит в качестве кислородоносителя перхлорат магния и дополнительно перхлорат лития, а в качестве катализатора супероксид натрия, при следующем соотношении компонентов, мас. %: перхлорат лития - 10 - 60 супероксид натрия - 13,2 - 45 перхлорат магия - остальное Перхлорат лития является одним из наиболее кислородоемких соединений и введение его вместо воды резко увеличивает выход кислорода - до 380 л/кг. Одновременно такая замена стабилизирует состав и обеспечивает его способность к длительному хранению (более 5 лет). Содержание перхлората лития более 60% нецелесообразно из-за потери способности состава к самостоятельному разложению. Содержание перхлората лития менее 10% снижает удельный выход кислорода для состава до 340 л/кг, недопустимо повышает температуру горения (свыше 600oC) и приводит к появлению в выделяемом газе примесей хлора и диоксида хлора. При изготовлении твердого источника кислорода используются технические реактивы без дополнительной очистки, изготовляемые на предприятиях Российской Федерации. Твердый источник кислорода готовят смешением компонентов в обычном смесителе и формованием полученной шихты в таблетки, блоки или иную форму традиционными приемами. Испытания формованных составов твердых источников кислорода осуществляют в герметичной камере, снабженной инициирующим устройством электро- или ударнокапсюльного типа, аэрозольным фильтром и выводом кислорода. Температура горения составов фиксируется с помощью термопары, а объем и скорость выделения кислорода определяются с помощью ротаметра и газосчетчика. Способность состава к длительному хранению устанавливается ускоренными испытаниями по специальной методике. Примеры заявляемого состава твердого источника кислорода приведены в таблице 1. Результаты испытаний составов твердых источников кислорода приведены в таблице 2. Линейная скорость разложения составов находится в пределах от 8 до 20 мм/мин. Литература 1. Патент США N 3174936, НКИ 258-186, приоритет 03.05.61. 2. Патент США N 3293187, НКИ 252-187, приоритет 23.10.63. 3. Заявка РФ N 94000941/12 МПК С 01 В 13/02, приоритет 11.01.94.
г), температура разложения не более 530oC. При горении состав не искрит. Однако удельный выход кислорода для него не более 330 л/кг. Кроме того, из-за большого содержания воды в составе он не может храниться длительное время (продолжительность его хранения не превышает одного года), в то время как длительный срок хранения является необходимым условием эксплуатации твердых источников кислорода. Задачей изобретения является улучшение эксплуатационных характеристик состава твердого источника кислорода за счет обеспечения возможности длительного хранения и повышения выхода кислорода с единицы веса. Задача решается предлагаемым изобретением, согласно которому состав твердого источника кислорода содержит в качестве кислородоносителя перхлорат магния и дополнительно перхлорат лития, а в качестве катализатора супероксид натрия, при следующем соотношении компонентов, мас. %: перхлорат лития - 10 - 60 супероксид натрия - 13,2 - 45 перхлорат магия - остальное Перхлорат лития является одним из наиболее кислородоемких соединений и введение его вместо воды резко увеличивает выход кислорода - до 380 л/кг. Одновременно такая замена стабилизирует состав и обеспечивает его способность к длительному хранению (более 5 лет). Содержание перхлората лития более 60% нецелесообразно из-за потери способности состава к самостоятельному разложению. Содержание перхлората лития менее 10% снижает удельный выход кислорода для состава до 340 л/кг, недопустимо повышает температуру горения (свыше 600oC) и приводит к появлению в выделяемом газе примесей хлора и диоксида хлора. При изготовлении твердого источника кислорода используются технические реактивы без дополнительной очистки, изготовляемые на предприятиях Российской Федерации. Твердый источник кислорода готовят смешением компонентов в обычном смесителе и формованием полученной шихты в таблетки, блоки или иную форму традиционными приемами. Испытания формованных составов твердых источников кислорода осуществляют в герметичной камере, снабженной инициирующим устройством электро- или ударнокапсюльного типа, аэрозольным фильтром и выводом кислорода. Температура горения составов фиксируется с помощью термопары, а объем и скорость выделения кислорода определяются с помощью ротаметра и газосчетчика. Способность состава к длительному хранению устанавливается ускоренными испытаниями по специальной методике. Примеры заявляемого состава твердого источника кислорода приведены в таблице 1. Результаты испытаний составов твердых источников кислорода приведены в таблице 2. Линейная скорость разложения составов находится в пределах от 8 до 20 мм/мин. Литература 1. Патент США N 3174936, НКИ 258-186, приоритет 03.05.61. 2. Патент США N 3293187, НКИ 252-187, приоритет 23.10.63. 3. Заявка РФ N 94000941/12 МПК С 01 В 13/02, приоритет 11.01.94.Формула изобретения
Твердый источник кислорода, включающий перхлорат магния и супероксид натрия, отличающийся тем, что дополнительно содержит перхлорат лития при следующем соотношении компонентов, мас.%: Перхлорат лития - 10 - 60 Супероксид натрия - 13,2 - 45 Перхлорат магния - ОстальноеРИСУНКИ
Рисунок 1Похожие патенты:

Изобретение относится к пиротехнике и используется для получения технического кислорода

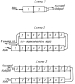

Изобретение относится к получению технического кислорода с использованием твердых источников кислорода
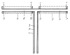
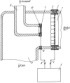
Изобретение относится к ионной технологии и может быть использовано в медицине, машиностроении, на транспорте, в том числе речном и морском, в автомобильной промышленности, сельском хозяйстве, авиации, космической технике, металлургии, энергетике
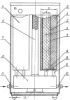
Изобретение относится к области химического машиностроения, а именно к технологии разделения воздуха путем короткоцикловой безнагревной адсорбции, и может быть использовано для получения газовой смеси с повышенным /90 95%/ содержанием кислорода

Изобретение относится к способам получения адсорбентов диоксида углерода, содержащих гидроксиды щелочноземельных металлов и предназначенных для использования в дыхательных аппаратах

Изобретение относится к составам химических веществ, используемых в изолирующих дыхательных аппаратах на химически связанном кислороде, в частности к составам пусковых брикетов

Изобретение относится к составам химических веществ, используемых в изолирующих дыхательных аппаратах

Изобретение относится к составам химических веществ, используемых в изолирующих дыхательных аппаратах, и может быть использовано в производстве регенеративных продуктов на основе надпероксида калия



Изобретение относится к производству адсорбентов на угольной основе, в частности к производству адсорбента для поглощения аварийно химически опасных веществ ингаляционного действия (АХОВИД) кислого (диоксид серы, хлористый водород, фтористый водород и т.п.) и нейтрального (хлор, фтор, гидрид серы и т.п.) характеров, отравляющих веществ (циан водорода, хлорциан, фосген и т
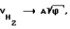
Изобретение относится к способам получения химических веществ, используемых в изолирующих дыхательных аппаратах на химически связанном кислороде

Изобретение относится к составам химических веществ, используемых в изолирующих дыхательных аппаратах на химически связанном кислороде

Изобретение относится к составам химических продуктов, используемых в изолирующих дыхательных аппаратах и системах регенерации воздуха
Изобретение относится к получению газообразного кислорода из твердых пиротехнических источников
www.findpatent.ru
Какого цвета КИСЛОРОД? Бывает ли он КРАСНЫМ? ;-)
Все зависит от того, какую аллотропную модификацию кислорода рассматривать. Кислород в своем обычном состоянии О2 либо бесцветен (если это газ) , либо имеет голубоватый оттенок (если конденсирован) . Если говорить об озоне, то это это синий газ с характерным запахом, либо темно-синяя жидкость. Уже получены молекулы О4, правда только в конденсированном виде и в очень небольших количествах, это аллотропная модификация кислорода имеет темный (почти черный) цвет.
Нет, только фиолетовым и зеленым, и то смотря какую травку покурил перед этим
газ кислород в естественном виде без цвета, вкуса и запаха. без красителей он красным не станет.
Кислород не имеет цвета вообще.
Кислород бесцветный, безвкусный и без запаха
возми учебник химия 7класс ТАМ все описано если чего не поимеш тагда незнаю где тебе есче чего узнавать
Это смотря какой краской баллоны покрасят, в россии по стандарту голубой.
Кислород не имеет цвета.
В жидком состоянии - голубоватая жидкость. Однако при изучении атмосфер планет и их спутников используется спектральный анализ. Полосатый спектр показывает какие цвета поглощаются веществами. А значит они и переизлуаются. Вот спектр газового разряда в кислороде: <a rel="nofollow" href="http://astro.u-strasbg.fr/~koppen/discharge/oxygen.html" target="_blank">http://astro.u-strasbg.fr/~koppen/discharge/oxygen.html</a> Добавляю: Не знаю насчёт красности. Вопрос условий и их трактовки. Можно поставить красный фильтр - будет только красный. Но это не считается? Можно взять дальтоника - не знаю что он увидит, но не то же самое что и мы с вами.
Учёные исследовали свойства твёрдого красного кислорода, образующегося при воздействии на этот газ очень высокого давления. Результаты оказались интересными и красивыми, хотя и совершенно бесполезными. В газообразном состоянии кислород представляет собой молекулы, которые перемещаются в пространстве, сталкиваясь друг с другом. Однако при повышении давления молекулы теснее прижимаются друг к другу, и кислород превращается в бледно-голубую жидкость. А при достижении давления в 5,4 гигапаскаля (примерно в 52 тысячи раз выше атмосферного) — в твёрдое тело такого же цвета. В 1979 году химики выяснили, что при дальнейшем повышении давления до 10 гигапаскалей твёрдый кислород становится красным. В ходе новых исследований ученые из двух независимых групп — под руководством Малкольма Макмэхона из университета Эдинбурга и во главе с Хироси Фуджихисой из Национального института промышленной науки и технологии — проводили анализ кристаллической решётки кислорода в этом состоянии с помощью рентгеновского излучения. Разница состояла, в первую очередь, в методе. При давлении порядка 13–18 гигапаскалей кислород становится твёрдым веществом красного цвета. При этом его кристаллическая решётка принимает такой вид<img src="//foto.mail.ru/mail/katenok77.7/_answers/i-196.jpg" > Если в первом эксперименте кристалл твёрдого кислорода положили на подложку из гелия (при таком давлении гелий стал мягким, "как масло"), то во втором выращенный кристалл размельчили в порошок. Обе работы дали ошеломляющие результаты. Обычно при повышении давления химические связи в твёрдом теле разрушаются, а вещество начинает вести себя так же, как и более тяжёлые элементы той же группы. Ожидалось, что атомы образуют группы по 8 штук, составив кольцо, — как это происходит, например, с атомами серы. Вместо этого атомы организовались по восемь, но образовали не кольцо, а ромбоэдр — фигуру наподобие сплющенного куба; то есть получилась молекула, состоящая из восьми атомов — O8.Такое неожиданное открытие должно заставить учёных пересмотреть прежние теоретические представления о кислороде в "сгущённом" состоянии. Интересно, что твёрдый красный кислород не имеет совсем никакой практической ценности. К тому же он создаётся в микроскопических количествах и испаряется, едва давление снижается. Не может он существовать и в природе: если бы и были возможны высокие давления, заставляющие кислород затвердеть, он всё равно бы быстро соединялся с другими веществами. Если бы кислород мог сохранять структуру кристаллической решётки после снижения давления, он был бы очень полезен, например, при производстве ракетного топлива, полагает Макмэхон. <a rel="nofollow" href="http://www.membrana.ru/lenta/?6437" target="_blank">http://www.membrana.ru/lenta/?6437</a> интерес для науки представляет не столько сам красный кислород, сколько методы, которые дали возможность выяснить структуру этого вещества в твёрдой фазе при столь высоком давлении.
touch.otvet.mail.ru
Интересные факты о кислороде | Интересные факты
Наверняка вы знаете, что кислород — это газ, который нужен людям и всем животным для дыхания. А что ещё можно рассказать о кислороде? Разные интересные факты о данном химическом элементе — в этом посте.
1) Открытие кислорода
 Несмотря на то, что кислород является составляющей частью воздуха, для того, чтобы его открыть, химикам понадобилось немало времени. Произошло это лишь в конце 18 века.
Несмотря на то, что кислород является составляющей частью воздуха, для того, чтобы его открыть, химикам понадобилось немало времени. Произошло это лишь в конце 18 века.
Открытию кислорода мешало несколько заблуждений. Во-первых, химики считали, что воздух однороден и представляет из себя один химический элемент. Во-вторых, у них была ложная теория, объясняющая процессы горения. Считалось, что горение происходит в результате освобождения вымышленной субстанции — флогистона, который якобы присутствует во всех горючих веществах. Однако со временем, изучая процессы горения в закрытых колбах, химики заметили, что при этом масса воздуха уменьшается на одну пятую, и пришли к выводу, что воздух на самом деле состоит из двух частей — поддерживающей горение и не поддерживающей. Действительно, как нам сегодня известно, воздух состоит в основном из азота (которого там почти 80%) и кислорода (которого чуть больше 20%). Следующим шагом химиков было выделение кислорода при разложении оксидов и кислот и изучение его свойств. Хотя первыми подобные опыты провели швед Шееле и англичанин Пристли, они так и не поняли, что открыли новый элемент. Разобраться во всём смог лишь французский химик Лавуазье.

Лавуазье показывает опыт по обнаружению кислорода
Он же дал и название новому элементу — «оксиген», или в переводе на русский — кислород. Это название элемент получил потому, что в то время его получали путём разложения кислот, и Лавуазье ошибочно решил, что кислород присутствует в любой кислоте. На самом деле главный элемент, который придаёт кислотам их свойства — водород, а кислород есть далеко не во всех кислотах, но полученное в 18 веке название так и осталось за кислородом.
2) Кислород не только нужен для жизни, но и существует благодаря ей
Когда было обнаружено, что кислород необходим для дыхания, учёные поначалу даже испугались. Ведь со временем кислород в атмосфере закончится, и тогда все умрут! Однако вскоре было обнаружено, что растения поглощают углекислый газ и вырабатывают кислород под действием света. Более того, сейчас известно, что до появления жизни в атмосфере вообще не было газообразного кислорода. И это не удивительно, поскольку кислород — очень активный химический элемент. Так что ещё до того, как Земля успела сформироваться, весь кислород соединился с другими химическими элементами.
Наполненная же кислородом атмосфера появилась далеко не сразу. Хотя жизнь возникла очень давно, первые формы жизни не нуждались в кислороде и не вырабатывали его. Около 3,5 млрд. лет назад появились первые цианобактерии, которые освоили процесс фотосинтеза. Газообразный кислород, который выделялся при этом, был побочным продуктом. Однако деятельность этих бактерий привела к глобальным и огромным изменениям. Миллиарды лет выделяемый бактериями кислород реагировал с веществами, растворёнными в океане, с газами в атмосфере и с горными породами. Но со временем все они окислились и кислород стал накапливаться в атмосфере. И только после этого вместо анаэробных форм жизни, живших в бескислородной среде, во множестве появились аэробные формы, которые, наоборот, стали использовать кислород для дыхания.

«Цветение» воды из-за сильного размножения цианобактерий
Кстати, микроскопические цианобактерии, возникшие миллиарды лет назад, до сих пор являются главным поставщиком кислорода в атмосферу Земли. Вклад больших зелёных растений заметно меньше. Все бактерии и растения вырабатывают примерно 200 млрд тонн в год, а общие запасы кислорода в атмосфере и океане составляют примерно 1200000 миллиардов тонн. Кажется, что это много, тем не менее, если на нашей планете вдруг прекратится фотосинтез, этого накопленного кислорода хватит всего на 6000 лет.
3) В чистом кислороде сгорает почти всё
Привычный нам процесс горения — это соединение различных веществ с кислородом, содержащимся в атмосфере. Кислород — второй по активности неметалл после фтора, поэтому он очень активно вступает в химические реакции. И если многие вещества легко загораются даже в обычном воздухе, в котором всего 20% кислорода, то что будет, если взять чистый, концентрированный кислород?
В чистом кислороде прекрасно сгорают такие вещества, которые обычно не горят или горят плохо, например, железо:
Ещё быстрее всё сгорит, если использовать жидкий кислород:
Если же пропитать жидким кислородом пористое или порошкообразное горючее вещество (опилки, торф, мох и т. п.), то получается мощная взрывчатка — оксиликвит.
4) Аллотропная модификация кислорода — озон — ещё более активен
 Даже в простом веществе атомы могут соединяться по-разному. Это явление называется аллотропией. У кислорода тоже есть аллотропные модификации. Обычный кислород состоит из молекул с двумя атомами, именно такие молекулы наиболее устойчивы. Но при определённых условиях (например, от электрических разрядов) может образоваться озон — модификация кислорода, молекулы которого состоят из трёх атомов.
Даже в простом веществе атомы могут соединяться по-разному. Это явление называется аллотропией. У кислорода тоже есть аллотропные модификации. Обычный кислород состоит из молекул с двумя атомами, именно такие молекулы наиболее устойчивы. Но при определённых условиях (например, от электрических разрядов) может образоваться озон — модификация кислорода, молекулы которого состоят из трёх атомов.
Озон — ещё более химически активное вещество, чем обычный кислород. Причина в том, что связи в тройной молекуле менее крепкие, и отдельные атомы легко от неё отрываются. По этой же причине в обычных условиях озон со временем самопроизвольно превращается в кислород, хотя при низких температурах и может храниться длительное время.
Из-за высокой активности озон реагирует с веществами, с которыми не реагирует простой кислород, например, с серебром. Также со многими веществами, которые для реакции с кислородом необходимо поджигать, озон реагирует при обычной температуре. Например спирт в присутствии озона загорается самопроизвольно, а смешивание озона с некоторыми горючими газами приводит к взрыву.
В более-менее значительных концентрациях озон ядовит и опасен для живых организмов. Но это свойство озона, как ни странно, оказывается очень полезным. Озон легко получить из кислорода при помощи озонаторов и использовать для дезинфекции воды, помещений и т. д. Озон эффективно убивает все микроорганизмы, плесень, при этом его применение не так опасно, как применение хлора и других ядовитых веществ. Причина в том, что со временем озон самопроизвольно превратится в кислород и его токсичные свойства исчезнут.
У озона есть и ещё одно крайне полезное свойство, благодаря которому жизнь на земле существует за пределами океана. Накапливаясь в верхних слоях атмосферы, этот газ поглощает вредное ультрафиолетовое излучение Солнца. Не будь в атмосфере озона, живые организмы на поверхности суши получили бы смертельную дозу радиации всего за несколько минут.
5) Кислород — очень распространённый элемент
В земной коре содержание кислорода (по массе) — почти 50%. Во Вселенной кислород — третий по распространённости элемент после водорода и гелия. А в теле человека 65% кислорода.
6) Кислород притягивается магнитом
Кислород, в отличие от большинства газов, является парамагнетиком, т. е. способен намагничиваться в магнитном поле. На этом видео можно посмотреть, как жидкий кислород притягивается к магнитам (в отличие от жидкого азота, который не притягивается):
7) Мало кислорода — вредно, много — тоже
Организм человека приспособлен к концентрации кислорода 21% (при атмосферном давлении). Но если эта концентрация снизится всего на несколько процентов, человек будет ощущать себя уже очень плохо. При падении содержания кислорода до 17% возникнет быстрая утомляемость, головокружение, головные боли, при 13% человек потеряет сознание, а при 7% умрёт.
А что будет, если дышать воздухом с повышенной концентрацией кислорода или вообще чистым кислородом? В определённых случаях это полезно. Например, в медицине применяют кислородотерапию — дыхание кислородом при лечении некоторых заболеваний (таких, как астма) и при отравлении ядовитыми газами. Тем не менее долго дышать чистым кислородом вредно, а при слишком больших концентрациях кислорода (если ещё и повысить давление) наступает кислородное отравление. Впервые столкнулись с этой проблемой водолазы, которые дышали кислородом из баллонов при повышенном давлении. При этом у них возникало онемение конечностей, тошнота и судороги. Пришлось снижать концентрацию кислорода в дыхательных аппаратах.
Похожие записи
interesnyjfakt.ru















