Дайджест - Промышленная безопасность. Кислород плотность
Кислород - это... Что такое Кислород?
химический элемент VI группы периодической системы Д.И. Менделеева; является важнейшим биоэлементом, входящим в состав большинства биомолекул.
В литосфере содержится 47% кислорода (по массе), он является самым распространенным химическим элементом на Земле. В свободном состоянии К. присутствует в атмосферном воздухе (23,1% по массе, 20,95% по объему), в растворенном состоянии и в виде соединений содержится в гидросфере Земли (88,8% по массе). Основная масса К. в природе находится в виде химических соединений: он входит в состав 1364 минералов, важнейших органических веществ, содержится в живых организмах (в организме человека относительное содержание К. составляет 20% сухой массы).
Атомный номер кислорода 8, атомная масса 15,9994. Природный К. состоит из 3 стабильных изотопов 16О, 17О и 18О. Известны 5 радиоактивных изотопов К. с периодами полураспада: 13О — 0,008 с, 14О — 76,5 с, 15О — 123 с, 19О — 29,1 с, 20О — 14 с. Радионуклид 15О, распадающийся с испусканием главным образом позитронов, используется в медицинских исследованиях для изучения дыхательной функции легких, скорости кровотока, поглощения и метаболизма кислорода. Кислород проявляет валентность -2. В обычных условиях его молекула состоит из двух атомов (О2). При электрическом разряде образуется аллотропическая модификация К. — озон (О3). Известны так называемые активные формы кислорода: супероксидный анион-радикал (продукт одноэлектронного восстановления О2), синглетный кислород (англ. single одиночный) и др. Молекулярный кислород О2 — бесцветный газ без запаха и вкуса; в сжиженном виде имеет бледно-голубой, а в твердом виде — синий цвет. При 0°, давлении 760 мм рт. ст. масса 1 л кислорода составляет 1,42895 г, мольный объем 22,3947 л, относительная плотность по воздуху 1,1053. Относительная плотность жидкого К. при t°кип. —183° равна 1,118, плотность твердого К. при —252,7° составляет 1,46, температура затвердевания кислорода —218,8°, критическая температура —118,8°, критическое давление 49,7 атм, растворимость в 100 объемах воды при 0, 20 и 100° соответственно 4,91; 3,11 и 1,70 объема. К. реагирует со всеми химическими элементами (за исключением инертных газов гелия, неона и аргона) с образованием нормальных оксидов (окисей) и пероксидов (перекисей). К важнейшим химическим процессам в природе, происходящим при участии К., относятся быстрое окисление веществ (горение) и медленное окисление (коррозия металлов, окисление минералов при их выветривании, окисление масел с образованием смол, свободнорадикальное, или перекисное, окисление органических молекул, в т.ч. липидов, гниение органических остатков и дыхание живых организмов). Конечными продуктами окисления органических веществ, в т.ч. тканевого дыхания (см. Дыхание тканевое), являются углекислый газ и вода.Кислород участвует в биологическом окислении органических соединений, в результате которого высвобождается энергия, необходимая для жизнедеятельности организма. Образуя с гемоглобином и другими дыхательными пигментами непрочные соединения. К. атмосферного воздуха транспортируется в ткани организма и используется для процесса тканевого дыхания, при котором происходит восстановление К. с образованием углекислого газа и воды.
Библиогр.: Березовский В.А. Напряжение кислорода в тканях животных и человека, Киев, 1975; Жиронкин А.Г. Кислород. Физиологическое и токсическое действие, М., 1972.
dic.academic.ru
Твердый кислород - Большая Энциклопедия Нефти и Газа, статья, страница 1
Твердый кислород
Cтраница 1
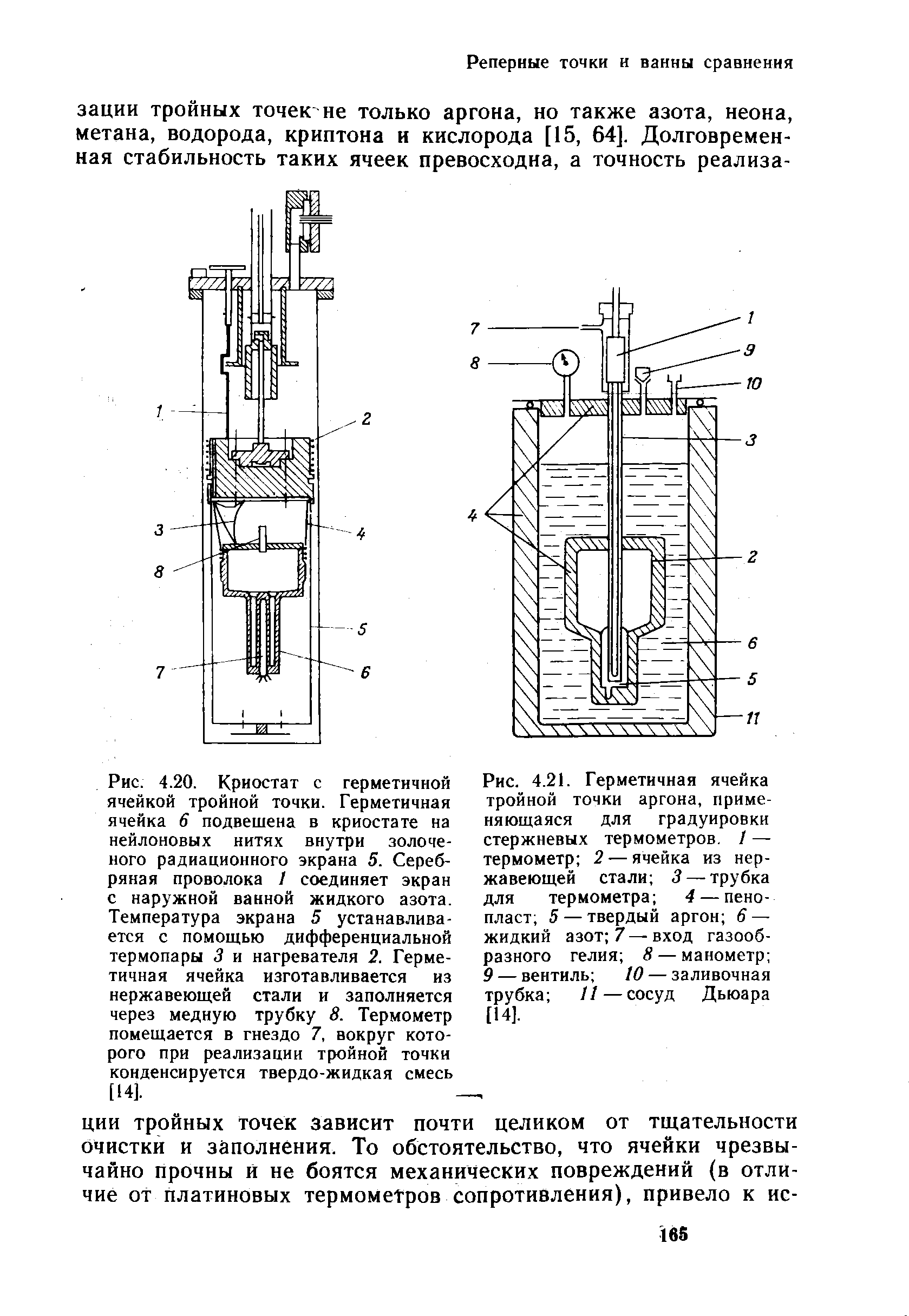
Твердый кислород ( при низких температурах) существует в трех аллотропических модификациях а, 5 и у. Превращение ар протекает при - 249 15 С с ДЯ 2 93 кДж / кг. Превращение В у протекает при - 229 23 С, ДЯ23 15 кДж / кг. С повышением давления возрастают температуры аллотропических превращений кислорода и температура его плавления. Коэффициент dT / dP кривой плавления равен на начальном участке 90 К / ГПа. Температура Рч у-превращения при 0 4 ГПа равна - 206 С. [1]
Твердый кислород кристаллизуется в решетке молекулярного типа, прочность которой небольшая, в связи с чем кислород плавится и кипит при низких температурах. Кислород мало растворим в воде: в 100 объемах воды при 20 С и 1 01325 - 105 Па ( 1 атм) растворяется всего 3 1 объема кислорода. [2]
Твердый кислород кристаллизуется в решетке молекулярного типа, прочность которой небольшая, в связи с чем кислород плавится и кипит при низких температурах. Кислород мало растворим в воде: в 100 объемах воды при 20 С и 1 атм растворяется всего 3 1 объема кислорода. [3]
Растворимость твердого кислорода в газообразном водороде в интервале 54 4 - 36 К примерно в 10 раз меньше, чем азота. Растворимость кислорода с повышением температуры с 36 К до 53 К при 1 5 МПа увеличивается примерно на два порядка. Растворимость кислорода в жидком водороде составляет ( 0 1 - 0 5) 10 - 7 мольной доли. [5]
Для твердого кислорода характерны кристаллы трех различных типов, устойчивые в определенном интервале температур: ниже 24 К, от 24 до 44 К и от 44 до 54 3 К - Температуры 24 и 44 К называются точками перехода. [6]
Наличие твердого кислорода в водороде может привести к взрыву. [7]
Кристаллы твердого кислорода, ароматические соединения ( такие, как бензол, нафталин, антрацен и др.), а также более сложные кристаллы платиносинеродистых и ураниловых соединений тоже дают высвечивание дискретных центров. [8]
Для твердого кислорода характерны кристаллы трех различных типов, устойчивые в определенном интервале температур: ниже 24 К, от 24 до 44 К и от 44 до 54 3 К - Температуры 24 и 44 К называются точками перехода. [9]
Наличие твердого кислорода в водороде может привести к взрыву. [10]
Плотность твердого кислорода ( при температуре плавления) равна 1 27 г / см3, а его теплота плавления 0 11 ккал / моль. Для твердого кислорода характерны кристаллы трех различных типов, причем каждый из них устойчив в определенных пределах температур: ниже - 249 С, от - 249 до - 229 С и от - 229 С до температуры плавления. [11]
Приходько с сотрудниками твердый кислород при сверхнизких температурах имеет три кристаллических состояния, которые отличаются друг от друга взаимным расположением молекул. [13]
Среди приведенных данных следует отметить низкое давление пара твердого кислорода, которое позволяет повышать на короткое время температуру кислородной матрицы до 0 7 Тпп ( 40 К) без испарения последней. Это означает, что процессы диффузии могут быть прослежены более полно в данной матрице. Надо также обратить внимание на относительную жесткость матриц С02 и SF6, для которых диффузия не начинается до температур, превышающих 100 К. [14]
Весьма актуальной является проблема очистки жидкого водорода от примесей твердого кислорода при транспортировке и хранении продукта. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Свойства кислорода
Свойства кислорода
Кислород при обычных условиях — бесцветный газ, не имеющий запаха и вкуса. Его плотность при температуре 273 К и давлении 0,1 МПа составляет 1,43 кг/м3. При охлаждении до 90 К под давлением 0,1 МПа кислород превращается в легкоподвижную голубоватую жидкость. При дальнейшем охлаждении до 54,3 К кислород переходит в твердое состояние — кристаллы голубого цвета. Плотность жидкого и твердого кислорода соответственно равна 1,14-103 и 1,46 ¦ 103 кг/м3. Теплота плавления твердого кислорода составляет 14,4 кДж/кг.[ ...]
Для твердого кислорода характерны кристаллы трех различных типов, устойчивые в определенном интервале температур: ниже 24 К, от 24 до 44 К и от 44 до 54,3 К. Температуры 24 и 44 К называются точками перехода.[ ...]
Для испарения 1 м3 жидкого кислорода необходимо сообщить ему энергию 242 МДж. Объем образующегося газа при 293 К и давлении 0,1 МПа составляет 800 м3.[ ...]
Одним из наиболее характерных свойств кислорода является его большая химическая активность. Он образует соединения со всеми химическими элементами, кроме аргона, гелия, криптона, ксенона и неона.[ ...]
Реакции соединения большинства элементов с кислородом являются экзотермическими, т. е. идут с выделением тепла. Горение веществ в чистом кислороде протекает гораздо быстрее, чем на воздухе, а температура горения в кислороде значительно выше. Горючие газы (водород, ацетилен и др.) могут образовывать с кислородом взрывчатые смеси. Смазочные масла, а также их продукты разложения в контакте с газообразным и жидким кислородом могут легко воспламеняться от различных источников, а при определенных условиях горение может перейти в детонацию.[ ...]
Пористые горючие вещества (древесная мука, угольная пыль, пенопластмассы и др.), пропитанные жидким кислородом, могут детонировать при поджигании в замкнутом объеме или воздействии сформированной детонационной волны (например, при подрыве капсюля-детонатора). Такие вещества называются оксиликвитами и находят применение при горновзрывных работах.[ ...]
В условиях продолжительного воздействия электрического разряда жидкий кислород может переходить в новое химическое соединение — жидкий озон, легко взрывающуюся жидкость темно-голубого цвета с температурой кипения 161 К- Газообразный озон имеет голубоватый цвет и обладает характерным запахом. В природе он образуется в основном при грозовых разрядах и окислении некоторых органических веществ (смолы хвойных деревьев, морских водорослей). В лабораторных условиях газообразный озон получают в специальных приборах — озонаторах действием на газообразный кислород тихого разряда (электрического разряда без свечения и искр).[ ...]
Озон состоит из молекул, содержащих три атома кислорода 03. Молекула Оз легко отдает один атом кислорода, что сопровождается значительным выделением энергии. Поэтому озон является очень сильным окислителем. В присутствии озона происходит очень быстрое «старение» резины, а ряд органических веществ (например, спирт) при соприкосновении с ним могут воспламениться. В жидком кислороде ацетилен и некоторые другие углеводороды могут самопроизвольно взрываться в присутствии озона. Жидкий озон смешивается с жидким кислородом в любых соотношениях при температурах выше 93 К (под давлением). При более низких температурах происходит расслоение жидкости.[ ...]
Вернуться к оглавлениюru-safety.info
Кислород плотность газа - Энциклопедия по машиностроению XXL
Чистый ксенон содержит ксенона не менее 97,5%, криптона не более 3%, примеси кислорода, азота и других инертных и химически активных газов и водяного пара не допускаются. Относительная плотность газа (по воздуху) не менее 4,51. [c.137]
Кислород - бесцветный газ, без запаха, тяжелее воздуха, плотность его при нормальном давлении и комнатной температуре 1,33 кг/м . Очень активен - соединяется со всеми химическими элементами, кроме инертных газов. Реакции веществ с кислородом экзотермические, идущие с выделением теплоты при высокой температуре, - это горение. Получают кислород из воздуха глубоким охлаждением или из воды электролизом. В первом случае воздух в несколько приемов сжимают, каждый раз отводя выделяющуюся теплоту. После каждого цикла сжатия воздух очищают от влаги и углекислого газа. При температуре -194,5 °С воздух становится жидким. Затем его разделяют на кислород и азот перегонкой (ректификацией), основанной на разности температур кипения жидкого азота (-196 °С) и кислорода (-183 °С). При ректификации жидкий воздух переливают в ректификационной колонне. Азот при этом испаряется и отводится через верхнюю часть колонны, а кислород сливается на ее дно. Часть его испаряется и отводится из колонны, а жидкий кислород закачивают в теплоизолированные цистерны (танки), в которых его транспортируют. К месту сварки кислород доставляют газообразным в баллонах синего цвета под давлением 150 кг/см (15 МПа). Ректификацией кислород доводят до чистоты не менее 99,2 % - это технический кислород 3-го сорта 2-й сорт содержит 99,5 %, а 1-й сорт - 99,7 % кислорода. Остальное- азот, аргон и другие примеси. Чем ниже чистота кислорода, тем хуже качество газопламенной обработки металла, особенно резки. [c.53]
Чем больше расход газа и его плотность, тем выше поднимется поплавок. Поплавки ротаметров изготавливаются из алюминия, эбонита и стали, они имеют различную массу. Каждый тип ротаметра имеет свою градуировочную шкалу. Например, шкала расходомера РС-3 (см. рис. 89, 6) отградуирована на расход воздуха (рис. 90). Защитные газы легче или тяжелее воздуха. Поэтому для них введены поправочные коэффициенты К чем больше плотность газа, тем меньше К. Например, для азота К = 1,02 для аргона К - 0,85 для водорода К - 3,6 для гелия К = 2,7 для кислорода К = 0,955 а для углекислого газа Л" = 0,81. [c.163]
При использовании водорода для охлаждения крупных электрических машин снижаются потери мощности на трение ротора о газ и на вентиляцию, эти потери приблизительно пропорциональны плотности газа. Далее, значительно улучшается охлаждение машины за счет весьма большой теплопроводности водорода, а также повышенного коэффициента теплоотдачи водород. Вследствие отсутствия окисляющего действия кислорода воздуха замедляется тепловое старение органической изоляции обмоток и устраняет-36 [c.36]
Влияние химической природы топлива коэффициента избытка воздуха плотности, температуры и степени завихрений рабочей смеси конструкции камеры сгорания характеристики топливоподающей системы примесей водяного пара, кислорода, инертных газов и т. д. также полностью еще не изучено, хотя большими и тщательно проведенными экспериментальными работами доказано их существенное значение для организации процесса сгорания. [c.148]
В ряде случаев к инертным газам для улучшения устойчивости дугового разряда, улучшения перехода металла в ванну, формирования шва, увеличения производительности сварки, а также повышения плотности металла швов к инертным газам добавляют те или иные активные газы в количествах, допустимых по их металлургическому воздействию на металл в условиях сварки. В качестве подобных добавок применяют кислород, углекислый газ, азот и водород. Такие смеси следует рассматривать тоже как инертные газы, хотя это и не совсем точно. [c.244]
В настоящей статье приводятся результаты исследования процесса отражения ударного разрыва от жесткого торца ударной трубы. В качестве рабочего газа использовался промышленный азот, содержащий около 0,5% кислорода. Установка и методика проведения опытов описаны в работах [1, 2]. Изменение плотности газа во времени в фиксированном сечении ударной трубы определялось по интерферограммам. Интерференционная картина, вырезаемая вертикальной щелью, регистрировалась на фотоматериал, движущийся с постоянной скоростью [c.119]
Стойкость в газах (азот, кислород, углекислый газ). Порошок мононитрида плутония с частицами размером 250 мкм в атмосфере азота, содержащей 1 вес.% кислорода, окисляется медленнее, чем на воздухе. Степень окисления за 30 суток составляет 18%. Компактный мононитрид плутония окисляется очень слабо, при этом образуется прочная пленка окисла, увеличивающаяся очень медленно. Так, да 30 суток хранения в атмосфере азота, содержащей 1 об.% кислорода, вес образца увеличился всего на 0,179%. Для таблеток более высокой плотности следует ожидать еще меньшего изменения веса. [c.338]
Лод молекулярным весом в химии понимают, как известно, отношение плотности газа к плотности кислорода, умноженное на молекулярный вес кислорода, равный числу 32. Это сравнение плотностей производится при таких малых давлениях, когда газы ведут себя как идеаль- [c.33]
Воздух по объему состоит из 21 % кислорода и 79 % азота. Определить состав воздуха по массе, парциальные давления кислорода и азота при давлении смеси 760 мм рт. ст. и плотность воздуха при нормальных физических условиях, считая его идеальным газом. [c.43]
В баллоне вместимостью 0,10 м находится кислород при давлении 6 МПа и температуре 25 °С. После того как из него была выпущена часть газа, показание манометра стало 3 МПа, а температура кислорода понизилась до 15 °С. Определить массу выпущенного и плотность оставшегося Б баллоне кислорода, если давление окружающей среды 1000 гПа. [c.10]
Снижение относительной влажности воздуха уменьшает агрессивное действие сернистого газа, при этом плотность коррозионных токов мало зависит от его концентрации. Таким образом, влажность воздуха является как бы аккумулятором примесей, в том числе сернистого газа, являющегося наряду с кислородом деполяризатором катодных реакций. Некоторые исследователи устанавливают прямую связь между скоростью коррозии и содержанием сернистых соединений в атмосфере. Повышенная относительная влажность воздуха особо опасна для изделий сложной конфигурации, имеющих много щелей, зазоров, трещин и т. п., в которых долго сохраняются пленка влаги и нерастворимые твердые частицы, адсорбирующие газы из атмосферы. С увеличением относительной влажности толщина адсорбционного слоя электролита на поверхности металла возрастает. Так, при влажности 55% она составляет 15 молекулярных слоев, при относительной влажности около 100% количество их возрастает до 90—100. Замечено, что коррозия на металлических образцах, обращенных к земле на высоте до 0,5 м, протекает интенсивнее, чем на поверхности, непосредственно доступной атмосферным осадкам. Это особенно ярко выражено в условиях повышенной относительной влажности и объясняется тем, что в стороне, обращенной к земле, дольше сохраняется влага. [c.17]
Механизм процесса электрохимического обезжиривания сводится к эмульгированию лэлектрохимического обезжиривания является влияние выделяющегося водорода, который проникает внутрь металла и вызывает его хрупкость. Установлено, что чем выше плотность тока (при затрате одинакового количества электричества), тем меньше степень наводороживания металла. Выгоднее проводить обезжиривание при высокой плотности тока (выше 5—10 A/дм ) и [c.124]
Плазменное напыление покрытий имеет ряд преимуществ по сравнению с защитными покрытиями других видов сверхвысокие температуры плазменного напыления позволяют расплавлять и наносить различные материалы с высокой температурой их плавления поток плазмообразующего газа, не содержащего кислорода, позволяет напылять материалы без их разложения, не допуская окисления поверхности обрабатываемого изделия поток плазмы дает возможность получать сплавы различных материалов, в том числе тугоплавких, теплостойких, и наносить многослойные покрытия высокая скорость потока газа позволяет увеличить плотность покрытия до 98% и достичь прочного сцепления с основным металлом заготовки покрываемая поверхность заготовки нагревается до температуры не выше 200° С, что исключает коробление деталей и позволяет наносить материал на дерево, пластмассы и т. п. энергетические характеристики потока плазмы легко регулировать в зависимости от требований технологии, что неосуществимо при газопламенном методе напыления. [c.327]
ВОДИТЬСЯ из воды несколькими методами, как термохимическими, так и электролитическими. На лабораторном уровне разработано и разрабатывается много идей, касающихся транспорта и хранения водорода. Водород может быть использован многими путями в авиации, автотранспорте, бытовых приборах и в электроэнергетических системах. В последнее время активно обсуждается возможная роль водорода как побочного продукта производства электроэнергии на ядерных электростанциях, поскольку этот метод обеспечивает дешевое получение энергии. Однако возникают серьезные проблемы при широкомасштабном использовании водорода, связанные с его транспортом и хранением. Водород способен проникать в металлы и делать их хрупкими. Предлагаются два решения этих проблем — использование ингибирующих добавок (например, очень небольших количеств кислорода) и применение защитных покрытий. Некоторые представители промышленности по добыче природного газа США (дебаты во время Мировой энергетической конференции, 1974 г.) рассматривают водород как жидкий энергоноситель будущего для наполнения газопроводов по мере истощения ресурсов природного газа. Это, видимо, беспочвенные надежды. Ведь должен быть найден чрезвычайно эффективный ингибитор, препятствующий возникновению утечек в старых газопроводных системах. Теплота сгорания водорода низка — только 10 056 кДж/м по сравнению с 33 520 кДж/м метана. Поэтому для обеспечения тех же количеств энергии при более низкой плотности водорода потребуются газопроводы большого диаметра или с большим давлением по сравнению с использованием природного или синтетического газа, с чем будут связаны значительные дополнительные капиталовложения. С особыми свойствами водорода связаны и проблемы его хранения. Водород можно хранить в дорогих сосудах Дьюара или под давлением, что обходится очень дорого. Имеются оценки затрат на [c.209]
Во всех исследованных реакторах содержание кислорода в паре было практически постоянно, независимо от мощности реактора, и общее разложение (газы в паре), следовательно, почти прямо пропорционально мощности реактора. Так как это справедливо как для реакторов с естественной циркуляцией (поток изменяется с мощностью), так и для реакторов с принудительной циркуляцией (постоянный поток), то не уделялось внимания скорости потока и общей мощности. Условия работы каждого реактора характеризовались соответствующей величиной образования газа на единицу мощности, выраженной в литрах кислорода в минуту на мегаватт общей мощности. Пропорциональность образования газа мощности реактора свидетельствует о том, что в изученной области плотность энергии не является важным или специфичным параметром. Это специально исследовалось на установке в Биг-Рок-Пойнте путем изменения удельной мощности от 45 до 30 кет/л при постоянной общей мощности и какой-либо эффект не был найден. Однако необходимо заметить, что одновременно изменялось распределение поглощения энергии между кипящим и некипящим теплоносителями, так как общий объем зоны не изменяется. [c.94]
Аргон Аг. Газ, молекулярный вес 39,944 плотность 1,784 г/л. Аргон принадлежит к числу недеятельных газов, т. е. не вступающих в соединение с другими веществами, и поэтому его используют в качестве оградительной нейтральной атмосферы при сварке и переплавке металлов. По ГОСТу 10157—62 выпускают трех марок А, Б и В с содержанием чистого аргона 99,99% 99,96% и 99,9% кислорода 0,003% 0,005%, 0,005 азота 0,01 0,04 и 0,10 и влаги 0,03% для всех марок. Поставляют в баллонах по ГОСТу 949—57. [c.280]
Согласно опытным данным, величины (га , р, t, ф—1) ведут себя так же, как и плотности воздуха, т. е. следуют законам Бойля —Мариетта и Гей-Люссака, а показатель преломления воздуха, уменьшенный на 1, получается сложением величин пх—1) для отдельных компонентов. Согласно DIN 5450—68, при нормальных атмосферных условиях воздух имеет следующий состав (7о) кислорода — 20,9476, азота — 78,087 аргона — 0,934 и углекислого газа — 0,0314. Данных по влажности в этом стандарте не приводится. Влияние содержания СОг на показатель преломления определяется по зависимости [c.87]
В этих формулах М = Gy, G ., — стехиометрический коэффициент, учитывающий соотношение между расходом топлива и кислорода, кг/кг и IV — скорость газов в начальном и рассматриваемом сечениях камеры сгорания, м сек при этом ю Т/То С(,жс —весовая концентрация кислорода в единице реакционного объема в начальном и рассматриваемом сечениях зоны горения, кг/м G ж От — плотность потока топлива на единицу площади камеры сгорания в начальном и рассматриваемом сечениях, кг/м -свк. й = б т/Ст(о) —степень выгорания топлива Хо и объем- [c.15]
Значительный интерес для электротехники представляет водород. Это очень легкий газ, обладающий весьма благоприятными свойствами для использования его в качестве охлаждающей среды вместо воздуха (водород характеризуется высокой теплопроводностью и удельной теплоемкостью). При использовании водорода охлаждение вращающихся электрических машин существенно улучшается. Кроме того, при замене воздуха водородом заметно снижаются потери мощности на трение ротора машины о саз и на вентиляцию, так как эти потери приблизительно пропорциональны плотности газа. Ввиду отсутствия окисляющего действия кислорода воздуха замедляется старение органической изоляции обмоток машины и устраняется опасность пожара при коротком замьпсании внутри машины. Наконец, в атмосфере водорода улучшаются условия работы щеток. Так как водородное охлаждение позволяет повысить мощность машины и ее КПД, крупные турбогенераторы и синхронные компенсаторы выполняются с водородньпч охлаждением (еще более эффективное охлаждение достигается циркуляцией жидкости внутри полых проводников обмоток статора и даже - что, конечно, технически сложнее - ротора). Применение циркуляционного водородного охлаждения требует герметизации машины (подшипники уплотняются при помощи масляных затворов). Чтобы избежать попадания внутрь машины B03ziyxa (водород при содержании его в возд тсе от 4 до 74% по объему образует взрывчатую смесь - гремучий газ), внутри машины поддерживается некоторое избыточное давление, сверх атмосферного постепенная утечка водорода восполняется подачей газа из баллонов. При прочих равных условиях электрическая прочность водорода примерно на 40 %, а угольного ангидрида СОт - на 10% ниже, чем электрическая прочность воздуха. Для заполнения [c.128]
Ингибитор Тайга-1 (ТУ 38 40347-73) представляет собой темно-коричневую легкоподвижную жидкость с характерным запахом растворим в спирте, ацетоне, бензоле, керосине и других растворителях, в воде образует эмульсию. Плотность при 20°С - 0,92-0,96 г/см вязкость при 50°С - 4-10 сСт температура застьшания - минус 58-59 С температура вспышки — 20°С. Ингибитор Тайга- относится к малотоксичным продуктам, защищает черные металлы в слабокислых и нейтральных средах, содержащих сероводород, кислород, углекислый газ, ионы хлора. Ингибитор может применяться для защиты нефтедобывающего оборудования от коррозии, вызьша-емой сильно обво,дненной нефтью, пластовыми и сточными водами, содержащими сероводород и кислород. Защитное действие для углеродистой стали в средах, содержащих сероводород при концентрации 300 мг/л - 97%. [c.25]
Так назУваёмый гремучий газ по массе состоит из 11,1% водорода и 88,9% кислорода. Определить объемный состав, газовую постоянную и плотность газа при барометрическом давлении 0,1 МПа и температуре 15°С. [c.47]
Ig Р в at) = — 39,8/Т -f 2,5 Ig Г - 1,14. Условная химич. константа В. равна 1,6 истинная химическая константа равна 3,685 (Ейкен). Жидкий В. — прозрачная бесцветная жидкость, не проводящая электричества и обладающая поверхностным натяжением в 35 раз меньшим, чем у воды. Коэф. внутреннего трения газообразного В. ч = = 8,5 10" Axi- K M при 0° ои значительно меньше, чем для воздуха, отношение r j lr eo- d— = 0,493 при значительном повышении давления или г° — увеличивается [ ]. В. диффундирует быстрее других газов коэф. диффузии В. в воздухе Л = 0,645 см /ск (0°) в кислороде Л = 0,667 (0°) в азоте А = 0,739 (12°,5, 755 мм) в двуокиси углерода А = = 0,532 (0°) в окиси углерода A = 0,647 (0°) в сернистом ангидриде А = 0,483 (0°) в метане А = 0,625 (0°) в водяном паре А = = 0,716 (0°). В. очень легко диффундирует через пористые перегородки, причем по закону Грэма скорость диффузии пропорциональна давлению и обратно пропорциональна корню квадратному из плотности газа. В. диффундирует также через металлы, кварц и другие вещества. Через железо и сталь В. диффундирует особенно легко при i° > 1 000° через слой Fe толщиной в 1,7 мм при красном калении через I м в I мин. диффундирует [c.507]
Соприкосновение жидкого металла с газами и шлаками может изменить его поверхностное натяжение. Например, кислород снижает поверхностное натяжение стали, поэтому при сварке в инертных газах в смесь добавляют до 5% кислорода. По данным И. К. Походни и А. М. Суптеля, при сварке на обратной полярности анодное пятно стабильно на торце жидкой капли и с увеличением тока его плотность остается постоянной, а размер пятна растет. Поэтому перегрев капли и ее кипение наступают при меньших токах, чем на прямой полярности, когда катодное пятно беспорядочно перемещается. При увеличении плот- [c.88]
Ферросилид представляет собой сплав железа с 14 % Si и 1 % С. Он имеет плотность 7,0—7,2 г-см . При протекании анодного тока на поверхности формируются покрытия, содержащие кремнезем (двуокись кремния), которые затрудняют анодное растворение железа и способствуют образованию кислорода по реакции (8.1). В морской и солоноватой воде образование поверхностного слоя на ферросилиде оказывается недостаточным. Для улучшения стойкости при работе в соленых водах в сплав добавляют около 5 % Сг, 1 % Мп и (или) 1—3 % Мо. Ферросилидовые анодные за землители ведут себя в воде с большим содержанием хлоридов хуже, чем графит, потому что ионы хлора разрушают пассивное покрытие на поверхности этого сплава. Поэтому предпочтительными областями применения таких сплавов являются грунт, солоноватая и пресная вода. Средняя допустимая токовая нагрузка составляет 10—50 А-м-2, причем потеря от коррозии в зависимости от условий эксплуатации не превышает 0,25 кг-Д- -год-. Ввиду малости коррозионных потерь материала ферросилидовые анодные заземлители нередко укладывают непосредственно в грунт [6] необходимо позаботиться об отводе образующихся газов, потому что иначе сопротивление растеканию тока с анодов получится слишком большим [7]. [c.202]
Эффективность химических моющих растворов может быть значительно усилена, а опасность их воздействия на металл уменьшена или предотвращена за счет электрохимического процесса. С этой целью используется поляризирующий ток плотностью примерно 500 А/м при напряжении 3—12 В. Обработка, например, черных металлов производится анодным способом, а сплавов с медью — катодным. Во многих случаях производится быстрое изменение полярности, чтобы снять осажденный шлам с находящегося в растворе изделия. В результате разряда ионов водорода или кислорода на поверхности металла под слоем жира образуются пузырьки газа, которые обеспечивают его механическое разрушение и удаление. Кроме того, щелочи, образованные при катодной обработке, способствуют разрыву масляной пленки и собиранию ее в капельки. Электрохимическое обезжиривание не пригодно для обработки олова, свинца, цинка, алюминия и легких сплавов. [c.57]
Пар и двухфазные системы. Реакции в паровой фазе. В паре низких плотностей, применяемом в технологии силовых реакторов, радиолитические процессы заметно изменяются по сравнению с конденсированной фазой. Для водяного пара низкой плотности при обычных температурах (—НгО) довольно высок, порядка 12. Файрестон [10] нашел, что в водяном паре при низкой температуре при действии -излучения трития g (H) =я(ОН) = 11,7. Практически важным соображением является низкое поглощение энергии в паре низкой плотности. Так, Хемфри [11] почти не обнаружил общего разложения воды в паре при 260°С под действием излучения реактора по сравнению с наблюдаемыми концентрациями кислорода в простой воде в тех же условиях. Хемфри провел также опыты по рекомбинации П2 и Ог в паре в тех же аппаратах. При высоких концентрациях газовой фазы скорость рекомбинации была близка к нулю и не зависела от температуры в интервале 149—260° С. При низких концентрациях общая скорость рекомбинации становилась равной нулю рекомбинация в газовой фазе компенсировалась разложением в жидкой фазе аппаратов. Это согласуется с наблюдаемым уменьшением общего разложения с ростом отношения объема пара к объему жидкости. Влияние ЛПЭ было проверено путем удвоения потока быстрых нейтронов в нейтронном ускорителе. При 260° С не было видимого роста скорости рекомбинации, но стационарная концентрация увеличилась примерно на 50%. К несчастью, с точки зрения применимости к реакторам в опытах по рекомбинации в газе самые низкие концентрации газа были порядка 300 см на литр газовой фазы, или около 2700 см 1иг конденсированного пара, по сравнению с примерно 60 см кг в паровой фазе кипящих водных реакторов. [c.76]
Несмотря на это, способ Винклера продолжали применять в Германии ив некотрых других странах в конце XIX в. Представляют интерес сведения профессора Г. Лунге о фабриках, работавших в то время по способу Винклера. Серную кислоту разлагали на сернистый газ, кислород и воду в вертикальных глиняных глазурованных ретортах (изготовленных из смеси 3 частей шамотных обломков размером с горошину с одной частью бельгийской огнеупорной глины). Реторты находились все в огне и имели вверху и внизу гидравлические запоры для наполнения реторты кислотою и проч. Плотность этих запоров достигалась заливкой их расплавленным стеклом. В первой реторте стоял цилиндр, в который вливалась серная ки- [c.155]
Очиститель газов рис. II-17 представляет собой цилиндрический сосуд / с электронагревателем 2. Через отверстие в верхней крышке 3 этот сосуд заполняется реакционной массой, способной вступать в химическое соединение с газом. При испытаниях с насыщением жидкости определенным количеством кислорода (в пределе нулевым) очиститель заполняют медной стружкой, предварительно отмытой от жира горячим раствором едкого натра или ацетоном. Стружку уплотняют до насыпного веса 0,6—0,9 кг1л такая плотность достигается за счет подбора стружки с размерами отдельных витков от 5 до 20 мм. Кислород удаляется из газа вследствие реакции, протекающей между медью и кислородом [c.80]
Ртуть Hg (Hydrargyrum). При обычной температуре — жидкий белый металл с серебристым оттенком. Распространенность в земной коре 7.10 %. — =—38,87° С, tj an = 357,25°С плотность 13,546 (20° С). В природе встречается в виде киновари HgS, реже в самородном состоянии. Металлическая ртуть получается окислительным обжигом ртутных руд или концентратов с конденсацией газов после обжига и последующей перегонкой сырой ртути. Непосредственно соединяется с серой и галогенами при нагревании с кислородом образует два окисла — закись ртути HgaO и окись ртути HgO, которым соответствует два ряда солей одновалентной и двухвалентной ртути. В разбавленных соляной и [c.373]
Продукты оторания газа при температуре 1 200° С и выше выходят из топки Ч0 рез пленку -воды и уносят выделившиеся из нее газы. Испытания показали, что к. п. д. этого аппарата доходит до 98% по высшей теплоте сгорания, тем пераг) ра отходяш их газов снижается до 30—60° С,, в -связи с чем потери тепла с уходящими газами не превышают ilO%. Плотность орошения составляет на сечение свободной баШ Ни от 6 до 20 ч. Содержание кислорода в воде близко к нулю, а СОг — порядка 3—6 жг/л. [c.59]
В этих уравнениях приняты следующие обозначения Псмад, Пом — скорость газовоздушной смеси в начальном и рассматриваемом сечениях 2 = Ст/Кт(о) — относительное количество газообразного топлива в рассматриваемом сечении Ст(о), Кт — плотность потока газообразного топлива в начальном и рассматриваемом сечениях К , — константа скорости горения газообразного топлива — средняя температура в начальном сечении (температура воспламенения) Т — средняя температура в рассматриваемом сечении Сд, с — относительная весовая концентрация кислорода в газовоздушной смеси в начальном и рассматриваемом сечениях с, с — относительная весовая концентрация горючего газа в начальном и рассматриваемом сечениях — коэффициент избытка воздуха М — стехиометрический коэффициент. [c.23]
Атмосферы К. состоят из иейтральпого газа, илазмы и пыли. Плотность кометной атмосферы зависит 0-г г и расстояния от ядра Д. Атмосферы нестационарны и резко неоднородны. Типичное зиачеиие концентрации молекул (гл. обр. Н О) у ледяной поверхности ири г=1 а. е. порядка 10 см и убывает с удалением от ядра но закону или быстрее. В радиусе носк. тыс. км происходит распад вышеназванных родительских молекул с образованием наблюдаемых радикалов j, С3, N, Nh3, NH, ОН, СН, S , а также ионов С0+, СО , СН +, и 0Н+. Продукты распада зато.м, в свою очередь, распадаются (прибл. за сутки) на отд. атомы и перестают излучать в видимом диапазоне (кроме атома кислорода). [c.427]
mash-xxl.info
Чистота и плотность кислорода, важные показатели

Все мы точно знаем, что есть определенные элементы, без которых жизни бы не было как таковой и одним из этих элементов является кислород. Причем не только наличие кислорода достаточно для жизни, необходимыми условиями для жизни являются нормальная плотность кислорода, его чистота и т.п. Если хотя бы один из показателей кислорода отходит от нормы качество жизни резко снижается, а иной раз возникает угроза возникновения разных тяжелых заболеваний и летального исхода. Однако и плотность кислорода и чистота его зависит от многих влияющих условий, от температуры, от уровня загрязнения, а сам кислород может быть в виде газа, жидкого кислорода и твердого кислорода.
Кислород – это газ, прозрачный, мы его не видим, без какого-либо запаха и вкуса. Благодаря кислороду мы не только дышим, но и существуем, он входит в состав наших молекул, обеспечивает функции и нормальные структуры нуклеиновых кислот, белков, углеводов, разных низкомолекулярных соединений и липидов. Именно кислорода и в животном и в растениях больше чем какого-либо другого элемента (примерно 70%), так в человеческом организме с массой тела около 70-ти килограмм содержится примерно 43 килограмма кислорода. Большая часть кислорода поступает через органы нашего дыхания, (так называемый свободный кислород) и с водой (так называемый связанный кислород). Наша потребность в кислороде определяется интенсивностью (уровнем) обмена веществ, зависящего от возраста, массы тела, пола, поверхности тела, внешних условий, питания и тому подобного.
Кислород применяется в разных сферах человеческой жизни, не только в биологическом плане:
- кислород применяется в металлургии;
- жидкий кислород применяется как окислитель в ракетном топливе;
- как реагент для взрывов.
Кислород применяется в медицине для кислородных подушек, но слишком долгое использование обогащенного кислорода может навредить человеку, образовывая свободные радикалы и нарушая функции и структуры биополимеров. Кислород используется в лучевой терапии, вызывая кислородный эффект, также кислород используется для насыщения кислородом организма при некоторых заболеваниях.
improvehealth.ru