Промышленные методы получения водорода. Как получают водород в промышленности
|
|
|
|
www.wewees.ru
Как получают водород в промышленности
Выбор того или иного способа получения водорода связан со специальным его назначением, с местными условиями производства, экономическими соображениями: стоимостью установки, компактностью аппаратуры, производительностью, степенью загрязнения водорода и т.д.Среди технических способов получения водорода (как получают водород в промышленности) выделяют:— Электролиз воды. Данный процесс сводится к разложению воды постоянным электрическим током. При этом из 36 л воды получается 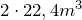 водорода и
водорода и 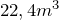 кислорода. Чтобы увеличить электропроводность чистой воды, к ней прибавляют какой-нибудь электролит – кислоту, щелочь, соль. Установки, в которых в технике производится электролиз воды, называются электролизерами. На их электродах поддерживают разность потенциалов около 2 – 3 В, плотность тока – 200
кислорода. Чтобы увеличить электропроводность чистой воды, к ней прибавляют какой-нибудь электролит – кислоту, щелочь, соль. Установки, в которых в технике производится электролиз воды, называются электролизерами. На их электродах поддерживают разность потенциалов около 2 – 3 В, плотность тока – 200 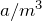 .— Метод глубокого охлаждения. При коксовании каменного угля в качестве основных побочных продуктов получается: сырой бензол, аммиак, смола и коксовый газ. Главной составной частью коксового газа (по объему) является водород – обычно от 45 до 60%.Наиболее простой способ использования водорода коксовых газов состоит в конденсации загрязняющих водород газов путем охлаждения газовой смеси до весьма низкой температуры. Этим же способом можно получить водород из водяного пара.— Конверсионный метод. Сущность этого способа заключается в окислении окиси углерода водяным паром. Реакция протекает при давлении (25 атм) и температуре
.— Метод глубокого охлаждения. При коксовании каменного угля в качестве основных побочных продуктов получается: сырой бензол, аммиак, смола и коксовый газ. Главной составной частью коксового газа (по объему) является водород – обычно от 45 до 60%.Наиболее простой способ использования водорода коксовых газов состоит в конденсации загрязняющих водород газов путем охлаждения газовой смеси до весьма низкой температуры. Этим же способом можно получить водород из водяного пара.— Конверсионный метод. Сущность этого способа заключается в окислении окиси углерода водяным паром. Реакция протекает при давлении (25 атм) и температуре 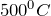 в присутствии катализаторов. Образующийся при этом окислении диоксид углерода удаляют растворением в воде под давлением. В качестве катализаторов применяют оксиды железа, хрома и других металлов.
в присутствии катализаторов. Образующийся при этом окислении диоксид углерода удаляют растворением в воде под давлением. В качестве катализаторов применяют оксиды железа, хрома и других металлов.
ru.solverbook.com
Способы получения водорода. Задачи 785
Задача 785. Почему в периодической системе элементов водород относят как к I, так и к VII группе?Решение:Атом водорода содержит один электрон, его электронная конфигурация имеет вид: 1s2. Поэтому атом водорода способен как отдавать, так и присоединять по одному электрону. Таким образом, образом водород проявляет двойственную химическую природу, как окислительную, так и восстановительную способность. В большинстве реакций водород выступает в качестве восстановителя, образуя соединения, в которых степень его окисленности равна +1. в реакциях с активными металлами водород выступает в качестве окислителя, степень окисленности его при этом равна -1. Итак, водород, отдавая электрон, проявляет сходство с металлами I-й группы главной подгруппы периодической системы химических элементов, а, присоединяя электрон, - с неметаллами VII-й группы главной подгруппы. Поэтому водород в периодической системе обычно помещают в главной подгруппе I-й группы и, в тоже время, в скобках, помещают в главной подгруппе VII-й группы.
Задача 786. Как получают водород в промышленности и в лаборатории? Привести уравнения реакций.Решение:а) Получение водорода в промышленности:1. Получение синтез-газа:
Ni 800oCСН4 + Н2О → CO + 3h3
2. Крекинг углеводородов:
С2Н6 → 2С + 3Н2
3. Электролиз водного раствора едкого натра или едкого калия. Используют 25% NaOH или 34% КОН. Электроды изготавливают из листового никеля. При этом на катоде выделяется водород, а на аноде – кислород:
Катодный процесс: 2Н2О + 2 = Н2 + 2ОН-;Анодный процесс: 4ОН- - 4
= Н2 + 2ОН-;Анодный процесс: 4ОН- - 4 = О2 + 4Н+.
= О2 + 4Н+.
4. Вытеснение водорода из воды различными металлами. Метод основан на том, что активные металлы вытесняют водород из воды, например, натрий и кальций разлагают воду при обычных условиях, магний – при нагревании, цинк – при накаливании с водяным паром, железо – при нагревании около 7000С. Чаще всего используют в промышленности для получения водорода так называемый железо-паровой метод:
3Fe + 4h3O = Fe2O4 + 4h3↑;Fe + h3O = FeO + h3↑.
5. Получение водорода из природного газа. В промышленности по этому методу природный газ смешивают с кислородом и водяным паром при нагревании данной смеси до 800-9000 С в присутствии катализатора (пароводяная и кислородная конверсия):
2Ch5 + O2 + 2h3O = 2CO2 + 6h3.
6. Метод выделения водорода из коксового газа или из газов переработки нефти. Метод основан на глубоко охлаждении газовой смеси, при котором все газы кроме водорода сжижаются – водород остаётся в газовой фазе, которую под давлением собирают в баллоны.
7. Метод получения водорода при получении сажи из природного газа:
Ch5 → C + 2h3↑
8. Метод получения водорода при пропускании паров воды над раскалённым углем при температуре 10000 С (водяной газ, содержащий до 86% угарного газа и водорода):
C + h3O = CO + h3
б) Получение водорода в лабораторных условиях:
1. Метод растворения цинка в холодной соляной кислоте или в разбавленной серной кислоте:
Zn + 2HCl = ZnCl2 + h3↑; Zn + h3SO4 = ZnSO4 + h3↑.
2. Растворение алюминия с сильными щелочами:
2Al + 2NaOH + 10h3O = 2Na[Al(OH)4(h3O)2] + 3h3↑
3. Электролиз раствора КОН (электроды из листового никеля):
Катодный процесс: 2Н2О + 2 = Н2 + 2ОН-;Анодный процесс: 4ОН- - 4
= Н2 + 2ОН-;Анодный процесс: 4ОН- - 4 = О2 + 4Н+.
= О2 + 4Н+.
4. Действие порошком алюминия на кипящую воду в присутствии нескольких капель разбавленного перманганата калия:
t0 2Al + 3h3O → Al2O3 + 3h3↑.
5. В полевых условиях водород получают из смеси (порошок ферросилиция с сухим Са(ОН)2 и NaOH). При поджигании данной смеси сначала она начинает тлеть, а затем наблюдается выделение водорода:
Si + Ca(OH)2 + NaOH = Na2SiO3 + CaO + 2h3↑
Смесь называется гидрогенит.
Задача 787. Можно ли для электролитического получения водорода использовать в качестве электролита водные растворы h3SO4, K2,SO4 KCl, CuSO4, NaOH? Ответ обосновать.Решение:Электродные потенциалы калия, натрия и меди соответственно равны -2,92 В, -2,714 В и +0,337 В, а водородного электрода в кислой в щелочной и в нейтральной средах соответственно равен 0,00 В, -0,83 В и -0,41 В. При этом на катоде происходит электрохимическое выделение водорода в зависимости от условий среды:Катодный процесс: В кислой среде: 2H+ + 2 = Н2↑;В щелочной или нейтральной среде: 2Н2О + 2
= Н2↑;В щелочной или нейтральной среде: 2Н2О + 2 2 = h3 + 2ОН-.Следовательно, при электролизе h3SO4 будет разряжаться ионы водорода и выделяться газообразный водород.
2 = h3 + 2ОН-.Следовательно, при электролизе h3SO4 будет разряжаться ионы водорода и выделяться газообразный водород.
При электролизе K2SO4 и KCl происходит электрохимическое восстановление воды, результатом которого будет выделение водорода и гидроксид-ионов, потому что электродный потенциал калия (-2,92 В) значительно электроотрицательнее, чем потенциалы -0,41В и -0,83 В.
При электролизе раствора CuSO4 будет происходить разряд ионов меди и, при этом на катоде выделится металлическая медь, потому что электродный потенциал меди значительно положительнее, чем потенциал водородного электрода.
При электролизе NaOH происходит электрохимическое восстановление воды, результатом которого будет выделение водорода и гидроксид-ионов, потому что электродный потенциал натрия (-2,714 В) значительно электроотрицательнее, чем потенциалы -0,41В и -0,83В.
Таким образом, для электрохимического получения водорода можно использовать растворы h3SO4, K2SO4 KCl и NaOH.
Задача 788. Железо-паровой метод получения водорода основан на обратимой реакции 3Fe + 4h3O = Fe3O4 + 4h3↑. В каких условиях следует осуществлять этот процесс, чтобы реакция протекала до практически полного окисления железа?Решение:Уравнение реакции имеет вид:
3Fe + 4h3O = Fe3O4 + 4h3↑
Из уравнения реакции следует, что из четырёх молекул парообразной воды образуется четыре молекулы газообразного водорода, т.е. реакция протекает без изменения числа молей газообразных веществ, поэтому равновесие системы не нарушается при изменении давления. В данном случае при удалении продукта реакции водорода из реакционной зоны равновесие системы согласно принципу Ле Шателье сместится вправо, в сторону увеличения образования водорода. Но лучше всего выводить из реакционной системы твёрдый продукт Fe3O4, что будет способствовать смещению равновесия вправо, если железную окалину направлять на регенерацию, допустим посредством накаливания окалины в струе паровоздушной смеси и, затем, возвратить образуемое металлическое железо в реакционную зону. Избыток металлического железа будет способствовать ускорению реакции и, следовательно, увеличению продукта реакции. Таким образом, отведение водорода и регенерация железа способствуют протеканию реакции до практически полного окисления металлического железа.
buzani.ru
Способ получения водорода в промышленности?
обработкой раскаленного угля водяным паром в специальных аппаратах - газогенераторах. В результате взаимодействия водяного пара с углеродом образуется так называемый водяной газ, состоящий из водорода и монооксида углерода: С + Н2О = СО + Н2. При обработке водяного газа водяным паром в присутствии железного катализатора монооксид углерода превращается в диоксид, который легко растворяется в воде при повышенном давлении или в растворах щелочей: СО + Н2О = СО2 + Н2; СО2 + Н2О = Н2СО3; СО2 + 2 КОН = К2СО3 + Н2О;
В промышленности водород получают способами: 1) обработкой раскаленного угля водяным паром в специальных аппаратах - газогенераторах. В результате взаимодействия водяного пара с углеродом образуется так называемый водяной газ, состоящий из водорода и монооксида углерода: С + Н2О = СО + Н2. При обработке водяного газа водяным паром в присутствии железного катализатора монооксид углерода превращается в диоксид, который легко растворяется в воде при повышенном давлении или в растворах щелочей: СО + Н2О = СО2 + Н2; СО2 + Н2О = Н2СО3; СО2 + 2 КОН = К2СО3 + Н2О; 2) конверсией (превращением) метана с водяным паром, углекислым газом или смесью водяного пара и углекислого газа: СН4 + Н2О = СО + 3 Н2; СН4 + СО2 = 2 СО + 2 Н2; 3 СН4 + СО2 + 2 Н2О = 4 СО + 8 Н2. Эти процессы протекают при температуре около 1000 град. С в присутствии катализатора на основе никеля с добавками оксидов магния, алюминия и других металлов. Полученная смесь может использоваться как сырье для производства различных органических веществ (метанола, альдегидов, углеводородов и др. ) или получения водорода (смесь обрабатывают водяным паром, как показано выше) ; 3) как побочный продукт производства хлора и гидроксидов щелочных металлов электролизом растворов их хлоридов.
touch.otvet.mail.ru
Промышленное получение - водород - Большая Энциклопедия Нефти и Газа, статья, страница 1
Промышленное получение - водород
Cтраница 1
Промышленное получение водорода не может быть основано на реакции цинка с разбавленными кислотами, поскольку такой процесс неэкономичен. [1]
Промышленное получение водорода из метана и высших углеводородов может базироваться на коксовом и природном газе и на газах гидрогенизации топлива. [2]
Для промышленного получения водорода было предложено большое количество различных способов. Однако перечислять все способы и патенты по производству водорода нет нужды; это представляет главным образом исторический интерес, поскольку большинство из предложенных способов вообще не было осуществлено в промышленном масштабе, а в практических условиях оправдали себя лишь некоторые из них. [3]
Основным сырьем для промышленного получения водорода служат природные горючие газы, коксовый газ, газы нефтепереработки, продукты газификации угля и воды. [4]
Основными видами сырья для промышленного получения водорода служат природные газы - коксовый газ и продукты газификации различных видов топлива. [5]
Однако использование этого процесса для промышленного получения водорода и кислорода было предложено русским физиком Д. А. Лачиновым [7] намного позже ( в 1888 г.), после того как промышленности стали доступны механические генераторы постоянного тока. [6]
Конверсия водяного газа является основным методом промышленного получения водорода. [7]
Эта реакция имеет важное значение при промышленном получении водорода. [8]
Теперь укажем третий способ, который имеет большое значение для промышленного получения водорода. При пропускании пара над докрасна раскаленным коксом образуется смесь водорода и оксида углерода. Из-за своего происхождения эта газовая смесь называется водяной газ. [9]
Каталитическая конверсия метана водяным паром лежит в основе одного из методов промышленного получения водорода. [11]
В технологии неорганических веществ большое значение имеет конверсия метана, лежащая в основе процесса промышленного получения водорода. При температуре около 0 С и более низкой СН4 образует гидрат со льдом, являющийся клатратом. Возможность образования данного соединения следует учитывать при эксплуатации газопроводов - если газ содержит влагу, то при низкой температуре происходит закупорка газопровода гидратом. [12]
В настоящее время установлено, что равновесное превращение углеводородов достигается только на никелевом катализаторе, особенно с добавкой окиси алюминия. Поэтому для промышленного получения водорода каталитической конверсией жидких углеводородов используют преимущественно катализатор на основе никеля. Содержание никеля, составы носителя и промоторов, способы приготовления никелевых катализаторов весьма разнообразны. [13]
Богатые метаном природные газы являются очень хорошим топливом, 1 м3 которого дает при сгорании 33 ч - 37 МДж. Кроме того, они служат основным сырьем для промышленного получения водорода. Получаемый газ подвергается затем вторичной обработке водяным паром ( доп. [14]
Процесс паровой каталитической конверсии природного газа является наиболее распространенным способом промышленного получения водорода. Этот эндотермический процесс обычно осуществляют в трубчатых реакторах с внешним газовым обогревом, Наиболее перспективным и экономичным считается процесс паровой конверсии под давлением 20 - 30 атм. [15]
Страницы: 1 2
www.ngpedia.ru
Применение водорода в промышленности - Справочник химика 21
Применение водорода в качестве моторного топлива для автомобильных двигателей в значительной мере определяется возможностью его получения в больших количествах при затратах на единицу энергии, сопоставимых с затратами, имеющими место при получении современных высокооктановых бензинов. В этом направлении в большинстве высокоразвитых стран ведутся интенсивные поиски высокоэффективных способов получения водорода. Ближайшей промышленной перспективой производства водорода будет его получение путем газификации углей. Объясняется это тем, что запасы углей достаточно велики и их использование путем газификации наиболее целесообразно как с экономической, так и с экологической точек зрения. Наиболее распространенным методом газификации углей является процесс Лурги — газификация под давлением в стационарном слое на парокислородном дутье. Перспективным также представляется способ получения водорода из воды в термохимических замкнутых циклах с использованием низкопотенциального тепла ядерных реакторов. Важное место в получении водорода отводится электролизу воды путем использования избыточной мощности электростанций в периоды их минимальной загрузки. Такое комбинирование электроэнергетики с системой производства и аккумулирования водорода позволит использовать электростанции в экономичном [c.6]
Современные крупные установки химической, нефтехимической и нефтеперерабатывающей промышленности (синтеза метанола, гидрирования нефтяных сред и др.) характеризуются применением аппаратуры, работающей при высоких давлениях и температурах до 550—600 °С, с применением водорода и его соединений в качестве одной из реакционных сред. Для изготовления этой аппаратуры используют преимущественно хромомолибденовые и хромистые стали. Стали с содержанием молибдена отличаются от углеродистых более высокими показателями механических свойств при повышенных температурах, поэтому рекомендуемая область их применения расширяется до 560 °С. Трубы из сталей с содержанием 5—8% хрома отличаются от труб из углеродистых ст.алей более высокой коррозионной стойкостью в серосодержащих средах, поэтому их часто применяют в теплообменных аппаратах даже при умеренных температурах, но при повышенной агрессивной активности сред. Стали, содержащие относительно небольшое количество хрома (0,5—11%), отличаются повышенной стойкостью к водородной коррозии. [c.215]
Для широкого применения водорода в энергетике и промышленности планируется его крупномасштабное производство из воды. Существующие и разрабатываемые способы производства водорода из воды следующие 1) электролиз воды 2) термохимические способы 3) комбинированные способы (термохимические и электрохимические). [c.78]
Поэтому водород применяют в металлургии для восстановления некоторых цветных металлов из их оксидов. Главное применение водород находит в химической промышленности для синтеза хлороводорода, для синтеза аммиака, идущего в свою очередь на производство азотной кислоты и азотных удобрений, для получения метилового спирта (см. разд. 29.10) и других органических соединений. Он используется для гидрогенизации жиров (см. разд. 29.14), угля и нефти. При гидрогенизации угля и нефти бедные водородом низкосортные виды топлива превращаются в высококачественные. [c.473]
Применение водорода. Основной потребитель водорода — химичес-ская промышленность. Огромные количества его (вместе с азотом) расходуются на синтез аммиака — исходного продукта для получения азотной кислоты и азотсодержащих минеральных удобрений. Следовательно, водород имеет большое сельскохозяйственное значение. Водород используют для гидрогенизации жидких жиров и получения более ценных твердых жиров, идуш,их на изготовление маргарина. Взаимодействием водорода с оксидом углерода (Н) (в присутствии катализаторов) синтезируют метанол 2Н2+СО=СНзОН. [c.276]
Как указывалось выше, развитие процессов каталитического риформинга создало обильные источники водорода, которые, несомненно, обеспечат потребности нефтепереработки на ближайшие несколько лет. Необходимо, однако, учитывать, что рост потребления водорода в нефтепереработке (например, для превращения нефтяных остатков) или в химической промышленности (нанример, для синтеза аммиака) может настолько увеличить общую потребность, что ресурсы побочного водорода -с установок каталитического риформинга окажутся совершенно недостаточными. Кроме того, водород, создающий высокую удельную тягу, может найти применение и в качестве ракетного топлива. Эта возможность становится более реальной в связи с разработкой процесса превращения нестабильного орто-водорода в стабильную пара-модификацию при помощи каталитического процесса с использованием гидрата окиси железа. Разработана также новая конструкция емкости типа сосуда Дьюара для применения водорода в автомобильном и воздушном транспорте. Подобные исследовательские работы расширяют области использования водорода настолько, что при калькуляции процессов гидрирования в нефтепереработке уже нельзя будет учитывать водород по цене топливного газа. [c.167]
Реакция замещения атомов водорода в парафиновых углеводородах на галоген, открытая в 1940 г. Дюма, получила широкое применение в промышленности. Она лежит в основе промышленного способа получения хлоропроизводных метана, этана и других предельных углеводородов. Ассортимент выпускаемых в СССР и за рубежом хлоралканов непрерывно расширяется. Однако наиболее широко используются хлористый метилен, хлороформ, четыреххлористый углерод, хлористый этил, хлорпентаны и керилхлорид. Технические требования к отдельным представителям этого ряда соединений представлены в табл 19. [c.125]
Древесный уголь находит разнообразное применение в промышленности и для бытовых нужд. Его используют в металлургии и перерабатывают в активный уголь для очистки воды, химического синтеза и т. д. [4]. Наряду с древесным углем типичными продуктами сухой перегонки древесины являются газ, смола, древесный уксус, древесный спирт [184]. Выход этих продуктов зависит от состава исходного сырья и особенно от условий пиролиза. Вследствие значительной массовой доли кислорода и водорода в древесине и лигноцеллюлозных материалах отношение жидких продуктов пиролиза к газообразным значительно выше, чем при пиролизе каменного угля. [c.403]
Первые опыты по гальваническому восстановлению железа быЛи проведены русским ученым Б.С.Якоби в 1846 г. Б.С.Якоби и инженер Е.И.Клейн в лаборатории гальванопластики експедиции заготовления государственных бумаг в 1066 г. применили гальванические железные покрытия при изготовлении стереотипного набора и клише. К тому же времени относятся и первые исследования механических свойств злект-ролитического железа, проведенные Г.Э.Ленцем. В результате было установлено, что осадки железа содержат большое количество водорода, который придает им значительную твердость. Благодаря зтим исследованиям электролитическое железнение стало находить применение в промышленности, главным образом в полиграфической, дяя повышения износостойкости клише и печатных досок. В настоящее время железнение широко используется в различных отраслях народного хозяйства как эффективное средство повышения поверхностной прочности деталей, изготовленных из углеродистых сталей, л надежный зкономический способ восстановления их свойств и размеров. Большое распространение оно получило с развитием ремонтного производства для восстановления изношенных деталей автомобилей, сельскохозяйственньк машин и другой техники. Разрабатывается обширная рецептура злектролитов железне-ния, из которых можно получать осадки металла различных толщин й свойств. [c.3]
Применение. Водород в больших количествах применяется в химической промышленности (синтез ННз, СН3ОН и других веществ), в пищевой промышленности (производство маргарина), в металлургии для получения железа прямым восстановлением железной руды. [c.467]
Применение. Водород широко используют в различных отраслях производства в анилинокрасочном производстве, в синтезе хлороводорода, аммиака (аммиак далее расходуется для производства азотных удобрений), при восстановлении некоторых цветных металлов из их руд. В пищевой промышленности водород широко применяют для получения заменителей животных жиров (маргаринов). [c.161]
Природные запасы соединений водорода огромны. Водород легко вступает в химические реакции, при его окислении выделяется большое количество тепла. Поэтому водород может найти широкое применение в промышленности и быту, для синтеза различных соединений, освещения, отопления и охлаждения, приготовления пищи и для получения электроэнергии при помощи электрохимических генераторов. [c.356]
Практическое применение водорода многообразно им обычно заполняют шары-зонды, в химической промышленности он служит сырьем для получения многих весьма важных продуктов (аммиака и др.), в пищевой — для выработки из растительных масел твердых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из нар[более эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т. технически водород получают, главным образом, взаимодействием природного метана с кислородом и водяным паром (по суммарной схеме 2СН4 + О2 + 2НгО = 2С0г + 6Н2 + 37 ккал) или выделяя его из коксового газа путем сильного охлаждения последнего. Иногда пользуются также разложением воды электрическим током. Транспортируют водород в стальных баллонах, где он заключен под большим давлением.2 . [c.117]
Применение водорода в технике. Водород находит применение в воздухоплавании, в технике высоких температур и химической промышленности. [c.623]
Применение. Водород широко используется в химической промышленности, главным образом для синтеза аммиака, хлороводорода и многих органических веществ. В металлургии водород применяется как восстановитель при получении железа, молибдена, вольфрама и других металлов. [c.110]
Практическое применение водорода довольно многообразно в химической промышленности он служит сырьем для получения многих важных продуктов (аммиака и др.), в пищевой —для выработки из растительных масел твердых жиров и т. д. Высокая температура (до 2600°С), получающаяся при горении водорода в [c.97]
Ускорители полимеризации каучуков. Наиболее важ-1 ная область применения меркаптанов — промышленность синтетических каучуков. Меркаптаны хорошо регулируют эмульсионную полимеризацию при получении кау- чуков и одновременно служат ускорителями этого про- цесса. Вырабатываемый из тетрамера пропилена и серо-водорода т/)ет г-додецилмеркантан [14] при 5° С на 30% и при 50° С на 20% увеличивает скорость полимеризации в процессе получения бутадиен-стирольного, каучука. Весьма эффективными ускорителями вулканизации каучуков оказались N-зaмeщeнныe р-меркаптоэтил-амины [8].. [c.53]
Укажите все известные лабораторные и промышленные спо- собы получения водорода. 2. Почему пламя водорода невидимо 3. Какой объем водорода при нормальных условиях можно получить из 1 г воды ф 4. Сколько килограммов алюминия необходимо для того, чтобы при взаимодействии с гидроксидом натрия получить 0,0418 м водорода при 27°С и 99 400 Па. ф5. Укажите, какие степени окисления может принимать водород в своих соединениях 6. Чем отличаются свойства молекулярного водорода от атомарного Приведите примеры. 7. Применение водорода. [c.164]
Если не считать термических методов, переработка нефтей и нефтяных фракций с применением водорода для получения ценных товарных продуктов возникла и начала использоваться в промышленности раньше, чем другие промышленные процессы превращения, в том числе каталитический крекинг, алкилирование и каталитический риформинг. На протяжении многих лет. гидрирование углеводородов является предметом интенсивных исследований. Эти исследования продолжаются и в настоящее время и охватывают широкую область, что и объясняет многочисленность публикаций, посвященных этой теме, включая патенты. [c.116]
Из вышеизложенного видно, что способ получения дифенилолпропана с применением хлористого водорода в качестве конденсирующего агента нашел широкое применение в промышленности разных стран. При этом можно получать качественный продукт, однако существенным недостатком способа является высокая корро-зионность среды, что создает большие трудности при выборе материала для аппаратуры и коммуникаций. [c.140]
В качестве восстановителей предложены водород, азотоводородная смесь, оксид углерода (И), природный, нефтяной, коксовый н богатые газы, пары керосина, мазута и др. [56, 57]. Практическое применение и промышленности нашел природный газ, содержание серы в котором не должно превышать 20 мг/м . [c.59]
Предназначена для специалистов химической, нефтехимической промышленности и других отраслей народного хозяйства, занимающихся получением и применением водорода в технологических процессах и в качестве энергетического источника. [c.255]
Основные области применения водорода. В настоящее время водород в основном используется в химической и нефтехимической отраслях промышленности (93-95%). Наибольшее количество водорода используется для производства аммиака по реакции [c.155]
Применение. В промышленности водород в больших количествах расходуется для получения аммиака, соляной кислоты, метилового спирта (из Щ и СО). Многие органические соединения синтезируют с использованием водорода. Преобразование твердых низкокачественных углей, сл шцев, тяжелых остатков от переработки нефти и каменноугольной смолы в легкое моторное топливо осуществляется путем их гидрогенизации (присоединения водорода).. Гидрогенизацией жидких растительных жиров (хлопкового, подсолнечного) получан)т заменители животного масла — твердые жиры, используемые в производстве маргарина, в мыловарении. [c.283]
Газообразные алканы находят очень широкое применение в промышленности и быту Природный газ является в настоящее время одним из основных бытовых и экологически чистых промышленных топлив. Он используется также в качестве сырья для производства водорода и технического углерода (сажи). [c.74]
С одной молекулой нитропарафина может реагировать столько молекул альдегида, сколько атомов водорода имеется при углероде, связанном с нитрогруппой. Эта реакция, открытая Л. Генр И [26], получила применение в промышленности. [c.273]
Таким образом, обзор первых исследований по пиролизу различных углеводородов показывает, что в присутствии водорода происходит увеличение выхода этилена и снижение коксо-образования, что является положительной стороной процесса. Однако, из анализа статей видно, что имеются противоречия в оценке выхода ароматических углеводородов, бутиленов и бутадиена, отсутствуют точные данные по выходу ацетиленистьпс соединений. Отсутствие в первьж исследованиях анализа экономики, также не позволяет оценить в достаточной мере эффективность процесса с применением водорода. Но, несмотря на это, именно данные работы явились базовыми для последующих разработок в области пиролиза углеводородов в присутствии водорода, нашедших промышленное применение [16,17], а также для исследований и формулирования теоретических основ данного процесса [18—21]. [c.191]
Применение. В промышленности водород в больших количествах расходуется для получения аммиака, соляной кислоты, метилового спирта (из Hj и СО). Многие органические соединения синтезируют с использованием водорода. Преобразование твердых низкокачественных углей, сланцев, тяжелых остатков от переработки нефти и каменноугольной смолы в легкоё моторное топливо, осуще- [c.213]
Весьма перспективно получение водорода термоконтактным способом в виде отдельного процесса. Термоконтактный процесс производства водорода получил высокую оценку на VIII Мировом нефтяном конгрессе и, видимо, найдет применение в промышленности. [c.278]
Одним из существенных недостатков палладиевых покрытий в электргяехинке является его высокая каталитическая активность н ад сорбционная способность по отношеиню к водороду и органическнм веществам, что может оказывать большое влияние на повышение переходного сопротивления Этим, а также меньшей по сравнению с другими металлами платиновой группы химической стойкостью ограничивается его применение в промышленности. [c.139]
За последние несколько лет появились новые взгляды о возможности использования гидрогепизациоппых методов в нефтепереработке и предложены многочисленные процессы гидрогенизациоппой обработки нефтепродуктов. В следующих разделах этой главы рассматриваются достижения последнего времени в области изучения химизма этих процессов, применяемых катализаторов и технологического оформления. Кратко рассмотрены важнейшие результаты гидрогенизациоппой обработки, дополнительные источники водорода и возможности применения процессов, разработанных для облагораживания как сырой нефти, так и различных нефтяных фракций. Эти процессы, частично уже осуществленные в промышленном масштабе, основываются на применении водорода для улучшения качества различных нефтяных фракций или промежуточных нефтезаводских потоков, в том числе газа, прямогопного и крекинг-бензинов, лигроинов, средних дистиллятов, газойлей — сырья для каталитического крекинга, смазочных масел, парафинов, нефтяных остатков и кокса. [c.120]
С внедрением каталитического риформинга неуклонно растут ресурсы дешевого водорода для процессов нефтепереработки. Хотя в настоящее время мощности гидроочистки и каталитического риформинга приблизительно одинаковы (соответственно 270 и 300 тыс. м 1сутки), согласно опубликованным расчетам [6] имеется избыток водорода, достаточный для гидрирования еще 480 тыс. м сутки нефтяных фракций п продуктов. В процессах нефтепереработки наиболее широкое промышленное применение водород находит для обессеривания бензино-лигроиновых фракций, направляемых на риформинг. Для возможности риформинга на платиновых катализаторах необходимо не только удалить серу, но и но возможности снизить [c.187]
В качестве материала для изготовления печей преимущественно используется сталь, применяются также графитовые и кварцевые печи. Однако размеры и соответственно производительность кварцевых аппаратов ограничены, кварцевая аппаратура очень дорога и трудна в ремонте и обслуживании. Эти недостатки, но в меньшей степени, присущи и графитовой аппаратуре, хотя графитовыё печи еще находят применение в промышленности. Печи из неметаллических материалов используются преимущественно для получения хлористого водорода повышенной чистоты, когда недопустимо загрязнение HG1 хлоридами металлов. [c.486]
Широкое применение в промышленности нашел продукт сульфирования углей — так называемый сульфоугопь, который используется в качестве ионитов, служащих для умягчения воды, методом замены ионов магния и кальция на ионы водорода и натрия. В качестве сырья для производства сульфатов используют уголь марки К. Сульфирование осуществляется олеумом, при этом водород органической части угля замещается сульфокислотной группой с образованием воды по реакции [c.259]
В качестве газообразных восстановителей используют водород, оксид углерода (II) и метан. В промышленности водород находит применение при восстановлении железа из руды в бездоменных процессах и для получения тугоплавких металлов. Применение водорода и оксида углерода (II) как в промышленности, так и в лаборатории сопряжено с большими трудностями, так как они образуют с воздухом взрьгооопасные смеси. [c.70]
chem21.info
Водород получение применение — Знаешь как
Сразу же оговоримся: в отличие от «науки», как области чистых идей, «практикой» мы назовем все, что служит практической деятельности человека — пусть это даже будет деятельность ученого-экспериментатора.
Химик имеет дело с водородом прежде всего как с веществом, обладающим свойствами идеального восстановителя.
Но откуда взять водород? Конечно, проще всего из баллона. Из зеленого баллона с красной надписью «Водород» и с вентилем с «левой» резьбой (горючий газ!). Но если баллона под руками нет? Водород можно получать взаимодействием металлов с кислотами:
Zn + h3SO4 → ZnSO4 + h3↑
Но этот водород не может быть идеально чистым, потому что нужны идеально чистые металл и кислота. Чистый водород получал еще Лавуазье, пропуская пары воды через раскаленный на жаровне ружейный ствол:
4h3O + 3Fe → Fe3O4 + 4h3↑
Но и этот способ не слишком удобен, хотя в современной лаборатория можно обойтись кварцевой трубкой, наполненной железными стружками и нагреваемой в электропечи.
Электролиз! Дистиллированная вода, в которую для повышения электропроводности добавлено немного серной кислоты, разлагается при прохождении постоянного тока:
2h3O → 2h3↑ + O2↑
К вашим услугам — водород почти идеальной чистоты, его нужно только освободить от мельчайших капелек воды. (В промышленности в воду добавляют щелочь, а не кислоту — чтобы не разрушалась металлическая аппаратура.)
А теперь будем медленно пропускать этот водород через воду, в которой взмучен хлористый палладий. Почти сразу начнется восстановление, и осадок почернеет — получится палладиевая чернь:
PdCl2 + h3 → Pd + 2HCl
Палладиевая чернь — прекрасный катализатор для гидрирования разнообразных органических соединений.
А катализатор тут нужен потому, что молекулярный водород весьма инертен: даже с кислородом при обычных условиях он реагирует необычайно медленно. Ведь сначала молекула водорода должна диссоциировать на атомы, а для этого на каждый моль водорода (т. е. всего на 2 г!) нужно затратить 104 ккал. А вот на поверхности катализатора этот процесс идет с гораздо меньшими затратами энергии, водород резко активизируется.
Пожалуй, не стоит много говорить о роли катализаторов в современной химической технологии: в их присутствии проводится подавляющее большинство процессов. И важнейший среди них — синтез аммиака из водорода и атмосферного азота:
3h3 + N2 → 2Nh4
При этом водород добывают или из воды и метана по так называемой реакции конверсии:
СН4 + 2Н2O → 4Н2 + СО2
или расщепляя природные углеводороды по реакции, обратной реакции гидрирования:
СНз—СНз → СН2=СН2 + h3
Синтетический аммиак незаменим в производстве азотных удобрений. Но водород нужен не только для получения аммиака. Превращение жидких растительных жиров в твердые заменители животного масла, преобразование твердых низкокачественных углей в жидкое топливо и многие другие процессы происходят с участием элементного водорода. Выходит, что водород — это пища и для человека, и для растений, и для машин…
Но вернемся в лабораторию. Здесь водород применяют не только в чистом виде, но и в виде его соединений с металлами — например алюмогидрида лития LiАlН4, боргидрида натрия NaBh5. Эти соединения легко и специфически восстанавливают определенные группировки атомов в органических веществах.
Изотопы водорода — дейтерий (²Н или D) и тритий(³Н или Т) — позволяют изучать тончайшие механизмы химически и биохимических процессов. Эти изотопы используют как «метки», потому что атомы дейтерия и трития сохраняют все химические свойства обычного легкого изотопа — протия — и способны подменять его в органических соединениях. Но дейтерий можно отличить от протия по массе, а тритий — и по радиоактивности. Это позволяет проследить судьбу каждого фрагмента меченой молекулы.
Вы читаете, статья на тему водород получение
znaesh-kak.com