Большая Энциклопедия Нефти и Газа. Как из угля получить карбид алюминия
Карбиды из металлов и угля
Кроме того, в процессе хлорирования из алюминия удаляют растворенные в нем водород и значительную часть других газов и примесей. Пары хлористого алюминия и хлора выносят эти примеси (глинозем, фтористые соли, карбид алюминия и уголь) на поверхность расплавленного алюминия. Всплывшие примеси образуют шлак в виде-рыхлого серого порошка, который периодически снимают с поверхности алюминия дырчатой ложкой — шумовкой. Процесс хлорирования ведут в течение 10—15 мин, пропуская хлоргаз через расплавленный металл. По окончании хлорирования ковш с металлом подают к разливочной машине. [c.503]
Углем как восстановителем нельзя пользоваться в тех случаях, когда сродство кислорода к металлу значительно больше, чем к углю. Это относится к щелочным и щелочноземельным металлам. Уголь не может применяться также и в тех случаях, когда он с металлами легко образует карбиды. К таким металлам относятся бериллий, алюминий, молибден, вольфрам, щелочноземельные металлы, хром, марганец и многие другие. В этих случаях для восстановления окислов применяют другие восстановители либо получают металлы при помощи электролиза. [c.102]
В электрохимических системах имеют дело с проводниками первого рода, в которых электрический ток переносится электронами, и с проводниками второго рода, в которых наблюдается исключительно ионный перенос электрического тока. К проводникам первого рода, или электронным проводникам, относят все металлы и сплавы, графит, уголь, а также некоторые твердые окислы, карбиды и сульфиды металлов. Металлические проводники состоят из положительно заряженных ионов и отрицательно заряженного газа , образованного коллективизированными электронами. Этот газ равномерно заполняет все пространство между нонами. [c.13]
Следует иметь в виду, что метод БЭТ позволяет измерять лишь общую поверхность адсорбентов. Между тем в ряде случаев в электродах топливных элементов используются высокодисперсные носители (уголь, карбиды металлов), активированные небольшим количеством благородных металлов. В этом случае возникает задача раздельного измерения поверхностей носителя и катализатора, которая может быть решена при проведении селективной адсорбции. Подбором условий эксперимента или типа адсорбента [21, 25, 26] можно обеспечить протекание хемосорбции только на катализаторе и, таким образом, найти его поверхность. [c.284]
Уголь и металл отвешивают на аналитических весах в соответствии с формулой получаемого карбида, 4—5 г смеси тщательно перемешивают и прессуют в таблетки под давлением не менее 15-10 Па. Спрессованную смесь помещают в фарфоровую или кварцевую трубку и прокаливают в атмосфере аргона, азота или в вакууме. Газ необходимо тщательно очистить от следов кислорода. Лучше всего для этой цели его пропустить через раскаленную трубку, наполненную магниевыми, кальциевыми или железными стружками, или через промывалку с расплавленным натрием. Синтез проводят в установке, схема которой показана иа рисунке 1. Лодочку со спрессованными таблетками помещают в трубку. Время прокаливания зависит от степени измельчения металла, его природы и температуры. Если используют металл в виде тончайшего порошка, реакция при соответствующей температуре заканчивается за 2—3 ч. Для гомогенизации продукт следует (после охлаждения в токе инертного газа) измельчить в ступке, немного смочить спиртом или глицерином, спрессовать и снова прокалить. При отсутствии пресса исходную смесь можно прокалить, утрамбовав ее в фарфоровой или кварцевой лодочке. В этом случае процесс образования карбидов замедляется вследствие ухудшения контакта между частичками исходных веществ. [c.53]
Превращение угля в графит может происходить различным образом. Например, путем превращения угля сначала в карбиды или растворы в металлах, или путем кристаллизации паров углерода и разложения его газообразных соединений. Графитация угля является своеобразным процессом, который отличается тем, что уголь сразу превращается в графит. В этом смысле ее называют гомогенной графитацией , подчеркивая тем самым, ЧТО для других случаев характерны гетерогенные физические процессы. [c.198]
Др. важный фактор, влияющий на св-ва Т. с.,-смачиваемость МХ расплавом металла триады Ре. Карбиды Сг, Мо, W полностью смачиваются расплавом металла (краевой угол смачивания 0 = 0°). Для карбидов Т1, V, НЬ и Та характерны след, краевые углы смачивания [c.509]
При катализе циклогексана на нагреваемых нихромовых спиралях автор и Н. 3. Котелков наблюдали [309] значительное углеобразование. Удивительной особенностью этого процесса является то, что с накоплением угля скорость реакции не только не падает, но сначала даже возрастает. Это было объяснено дендритной гипотезой образования угля уголь растет в виде дендритов, основания которых лежат на границе раздела хрома (или окиси хрома) и никеля (ср. выше). Молекулам циклогексана дендриты не мешают попадать на никель, так же как деревья не мешают дождю попадать на землю в лесу. Первоначальное ускорение реакции, происходящее по мере накопления угля, было объяснено разъеданием металла вследствие образования карбидов как первой стадии углеобразования и восстановления этих карбидов. Когда угля становится слишком много, то реакция замедляется. [c.79]
Другие виды катализаторов менее универсальны, чем платиновые металлы. Во многих случаях они химически недостаточно устойчивы и поэтому не могут быть использованы. На практике в качестве электродов-катализаторов применяют металлы (никель и другие металлы железной группы, серебро, золото, ртуть), углеродные материалы (графит, активный уголь, стекло-углерод, сажа), оксиды (простые оксиды ряда металлов, смешанные оксиды шпинельной или перовскитной структуры), твердые соединения (карбид вольфрама). В последние годы было показано, что в ряде реакций в качестве катализаторов могут быть использованы органические комплексные (металлосодержащие). соединения—фталоцианины, порфирины, а также полимерные вещества, получающиеся при их термической обработке. [c.384]
Исследование смачивания тугоплавких карбидов жидкими металлами проведено в работе . Были использованы карбиды тугоплавких металлов IV Б — VI Б подгрупп периодической системы. Применяли расплавы следующих металлов Си А1, Оа, 1п, ТЬ 51, Ое, 5п, РЬ 8Ь, В Мп, Ре, Со, N1. Краевой угол определяли методом лежащей капли в вакууме в среде аргона при температуре, превышающей на 50—100 °С температуру плавления металла, и экспозиции, равной 15 мин. Работу адгезии рассчитывали по формуле (I, 10). [c.266]
Известно получение тетрахлорида титана из карбида титана, хлорирование карбида начинается при температуре около 200°С. При хлорировании технического титана добавляют восстановитель (например, уголь) с целью предотвращения образования оксихлорида титана, обусловленного присутствием в исходном сырье примеси TiO. Для этого смесь титана с углем предварительно прокаливают в среде диоксида углерода. Тетрахлорид титана можно получить также действием хлористого водорода на металлический титан при температуре выше 300 °С. Наиболее распространены способы получения тетрахлорида титана хлорированием диоксида титана в присутствии восстановителей (угля, оксида углерода, фосгена). Для снижения температуры хлорирования рекомендуют добавлять хлориды или оксиды марганца, циркония, церия и других редкоземельных металлов. [c.245]
Улучшения смачивания керамических материалов из окиси алюминия можно достичь легированием металла применяемого в качестве расплава. Легирование кобальта и никеля производят карбидами молибдена, вольфрама, титана и меди. Расплавы исходных никеля и кобальта дают на поверхности из окиси алюминия при температуре 1950 °С краевой угол, равный 120°. При введении легирующих элементов происходит снижение краевого угла по мере увеличения доли вводимого легирующего компонента в последовательности медь, молибден, вольфрам и титан. [c.278]
Краевой угол для системы карбид — расплав металла с учетом пористости смачиваемой поверхности может быть оценен при помощи формулы [c.286]
Значительное количество ацетилена (а также и карбида кальция) потребляется для автогенной сварки и резки металлов в смеси с кислородом температура такого пламени доходит до 3000° С и выше. При этом ацетилен получается обычно на месте потребления в переносных генераторах, работающих по мокрому способу , а иногда доставляется в баллонах в виде раствора его в ацетоне, которым пропитывается пористая масса (пемза, силикагель, древесный уголь и т. д.). Давление в баллоне доходит до 16 ат (при 20° С). [c.277]
Восстановление может идти не только под действием водорода. На практике часто используется уголь. Применение твердого восстановителя несколько упрощает производство, однако в этом случае требуется более высокая температура — до 1300—1400° С. Кроме того, уголь и примеси, которые он всегда содержит, вступают в реакцию с вольфрамом, образуя карбиды и другие соединения. Это приводит к загрязнению металла. Между тем, электротехнике нужен весьма чистый вольфрам, Всего 0,1% же- [c.144]
Химические свойства углерода. Карбиды. При низки.х температурах и уголь, и графит к, в особенности, алмаз инертны. Пря на.гревании их активность увеличивается уголь легко соединяется с кислородом и служит хорошим восстановителем. Важнейший процесс металлургии — выплавка металлов из руд — осуш есТ вляется путем восстановления оксидов металлов углем (или оксидом углерода). [c.437]
Физические свойства. У. известен в виде двух кристаллич. модификаций — алмаза и графита. Термодинамически стабильным при обычных условиях является графит. Область устойчивости алмаза находится при высокпх давлениях, однако благодаря кинетич. затрудненности перехода в графит он также существует при обычных условиях. Расчетным путем получено следующее ур-ние для кривой равновесия алмаз графит 7(атм) = 7000 - - 27 Г (при Т> >1200° К). Тройная точка равновесия алмаз гра-фит гжидкий У. на диаграмме состояния У. находится ок. 3800+200° и 125 кбар. Для твердого У. характерно также состояние с неупорядоченной структурой, называемое часто аморфным У. кокс, сажа, уголь древесный, активный уголь и др. Все формы У. нерастворимы в обычных неорганич. и органич. растворителях и растворяются в расплавленных металлах железе, кобальте, никеле, платиновых металлах и др., из к-рых при охлаждении У. кристаллизуется в виде графита или карбидов металлов. Нек-рые физич. свойства кристаллов алмаза и графита приведены в таблице. [c.153]
Получение именно этих двух карбидов карбида кальция и карбида кремния, обратилось в мощные отрасли химической промышленности. Карбид кальция впервые был получен при попытке синтеза искусственного алмаза. Так же, как Муассан для той же цели предпринял кристаллизацию углерода из железа, воспроизводя условия образования алмазов в железных метеоритах, была сделана попытка воспроизвести в лабораторных условиях образование алмазов в неметаллических горных породах. Широкая распространенность в природе известняков побудила сплавить уголь именно с известняком. Таким образом вместо алмаза и был получен карбид кальция — источник ацетилена, газообразного горючего, превосходящего по развиваемой им температуре все другие обычные горючие газы, а потому особенно пригодного для сварки и резки металла. [c.532]
Важнейшим сырьем, используемым в Европе для получения активного угля, являются древесина (в виде опилок), древесный уголь, торф, торфяной кокс, некоторые каменные и бурые угли, а также полукокс бурых углей. При получении углей для противогазов и других углей специального назначения, которые должны обладать высокими прочностными свойствами и большим объемом тонких нор, используется скорлупа кокосового ореха. В США широко используются лигннтовые угли, а также нефтехимические продукты. Кроме того, в литературе приводятся сведения о возможном использовании большого числа других углеродсодержащих природных и синтетических материалов. Здесь следует назвать скорлупу различных видов орехов, фруктовые косточки, асфальт, карбиды металлов, сажу, углеродсодержащие отходы разного рода — мусор, осадки сточных вод, летучую золу, изношенные резиновые покрышки, от- [c.36]
Карбиды мо.лпбдена можно также получать из смесп двуокиси молибдена с углем в электрической дуге методом, примепяемым для изготовления карбида кальция. Уголь берут в таком количестве, чтобы его было достаточпо д.чя восстанопления двуокиси молнбдепа и для насыщения металла углеродом. Эту смесь нужно прикрыть сверху кусочками древесного угля, чтобы предупредить выгорание угля из смеси. [c.309]
Независимо от случаев соприкосновения различных металлов, электрохимическая коррозия может возникать на внешне однородном металле, например на каком-либо изделии из стали или железа, в зависимости от особенностей его состава и обработки. Это обусловлено тем, что сталь на самом деле не однородна. В ее состав входят, как известно, графит в виде вкрапленных чешуек и аморфный уголь затем феррит (раствор углерода в а-железе), цементит или карбид железа — РезС аустенит — твердый раствор углерода в у-железе перлит — эвтектическая смесь феррита и цементита мартенсит — твердый раствор углерода в с.-железе, иного типа, чем феррит, — первый продукт распада аустенита при быстром охлаждении, входящий в состав закаленной стали, и др. [c.408]
Воду нельзя применять для тушения веществ, бурно реагирующих с ней с выделением горючих газов. К таким веществам относятся металлы (особенно опасны щелочные металлы, которые реагируют со взрывом), многие металлоорганические соединения (концентрированные алюминийорганические, литийоргани-ческие соединения и др.), карбиды металлов, многие гидриды металлов и т. д. В обычных условиях, как отмечалось выше, опасность разложения воды с образованием гремучей смеси маловероятна. Но эта опасность становится реальной при попадании воды на раскаленные уголь, железо. [c.67]
КЧЗО-6, ковким перлитным КЧ50-4, высокопрочным магниевым ВЧ 50—1,5) установлено [204], что смачиваемость улучшается при переходе от карбидов металлов IV группы к карбидам металлов V и VI групп в случае карбида вольфрама краевой угол смачивания близок к нулю. [c.61]
К проводникам первого рода, или электронным проводникам, относятся все металлы и их сплавы, графит, уголь, а также некоторые твердые окислы, карбиды и сульфиды металлов. Металические проводники состоят из положительно заряженных ионов и отрицательно заряженного газа , образованного коллективизированными электронами. [c.23]
При сплавлении цинка, кадмия с платиной или палладием вполне пригодным материалом тигля оказывается электрографитированный уголь, между тем как AI2O3 при повторных плавках может служить лишь в течение незначительного времени. Потеря летучего металла из сплава может достигать 25%. Угольная трубка и приспособления для ее крепления могут выдерживать 40— 70 плавок по 10 мин каждая. Ясно, что металлы, образующие устойчивые карбиды, в этой установке нагревать нельзя. [c.2156]
Известны. взрывоопасные, термически малоустойчивые карбиды, такие как карбид серебра Agj j и меди uj a они разлагаются на металл и уголь. Особой твердостью отличаются карбид бора В4С, карбид кремния Si и карбид вольфрама W2 . Карбид железа Fe (цементит) является компонентом железоуглеродных сплавов (сталь, чугун). [c.319]
Адгезия и науглероживание металлов. Как уже отмечалось в этой главе, при смачивании графита расплавами железа, кобальта, никеля, палладия и платины происходит науглероживание металлов, что соответствует второ1 у виду физико-химического взаимодействия (см. табл. VIII, 3). Науглероживание резко изменяет смачивание. Поэтому лишь начальные значения краевого угла в какой-то степени соответствуют ненауглероженному металлу Расплавы железа, никеля, кобальта и палладия образуют краевые углы порядка 50—70°. Если эти металлы насытить углеродом, то смачивание ухудшается, а краевой угол увеличивается до 110°. Небольшие добавки хрома (0,5 вес.%) приводят к уменьщению краевого угла от 110 до 70°, так как имеет место образование карбида хрома на границе фаз. При содержании хрома, равном 5— 10 вес.%, происходит почти полное смачивание [c.263]
Из приведенных данных следует, что при смачивании карбидой для большинства расплавов металлов краевой угол превышает 95°, а работа адгезии колеблется в пределах 70—754 эрг/см . В этих условиях физико-химическое взаимодействие влияет на адгезию незначительно. [c.267]
В табл. 39 приведены краевые углы смачивания, образуемые металлами на поверхности тугоплавких соединений. Из табл. 39 видно, что металлы железной группы (Fe, Ni, Со) хорошо смачивают карбиды (W , Т1С) и бориды (TIB2, СгВа), что характеризуется величиной краевого угла смачивания 0этим железо, никель, кобальт, а также сплавы на их основе чаше всего применяются при жидкообразном спекании и пропитке. Пористые тела из AI2O3 нельзя пропитать жидкими металлами группы железа, так как краевой угол смачивания 8>0,5 рад (90°). [c.282]
chem21.info
Как из карбида алюминия получить метан
Карбид алюминия представляет собой твердое вещество желтого цвета. Разлагается при прокаливании. Полностью гидролизуется водой. Разлагается разбавленными кислотами, концентрированными щелочами. Восстанавливается водородом при нагревании. Во всех вышеперечисленных реакциях одним из продуктов является метан (как из карбида алюминия получить метан). Окисляется на воздухе. Легко хлорируется.
![Rendered by QuickLaTeX.com \[Al_4C_3 + 12H_2O \rightarrow4Al(OH)_3_{solid} + 3CH_4_{gas};\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-13ba4fa1bfacf7ae88f2808dac8e2bf3_l3.png)
![Rendered by QuickLaTeX.com \[Al_4C_3 + 12HCl_{dilute} \rightarrow4AlCl_3 + 3CH_4_{gas};\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7f9864b434dc22ceb2677464dbc56dee_l3.png)
![Rendered by QuickLaTeX.com \[Al_4C_3 + 4NaOH_{conc} + 12H_2O \rightarrow4Na[Al(OH)_4] + 3CH_4_{gas};\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-f93ad8f38290e5b24d6305faefbfe1e8_l3.png)
![Rendered by QuickLaTeX.com \[Al_4C_3 + 6H_2 \rightarrow4Al + 3CH_4 (2200^{0}C).\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c2014f3d6f6794ab9998bf71af961797_l3.png)
Карбид алюминия синтезируют нагреванием простых веществ углерода и алюминия в вакууме или в атмосфере благородного газа при температуре 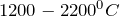 :
:
![Rendered by QuickLaTeX.com \[4Al + 4C \rightarrowAl_4C_3.\]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9b3c942ff3e13efc3bcf5f06033352a1_l3.png)
Пленку карбида алюминия можно нанести из газовой фазы взаимодействие галогенидов (или карбонилов) с углерод— или азотсодержащими газами в восстановительной атмосфере.
ru.solverbook.com
Карбид - алюминий - Большая Энциклопедия Нефти и Газа, статья, страница 1
Карбид - алюминий
Cтраница 1
Карбид алюминия также представляет собой пространственный полимер. [1]
Карбид алюминия, А14С3, получается прокаливанием смеси, состоящей из 1 вес.ч. сажи ( или угля, полученного обугливанием сахара) с 6 вес. [2]
Карбид алюминия по наблюдениям этих исследователей выше 2100 диссоциирует, а освобождающийся при этом алюминий способен ( растворяться в карбиде. При охлаждении этот раствор разлагается и происходит обратное выделение металлического алюминия. В вакууме, в интервале 400 - 1400 карбид алюминия прочен и не обнаруживает никаких изменений. При температуре 2200 карбид алюминия возгоняется не переходя в жидкое состояние. [3]
Карбид алюминия разлагается водой с выделением метана. [4]
Карбид алюминия Al4Cj получают путем непосредственного соединения элементов при высоких температурах. [5]
Карбид алюминия А14С3 получают путем непосредственного соединения элементов при высоких температурах. [6]
Карбид алюминия в смеси с электролитом, глиноземом и углем образует тестообразные наросты ( так называемые грибы), замыкающие анод на угольную подину электролизера. Характерными признаками начала карбидообразования является появление у анода участков раскаленного добела расплава, интенсивное испарение ( дымление) электролита, отсутствие корки на поверхности расплава. Температура электролита поднимается до 1000 - 1100 С. [7]
Карбид алюминия АЦСз образуется при нагреве на воздухе до 2000 С; в вакууме - при 1000 - 1200 С. При нагреве выше 2000 С А14СЭ распадается с выделением графита. [8]
Морфологически карбид алюминия представляет собой в данном случае тонкие случайно ориентированные пластины, расположенные на поверхности волокна и приводящие к образованию на ней не-однородностей, которые постепенно утолщаются и сливаются. [10]
Образование карбида алюминия ведет не только к потерям алюминия, но и вызывает появление на поверхности подины тонкого карбидного слоя с большим сопротивлением току, что связано с дополнительным падением напряжения. Присутствие А14С3 на поверхности угля улучшает также смачиваемость последнего расплавленным алюминием, чем способствует проникновению металла в поры и трещины катодных блоков, разрушая их. [11]
Образование карбида алюминия ведет не только к потерям алюминия, но и вызывает появление на поверхности подины тонкого слоя АЦСз с большим сопротивлением току, что связано с дополнительным падением напряжения. [12]
Плотность карбида алюминия равна 2 36 г / см3, а теплота образования по реакции 4А1 ЗСА14Сэ составляет 63 2 ккал / моль. При высокой температуре карбид алюминия является физически довольно устойчивым соединением, но окисляется всем, что может отдать кислород. Поэтому А14С3 восстанавливает металлические окислы, причем течение реакций зависит от температурных условий и может быть довольно сложным и вести либо к восстановлению окисла до металла с образованием глинозема, либо от карбида алюминия может параллельно частично отщепляться алюминий и давать сплав с восстановленным металлом. [13]
Образование карбида алюминия ведет не только к потерям алюминия, но и вызывает появление на поверхности подины тонкого карбидного слоя с большим сопротивлением току, что связано с дополнительным падением напряжения. Присутствие АЦСз на поверхности угля улучшает также смачиваемость последнего расплавленным алюминием, чем способствует проникновению металла в поры и трещины катодных блоков, разрушая их. [14]
Сульфид и карбид алюминия полностью гидролизуют-ся с образованием гидроксида алюминия и соответственно сероводорода и метана. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Алюминий карбид, гидролиз его - Справочник химика 21
При гидролизе карбида алюминия образовался метан объемом 2,24 л (н. у.). Вычислите массу образовавшегося гидроксида алюминия. [c.290]
Сульфид и карбид алюминия полностью гидролизуются [c.258]
Задача 0-12. При гидролизе карбида алюминия и карбида кальция образуются, соответственно, метан и ацетилен [c.218]
Сульфид и карбид алюминия полностью гидролизуются с образованием гидроксида алюминия и соответственно сероводорода и метана. [c.247]
Метаниды - карбиды алюминия, бериллия и марганца, которые гидролизуются с выделением метана [c.314]Задача 16-4. При полном гидролизе смеси карбидов кальция и алюминия образуется смесь газов, которая в 1,6 раза легче кислорода. Определите массовые доли карбидов в исходной смеси. [c.203]
Гидролиз карбида алюминия (лабораторный метод получения метана) [c.321]
Полученное соединение носит название карбида алюминия и интересно в том отношении, что при гидролизе дает метан [c.438]
При полном гидролизе смеси карбидов кальция и алюминия образуется смесь газов, которая в 1,6 раза [c.235]
Карбиды и силициды щелочных и щелочноземельных металлов и алюминия легко разлагаются водой (гидролиз) и кислотами с образованием газообразных водородных соединений [c.227]
Рассматриваемые бинарные соединения приближаются по свойствам к солям при усилении неметаллических свойств элемента В. Так, в естественном ряду — карбиды, нитриды, теллуриды, селениды, сульфиды, иодиды металлов—наблюдается постепенное нарастание свойств, характерных для солей. Иодиды и большинство сульфидов являются типичными солями то же наблюдается и при усилении металлических свойств элемента А. Например, в ряду сульфидов это можно проследить при переходе от соединений неметаллов пятой и четвертой групп периодической системы элементов к металлам третьей группы. Так, сульфид алюминия в отличие от сульфидов азота уже относится к солям, хотя и подвергается в водных растворах полному гидролизу. [c.255]
Значительно раньше, в мае 1892 г., канадский инженер Вил-сон получил большое количество карбида кальция в промышленной печи, предназначенной для производства алюминия (см. [3, стр. 15]). Подобно Муассану, Вилсон предпринял этот эксперимент в надежде приготовить чистый кальций, однако образовавшаяся темная масса при гидролизе выделяла не водород, а какой-то другой горючий газ Образец массы был направлен на анализ в ближайший университет, где установили, что масса — это карбид кальция, а газ — ацетилен (см. [18]). [c.62]
Метод получения метана. Метан может быть получен гидролизом карбида алюминия [c.152]
Не все карбиды металлов дают при гидролизе такие же продукты. Карбид алюминия реагирует с водой с образованием метана и гидроокиси -алюминия, тогда как карбид магния дает смесь аллена (пропадиена-1,2) и Пронина, а также гидроокись магния [c.199]
Алюминий вяло реагирует с углеродом при 650°, но при 1400° реакция становится интенсивной. Карбид алюминия можно также синтезировать из окиси алюминия и угля. Очень твердые ярко-желтые кристаллы полимерного тела разлагаются выше 1400° с выделением графита и гидролизуются уже при комнатной температуре с выделением метана [c.138]
Гидролиз металлических карбидов. Карбиды алюминия а бериллия энергично реагируют с водой или с разбавленными кислотами, образуя метан [c.232]
Многие нитриды, карбиды, сульфиды и подобные им бинарные соединения легко подвергаются гидролизу, давая при этом гидраты окислов металлов и соответствующие гидриды неметаллов. Этот способ получения гидридов имеет ограниченное применение и практически используется главным образом при получении сероводорода, селеноводорода и теллуроводорода из соответствующих соединений алюминия, а также ацетилена—из карбида кальция. [c.147]
При сильном нагревании он взаимодействует с серой, углеродом и азотом с образованием сульфида АЬЗз, карбида AI4 3 и нитрида A1N. Эти соединения легко гидролизуются с выделением соответственно сероводорода, метана, аммиака и гидроксида алюминия. [c.151]
Карбиды желтого цвета имеют состав ЭСг- При их гидролизе выделяются углеводороды, среди которых доминирует ацетилен. Скандий наряду с карбидом S a образует темно-серый S 4 3, аналогичный карбиду алюминия AI4 3. [c.175]
В лаборатории метан можно получить по Дюма из ацетата патрия и натронной извести [см. выше, получение алканов, метод (6)], гидролизом метилмагнийгалогенидов [см. там же, метод (4)] или по Муас сану разложением карбида алюминия водой [c.203]
Карбиды типа (а) ири гидролизе дают СН как примеры можно указать на Ве,С с антифлюоритов зй структурой и А1 С . Структура последнего соединения несколько сложнее и деталыю здесь рассмотрена ие будет. Достаточно указать, что каждый атом углерода окружен атомами алюминия, находящимися на расстояниях от 1,90 до 2,22 А, причем кратчайшее расстояние С — С равно 3,16А. Таким образом. [c.525]
Только алюминий и титан образуют) соответственно карбиды А14Сз и Т10, которые можно рассматривать, как продукты замещения водорода в метане соответствующими металлами. При гидролизе этих карбидов (при действии воды или не окисляющих кислот) про-исходит выделение метана. [c.5]
Во время электролиза металлический алюминий периодически удаляется со дна электролизера в сосуд емкостью около 5 т, меняются или наращиваются аноды, загружается электролизер и корректируется электролит, чтобы соотношение концентраций NaF и AIF3 оставалось равным 3 1. Алюминий из электролизера удаляют не полностью, оставляя тонкий слой, который защищает дно от коррозии и образует гладкую катодную поверхность. Расплавленный металлический алюминий частично реагирует с диспергированным в электролите углем, образуя карбид алюминия AI4 3. Присутствие влаги в исходном сырье нежелательно, так как вода гидролизует смесь. Криолит при этом разлагается [c.284]
Можно ол сидать, что любые факторы, влияющие на свойства поверхностной пленки окиси бериллия, будут отражаться и на коррозионной стойкости металла. Например, растворенные фтор-ионы и хлор-ионы вызывают усиленную питтинговую коррозию, аналогичную коррозии алюминия в таких же условиях. Во влажном воздухе на присутствующих в металле включениях карбида бериллия при его гидролизе возникает гидратированная окись или гидроокись бериллия [8]. При этом, если размеры включения достаточно велики, в металле может возникнуть питтинг. Заметное отрицательное влияние на коррозионную стойкость бериллия оказывают катионы, приводящие к осаждению на бериллии тяжелых металлов и образованию на его поверхности локальных катодных участков. Оказалось, в частности, что двухвалентные ионы меди при концентрации менее 1 мг/л приводят к значительному питтингу бериллия в 0.005М растворе перекиси водорода при 85° С. Ионы трехвалептного железа также увеличивают скорость коррозии, хотя, по-видимому, не в такой степени, как медь. [c.171]
При гидролизе карбида кальция содержащиеся в нем примеси сульфида, фосфида и цианамида кальция разлагаются с образованием главным образом фосфористых соединений, сероводорода и аммиака. Аммиак образуется также вследствие гидролиза содержащихся в карбиде нитридов магния и алюминия. В состав фосфористых соединений входят в основном фосфин РНз, небольшие количества легко самовоспламеняющегося дифосфина Р2Н4 и фосфорорганических соединений . Из сернистых соединений помимо сероводорода образуется дивинилсульфид при взаимодействии ацетилена с мокрым Са5 или Са(ЗН)2 при температуре гидролиза карбида. [c.66]
chem21.info
Алюминия карбид, реакция с водой
Какие соединения называются карбидами и силицидами Напишите уравнения реакций их получения. Как взаимодействует с водой карбид алюминия силицид магния с соляной кислотой [c.79]
Третьим способом получения метана и других парафинов из неорганических соединений является разложение некоторых карбидов металлов водой или кислотами. Так, при обработке кислотами железа, содержащего карбид железа, выделяются предельные углеводороды. Особенно гладко, по Муассану, протекает образование метана из карбида алюминия и воды в результате реакции получается довольно чистый метан [c.31]Натрий довольно широко применяется в качестве теплоносителя в различных энергетических установках. Он обладает достаточно хорошими физическими и теплофизическими свойствами, позволяющими осуществлять интенсивный теплосъем в различных теплообменных аппаратах (теплотворная способность 2180ккал/кг коэффициент теплопроводности, кал (см-с-град), 0,317 при 21 °С и 0,205 при 100 °С). Вместе с тем натрий характеризуется и существенными недостатками. Он обладает высокой химической активностью, благодаря которой он реагирует со многими химическими элементами и соединениями. При его горении выделяется большое количество тепла, что приводит к росту температуры и давления в помещениях. Он обладает большой реакционной способностью [температура горения около 900 °С, температура самовоспламенения в воздухе 330—360 °С, температура самовоспламенения в кислороде 118°С, минимальное содержание кислорода, необходимое для горения, 5 % объема, скорость выгорания 0,7—0,9 кг/ /(м2-мин)]. При сгорании в избытке кислорода образуется перекись NaaOa, которая с легкоокисляющимися веществами (порошками алюминия, серой, углем и др.) реагирует очень энергично, иногда со взрывом. Карбиды щелочных металлов обладают большой химической активностью в атмосфере углекислого и сернистого газов они самовоспламеняются энергично и взаимодействуют с водой со взрывом. Твердая углекислота взрывается с расплавленным натрием при температуре 350 °С. Реакция с водой начинается при температуре —98 °С с выделением водорода. Азотистое соединение NaNa взрывается при температуре, близкой к плавлению. В хлоре и фторе натрий воспламеняется при обычной температуре, с бромом взаимодействует при темпера- [c.115]
Приведите все возможные объяснения, почему в реакции с карбидом кальция образуется ацетилен, а с карбидом алюминия — метан. Какие другие карбиды Вы знаете и как они реагируют с водой [c.146]
Метан может быть получен также разложением водой карбида алюминия по реакции [c.4]
Сначала приготовляют смесь из 1 вес. ч. сажи и 6 вес. ч. порошкообразного алюминия, смачивают смесь скипидаром, помещают плотным слоем в шамотовый тигель и засыпают сверху слоем угля. Тигель нужно закрыть крышкой и все щели тщательно промазать огнеупорной глиной, смешанной с волокнистым асбестом. Затем, после предварительного подсушивания тигля со смесью в сушильном шкафу, смесь прокаливают в течение 30 мин. при температуре не ниже 1200°. Более высокая температура способствует лучшему протеканию реакции. После охлаждения продукт обрабатывают на холоду разбавленной соляной кислотой или раствором щелочи) для удаления избытка алюминия. Полученный в виде мелкокристаллического порошка карбид отмывают водой от хлорида алюминия, затем воду быстро смывают спиртом и препарат сушат в сушильном шкафу при температуре 80—90°. Продукт содержит значительное количество нитрида алюминия. [c.263]
Карбиды и силициды щелочных и щелочноземельных металлов и алюминия легко разлагаются водой (гидролиз) и кислотами с образованием газообразных водородистых соединений по реакциям, например [c.198]
При действии воды на карбид алюминия AI4 3 выделяется метан и образуется гидроксид алюминия. Написать уравнение реакции. [c.168]
Очистка карбидного ацетилена от примесей. При разложении карбида кальция водой одновременно с основной реакцией, продуктами которой являются высококонцентрированный ацетилен и гидрат оки. и кальция, протекают реакции разложения содержащихся в карбиде примесей (фосфористого, сернистого и кремнистого кальция, азотистого алюминия и других соединений). В результате этих побочных реакций технический ацетилен содержит обычно в качестве примесей сероводород и органические сернистые соединения, фосфористый водород и другие фосфористые соединения, аммиак, кремневодороды (силаны), а также водород, окись углерода, мышьяковистые соединения. Кроме того, в качестве основной примеси в карбидном ацетилене присутствует то или иное количество водяных паров (в зависимости от температуры генерирования ацетилена) и воздуха. Содержание примесей в ацетилене зависит главным образом от качества исходного карбида кальция и от способа его разложения. При получении ацетилена в мокрых генераторах, при сравнительно низких температурах (до 50 °С), получается газ с содержанием примесей в 4—5 раз меньше, чем при получении его в сухих генераторах при более высокой температуре. [c.51]
При повторении темы Углерод стоит обратить внимание не только на аллотропные модификации, но и на химические свойства простого вещества. Образование карбидов кальция и алюминия и их реакции с водой являются переходным мостиком в большинстве цепочек, предлагающих получить какие-либо органические вещества из неорганических. Стоит сопоставить свойства оксидов углерода (II) и (IV). Важно помнить, что угольная кислота существует только в растворе и только в диссоциированном виде. Помните, что раствор углекислого газа в воде (обычная газировка) не окрашивает лакмусовую бумажку в красный цвет. Часто встречаются задачи, в которых изюминка кроется в различных растворимостях карбонатов и гидрокарбонатов, во взаимных превращениях карбонатов и гидрокарбонатов, в термическом разложении некоторых карбонатов и гидрокарбонатов. [c.116]
К химическим реагентам предъявляются специфические требования. Необходимо, чтобы эти вещества были дешевы и продукты их реакции с удаляемыми соединениями не растворялись в нефтепродуктах. Наиболее подходят для этой цели нерастворимые в углеводородах соединения кальция, алюминия, лития. Гидроокись кальция практически нерастворима в углеводородах, поэтому соединения кальция, образующие ее в результате реакции с водой, могут использоваться для осушки топлив и масел. Из таких соединений наиболее пригодны окись, карбид и гидрид каль- [c.273]
Холодная обработка как способ инициирования твердофазных реакций иногда применяется и к неметаллическим реагентам. Так, при прокатке смеси оксидов железа и молибдена с карбонатом кальция происходит реакция со взрывом. Химический синтез неорганических веществ при ударном сжатии впервые был предложен 20 лет назад, когда японским исследователям с помощью этого метода удалось получить феррит цинка из смеси соответствующих оксидов. Несколько позже метод ударного сжатия позволил синтезировать карбиды титана, вольфрама и алюминия из порошков простых веществ. Было обнаружено, что химическое взаимодействие, инициированное ударным сжатием, часто сопровождается быстрым выделением теплоты и соответствующим ему повышением температуры. Это может изменить структуру и состав продуктов взаимодействия. Например, при ударном сжатии смеси оксида европия (П1) и воды образуется не гидроксид, как в обычных условиях, а оксигидрат ЕиО(ОН). [c.114]
Метан-Н4 получали восстановлением окиси углерода [2,3,10] и двуокиси углерода [4,5] над никелем, разложением карбида алюминия [6—9, 13] водой-Нг и реакцией четыреххлористого углерода с этанолом-Н и цинком [10]. [c.219]
Однако применять воду для тушения загораний и пожаров не всегда целесообразно, а в некоторых случаях недопустимо. Так, нельзя тушить водой вещества, вступающие с ней в реакцию с выделением тепла или с образованием опасных соединений (металлический натрий, калий, карбид кальция и т. п.). Нельзя применять воду для тущения горящего магния, его сплавов, алюминия в порошке или стружках. Бесполезно и опасно тушение горящих углеводородов, по удельному весу более легких, чем вода, например бензина, бензола, скипидара, керосина, смазочных масел и т. п. Для тушения электроустановок и электрооборудования, находящегося под напряжением, воду также применять нельзя. [c.178]
На примере реакции окисления железа водой мы уже видели, что введение добавок может заметно изменить реакционную способность образцов. Менее детально этот вопрос был обсужден для реакции карбидирования железа в связи с методическими трудностями. Однако из данных для последней реакции ясно, что добавки окислов калия и алюминия по разному влияют на реакционную способность. Кроме того, свойства образцов, в которые вводились обе добавки одновременно, неаддитивны. Напротив, для реакции окисления железа свойства образцов, содержащих добавки окислов калия и алюминия, были близки к аддитивным. Интересно теперь проследить влияние этих добавок на реакционную. способность карбида железа, полученного при карбидировании тех же образцов восстановленного железа. Этими соображениями обусловлен выбор в качестве добавок окислов алюминия и калия. В связи со сказанным заслуживает упоминания также тот факт, что реакции карбидирования железа и гидрирования карбида железа приводят к противоположным превращениям твердого вещества, а в некоторых процессах (например, в процессах гетерогенно-каталитических синтезов органических соединений из окиси углерода и водорода) конкурируют между собой. [c.194]
Как мы вскоре узнаем, нефть представляет собой смесь углеводородов, имеющих различную структуру и длину цепи. Эти соединения, входящие в состав нефти, уже давно были известны химикам, и они умеют получать их в лаборатории. При реакциях между карбидами — соединениями металлов с углеродом — и водой образуются углеводороды. Мы уже знаем, например, что при реакции карбида кальция с водой получается газообразный ацетилен, а карбида алюминия — метан. Карбид урана при реакции с водой также дает в основном метан, но, кроме того, образуются в незначительных количествах жидкие и даже твердые углеводороды, т. е. соединения с относительно большими молекулами. [c.62]
Присутствие в сфере реакции воды или других веществ, содержащих активный водород (кислоты, спирты и др.), способствует декарбок-силированию фталата с образованием соли бензойной кислоты. Поэтому содержание свободной фталевой кислоты, кислого фталата и влаги в исходном фталате должно быть сведено до минимума [29, 34—36]. Для связывания воды, образующейся в процессе реакции в результате частичного разложения солей, в реакционную смесь предложено добавлять карбиды, бориды или нитриды металлов, например карбид алюминия [33]. [c.159]
Перекись натрия является довольно устойчивым веществом при температуре ниже точки плавления и не подвержена взрывному разложению при ударе или пагревапии в пламени. Тем не менее смеси перекиси с самыми различными легкоокисляемыми веществами органического и неорганического происхождения могут давать взрывные реакции. Если смесь перекиси натрия с железными опилками, порошкообразным алюминием, карбидом кальция или тонко-измельченной серой увлажнить водой или копцептрированпой серной кислотой или сильно нагревать такую смесь, то может произойти взрыв в аналогичных условиях и многие органические вещества, например сахар, глицерин, ледяная уксусная кислота и эфир, также могут привести к сильным взрывам илн к раскаливанию смеси. Дерево, бу.мага или ткань при соприкосновении с перекисью иатрия могут воспламениться. [c.540]
Образующийся в результате реакции метан характеризуется тетраэдрической структурой молекул с углеродом в центре и водорода-ми в вершинах тетраэдра и ковалентной sp -связью. Вследствие этого метан мало растворим в воде и полярных растворителях и не диссоциирует в них на ионы. Атомы водорода метана могут замещаться на электроотрицательные и электроположительные атомы и атомные группировки, хотя он характеризуется невысокой реак-ционноспособностью и не реагирует с кислотами и щелочами при нормальных условиях. Продуктом замещения водородов метана на металлы являются карбиды. Например, карбид алюминия, который разлагается водой с образованием метана [c.215]
Реакцию находящегося в процессе возникновения ацетилена с бензолом и хлористым алюминием изучал Парон [151]. На слой воды высотой около 1 см помещалось 50 г кристаллического бензола (т. пл. 280—281°) и в эту воду осторожно вводился карбид кальция таким образом, чтобы он не соприкасался с бензолом. Как только появлялись первые пузырьки ацетилена, прибавлялся хлористый алюминий. Этой реакции давали продолжаться несколько дней, в течение которых вода, хлористый алюминий и карбид кальция часто подбавлялись. К концу реакции верхний слой промывался, отфильтровывался и перегонялся над известью. Дестил-лат разделялся на следующие фракции [c.496]
Нагреванием алюминия с углеродом в электрической печи ( 2000°С) получают карбид АЬСз, которой можно рассматривать как произьодное метана, о чем свидетельствуют его состав и реакция взаимодействия с водой [c.342]
Катализаторами реакции могут также быть первичный фосфат алюминия, нанесенный на инертный или кислотный носитель — нейтральный фосфат алюминия, борофосфат, карбид кремния, силикагель, силикаты. При использовании первичного фосфата алюминия, в отличие от обычного ф сфорнокислот-ного катализатора, отпадает необходимость ввода воды в реакционную зону. [c.247]
Наиболее значимым фактором, определяющим структуру нефти, является температура. В процессе добычи температура нефти постепенно снижается и, как правило, достигает значений ниже температуры насыщения парафинами, тем самым превращая нефть в дисперсную систему. Предотвратить такое снижение температуры можно путем подогрева нефти непосредственно в призабойной зоне пласта до 90-140°С. Сообщается /41/, что для этих целей может быть использовано тепло специально осуществляемых в призабойной зоне экзотермических реакций. При этом в качестве реагентов рекомендуются следующие пары соляная кислота - керосиновая гель магния, вода - карбид кальция, каустик - металлический алюминий, барий - вода и др. Следует, однако, отметить, что нагрев всей добываемой нефти скважины любым способом энергетически нецелесообразен, поэтому термообработка используется лишь как профилактический метод для усфз-нения уже образовавшихся отложений. [c.135]
Нагреванием алюминиа с углеродом а электрической печи ( 2000° С) получают карбид АЦС], который можно рассматривать как производное метана, о чем свидетельствует его состав и реакция с водой [c.354]
При температуре 800° С алюминий вступает в реакцию с азотом, образуя нитрид A1N, при 1000° С — с серой, образуя сульфид AI2S3. С углеродом алюминий взаимодействует при 2000° С, причем получается карбид алюминия А14Сз. Карбид алюминия разлагается водой с выделением метана. [c.177]
При попадании воды на биту.м, жиры, масло, пероксид натрия, петролатум происходит уси.тение горения в результате В1.г броса, разбрызгивания, вскипания. При взаимодействии вол1. с литийорганическими соединениями, карбидами щелочных металлов и кальция, алюминия, бария, гидрида.ми ряда мета.мов, алюминием, магнием и другими металлами происходит выделение горючих газов, с алюмииийорганическими соединениями — реакция со взрывом, с гидросульфитом натрия — происходит самовозгорание. [c.371]
Вода. Для открытия воды в спирте Henle рекомендует раствор этилата алюминия в ксилоле. Б зависимости от количества присутствующей воды немедленно или через несколько секунд выпадает объемистый студенистый осадок гидроокиси алюминия реакция чрезвычайно чувствительна. Несколько менее точна проба с безводной сернокислой медью или парафиновым маслом. С карбидом кальция содержащий воду спирт выделяет ацетилен. Об открытии и определении воды в спирте см. также у Adi kes a и у S hutz и К1 а и d i t z a. [c.246]
В колбу всыпают карбид алюминия и из капельной воронки наливают немного воды, затем реакционную смесь осторожно нагреваю до тех пор, пока не начнется реакция. Если реакция протекает слиш ком бурно, приливают из капельной воронки холодную воду. Посж того как воздух из прибора вытеснен (стр. 29) собирают метан в газо метр или цилиндры. [c.30]
Другие соединения дейтерия. Действием тяжелой воды на нитрид магния был получен дейтеро-аммиак ND3, обычно несколько загрязненный NHDg и NHaD. Хлористый дейтерий дает в растворе дейтеро-соляную кислоту и получается при реакции паров DgO с безводным хлористым магнием при температуре 600° фтористый дейтерий DF образуется при взаимодействии газообразного дейтерия с фтористым серебром при 110°. Дейтеро-метан получается действием тяжелой воды на карбид алюминия. [c.134]
Когда карбпд кальция обрабатывают насыщенным раствором нитрата аммония, образующаяся гидроокись кальция растворяется, не разрушая исходную кристаллическую решетку карбида. Быстро реагирующий карбид после такой обработки дает остаток в виде скелетного губчатого (ноздреватого) материала, содержащего алюминаты и силикаты кальция с включениялш карбида кремния. Этот скелет присутствует и в исходном карбиде и образует каналы для проникновения воды плп водяных паров в центральную часть карбидной частицы и таким образом ускоряет генерацию. Карбид с низким содержанием двуокиси кремния и окиси алюминия дает (после обработки нитратом аммония) небольшой остаток, содержащий карбид кремния п графит (рис. IV.2). При обычной генерации зерна карбида покрываются сплошным слоем гидроокиси кальция, обладающей более низкой проницаемостью по отношению к воде и водяным парам, чем скелетная структура, и, следовательно, скорость реакции уменьшается. [c.267]
Воду разлагают действием метилмагнийиодида (реактив Гриньяра), в результате реакции образуется метан. Для определения содержания в воде дейтерия метан анализируют масс-спектрометрически, а для определения трития — с помощью счетчика радиоактивности [6.168]. Некоторые исследователи предпочитают использовать бутилмагнийиодид, при взаимодействии которого с водой образуется бутан [6.169]. Наиболее эффективный реагент — диэтилцинк, так как он взаимодействует с водой более полно [6.170]. В другом методе используют карбид алюминия, дающий метан [6.171]. [c.289]
Желтый карбид алюминия (AI4 3) образуется при нагревании смеси окиси алюминия и угля приблизительно до 2000 °С. Реакция его образования из элементов протекает с выделением тепла (47 ккал/.но.гь). Ои растворим в жидком алюминии и может быть из него перекристаллизован. Выше 2000 °С карбид алюминия начинает испаряться с частичным разложением (общее давление достигает 1 атм при 2400°С). Водой ои разлагается по уравнению Л14Сз+121 120=4А1(0Н)з-ЬЗСН4. Нагреванием металлического алюминия в токе ацетилена до 500 °С может быть получен карбид (точнее, ацетилид) состава А)2(Са)з. Водой он разлагается с выделением ацетилена. [c.205]
chem21.info