2.3.2. Химические свойства кислорода и серы. Химические свойства кислорода
Характерные химические свойства кислорода и серы.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
| Химические свойства озона: Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах: PbS + 4O3 = PbSO4 + 4O2 Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном: 2Ag + O3 = Ag2O + O2 Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода: 2KI + O3 + h3O = I2↓ + O2 + 2KOH |
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
Кислород: физические и химические свойства

Содержание:
Пожалуй, среди всех известных химических элементов, именно кислород занимает ведущее значение, ведь без него попросту было бы невозможным возникновение жизни на нашей планете. Кислород – самый распространенный химический элемент на Земле, на его долю приходится 49% от общей массы земной коры. Также он входит в состав земной атмосферы, состав воды и состав более 1400 различных минералов, таких как базальт, мрамор, силикат, кремнезем и т. д. Примерно 50-80% общей массы тканей, как животных, так и растений состоит из кислорода. И, разумеется, общеизвестна его роль для дыхания всего живого.
История открытия кислорода
Люди далеко не сразу постигли природу кислорода, хотя первые догадки о том, что в основе воздуха лежит некий химический элемент, появились еще в VIII веке. Однако в то далекое время не было ни подходящих технических инструментов для его изучения, ни возможности доказать существования кислорода, как газа, отвечающего в том числе за процессы горения.
Открытие кислорода состоялось лишь спустя тысячелетие, в ХVIII веке, благодаря совместной работе нескольких ученых.
- В 1771 шведский химик Карл Шееле опытным путем исследовал состав воздуха, и определил, что воздух состоит из двух основных газов: одним из этих газов был азот, а вторым, собственно кислород, правда на то время само название «кислород» еще не появилось в науке.
- В 1775 году французский ученый А. Лувазье дал название открытому Шееле газу – кислород, он же оксиген в латыни, само слово «оксиген» означает «рождающий кислоты».
- За год до официальных «именин кислорода», в 1774 году английский химик Пристли путем разложение ртутного оксида впервые получает чистый кислород. Его опыты подкрепляют открытие Шееле. К слову сам Шееле также пытался получить кислород в чистом виде путем нагревания селитры, но у него не получилось.
- Более чем через столетия в 1898 году английский физик Джозеф Томпсон впервые заставил общественность задуматься, о том, что запасы кислорода могут закончиться вследствие интенсивных выбросов углекислого газа в атмосферу.
- В этом же году русский биолог Климент Тимирязев, исследователь фотосинтеза, открывает свойство растений выделять кислород.
Хотя растения и выделяют кислород в атмосферу, но проблема поставленная Томпсоном о возможной нехватки кислорода в будущем, остается актуальной и в наше время, особенно в связи с интенсивной вырубкой лесов (поставщиков кислорода), загрязнением окружающей среды, сжиганием отходов и прочая. Больше об этом мы писали в прошлой статье об экологических проблемах современности.
Значение кислорода в природе
Именно наличие кислорода, в сочетании с водой привело к тому, что на нашей планете стало возможным возникновение жизни. Как мы заметили выше, основными поставщиками этого уникального газа являются различные растения, в том числе наибольшее количество выделяемого кислорода приходится на подводные водоросли. Выделяют кислород и некоторые виды бактерий. Кислород в верхних слоях атмосферы образует озоновый шар, который защищает всех жителей Земли от вредного ультрафиолетового солнечного излучения.
Строение молекулы кислорода
Молекула кислорода состоит из двух атомов, химическая формула имеет вид О2. Как образуется молекула кислорода? Механизм ее образования ковалентный неполярный, другими словами за счет обобществления электроном каждого атома. Связь между молекулами кислорода также ковалентная и неполярная, при этом она двойная, ведь у каждого из атомов кислорода есть по два неспаренных электрона на внешнем уровне.

Так выглядит молекула кислорода, благодаря своим характеристикам она весьма устойчива. Для многих химических реакций с ее участием нужны специальные условия: нагревание, повышенное давление, применение катализаторов.
Физические свойства кислорода
- Прежде всего, кислород является газом, из которого состоит 21% воздуха.
- Кислород не имеет ни цвета, ни вкуса, ни запаха.
- Может растворяться в органических веществах, поглощаться углем и порошками металлов.
- - Температура кипения кислорода составляет -183 С.
- Плотность кислорода равна 0,0014 г/см3
Химические свойства кислорода
Главным химическим свойством кислорода является, конечно же, его поддержка горения. То есть в вакууме, где нет кислорода, огонь не возможен. Если же в чистый кислород опустить тлеющую лучину, то она загорится с новой силой. Горение разных веществ это окислительно-восстановительный химический процесс, в котором роль окислителя принадлежит кислороду. Окислители же это вещества, «отбирающие» электроны у веществ восстановителей. Отличные окислительные свойства кислорода обусловлены его внешней электронной оболочкой.
Валентная оболочка у кислорода расположена близко к ядру и как следствие ядро притягивает к себе электроны. Также кислород занимает второе место после фтора по шкале электроотрицательности Полинга, по этой причине вступая в химические реакции со всеми другими элементами (за исключением фтора) кислорода выступает отрицательным окислителем. И лишь вступая в реакции со фтором кислород имеет положительное окислительное воздействие.
А так как кислород второй окислитель по силе среди всех химических элементов таблицы Менделеева, то это определяет и его химические свойства.
Получение кислорода
Для получения кислорода в лабораторных условиях применяют метод термической обработки либо пероксидов либо солей кислосодержащих кислот. Под действием высокой температуры они разлагаются с выделением чистого кислорода. Также кислород можно получить с помощью перекиси водорода, даже 3% раствор перекиси под действие катализатор мгновенно разлагается, выделяя кислород.
2KClO3 = 2KCl + 3O2↑ — вот так выглядит химическая реакция получения кислорода.
Также в промышленности в качестве еще одного способа получения кислорода применяют электролиз воды, во время которого молекулы воды раскладываются, и опять таки выделяется чистый кислород.
Использование кислорода в промышленности
В промышленности кислород активно применяется в таких сферах как:
- Металлургия (при сварке и вырезке металлов).
- Медицина.
- Сельское хозяйство.
- Как ракетное топливо.
- Для очищения и обеззараживания воды.
- Синтеза некоторых химических соединений, включая взрывчатые вещества.
Кислород, видео
И в завершение образовательное видео про кислород.
www.poznavayka.org
Химические свойства кислорода
Кислород вступает в соединения почти со всеми элементами периодической системы Менделеева.
Реакция соединения любого вещества с кислородом называется окислением.
Большинство таких реакций идет с выделением тепла. Если при реакции окисления одновременно с теплом выделяется свет, ее называют горением. Однако не всегда удается заметить выделяющиеся тепло и свет, так как в некоторых случаях окисление идет чрезвычайно медленно. Заметить тепловыделение удается тогда, когда реакция окисления происходит быстро.
В результате любого окисления — быстрого или медленного — в большинстве случаев образуются окислы: соединения металлов, углерода, серы, фосфора и других элементов с кислородом.
Вам, вероятно, не раз приходилось видеть, как перекрывают железные крыши. Перед тем как покрыть их новым железом, старое сбрасывают вниз. На землю вместе с железом падает бурая чешуя — ржавчина. Это гидрат окиси железа, который медленно, в течение нескольких лет, образовывался на железе под действием кислорода, влаги и углекислого газа.
Ржавчину можно рассматривать как соединение окиси железа с молекулой воды. Она имеет рыхлую структуру и не предохраняет железо от разрушения.
Для предохранения железа от разрушения — коррозии — его обычно покрывают краской или другими коррозионно устойчивыми материалами: цинком, хромом, никелем и другими металлами. Предохранительные свойства этих металлов, как и алюминия, основаны на том, что они покрываются тонкой устойчивой пленкой своих окислов, предохраняющих покрытие от дальнейшего разрушения.
Предохранительные покрытия значительно замедляют процесс окисления металла.
В природе постоянно происходят процессы медленного окисления, сходные с горением.
При гниении дерева, соломы, листьев и других органических веществ происходят процессы окисления углерода, входящего в состав этих веществ. Тепло при этом выделяется чрезвычайно медленно, и поэтому обычно оно остается незамеченным.
Но иногда такого рода окислительные процессы сами по себе ускоряются и переходят в горение.
Самовозгорание можно наблюдать в стоге мокрого сена.
Быстрое окисление с выделением большого количества тепла и света можно наблюдать не только при горении дерева, керосина, свечи, масла и других горючих материалов, содержащих углерод, но и при горении железа.
Налейте в банку немного воды и наполните ее кислородом. Затем внесите в банку железную спираль, на конце которой укреплена тлеющая лучинка. Лучинка, а за ней и спираль загорятся ярким пламенем, разбрасывая во все стороны звездообразные искры.
Это идет процесс быстрого окисления железа кислородом. Он начался при высокой температуре, которую дала горящая лучинка, и продолжается до полного сгорания спирали за счет тепла, выделяющегося при горении железа.
Тепла этого так много, что образующиеся при горении частицы окисленного железа накаляются добела, ярко освещая банку.
Состав окалины, образовавшейся при горении железа, несколько иной, чем состав окисла, образовавшегося в виде ржавчины при медленном окислении железа на воздухе в присутствии влаги.
В первом случае окисление идет до закиси-окиси железа (Fe3O4), входящей в состав магнитного железняка; во втором — образуется окисел, близко напоминающий бурый железняк, который имеет формулу 2Fe2O3 ∙ Н2O.
Таким образом, в зависимости от условий, в которых протекает окисление, образуются различные окислы, отличающиеся друг от друга содержанием кислорода.
Так, например, углерод в соединении с кислородом дает два окисла — окись и двуокись углерода. При недостатке кислорода происходит неполное сгорание углерода с образованием окиси углерода (СО), которую в общежитии называют угарным газом. При полном сгорании образуется двуокись углерода, или углекислый газ (СO2).
Фосфор, сгорая в условиях недостатка кислорода, образует фосфористый ангидрид (Р2O3), а при избытке — фосфорный ангидрид (Р2O5). Сера в различных условиях горения также может дать сернистый (SO2) или серный (SO3) ангидрид.
В чистом кислороде горение и другие реакции окисления идут быстрее и доходят до конца.
Почему же в кислороде горение идет энергичнее, чем в воздухе?
Обладает ли чистый кислород какими-то особыми свойствами, которых нет у кислорода воздуха? Конечно, нет. И в том и в другом случае мы имеем один и тот же кислород, с одинаковыми свойствами. Только в воздухе кислорода содержится в 5 раз меньше, чем в таком же объеме чистого кислорода, и, кроме того, в воздухе кислород перемешан с большими количествами азота, который не только сам не горит, но и не поддерживает горение. Поэтому, если непосредственно около пламени кислород воздуха уже израсходован, то другой его порции необходимо пробиваться через азот и продукты горения. Следовательно, более энергичное горение в атмосфере кислорода можно объяснить более быстрой подачей его к месту горения. При этом процесс соединения кислорода с горящим веществом идет энергичнее и тепла выделяется больше. Чем больше в единицу времени подается к горящему веществу кислорода, тем пламя ярче, тем температура выше и тем сильнее идет горение.
А горит ли сам кислород?
Возьмите цилиндр и опрокиньте его вверх дном. Подведите под цилиндр трубку с водородом. Так как водород легче воздуха, он полностью заполнит цилиндр.
Зажгите водород около открытой части цилиндра и введите в него сквозь пламя стеклянную трубку, через которую вытекает газообразный кислород. Около конца трубки вспыхнет огонь, который будет спокойно гореть внутри цилиндра, наполненного водородом. Это горит не кислород, а водород в присутствии небольшого количества кислорода, выходящего из трубки.
Что же образуется в результате горения водорода? Какой при этом получается окисел?
Водород окисляется до воды. Действительно, на стенках цилиндра постепенно начинают осаждаться капельки конденсированных паров воды. На окисление 2 молекул водорода идет 1 молекула кислорода, и образуются 2 молекулы воды (2Н2 + O2 → 2Н2O).
Если кислород вытекает из трубки медленно, он весь сгорает в атмосфере водорода, и опыт проходит спокойно.
Стоит только увеличить подачу кислорода настолько, что он не успеет сгореть полностью, часть его уйдет за пределы пламени, где образуются очаги смеси водорода с кислородом, появятся отдельные мелкие вспышки, похожие на взрывы.
Смесь кислорода с водородом — это гремучий газ. Если поджечь гремучий газ, произойдет сильный взрыв: при соединении кислорода с водородом получается вода и развивается высокая температура. Пары воды и окружающие газы сильно расширяются, создается большое давление, при котором может легко разорваться не только стеклянный цилиндр, но и более прочный сосуд. Поэтому работа с гремучей смесью требует особой осторожности.
Кислород обладает еще одним интересным свойством. Он вступает в соединение с некоторыми элементами, образуя перекисные соединения.
Приведем характерный пример. Водород, как известно, одновалентен, кислород двухвалентен: 2 атома водорода могут соединиться с 1 атомом кислорода. При этом получается вода. Строение молекулы воды обычно изображают Н — О — Н. Если к молекуле воды присоединить еще 1 атом кислорода, то образуется перекись водорода, формула которой Н2O2.
Куда же входит второй атом кислорода в этом соединении и какими связями он удерживается? Второй атом кислорода как бы разрывает связь первого с одним из атомов водорода и становится между ними, образуя при этом соединение Н—О—О—Н. Такое же строение имеет перекись натрия (Na—О—О—Na), перекись бария.
Характерным для перекисных соединений является наличие 2 атомов кислорода, связанных между собой одной валентностью. Поэтому 2 атома водорода, 2 атома натрия или 1 атом бария могут присоединить к себе не 1 атом кислорода с двумя валентностями (—О—), а 2 атома, у которых в результате связи между собой также остается только две свободные валентности (—О—О—).
Перекись водорода можно получить действием разбавленной серной кислоты на перекись натрия (Na2O2) или перекись бария (ВаO2). Удобнее пользоваться перекисью бария, так как при действии на нее серной кислотой образуется нерастворимый осадок сернокислого бария, от которого перекись водорода легко отделить путем фильтрования (ВаO2 + h3SO4 → BaSO4 + Н2O2).
Перекись водорода, как и озон, — соединение неустойчивое и разлагается на воду и атом кислорода который в момент выделения обладает большой окислительной способностью. При низких температурах и в темноте разложение перекиси водорода идет медленно. А при нагревании и на свету оно происходит значительно быстрее. Песок, порошок двуокиси марганца, серебра или платины также ускоряют разложение перекиси водорода, а сами при этом остаются без изменения. Вещества, которые только влияют на скорость химической реакции, а сами остаются неизмененными, называются катализаторами.
Если налить немного перекиси водорода в склянку, на дне которой находится катализатор — порошок двуокиси марганца, разложение перекиси водорода пойдет с такой быстротой, что можно будет заметить выделение пузырьков кислорода.
Способностью окислять различные соединения обладает не только газообразный кислород, но и некоторые соединения, в состав которых он входит.
Хорошим окислителем является перекись водорода. Она обесцвечивает различные красители и поэтому применяется в технике для отбеливания шелка, меха и других изделий.
Способность перекиси водорода убивать различные микробы позволяет применять ее как дезинфицирующее средство. Перекись водорода употребляется для промывания ран, полоскания горла и в зубоврачебной практике.
Сильными окислительными свойствами обладает азотная кислота (HNO3). Если в азотную кислоту добавить каплю скипидара, образуется яркая вспышка: углерод и водород, входящие в состав скипидара, бурно окислятся с выделением большого количества тепла.
Бумага и ткани, смоченные азотной кислотой, быстро разрушаются. Органические вещества, из которых сделаны эти материалы, окисляются азотной кислотой и теряют свои свойства. Если смоченную азотной кислотой бумагу или ткань нагреть, процесс окисления ускорится настолько, что может произойти вспышка.
Азотная кислота окисляет не только органические соединения, но и некоторые металлы. Медь при действии на нее концентрированной азотной кислотой окисляется сначала до окиси меди, выделяя из азотной кислоты двуокись азота, а затем окись меди переходит в азотнокислую соль меди.
Не только азотная кислота, но и некоторые ее соли обладают сильными окислительными свойствами.
Азотнокислые соли калия, натрия, кальция и аммония, которые в технике получили название селитры, при нагревании разлагаются, выделяя кислород. При высокой температуре в расплавленной селитре тлеющий уголек сгорает так энергично, что появляется яркобелый свет. Если же в пробирку с расплавленной селитрой вместе с тлеющим угольком бросить кусочек серы, горение пойдет с такой интенсивностью и температура повысится настолько, что стекло начнет плавиться. Эти свойства селитры давно были известны человеку; он воспользовался этими свойствами для приготовления пороха.
Черный, или дымный, порох приготовляется из селитры, угля и серы. В этой смеси уголь и сера являются горючими материалами. Сгорая, они переходят в газообразный углекислый газ (СO2) и твердый сернистый калий (K2S). Селитра, разлагаясь, выделяет большое количество кислорода и газообразный азот. Выделившийся кислород усиливает горение угля и серы.
В результате горения развивается такая высокая температура, что образовавшиеся газы могли бы расшириться до объема, который в 2000 раз больше объема взятого пороха. Но стенки замкнутого сосуда, где обычно производят сжигание пороха, не позволяют газам легко и свободно расширяться. Создается огромное давление, которое разрывает сосуд в его наиболее слабом месте. Раздается оглушительный взрыв, газы с шумом вырываются наружу, унося с собой в виде дыма размельченные частицы твердого вещества.
Так из калийной селитры, угля и серы образуется смесь, обладающая огромной разрушительной силой.
К соединениям с сильными окислительными свойствами относятся и соли кислородосодержащих кислот хлора. Бертолетова соль при нагревании распадается на хлористый калий и атомарный кислород.
Еще легче, чем бертолетова соль, отдает свой кислород хлорная, или белильная, известь. Белильной известью отбеливают хлопок, лен, бумагу и другие материалы. Хлорная известь употребляется и как средство против отравляющих веществ: отравляющие вещества, как и многие другие сложные соединения, разрушаются под действием сильных окислителей.
Окислительные свойства кислорода, его способность легко вступать в соединение с различными элементами и энергично поддерживать горение, развивая при этом высокую температуру, уже давно обратили на себя внимание ученых различных областей науки. Особенно этим заинтересовались химики и металлурги. Но использование кислорода было ограничено, так как не было простого и дешевого способа получения его из воздуха и воды.
На помощь химикам и металлургам пришли физики. Они нашли очень удобный способ выделения кислорода из воздуха, а физико-химики научились получать его в огромных количествах из воды.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Кислород. Химические свойства кислорода.
Урок 1.
Тема. Оксиген Кислород, состав его молекулы, физические свойства.
Получение кислорода в лаборатории Реакция разложения.
Понятие о катализаторе.
Задачи урока: в ходе урока закрепить знания учащихся о химическом
элементе и простом веществе на примере Оксигена и
кислорода;
рассмотреть способы получения кислорода в лаборатории и
промышленности;
познакомить учащихся с историей открытия кислорода и
распространением элемента Оксигена в природе;
обобщить знания учащихся о воздухе и его составе;
сформировать представление о реакции разложения,
катализаторе.
продолжать формировать умение работать с дополнительной
литературой, обобщать, выделять главное.
Ход урока.
1. Орг. момент.
2. Актуализация опорных знаний учащихся.
- Что изучает химия?
- Дайте определение вещества.
- Что мы называем простым веществом? Приведите примеры.
- На какие две группы делятся простые вещества?
- Приведите примеры металлов и неметаллов.
- По каким признакам металлы отличаются от неметаллов?
- Что такое «химический элемент»?
- В чем заключается разница между «химическим элементом» и «простым веществом»?
3. Изучение нового материала.
С этого урока мы начинаем знакомиться с веществами, которые играют важную роль в жизни человека - одним из таких веществ является кислород.
- Что вы уже знаете о кислороде?
- А что еще можете и хотите узнать?
По мнению людей религиозных, вездесущим, всемогущим и в то же время невидимым может быть только бог. В действительности же все эти три эпитета вполне можно к химическому элементу с порядковым номером 8 – Оксигену, который образует простое вещество Кислород.
- Подумайте, и заполните таблицы - характеристики химического элемента и простого вещества.
Химический знак Простое вещество
Название элемента Оксиген Формула соединения O2
Символ O Mr 32
Ar 16 Физические свойства
Валентность 11 Химические свойства
Получение
Нахождение в природе
Применение
- Где, по вашему мнению, встречается элемент Оксиген?
47% от массы защитной коры
 ( SiO2, Fe2O3, Al2O3 и т.п. )
( SiO2, Fe2O3, Al2O3 и т.п. )
65% массы тела
 О2
О2
 человека
человека
80% гидросферы (h3O)
Химический элемент Оксиген вполне заслуживает такие поэтические строчки.
Я скрізь навколо тебе є,
Бо Оксиген – ім'я моє.
Я і в деревах, у траві
У твоїх жилах, у крові.
- Что мы знаем о физических свойствах простого вещества кислорода?
При обычных условиях это газ, который не имеет цвета, вкуса и запаха. Он тяжелее воздуха и его собирают способом вытеснения воздуха. Он малорастворим в воде, но этого достаточно чтобы в воде жили живые существа (рыбы, насекомые и т.д). Его можно также собирать и способом вытеснения воды. Для человека наиболее важны такие свойства кислорода как способность поддерживать дыхание и горение.
В лаборатори кислород получают при нагревании кислородсодержащих
веществ, таких как перманганат калия, перекись водорода, хлорат калия. Они разлагаются с выделение кислорода. Обратите внимание на следующие уравнения
o
t
2КМnО4 → К2МnО4+МnО2 + О2↑
o
t,MnO2
2h3O2 → 2h3O + O2↑
o
t
2KCLO3 → 2KCL + 3O2↑
- что общего в этих уравнениях?
Да вы правы. И такие реакции называются реакциями разложения. Это реакции, в результате которых из одного сложного вещества получают несколько простых или сложных.
условия протекания реакций помимо температуры, стоит и формула манган (IV) оксида. Это вещество называется катализатором.
В промышленности для получения кислорода используют те вещества, которые широко распространены в природе.
Это вода и воздух.
Через воду пропускают постоянный ток, и она разлагается с выделением кислорода.
пост. ток
2h3O → 2h3↑ + O2↑
- К какому типу относится эта реакция?
Чтобы выделить кислород из воздуха, воздух охлаждают до tº = -196ºС. Затем температуру повышают в растворе остается жидкий кислород. Его хранят в специальных сосудах – кислородных танках и используют для нужд промышленности.
Химические свойства кислорода мы с вами рассмотрим на следующих уроках.
4. Общение знаний учащихся.
- Что нового вы узнали на уроке?
- Дайте характеристику химическому элементу Оксигену.
- Опишите физические свойства кислорода.
- Расскажите, как получают кислород в лаборатории и промышленности.
- Расставьте коэффициенты в уравнениях реакций и найдите реакции разложения.
Fe + HCL → FeCL2 + h3 CaCO3 → CaO + CO2
tº
N2O5 → No2 + O2 KBr + Cl2 → Kcl + Br2
tº
Pb + O2 → PbO KNO3 → KNO2 + O2
5. Итоги урока.
- выставление оценок.
-задание творческой группе подготовит сообщение об истории открытия кислорода.
6. Домашнее задание.
1) прочитать §§ 17,18, упр. 9(с.141)
2) Составить схему – конспект
«Характеристика элемента Оксигена»
«Получение кислорода лаборатории и промышленности»
«Физические свойства кислорода»
3) попробуйте составить сенкан, описывающий свойства кислорода или его применение (см. с.12).
Урок 2.
ТЕМА. Химические свойства кислорода: взаимодействие с углем, серой, фосфором. Реакция соединения. Понятие об оксидах, окислении, горении.
Задачи урока: в ходе урока продолжить формировать представление о
различии понятий «химический элемент» и «простое
вещество»;
рассмотреть химические свойства простого вещества
кислорода;
продолжить формировать умение составлять уравнения
химических реакций;
познакомить с понятиями: реакция горения, оксиды, окисление, горение;
продолжить формировать умение выделять главное, обобщать.
Ход урока.
Орг. момент.
Проверка выполнения домашнего задания.
а) выполнение упр. 9 (с.141).
б) рассмотреть составленные схемы – конспекты.
в) заслушивание стихотворений.
г) сообщение творческой группы.
3. Актуализация опорных знаний учащихся.
- Какие простые вещества образует химический элемент Оксиген?
- Какими методами можно собрать кислорода? Почему?
- Как доказать, что в стакане находится кислород?
- Перечислите физические свойства кислорода.
- Какие из них играют важную роль в жизни человека? Почему?
- Какие свойства вещества называются химическими?
4.Изучение нового материала.
Кислород – одно из самых активных веществ он реагирует с простыми веществами: металлами и неметаллами, со сложными веществами. Большинство реакций протекает при нагревании.
Рассмотрим некоторые из этих реакций.
- Демонстрация горения серы, углерода, спирта в кислороде.
Давайте запишем уравнения этих превращений.
S + O2 → SO2
IV II
C + O2 → CO2
- Найдите в §19 описание опыта сжигания красного фосфора.
-Записываем уравнение реакции горения фосфора.
IV II
4P + 5O2 → 2P2O5
- Что общего в уравнения записанных реакций.
- Реакции, когда из нескольких соединений получается только одно сложное вещество, называются реакциями соединения.
- Реакции, в которых участвует кислород, называются реакциями окисления. Если процесс окисления сопровождается выделением света и тепла, то он называется горением.
Давайте рассмотрим соединения, которые образовались при горении серы, углерода, фосфора.
- Что общего в данных соединениях?
- Какие отличия вы видите в записанных формулах:
Эти соединения называются оксидами. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.
Все новое, что мы узнали на этом уроке можно записать в виде короткой схемы.
 Me окисление
Me окисление
O2 + не Me Э2Оx
сл. в-ва горение оксиды.
5. Закрепление знаний учащихся.
- Что нового мы узнали на уроке?
- Что вам понравилось на уроке?
- Что не понравилось?
- Кто из учащихся, по вашему мнению, был наиболее активным?
- Из перечня веществ выпишите формулы оксидов
HNO3, K2O, NaCl, HJ, CaO, h3So4, So2, CuSo4, O2.
- Расставьте коэффициенты в уравнениях следующих реакций.
Fe + O2 → Fe3 O4 Ca + O2 → CaO
SO2 + O2 → SO3 Li + O2 → Li2 O
h3 + O2 → h3O Ph4 + O2 → P2O5 + h3O
- Назовите среди них реакции соединения.
- Какие из уравнений отражают сжигание простых веществ.
- Назовите формулы оксидов, которые встречаются в этих уравнениях.
- Составьте уравнения реакций, опережающих следующие превращения.

 ZnO Al2O3 2Zn + → 2ZnO
ZnO Al2O3 2Zn + → 2ZnO
4Al + 3O2 → 2 Al2O3
 O2 2h3 + O2 → 2h3O
O2 2h3 + O2 → 2h3O
h3O
6. Итоги урока.
7. Домашнее задание.
1) прочитать §19, упр. 3 (с.147)
2) подготовить сообщение о свойствах озона.
3) составить уравнения реакций, опережающих следующие превращения.
 Fe3O4
Fe3O4
 KMnO4 O2
KMnO4 O2
 BaO
BaO
infourok.ru
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА. РЕАКЦИЯ СОЕДИНЕНИЯ - КИСЛОРОД - Химия 7 класс Ярошенко О.Г. - Сиция 2015 год
Тема 2 КИСЛОРОД
§ 27. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА. РЕАКЦИЯ СОЧЕТАНИЯ
Изучение параграфа поможет вам:
· называть состав и приводить примеры оксидов;
· характеризовать химические свойства кислорода;
· составлять уравнения реакций с участием кислорода;
· различать реакции разложения и соединения;
· объяснять сущность реакций соединения
Вам известно, что химические свойства веществ-это их способность взаимодействовать с другими веществами. Взаимодействие завершается тем, что из структурных частиц, которые входили в состав реагентов, образуются структурные частицы продуктов реакции. При участии кислорода такие процессы происходят со многими простыми, а также сложными веществами. Это дает основания для того, чтобы назвать кислород активным веществом.
ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА С ПРОСТЫМИ ВЕЩЕСТВАМИ.
1. Взаимодействие я углеродом. Раскалите на пламени спиртовки уголек и внесем ее в наполненную кислородом колбу. Уголек быстро сгорает, не образуя копоти и дыма (рис. 87, а), а стенки колбы нагреваются. Нальем в колбу известковой воды, она помутнеет. А это доказывает, что в колбе, где раньше содержался кислород, появился углекислый газ.
Выделение света и тепла свидетельствуют о том, что произошло горение, которое относится к химическим явлениям:
С + О2 = СО2 — углекислый газ, или карбон(IV) оксид (1)
2. Взаимодействие с водородом. К наполненной водородом сухой пробирки возведем зажженную спичку. Сразу услышим приглушенный хлопок. Это потому, что водород реагирует с кислородом мгновенно — со взрывом. Появление на стенках сухой пробирки капелек воды — убедительное доказательство образования этого вещества:
2h3 + O2 = 2h3О — вода, или гидроген оксид (2)
3. Взаимодействие с серой. Наполним ложечку для сжигания веществ на 1/3 серой, внесем в пламя спиртовки и потримаймо, пока сера не расплавится и не начнет гореть. После этого внесем ложечку в колбу с кислородом. Сера сразу вспыхивает ярким синим пламенем, колба наполняется сернистым газом (рис. 87, б):
S + O2 = SO2 — сернистый газ, или сульфур (IV) оксид (3)
Эту реакцию сопровождает появление резкого специфического запаха сернистого газа.
4. Взаимодействие с магнием. Подожжем магниевую ленту, и она быстро сгорит ярко-ослепительным пламенем:
2Mg + O2 = 2MgO магний оксид (4)
Видимой нам признаком этой химической реакции является появление света.
5. Взаимодействие с железом. Попробуем, подобно магния, сжечь тоненькую железную иглу. Сделать это в воздухе нам не удастся. Проверим, сгорит игла в колбе, наполненной кислородом. Для безопасного проведения опыта дно колбы покроем слоем песка. Устромимо тоненькую иглу той ее частью, где расположено ушко, в деревянную палочку и на острие иглы наколемо спичку. Сразу после поджигания спички медленно внесем иглу в колбу с кислородом. Железо быстро загорается, образованный продукт реакции яркими искрами, напоминающими новогодние бенгальские огни, разлетается в разные стороны (рис. 87, в). От иглы остается маленькая оплавлена шарик в месте ее закрепления. Стенки колбы нагреваются. Это химическое явление передается следующим уравнением реакции:
3Fe + 2O2 = Fe3O4 железная окалина (б)
Реакция сопровождается выделением света и тепла.
6. Взаимодействие с медью. Медную пластинку подержим несколько минут над пламенем спиртовки. Будем наблюдать, как вместо красно-медного цвета появляется черный:
2Си + O2 = 2СиО — купрум(II) оксид (в)
Реакция сопровождается изменением цвета.
ПОНЯТИЕ О ОКСИДАХ. Во всех только что рассмотренных реакциях образовывались бинарные соединения элемента с Оксигеном — оксиды.
До простых или сложных веществ относятся оксиды? Ответ объясните.
Рис. 87. Горение в кислороде угля (а), серы (6) и железа (в)
Вы уже знаете, что оксидами называют бинарные соединения элементов с Оксигеном и умеете определять валентность химического элемента в оксиде. Вспомнить это можно обратившись к параграфу 18.
Продукт взаимодействия железа с кислородом — железная окалина Fe3O4 — особая бинарная соединение Кислорода. Она образована из двух оксидов — FeO и Fe2O3.
Определите по формулам обоих оксидов. в каком из них металлический элемент Ферум двовалентний, а в каком — трехвалентный.
РЕАКЦИЯ СОЧЕТАНИЯ. В каждом из шести рассмотренных примеров общим было то, что из двух веществ образовывалась одна. Такие реакции относятся к реакциям соединения.
Реакции, в результате которых из двух или более веществ образуется одно вещество, называют реакциями соединения.
Чтобы после рассмотренных примеров у вас не сложилось впечатление, что сочетаться могут только простые вещества, приведем примеры уравнений реакций сочетание сложного и простого вещества; двух сложных веществ:
2СО + О2 = 2СО2 (7)
Na2O + ЅО3= Nа3SO4 — натрий сульфат (8)
Как видим, главным для реакций сочетания является то, что образуется один продукт реакции, а реагенты могут быть и сложными, и простыми веществами, но их непременно должно быть два или больше.
Обобщим изученное:
ВЗАИМОДЕЙСТВИЕ КИСЛОРОДА СО СЛОЖНЫМИ ВЕЩЕСТВАМИ. Взаимодействие с метаном. Каждый раз, зажигая газовую плиту, люди осуществляют химическую реакцию между метаном СН4 (основная составная часть природного газа) и кислородом:
Это химическое явление сопровождается двумя физическими явлениями световым и тепловым. Во время его течения содержание кислорода в помещении кухни уменьшается, а углекислого газа, наоборот, увеличивается. Поэтому правильно поступают те, кто проветривает кухню, держит открытой форточку, устанавливает электрические вытяжки.
Взаимодействие кислорода с гидроген сульфидом h3S. сульфид водорода, или сероводород, также сгорает в кислороде. За достаточного количества кислорода реакция сопровождается образованием уже известного вам сернистого газа и воды:
2Н2S + 3О2 = 2 ЅО2 + 2Н2О (10)
Полное окисление глюкозы C6Н12О6. Уже одно то, что без дыхания человек может прожить не более 5-7 минут, наводит на мысль о чрезвычайной важности кислорода для организма. А задумывались ли вы над тем, какие функции кислорода в нашем организме? Ведь его суточная норма не такая уж и мала — около 700 г.
Ученые исследовали, что с участием кислорода в организме происходит много реакций. В частности глюкоза, которая поступает в организм человека с продуктами питания, тоже реагирует с кислородом. Взаимодействие происходит в присутствии ферментов (катализаторов) и завершается образованием углекислого газа и воды. Это можно выразить следующим суммарным уравнением реакции:
С6Н12О6 + 6О2 = 6СО2 + 6Н2О (11)
Во всех рассмотренных примерах независимо от того, простое или сложное вещество взаимодействует с кислородом, образуются оксиды тех элементов, которые входили в состав реагентов. Однако, при неполной взаимодействии сложного вещества с кислородом может образоваться и простое вещество. Например, рассмотренное выше взаимодействие кислорода с гидроген сульфидом Н2S может происходить с образованием серы и воды, если кислорода взято с недостачей:
2Н2S + O2 = 2S + 2Н2О (12)
Кислород принадлежит к активных веществ. Он легко вступает во взаимодействие с простыми и сложными веществами. Продуктами этих реакций являются оксиды.
Копилка эрудита
В начале параграфа было сказано, что большинство простых веществ взаимодействует с кислородом. Примерами металлов, которые не входят в это большинство, есть золото Au, платина Pt, поэтому их называют благородными металлами. Среди неметаллов «безразличие», или инертность, к кислороду проявляют гелий Не, неон Ne, аргон Аг, криптон Кг, ксенон Хе и радон Rn. Поэтому эти газообразные вещества имеют общее название инертные газы.
Долгое время в науке считалось, что инертные газы не взаимодействуют ни с какими веществами. Однако за последние полвека удалось добыть некоторые их соединения, в том числе и с Оксигеном, правда не за реакцией сочетания инертного газа с кислородом, а другими способами.
?
1. Из чего состоят оксиды? Приведите примеры оксидов.
2. Охарактеризуйте химические свойства кислорода.
3. Какие реакции называют реакциями соединения? Приведите примеры.
4. В чем заключается различие между химическими реакциями разложения и соединения?
5. Выпишите из текста параграфа формулы и названия веществ, которые для вас являются новыми.
6. По формулам оксидов, имеющиеся в тексте параграфа, определите, какой из них имеет наименьшую, а какой — наибольшую массовую долю Кислорода.
7. По приведенным схемам напишите уравнения реакций:
а) Ва + О2 —> ВаО
б) PbS + О2 —> РbО + SO2
в) Си + O2 —> СиО
г) HgS + O2 —> Hg + SO2
8. Напишите уравнения реакций кислорода с:
а) амоніаком Nh4, если в образовавшемся оксиде валентность Азота равна 2;
6) цинк сульфидом ZnS, если в образовавшемся оксиде валентность Серы равна IV.
Выясните расположение инертных газов в периодической системе химических элементов Д. И. Менделеева.
schooled.ru
Свойства кислорода — урок. Химия, 8–9 класс.
Простое вещество кислород состоит из двухатомных молекул. Атомы в молекуле связаны ковалентной неполярной связью. Связь двойная, так как у каждого атома имеются два неспаренных электрона на внешнем энергетическом уровне. Структурная и электронная формулы кислорода:
O=O, :O:..:O:..
Физические свойства
При комнатной температуре кислород — газ без цвета, запаха и вкуса. Он примерно в \(1,1\) раза тяжелее воздуха.
При температуре \(–183\) °С кислород сжижается и превращается в голубую жидкость, а при \(–218\) \( \)°С становится твёрдым.
Кислород плохо растворяется в воде. При \(20\) °С в \(1\) объёме воды растворяется примерно \(3,1\) объёма кислорода. Растворимость кислорода, так же как и других газов, зависит от температуры. С повышением температуры растворимость уменьшается.
Химические свойства
Связь в молекуле кислорода прочная. При обычных условиях это малоактивный газ, который вступает в реакции только с наиболее активными веществами: щелочными и щелочноземельными металлами. При повышении температуры активность кислорода резко возрастает. Он энергично реагирует с большинством простых и многими сложными веществами, проявляя при этом окислительные свойства.
Почти все реакции с кислородом экзотермичны, поэтому нагревание требуется лишь для начала процесса. Большинство реакций с участием кислорода сопровождается выделением тепла и света. Такие реакции называют реакциями горения.
- Взаимодействие с простыми веществами-неметаллами.
При нагревании неметаллы (кроме инертных газов и галогенов) сгорают в кислороде с образованием оксидов. Если серу зажечь и опустить в сосуд с кислородом, то она сгорает ярким синим пламенем. При этом образуется сернистый газ:
Зажжённый фосфор горит в кислороде белым пламенем. Сосуд заполняется дымом, состоящим из мелких частиц оксида фосфора(\(V\)):
4P+5O2=t2P2O5+Q.
Подобным образом протекают реакции с углеродом, кремнием, водородом:
C+O2=tCO2+Q,
Si+O2=tSiO2+Q,
2h3+O2=t2h3O+Q.
Реакция азота с кислородом идёт с поглощением тепла. Для её протекания требуется высокая температура:
N2+O2⇄3000°CNO−Q.
- Взаимодействие с простыми веществами-металлами.
Активные металлы реагируют с кислородом при комнатной температуре:
4Li+O2=2Li2O,
2Ca+O2=2CaO+Q.
При нагревании реагируют менее активные металлы:
2Cu+O2=t2CuO.
Многие металлы сгорают в кислороде. Так, раскалённое железо в чистом кислороде начинает ярко светиться и разбрасывать яркие искры:
3Fe+2O2=tFe3O4+Q.
В реакции с железом образуется смешанный оксид: Fe3O4 (FeO⋅Fe2O3).
Неактивные металлы (золото, платина, серебро) с кислородом не реагируют.
- Взаимодействие со сложными веществами.
В кислороде горят многие сложные органические и неорганические вещества. При этом, как правило, образуются оксиды элементов, входящих в состав этих веществ:
Ch5+3O2=tCO2+2h3O+Q,
2h3S+3O2=t2SO2+2h3O+Q,
2CO+O2=t2CO2+Q.
www.yaklass.ru
КИСЛОРОД | Энциклопедия Кругосвет
КИСЛОРОД, O (oxygenium), химический элемент VIA подгруппы периодической системы элементов: O, S, Se, Te, Po – член семейства халькогенов. Это наиболее распространенный в природе элемент, его содержание составляет в атмосфере Земли 21% (об.), в земной коре в виде соединений ок. 50% (масс.) и в гидросфере 88,8% (масс.).
Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), жиров и белков. Глины, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Историческая справка.
Первые сведения о кислороде стали известны в Европе из китайских рукописей 8 в. В начале 16 в. Леонардо да Винчи опубликовал данные, связанные с химией кислорода, не зная еще, что кислород – элемент. Реакции присоединения кислорода описаны в научных трудах С.Гейлса (1731) и П.Байена (1774). Заслуживают особого внимания исследования К.Шееле в 1771–1773 взаимодействия металлов и фосфора с кислородом. Дж.Пристли сообщил об открытии кислорода как элемента в 1774, спустя несколько месяцев после сообщения Байена о реакциях с воздухом. Название oxygenium («кислород») дано этому элементу вскоре после его открытия Пристли и происходит от греческих слов, обозначающих «рождающий кислоту»; это связано с ошибочным представлением о том, что кислород присутствует во всех кислотах. Объяснение роли кислорода в процессах дыхания и горения, однако, принадлежит А.Лавуазье (1777).
Строение атома.
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть равно 8, 9 или 10. Наиболее распространенный из трех изотопов кислорода (99,76%) – это 168O (8 протонов и 8 нейтронов). Содержание другого изотопа, 188O (8 протонов и 10 нейтронов), составляет всего 0,2%. Этот изотоп используется как метка или для идентификации некоторых молекул, а также для проведения биохимических и медико-химических исследований (метод изучения нерадиоактивных следов). Третий нерадиоактивный изотоп кислорода 178O (0,04%) содержит 9 нейтронов и имеет массовое число 17. После того как в 1961 масса изотопа углерода 126C была принята Международной комиссией за стандартную атомную массу, средневзвешенная атомная масса кислорода стала равна 15,9994. До 1961 стандартной единицей атомной массы химики считали атомную массу кислорода, принятую для смеси трех природных изотопов кислорода равной 16,000. Физики за стандартную единицу атомной массы принимали массовое число изотопа кислорода 168O, поэтому по физической шкале средняя атомная масса кислорода составляла 16,0044 (см. также АТОМНАЯ МАССА).
В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов – на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд (см. также АТОМА СТРОЕНИЕ).
Молекулярный кислород.
Как большинство других элементов, у атомов которых для достройки внешней оболочки из 8 электронов не хватает 1–2 электронов, кислород образует двухатомную молекулу. В этом процессе выделяется много энергии (~490 кДж/моль) и соответственно столько же энергии необходимо затратить для обратного процесса диссоциации молекулы на атомы. Прочность связи O–O настолько высока, что при 2300° С только 1% молекул кислорода диссоциирует на атомы. (Примечательно, что при образовании молекулы азота N2 прочность связи N–N еще выше, ~710 кДж/моль.)
Электронная структура.
В электронной структуре молекулы кислорода не реализуется, как можно было ожидать, распределение электронов октетом вокруг каждого атома, а имеются неспаренные электроны, и кислород проявляет свойства, типичные для такого строения (например, взаимодействует с магнитным полем, являясь парамагнетиком).
Реакции.
В соответствующих условиях молекулярный кислород реагирует практически с любым элементом, кроме благородных газов. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Вероятно, большинство реакций протекает только после диссоциации кислорода на атомы, а диссоциация происходит лишь при очень высоких температурах. Однако катализаторы или другие вещества в реагирующей системе могут способствовать диссоциации O2. Известно, что щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы реагируют с молекулярным кислородом с образованием пероксидов:
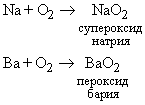
Получение и применение.
Благодаря наличию свободного кислорода в атмосфере наиболее эффективным методом его извлечения является сжижение воздуха, из которого удаляют примеси, CO2, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород. В результате жидкий кислород содержит следы благородных газов и относительно большой процент азота. Для многих областей применения эти примеси не мешают. Однако для получения кислорода особой чистоты процесс дистилляции необходимо повторять. Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием. Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике.
Электролиз.
Один из методов получения кислорода – электролиз воды, содержащей небольшие добавки NaOH или h3SO4 в качестве катализатора: 2h3O ® 2h3 + O2. При этом образуются небольшие примеси водорода. С помощью разрядного устройства следы водорода в газовой смеси вновь превращают в воду, пары которой удаляют вымораживанием или адсорбцией.
Термическая диссоциация.
Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO ® 2Hg + O2. Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора – диоксида марганца:
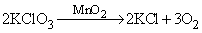
Диоксид марганца, добавляемый в небольших количествах перед прокаливанием, позволяет поддерживать требуемую температуру и скорость диссоциации, причем сам MnO2 в процессе не изменяется.
Используются также способы термического разложения нитратов:
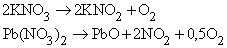
а также пероксидов некоторых активных металлов, например:
2BaO2® 2BaO + O2
Последний способ одно время широко использовался для извлечения кислорода из атмосферы и заключался в нагревании BaO на воздухе до образования BaO2 с последующим термическим разложением пероксида. Способ термического разложения сохраняет свое значение для получения пероксида водорода.
| НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА | |
| Атомный номер | 8 |
| Атомная масса | 15,9994 |
| Температура плавления, °С | –218,4 |
| Температура кипения, °С | –183,0 |
| Плотность | |
| твердый, г/см3 (при tпл) | 1,27 |
| жидкий г/см3 (при tкип) | 1,14 |
| газообразный, г/дм3 (при 0° С) | 1,429 |
| относительная по воздуху | 1,105 |
| критическаяа, г/см3 | 0,430 |
| Критическая температураа, °С | –118,8 |
| Критическое давлениеа, атм | 49,7 |
| Растворимость, см3/100 мл растворителя | |
| в воде (0° С) | 4,89 |
| в воде (100° С) | 1,7 |
| в спирте (25° С) | 2,78 |
| Радиус, Å | 0,74 |
| ковалентный | 0,66 |
| ионный (О2–) | 1,40 |
| Потенциал ионизации, В | |
| первый | 13,614 |
| второй | 35,146 |
| Электроотрицательность (F = 4) | 3,5 |
| а Температура и давление, при которых плотность газа и жидкости одинаковы. | |
Физические свойства.
Кислород при нормальных условиях – бесцветный газ без запаха и вкуса. Жидкий кислород имеет бледно-голубой цвет. Твердый кислород существует по крайней мере в трех кристаллических модификациях. Газообразный кислород растворим в воде и, вероятно, образует непрочные соединения типа O2Чh3O, а возможно, и O2Ч2h3O.
Химические свойства.
Как уже упоминалось, химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2. Другие же элементы и соединения реагируют только с продуктом диссоциации O2. В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях.
Электронная структура кислорода (1s22s22p4) такова, что атом O принимает для образования устойчивой внешней электронной оболочки два электрона на внешний уровень, образуя ион O2–. В оксидах щелочных металлов образуется преимущественно ионная связь. Можно полагать, что электроны этих металлов практически целиком оттянуты к кислороду. В оксидах менее активных металлов и неметаллов переход электронов неполный, и плотность отрицательного заряда на кислороде менее выражена, поэтому связь менее ионная или более ковалентная.
При окислении металлов кислородом происходит выделение тепла, величина которого коррелирует с прочностью связи M–O. При окислении некоторых неметаллов происходит поглощение тепла, что свидетельствует об их менее прочных связях с кислородом. Такие оксиды термически неустойчивы (или менее стабильны, чем оксиды с ионной связью) и часто отличаются высокой химической активностью. В таблице приведены для сравнения значения энтальпий образования оксидов наиболее типичных металлов, переходных металлов и неметаллов, элементов A- и B-подгрупп (знак минус означает выделение тепла).
| Реакции | Энтальпии образования, кДж/моль |
| 4Na + O2 ® 2Na2Oa | –208 |
| 2Mg + O2 ® 2MgO | –297 |
| 4Al + 3O2 ® 2Al2O3 | –273 |
| Si + O2 ® SiO2 | –215 |
| 4P + 5O2 ® P4O10 | –151 |
| S + O2 ® SO2 | –74 |
| 2Cl2 + 7O2 ® 2Cl2O7 | +19 |
| 2Hg + O2 ® 2HgO | –45 |
| 2Cr + 3O2 ® 2CrO3 | –97 |
| 3Fe + 2O2 ® Fe3O4 | –140 |
| a При нормальных условиях предпочтительнее образование Na2O2. | |
О свойствах оксидов можно сделать несколько общих выводов:
1. Температуры плавления оксидов щелочных металлов уменьшаются с ростом атомного радиуса металла; так, tпл (Cs2O) tпл (Na2O). Оксиды, в которых преобладает ионная связь, имеют более высокие температуры плавления, чем температуры плавления ковалентных оксидов: tпл (Na2O) > tпл (SO2).
2. Оксиды химически активных металлов (IA–IIIA подгрупп) более термически стабильны, чем оксиды переходных металлов и неметаллов. Оксиды тяжелых металлов в высшей степени окисления при термической диссоциации образуют оксиды с более низкими степенями окисления (например, 2Hg2+O ® (Hg+)2O + 0,5O2® 2Hg0 + O2). Такие оксиды в высоких степенях окисления могут быть хорошими окислителями.
3. Наиболее активные металлы взаимодействуют с молекулярным кислородом при повышенных температурах с образованием пероксидов:
Sr + O2® SrO2.
4. Оксиды активных металлов образуют бесцветные растворы, тогда как оксиды большинства переходных металлов окрашены и практически нерастворимы. Водные растворы оксидов металлов проявляют основные свойства и являются гидроксидами, содержащими OH-группы, а оксиды неметаллов в водных растворах образуют кислоты, содержащие ион H+.
5. Металлы и неметаллы A-подгрупп образуют оксиды со степенью окисления, соответствующей номеру группы, например, Na, Be и B образуют Na12O, BeIIO и B2IIIO3, а неметаллы IVA–VIIA подгрупп C, N, S, Cl образуют CIVO2, NV2O5, SVIO3, ClVII2O7. Номер группы элемента коррелирует только с максимальной степенью окисления, так как возможны оксиды и с более низкими степенями окисления элементов. В процессах горения соединений типичными продуктами являются оксиды, например:
2h3S + 3O2® 2SO2 + 2h3O
Углеродсодержащие вещества и углеводороды при слабом нагревании окисляются (сгорают) до CO2 и h3O. Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Тепло от процесса горения утилизируется на производство пара (а далее электричества или идет на силовые установки), а также на отопление домов. Типичные уравнения для процессов горения таковы:
а) древесина (целлюлоза):
(C6h20O5)n + 6nO2® 6nCO2 + 5nh3O + тепловая энергия
б) нефть или газ (бензин C8h28 или природный газ Ch5):
2C8h28 + 25O2® 16CO2 + 18h3O + тепловая энергия
Ch5 + 2O2® CO2 + 2h3O + тепловая энергия
в) спирт:
C2H5OH + 3O2® 2CO2 + 3h3O + тепловая энергия
г) углерод (каменный или древесный уголь, кокс):
2C + O2® 2CO + тепловая энергия
2CO + O2® 2CO2 + тепловая энергия
Горению подвержены также ряд C-, H-, N-, O-содержащих соединений с высоким запасом энергии. Кислород для окисления может использоваться не только из атмосферы (как в предыдущих реакциях), но и из самого вещества. Для инициирования реакции достаточно небольшого активирования реакции, например удара или встряски. При этих реакциях продуктами горения также являются оксиды, но все они газообразны и быстро расширяются при высокой конечной температуре процесса. Поэтому такие вещества являются взрывчатыми. Примерами взрывчатых веществ служат тринитроглицерин (или нитроглицерин) C3H5(NO3)3 и тринитротолуол (или ТНТ) C7H5(NO2)3. См. также ХИМИЧЕСКОЕ И БИОЛОГИЧЕСКОЕ ОРУЖИЕ.
Оксиды металлов или неметаллов с низшими степенями окисления элемента реагируют с кислородом с образованием оксидов высоких степеней окисления этого элемента:
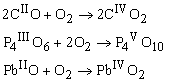
Оксиды природные, полученные из руд или синтезированные, служат сырьем для получения многих важных металлов, например, железа из Fe2O3 (гематит) и Fe3O4 (магнетит), алюминия из Al2O3 (глинозем), магния из MgO (магнезия). Оксиды легких металлов используются в химической промышленности для получения щелочей или оснований. Пероксид калия KO2 находит необычное применение, так как в присутствии влаги и в результате реакции с ней выделяет кислород. Поэтому KO2 применяют в респираторах для получения кислорода. Влага из выдыхаемого воздуха выделяет в респираторе кислород, а KOH поглощает CO2. Получение оксида CaO и гидроксида кальция Ca(OH)2 – многотоннажное производство в технологии керамики и цемента.
Вода (оксид водорода).
Важность воды h3O как в лабораторной практике для химических реакций, так и в процессах жизнедеятельности требует особого рассмотрения этого вещества (см. также ВОДОРОД; ВОДА, ЛЕД И ПАР). Как уже упоминалось, при прямом взаимодействии кислорода и водорода в условиях, например, искрового разряда происходят взрыв и образование воды, при этом выделяется 143 кДж/(моль h3O).
Молекула воды имеет почти тетраэдрическое строение, угол H–O–H равен 104°30ў. Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
Из-за высокой прочности связей H–O водород с трудом отщепляется от кислорода и вода проявляет очень слабые кислотные свойства. Многие свойства воды определяются распределением зарядов. Например, молекула воды образует с ионом металла гидрат:
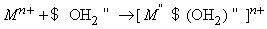
Одну электронную пару вода отдает акцептору, которым может быть H+:
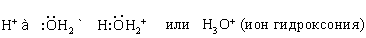
Молекулы воды связываются друг с другом в большие агрегаты (h3O)x слабыми водородными связями (энергия связи ~21 кДж)
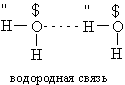
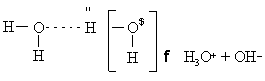
Вода в такой системе водородных связей подвергается диссоциации в очень слабой степени, достигающей концентрации 10–7 моль/л. Очевидно, расщепление связи, показанное квадратными скобками, приводит к образованию гидроксид-иона OH– и иона гидроксония h4O+:
Пероксид водорода.
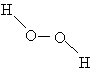
Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода h3O2. Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
Пероксид водорода получают по реакции пероксида металла с кислотой
BaO2 + h3SO4® BaSO4 + h3O2
либо разложением пероксодисерной кислоты h3S2O8, которую получают электролитически:
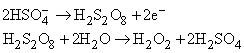
Концентрированный раствор h3O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями. h3O2 добавляют ко многим кислотам и оксидам для получения соединений, аналогичных гидратам. В присутствии сильного окислителя (например, MnO2 или MnO4–) h3O2 окисляется, выделяя кислород и воду.
Оксоанионы и оксокатионы
– кислородсодержащие частицы, имеющие остаточный отрицательный (оксоанионы) или остаточный положительный (оксокатионы) заряд. Ион O2– имеет высокое сродство (высокую реакционную способность) к положительно заряженным частицам типа H+. Простейшим представителем стабильных оксоанионов является гидроксид-ион OH–. Это объясняет неустойчивость атомов с высокой зарядовой плотностью и их частичную стабилизацию в результате присоединения частицы с положительным зарядом. Поэтому при действии активного металла (или его оксида) на воду образуется OH–, а не O2–:
2Na + 2h3O ® 2Na+ + 2OH– + h3
или
Na2O + h3O ® 2Na+ + 2OH–
Более сложные оксоанионы образуются из кислорода с ионом металла или неметаллической частицей, имеющей большой положительный заряд, в результате получается низкозаряженная частица, обладающая большей стабильностью, например:
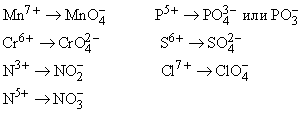
Озон.
Кроме атомарного кислорода O и двухатомной молекулы O2 существует третья форма кислорода – озон O3, содержащий три кислородных атома. Все три формы являются аллотропными модификациями. Озон образуется при пропускании тихого электрического разряда через сухой кислород: 3O2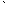 2O3.
2O3.
При этом образуется несколько процентов озона. Реакция катализируется ионами металлов. Озон имеет острый резкий запах, который можно обнаружить вблизи работающих электрических машин или в окрестности атмосферного электрического разряда. Газ имеет голубоватый цвет и конденсируется при –112° С в темноголубую жидкость, а при –193° С образуется темнопурпуровая твердая фаза. Жидкий озон слаборастворим в жидком кислороде, а в 100 г воды при 0° С растворяется 49 см3 O3. По химическим свойствам озон намного активнее кислорода и по окислительным свойствам уступает только O, F2 и OF2 (дифториду кислорода). При обычном окислении образуются оксид и молекулярный кислород O2. При действии озона на активные металлы в особых условиях образуются озониды состава K+O3–. Озон получают в промышленности для специальных целей, он является хорошим дезинфицирующим средством и используется для очистки воды и как отбеливатель, улучшает состояние атмосферы в закрытых системах, дезинфицирует предметы и пищу, ускоряет созревание зерна и фруктов. В химической лаборатории часто используют озонатор для получения озона, необходимого для некоторых методов химического анализа и синтеза. Каучук легко разрушается даже под действием малых концентраций озона. В некоторых промышленных городах значительная концентрация озона в воздухе приводит к быстрой порче резиновых изделий, если они не защищены антиоксидантами. Озон очень токсичен. Постоянное вдыхание воздуха даже с очень низкими концентрациями озона вызывает головную боль, тошноту и другие неприятные состояния.
www.krugosvet.ru