Справочник химика 21. Горение азота
Горение I азота - Справочник химика 21
Горение азота не распространяется по всей массе газов, как в смеси водорода с кислородом появившееся пламя, если прекратить пропускание искр, мгновенно гаснет. Это объясняется тем, что при горении азота теплота не выделяется, а поглощается пламя наблюдается до, тех пор, пока извне (от электрических искр) притекает необходимая для его поддержания теплота. [c.116]
Очень возможно, — сказал он однажды, демонстрируя горение азота>, — что этот скромный опыт приведет когда-либо к развитию большой промышленности, предназначенной решить великую проблему добывания пиш,и . [c.323]Желтая дуга — это пламя азота, соединяющегося с кислородом в окись азота. Так как реакция сгорания азота происходит с поглощением тепла, горение азота происходит лишь в зоне электрической искры и мгновенно прекращается, как только выключается ток. [c.441]
В определение высшей теплоты сгорания необходимо вводить еще две поправки — на горение азота и серы. Необходимость таких поправок сводится к тому, что оба эти элемента при сжигании топлива в промышленных условиях и в бомбе в атмосфере сжатого кислорода ведут себя по-разному, в результате чего выделяется различное количество тепла. [c.25]
При засосе воздуха происходит частичное горение азота N2 + Оз 2N0 + 43 600 ккал. [c.331]
В приведенных реакциях горения окислителем является сухой воздух, состоящий примерно по объему из 21% кислорода и 79% азота,, и поэтому продукты сгорания балластируются азотом. При использовании в качестве окислителя чистого сухого кислорода балласт будет отсутствовать. В дальнейшем для простоты мы будем писать реакции горения без балластного азота, не забывая учитывать его при расчете горения. Азот только в условиях высоких температур (выше 2 000°С) начинает связываться с кислородом, образуя закись азота N0, и поэтому в расчетах горения азот рассматривается как инертный газ. [c.46]
При полном горении продукты сгорания могут состоять только из инертных, не способных к дальнейшему окислению газов. Так, окись углерода при полном сгорании превращается в инертный углекислый газ, водород — в инертный водяной пар, метан и другие углеводороды — в то и другое. Следовательно, при полном сгорании любого газа образуются инертные газы — водяной пар и углекислый газ. Но вместе с воздухом, подаваемым в топку, поступает не принимающий участия в горении азот. Он смешивается с водяным паром и углекислым газом и входит в состав дымовых газов. В состав дымовых газов входят также балластные газы и кислород, поступивший в топку с избыточным воздухом. [c.36]
Азотсодержащие продукты разложения и горения. Азот, содержащийся в полимере, может образовать следующие газообразные продукты разложения и горения молекулярный азот N2, аммиак ЫНз, окислы азота N0 и N02, цианид водорода H N, амины Н—СНг—N1 2 табл. I). [c.14]
В процессе горения азот топлива переходит в дымовые газы в виде молекулярного азота N2, а при высокой температуре в топках и печах частично окисляется с образованием весьма вредных для здоровья окислов азота. [c.21]
Продукты полного горения топлива состоят из углекислого газа, сернистого газа, паров воды, избыточного кислорода и азота. При неполном горении в продуктах горения могут также присутствовать окись углерода, углеводороды, водород и элементарный углерод — сажа. [c.110]
Общее содержание азота и избыточного кислорода в продуктах горения [c.111]
Продукты сгорания топлива. Процессы горения играют главную роль в образовании загрязнений атмосферы. В качестве топлива наиболее широко применяют нефть, уголь, природный и попутный газы, в некоторых странах — древесину. Основные продукты сгорания топлива — диоксид и оксид углерода. В результате окисления примесей, содержащихся в топливе, образуются также оксиды серы и азота. [c.14]
Описан взрыв кислородного баллона, происшедший при затягивании вентиля иа заполненном кислородом баллоне. Взрывом баллон был разрушен на множество мелких осколков. Крупные осколки от нижней части баллона, а также находившиеся на расстоянии нескольких метров предметы, были забрызганы маслом. При проверке редукторов других баллонов, эксплуатируемых на этом предприятии, на них была обнаружена масляная жидкость, аналогичная той, которая была разбрызгана на месте взорвавшегося баллона. Полагают, что причиной взрыва было горение масла, находившегося внутри баллона и баллонного вентиля. Масло в баллон попало с азотом, которым ранее заполнялся взорвавшийся баллон. Поэтому следует категорически запретить использование кислородных баллонов для других газов или жидкостей. Прп использовании же кислородных баллонов для других целей их не следует возвращать для заполнения кислородом. [c.379]
Обычно упрощения заключаются в том, что в расчет не принимается содержание примесей в исходных веществах, участвующих в химических превращениях, округляются содержания компонентов, стехиометрические соотношения и т. д. Например, довольно часто в ориентировочных стехиометрических расчетах допускается, что воздух состоит из 1 части (объемн.) кислорода и 4 частей (объемн.) азота, т. е. мольное отношение кислорода и азота равно 1 4 (вместо 1 3,76). Это упрощение дает возможность быстро, но приближенно оценить ход процессов окисления и горения. [c.123]
Дополнительные данные о пожаро- и взрывоопасности веществ приведены ниже. Минимальное взрывоопасное содержание кислорода при разбавлении азотом смесей окиси углерода с воздухом 6,5% (об.), двуокисью углерода 9,8%, максимальная скорость горения водорода 2,67 м/с. [c.26]
Метан горюч и взрывоопасен, минимальная энергия зажигания 0,28 мДж. Он горит бледным синеватым пламенем, максимальная нормальная скорость горения 0,338 м/с. Минимальное взрывоопасное содержание кислорода при разбавлении метано-воздушных смесей (в %об.) двуокисью углерода 15,6 азотом 12,8 гелием 12,7 аргоном 10,1. Максимальное взрывоопасное содержание кислорода при разбавлении аммиачно-воздушных смесей азотом 16,27о (об.). [c.27]
Окись азота, которая образуется за счет связывания азота при горении, также присутствует в небольших количествах в выхлопном газе [11, 12]. Наличие несгоревшего остатка можно объяснить возможностью реакции окиси углерода с водой по уравнению [c.389]
Противопожарный азот необходимо подавать к основанию горящей струи. Азот разбавляет воздух, понижая концентрацию в нем кислорода и способствуя, таким образом, прекращению горения. [c.146]
Для того чтобы избежать выделения азота из продуктов реакции, используют чистый кислород, что несколько удорожает процесс. Водяной газ по этому методу получают в две ступени сначала быстро проводят реакцию полного горения, затем более медленно — окисление избытка метана двуокисью углерода и парами воды, образовавшимися в первой стадии [c.212]
Повышение температуры окисления в пустотелой колонне сопровождается увеличением температуры в ее газовом пространстве, поскольку выходящие из. барботажного слоя газы имеют более высокую температуру. Капельки жидкости, выносимые из слоя жидкости газом и частично оседающие на стенках газового пространства, также имеют более высокую температуру. Это создает условия для ускоренного закоксовывания внутренней поверхности газового пространства, горения коксовых отложений или окисления органических паров в газовом пространстве. В результате температура верха растет с неконтролируемой скоростью — до 320 °С и выше. Для обеспечения стабильности и безопасности производства битумов при температурах окисления выше 280—290 °С в газовое пространство колонн подают инертный газ (азот [75] или- водяной пар [44, 83]. [c.61]
На битумных установках, вырабатывающих окисленные битумы, выделяются отработанные газы. Для их термического обезвреживания используют специальные печи. На Киришском НПЗ, например, используется трехкамерная печь (рис. 88) с внутренним сечением 1,3x2,1 м и длиной 9 м. Печь рассчитана на сжигание 6000 м /ч газов, С целью интенсификации горения в печи предложено установить карборундовый муфель, температура наружной поверхности которого достигает 1000°С, что способствует восполнению дефицита тепла, необходимого для воспламенения газов. Состав продуктов сгорания на выходе из печи следующий 9,6% (об.) диоксида углерода и диоксида серы, 3% (об.) кислорода, 87,4% (об.) азота и отсутствие оксида углерода [210]. [c.143]
Горение большинства веществ прекращается при снижении содержания кислорода в окружающей среде (азоте) до 12—16% [284] (или 11,0—13,5% [285]), а этилена и бутадиена — 10,0— 10,4% [286]. Исключение составляют вещества, обладающие широкой областью воспламенения, — водород, ацетилен, оксид углерода для них эта величина не превышает 5%, но в газах битумного производства они не присутствуют или присутствуют. практически в незначительных количествах. При хранении битумов в резервуарах пожаробезопасное содержание кислорода зависит от природы инертного газа (азота, водяного пара, диоксида углерода), т. е. флегматизатора, и составляет от 10 до 15% [209]. Эффективность действия,флегматизатора зависит от его свойств и пропорциональна отнощению теплоемкости к теплопроводности [287]. [c.176]
Закись и окись азота, как показали опыты, будучи воспламеняемыми, не инициируют горение даже в случае образования суспензии каждой из этих окисей с жидким кислородом. [c.27]
К сожалению, опытов со смесями, содержащими 20% кислорода, не было проведено. Из других опытов по горению органических материалов в азото-кислородных смесях известно, что увеличение содержания кислорода в воздухе всего на 5—10% значительно повышает скорость горения. В ряде же случаев необходимо иметь данные о горении пленок масла П-28 в воздухе. [c.81]
Так, нацример, применение обогащенного кислородом ьоздуха в металлургии позволяет улучшить качество выплавляемого металла, резко повысить производительность цехов, не гррибегая к сооружению новых печей, и одновременно уменьшить расход топлива. В самом деле, новышение содержания кислорода в дутье интенсифицирует технологический процесс благодаря возможности вести работу при более высокой температуре и меньшем разбавлении продуктов горения азотом, но по этой же при- [c.132]
Однако идеи М. В. Ломоносова не были изестны западным ученым, так как были высказаны либо в письмах Л. Эйлеру, либо опубликованы в России на русском языке. Поэтому честь открытия первого закона химии — закона сохранения массы — обычно приписывается другому великому химику А. Л. Лавуазье (1743-1794). Взвешивая различные вещества до и после прокаливания их на воздухе, он много раз убеждался в неизменности суммарной массы всех участников реакции. С помощью взвешиваний он доказал, что воздух и вода не являются элементами. Воздух состоит из одной части газа, поддерживающего горение, названного им кислородом, и четырех частей газа, не поддерживающего горения (азота), а вода образуется при горении водорода в кислороде. Лавуазье также ввел в обиход современную номенклатуру химических соединений. [c.10]
Рис 42. Горение азота в кис.чороде [c.116]
Монтежю. Монтежю представляют собой аппараты, служащие для перемещения жидкости с помощью давления газа, чаще всего воздуха. Огнеопасные жидкости передаются с помощью давления газов, не поддерживающих горение,—азота или углекислоты. В качестве монтежю может быть применен любой сосуд, выдерживающий давление сжатого газа до 2—З.атл. Чаще всего монтежю представляют собой стальные вертикальные или горизонтальные цилиндрические аппараты той же конструкции как и хранилища для жидкостей, изображенные на рис. 16 и 17 (см. стр. 107). Нередко хранилище исгользуют как монтежю. [c.111]
В конце 1774 года Пристли посетил Париж и встречался со знаменитым французским ученым Лавуазье. Его описание опытов но получению и изучению свойств кислорода побудило Лавуазье заняться более детальным исследованием этого газа. В 1777 году Лавуазье изучал связь кислорода с воздухом и роль кислорода в процессах горения. Он нагревал ртуть в реторте, длинный конец которой проходил через воду и заканчивался резервуаром для собирания газа (рис. 62). После двенадцатидневного нагревания он заметил, что объем воздуха в сосуде уменьшился на одну пятую часть, а ртуть покрылась слоем красной окиси ртути. В оставшемся в сосуде воздухе мышь задыхалась, а свеча гасла. В результате более энергичного нагревания красной окиси ртути выделялся газ, объем которого точно соответствовал потерянному в предшествовавшем двенадцатидневном эксперименте. Этот газ, свойства которого совпадали со свойствами открытого Пристли дефлогистированного воздуха , Лавуазье назвал кислородом, а остававшийся воздух, не поддерживавший горения,— азотом. Благодаря Лавуазье были получены отчетливые представления о процессах горения ему принадлежит множество изобретений и открытий в области химии. Роль Лавуазье в раз- [c.83]
Второй газ, составляющий четыре пятых воздуха ( флогисти> рованный воздух Резерфорда), был признан совершенно самостоятельным веществом. Этот газ не поддерживал горения, мыши в нем гибли. Лавуазье назвал его азотом — безжизненным. Позднее азот был переименован в нитроген, что в переводе с латинского оз- [c.48]
Гидропероксидный радикал почти равномерно распределен на высоте 5—30 км в концентрации 10 —10 см . Он является важнейшей промежуточной частицей в процессах горения и образования фотохимического смога, активно участвует в окислении моноокснда азота. [c.30]
Исследование поровой характеристики проведено на поро51 метре Карло-Эрба (модель 70). Создаваемое в аппарате давление от 0,1 до 196 МПа позволяет определять объем пор радиусом от 3,75 до 7500 нм. Удельная поверхность определена методом тепловой десо ции азота хроматографически. Содержание углерода и серы на катализаторе определялось сжиганием и оценкой количества по продуктам горения, ванадия, никеля, железа - химическими методами. Проба катализатора на анализ отбиралась из верхней и нижней части слоя. Подача водородно-сырьевой смеси осуществлялась восходящим потоком. [c.132]
Нитрофоска представляет собой продукт светло-серого цвета с температурой теплового разложения 198—200 °С. Разложение нитрофоски в изотермических условиях при 170—240 °С протекает с автокаталитическим ускорением (после некоторого индукционного периода скорость разложения резко возрастает). В период автокаталптического разложения из нитрофоски выделяется 35— 40% газообразных продуктов. При горении из нитрофоски в газовую фазу удаляется 94—96% азота, 40% хлора и 30% фосфора нитраты и Nh5 I разлагаются полностью. Температура самовоспламенения аэровзвеси нитрофоски влажностью 0,4% для фракции 0,5—0,25 мм составляет 550—540 С и для фракции 0,25 мм она равна 380—390°С. [c.57]
Во вре.чя работы был обнаружен резкий стук а компрессоре сжатия азотоводородной смеси (АВС), поэтому он был аварийно остановлен. Избыток АБС, как предусмотрено проектом, через регулирующий клапан был сброшен на факел. В это же время пронзошел взрыв на факельной установке с отрывом конусной части куба и загоранием газа в месте разрушения. Для ликвидации аварии снизили давление с иоследующи.м полным прекращением подачи АВС, разгрузили агрегат, закрыли задвижки с агрегата на факел и подали азот в линию факела, В результате этих мер горение было прекращено. [c.210]
Особые условия должны соблюдаться при сжигании на факелах ацетилена. При сжигании ацетилена в среде воздуха скорость горения этого газа составляет около 3 м/с. Поэтому считают, что принимаемая скорость движения газа в трубе 5— 8 м/с соответствует условиям безопасного горения. Чтобы предотвратить образование застойных зон горючего газа в стволе периодически работающей факельной установки, его следует продувать азотом. В необходимых случаях перед факельным стволом на газопроводе устанавливают огнепреградители. Это позволяет предотвратить распространение пламени в факельные трубопроводы через ствол. Предварительно огнепреградители должны быть испытаны если при испытанни не было проскока пламени, то их можно устанавливать на трубопроводе. Огнепреградители обычно устанавливают в тех случаях, когда могут образоваться горючие смеси с нормальной скоростью распространения пламени с 0,45 м/с и для локализации взрывного распада ацетилена. [c.221]
Превращения энергии при химических реакциях. Химические реакции протекают с выделением или с поглощением энергии. Обычно эта энергия выделяется или поглощается в виде теплоты. Так, горение, соединение металлов с серой или с хлором, нейтрализация кислот щелочами сопровождаются выделением значительных количеств теплоты. Наоборот, такие реакции как разложение карбоната кальция, образование оксида азота(II) из азота и кислорода требуют для своего протекаиия ненрерывного притока теплоты извне и тотчас же приостанавливаются, если нагревание прекращается. Ясно, что этп реакции протекают с поглощением теплоты. [c.166]
Наконец, к случайным примесям воздуха относятся такие вещества, как сероводород и аммиак, выделяющиеся при гниении органических остатков диоксид серы SO2, получающийся прн обжиге сернистых руд или при горении угля, содержащгго сору оксиды азота, образующиеся при электрических разрядах а атмосфере, и т. п. Эти примеси обычно встречаются в ничтожных количествах и постоянно удаляются из воздуха, растворяясь в дождевой воде. [c.375]
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты как и при горении в воздухе, по процесс протекает быстрее и выделяющаяся теплота пе тратится на нагревание азота воздуха . тоэтому температура горения в кислороде значительно выше, чем в воздухе. [c.377]
Некоторая же часть азота всегда выделяется при гниении г свободном виде в атмосферу. Свободный азот выделяется также при горении органических веществ, при сжигании дров, камениогс угля, торфа. Кроме того, существуют бактерии, которые при недостаточном доступе воздуха могут отнимать кислород от нитратов, разрушая их с выделением свободного азота. Деятельность этих д с и и т р и ф и ц и р у ю щ н X бактерий приводит к тому, что часть азота из доступной для зеленых расте1[ий формы (нитраты) переходит в недоступную (свободный азот). Таким образом, далеко не весь азот, входивший в состав погибших растении, возврантается обратно в почву часть его постепенно выделяется в свободном виде. [c.416]
В последующие годы Генри Кавендиш открыл водород (1766), Да-ниель Резерфорд-азот (1772), а Джозеф Пристли изобрел насыщенную углекислым газом воду и открыл моноксид азота ( веселящий газ ), диоксид азота, моноксид углерода, диоксид серы, хлористый водород, аммиак и кислород. В 1781 г. Кавендиш доказал, что вода состоит только из водорода и кислорода, после того как он наблюдал, как Пристли взорвал эти два газа (Пристли впоследствии вспоминал об этом как о случайном эксперименте для развлечения нескольких философствующих друзей ). Открытие кислорода (рис. 6-2) заставило Антуана Лавуазье отказаться от господствовавшей в химии XVIII в. флогистонной теории горения. История крушения этой теории показывает важность количественных измерений в химии. [c.272]
chem21.info
Образование оксидов азота при горении.
Изучение механизма образования оксидов азота получило значительное развитие в последние три десятилетия благодаря усилиям отечественных и зарубежных ученых. Однако, несмотря на это, механизм образования оксидов азота при горении до сих пор не изучен в достаточной мере. Причиной этого является сложность химической кинетики процесса окисления азота, связанной с химической физикой самого горения.
Согласно современным представлениям существует три основных группы источников образования оксида азота при горении: «термические», «быстрые» и «топливные» NO. 

Образование «термических» оксидов азота. Установлено, что при горении топлива под воздействием высоких температур происходит окисление атмосферного азота свободным кислородом. Образующиеся при этом оксиды азота NO и NO2 получили название «термических». Причем оксид азота NO составляет около 95% от суммы оксидов азота.
Суммарная реакция образования NO записывается в виде
N2 + O2 = 2NO – 180.2 кДж/моль
Для равновесного количества оксидов азота в продуктах сгорания получено уравнение
[CNO] = 4,6 · (CO2 · CN2 · exp[-21500/(R · T)])0,5
Таким образом, концентрация термических оксидов азота определяется, главным образом, максимальной температурой в зоне горения, отношением времени реакции ко времени установления равновесия (т.е. времени пребывания продуктов сгорания при этой температуре) и концентрацией свободного радикала кислорода.
Образование «быстрых» оксидов азота. Скорость образования «быстрых» NO выше на порядок скорости образования «термических» NO, в связи с чем они и получили свое название.
Процесс образования «быстрых» оксидов азота начинается у передней границы фронта пламени в области температур около 1000 К.
Образование «топливных» оксидов азота. При сжигании топлива, содержащего химически связанный азот, образуются «топливные» NO.
Механизм образования «топливных» NO полностью еще не разработан. Имеющиеся результаты исследований показывают на наличие радикалов HCN, CN, NH, Nh3 и OH в зоне горения азотосодержащего топлива. Это дало основание предполагать, что азот топлива вначале переходит в промежуточные соединения – радикалы, а затем частично окисляется до оксидов азота.
Образование «топливных» оксидов азота происходит при относительно низких температурах, выход NOx слабо зависит от температуры при Т >1200К. Доля превращения азота топлива в NOx составляет 20-30%.
Существование нескольких механизмов образования оксидов азота при сжигании топлива значительно осложняет разработку методов снижения их концентрации в продуктах сгорания.
Несмотря на многообразие факторов, влияющих на образование оксидов азота в реальных условиях горения, в качестве основных выделяются температура факела, концентрация свободного кислорода и время пребывания в зоне реагирования.
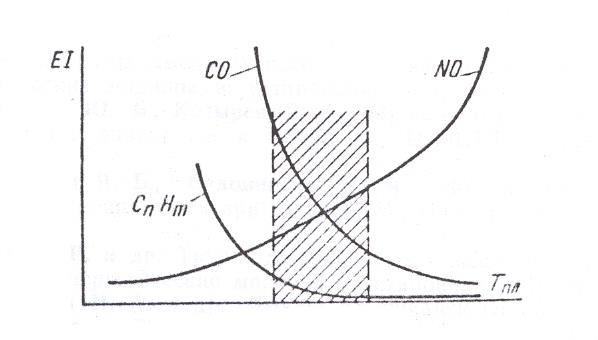
Рис.1 Зависимость эмиссии токсичных веществ EI от температуры горения Тпл
Таким образом, с точки зрения снижения эмиссии NOx желательно уменьшать температуру горения и время пребывания продуктов сгорания при этой температуре. Однако, как видно из рис.1, они должны быть достаточными для получения минимального выхода CnHm и возможно полного завершения окисления С и СО в СО2.
Из сказанного выше следует, что задача улучшения показателей токсичности современных ГТД должна решаться так, чтобы необходимому радикальному уменьшению эмиссии NOx не сопутствовало значительное увеличение эмиссии СО, С, CnHm. Теоретические исследования показали, что если ориентироваться на перспективные Федеральные нормы США, то должна быть температура горения 1922 К. Отсюда типичные значения температур воздуха перед камерой сгорания современного регенеративного ГТД на холостом ходу ~500 К и на номинальном режиме ~850 К, а коэффициент избытка воздуха в горючей смеси должен быть не менее 1,7 и 2 соответственно.
Способы уменьшения выбросов NOx за камерой сгорания ГТД.
Для существующих конструкций камер сгорания (КС) уменьшить выход NOx можно следующими мероприятиями.
1. Увеличением коэффициента избытка воздуха αг в зоне горения. Дополнительная масса воздуха будет способствовать снижению уровня температур в зоне горения и уменьшению времени пребывания газов в ней путем ускоренного охлаждения продуктов сгорания. Для этого необходимо, прежде всего, чтобы в окрестностях каждой горящей капли топлива было больше воздуха, чем это требуется, т.е. чтобы зона горения была повсеместно обеднена. И, наконец, быстрое охлаждение невозможно без достаточно развитой турбулентности, масштаб которой должен быть увязан с распределением топлива для исключения уноса капель за пределы зоны горения. Поскольку факел распыленного топлива обычно полидесперсен и распределение капель в нем подчинено вероятностным факторам, обеспечение этих условий даже на одном режиме камеры – задача довольно сложная. Отсутствие четких стационарных границ у факела не позволяет организовать своевременного охлаждения продуктов сгорания. Стремление уменьшить образование NOx до приемлемых величин, как правило, наталкивается на существенное ухудшение полноты сгорания со всеми вытекающими из этого последствиями. Время пребывания продуктов сгорания при высоких локальных температурах уменьшается с выравниванием структуры факела, но даже при размере капель 1 мкм образование NOx снижается не слишком много. Таким образом, эффективность этого мероприятия будет достигнута, если не ухудшатся другие характеристики работы камеры.
2. Улучшением распыливания топлива и перемешивания его с воздухом. Оптимальный вариант – получение гомогенной топливовоздушной смеси и введение ее в зону горения камеры. В результате из времени пребывания в зоне высоких температур исключается время смесеобразования, что уменьшает выход NOx. Предварительное смесеобразование уменьшает размеры зоны горения и КС. Достигнуть этого можно, например, установкой воздушных форсунок. Опытом установлено, что выход NOx может снизиться более чем на 25-35% в зависимости от конструктивных и рабочих параметров форсунки и камеры. В ряде случаев положительный эффект был получен простым увеличением числа форсунок и постановкой дополнительных завихрителей, улучшающих перемешивание потоков. Очевидно, что в результате таких мероприятий можно понизить выход и других вредных выбросов, повышая этим полноту сгорания топлива. Однако чрезмерная гомогенизация смеси сокращает область устойчивой работы камеры.
3. Впрыскиванием воды (пара) или использованием топливо-водяной смеси. Кроме возможного каталитического эффекта происходит охлаждение зоны горения. В отдельных случаях выход NOx можно уменьшить на 20-30%.
Существует двоякое отношение к данному методу снижения выбросов NOx. С одной стороны, как видно из работы [5], подача пара действительно оказывает существенное влияние как на процесс горения, так и на кинетику образования окислов азота и окиси углерода. Во-первых, пар понижает максимум температур в ядре факела, во-вторых, снижение температуры приводит к почти двукратному уменьшению концентрации окислов азота на выходе из рабочего участка. Причем падение максимума температуры незначительно по сравнению с концентрацией окислов азота. Кроме того, ввод пара в зону горения приводит к сокращению участка, соответствующего процессу горения. В соответствии с этим происходит уменьшение концентрации образующейся окиси углерода в конце рабочего участка примерно в 2-3 раза. Следует отметить, что наличие пара приводит к сокращению длины факела и более полному выгоранию топлива.
С другой стороны существует точка зрения, что с вводом воды в воздух, т.е. при повышенном влагосодержании, полнота горения снижается, пределы стабилизации сужаются. Результаты исследований, проведенных в работе [6], показывают, что увеличение влагосодержания d действительно приводит к сужению области устойчивого горения, заметному уменьшению турбулентной скорости распространения пламени, замедленному процессу выгорания (т.е. уменьшению полноты сгорания топлива) и, как результат, росту протяженности зоны горения.
Наверное, следует связывать это с не до конца изученными вопросами, касающихся вообще кинетики реакций горения и образования NO, а также механизмов влияния влагосодержания атмосферного воздуха на горение.
Кроме того, надо согласиться, что рассмотренный способ снижения выбросов сопряжен с очевидными эксплуатационными неудобствами и требует очень больших расходов жидкости, что отрицательно сказывается на дальности и продолжительности полета самолета.
4. Использование конструкционных материалов-катализаторов. Интенсификация процессов горения, повышение его надежности и устойчивости могут позволить без отрицательных последствий понизить среднюю эффективную температуру в зоне горения и даже уменьшить ее размеры, сокращая время пребывания газов в зоне высоких температур, что в итоге обуславливает снижение выхода NOx. Из катализатора выполняются жаровые трубы (ЖТ) или их части, а также специальные пористые вставки. Как катализатор используют керамические материалы, оксиды хрома, кобальта, редкоземельных элементов (цезий, лантан и др.).
5. Введением специальных присадок в топливо, которые препятствуют образованию оксидов азота, способствуют их распаду на исходные вещества или снижают температуру пламени, приводит к уменьшению образования NOx. Так, например, добавка 0.3 % кобальта или меди уменьшает эмиссию оксидов азота на 20-25%. Добавка карбоната натрия или лития также снижает выход NOx.
Перечисленные наиболее известные мероприятия по предупреждению выбросов NOx в существующих КС иногда сильно усложняют и даже изменяют конструкцию камеры и ее основных узлов и систем. Заметное уменьшение вредных выбросов часто достигается не на всех режимах работы КС. На порядок можно снизить выбросы NOx, создавая специальные конструкции малотоксичных камер: гомогенной, гибридной, микрофакельной и др.
В гомогенной малотоксичной камере (рис. 2а) топливовоздушная смесь подготовляется вне зоны горения, например, в предкамере или в воздухоподводящих каналах, куда подается топливо. Обедненная гомогенная горючая смесь с αс≈1.5-1.7, сгорая в укороченной зоне горения при невысокой средней температуре (до 1970 К), дает очень малый выход NOx. Большим недостатком гомогенных камер вместе с опасностью самопроизвольного воспламенения смеси в подводящих каналах является узкая область устойчивых и экономичных режимов работы, так как стабилизация и эффективность процесса горения при значительных коэффициентах избытка воздуха резко ухудшается.
Для частичного устранения этих недостатков используют гибридные камеры (рис.2б). Здесь при обычной схеме организации процесса и конструкции форсунки создают надежный дежурный факел G’т, обеспечивающий стабилизацию пламени и выгорание основной массы топлива Gт, поступающей в виде обедненной гомогенной топливовоздушной смеси. Токсичность таких камер выше, чем гомогенных, но значительно меньше, чем обычной конструкции. Конечно, дополнительные объемы, где готовится горючая смесь, увеличивают размеры и массу установки и снижают пожарную безопасность работы.
Наиболее рационально использование микрофакельной схемы конструкций (рис.2в), где принцип организации эффективного процесса горения иной. Рассредоточение поверхности фронта пламени в виде множества микрофакелов по входному сечению зоны горения позволяет резко укоротить ее, сокращая время пребывания смеси в высокотемпературной области. Так, например, если в обычных камерах с вытянутым по длине зоны горения факелом среднее время пребывания в зоне составляет обычно 5-6 мс, то в этой камере оно в 2-3 раза меньше, в результате чего значительно сокращается выход оксидов азота.
При использовании микрофакельных устройств для надежной стабилизации пламени применяют небольшие участки фронтовых стабилизаторов, где подается несколько обогащенная смесь. Поскольку же общий объем камеры здесь не разделен на зоны горения и смешения и весь воздух подается через фронтовое устройство, коэффициенты избытка воздуха при горении будут повышенными, определяясь полным расходом воздуха. Образующаяся очень бедная смесь (αсм≈2÷3÷5) устойчиво сгорает за короткое время в микрофакельном фронте и дает минимальный выход токсичных компонентов при высокой полноте сгорания топлива. Значительные избытки воздуха в рабочем объеме позволяют получать малую токсичность газов даже при высоких (до 980-1080 К) температурах поступающего в камеру воздуха, что характерно для ГТД с регенератором или при наличии высоких степеней повышения давления в компрессоре. Рост температуры воздуха перед камерой улучшает подготовку и сам процесс выгорания горючей смеси.
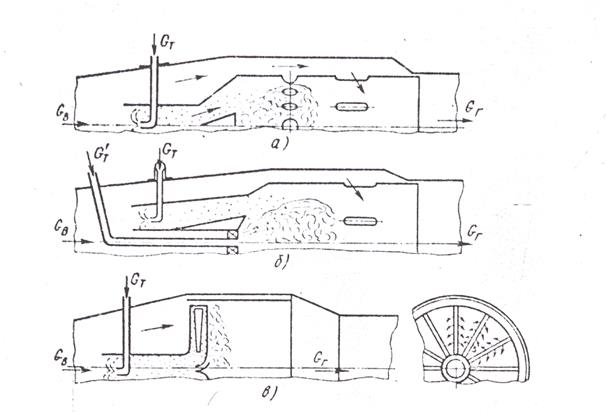
Рис.2 Схемы специальных малотоксичных камер сгорания
Примеры разработки и доводки малотоксичных КС. В первую очередь здесь нужно отметить применение форсунок различных модификаций: воздушно-механические, форсунки-стабилизаторы, чисто воздушные форсунки, комбинированные форсунки. Основная их цель – обеспечение хорошего качества распыливания, а, следовательно, и смесеобразования. Такие форсунки имеют значительные преимущества перед центробежными вследствие уменьшения всех вредных выбросов и особенно дымления. Единственным их недостатком можно назвать сужение границ срывных характеристик, так как излишняя гомогенизация и однородность смеси резко ухудшает устойчивость горения при значительном обеднении смеси.
Для повышения экономичности и снижения уровня токсичности уходящих газов авиационных ГТД, имеющих высокие степени повышения давления воздуха в компрессоре, было предложено использовать большое число модульных головок (по существу воздушных форсунок) в составе фронтового устройства КС, схема которой дана на рис.3а. Конструкция отдельного модуля показана на рис.3б. Модульная конструкция камеры – многогорелочная с хорошим предварительным смесеобразованием, причем большая масса воздуха идет непосредственно через фронт, определяя значительный коэффициент избытка воздуха αг>1.3÷1.5. Ее схема близка к схеме микрофакельного устройства. Такая камера может работать с низким уровнем вредных выбросов вследствие невысокой температуры в зоне горения и малого времени пребывания в ней: 1-2 мс вместо обычных 4-6 мс. Результаты экспериментального исследования модульной камеры показали пониженный уровень ее токсичности.
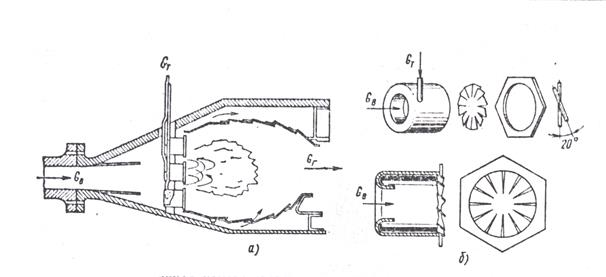
Рис. 3 Малотоксичная камера сгорания
Для улучшения характеристик работы, в основном по токсичности газов, кроме варианта конструкции с модульным фронтовым устройством были исследованы схемы двухзонных камер с последовательным расположением зон и с предварительным смешением топлива и воздуха (рис.4). В камере с последовательным расположением зон горения на режиме малой мощности в основную вторую зону топливо не поступает. Работает только первая зона горения, куда топливо подается центробежными форсунками, установленными в центре лопаточного завихрителя фронтового устройства. С повышением нагрузки топливо главными форсунками начинает подаваться и в основную зону. Организация последовательно двух зон горения помогает оптимизировать параметры работы, а вследствие этого и характеристики камеры на крайних по нагрузке режимах.
В обычных камерах сгорания с одной зоной горения высокая эффективность рабочего процесса, обеспечивается в области расчетного режима, а, например, при малых нагрузках качество горения резко ухудшается, полнота сгорания топлива уменьшается иногда до 88-93 %. Это происходит из-за резкого изменения состава (обеднения) смеси, ухудшения качества распыливания и перемешивания топлива вследствие снижения перепада давлений, при котором топливо вводится в воздушный поток зоны горения. При форсировке по нагрузке рабочего объема процесс горения улучшается, но существенно возрастает выход оксидов азота в связи с ростом температуры в зоне горения.
В двухзонной камере можно исключить некоторые из отмеченных недостатков. Последовательное расположение зон позволяет использовать зону малой мощности как дежурную и увеличить избыток воздуха в основной зоне, уменьшая тем самым выход NOx. Кроме того, подавая основное топливо в конце зоны малой мощности в поток выходящих из нее горячих газов, можно за счет предварительного подогрева и испарения сократить время пребывания смеси в основной высокотемпературной зоне, а тем самым и выход оксидов азота.
Эмиссия NOx в газах за этими камерами (модульной и двухзонной) уменьшилась более чем на 60% по сравнению с эмиссией в исходной серийной камере.
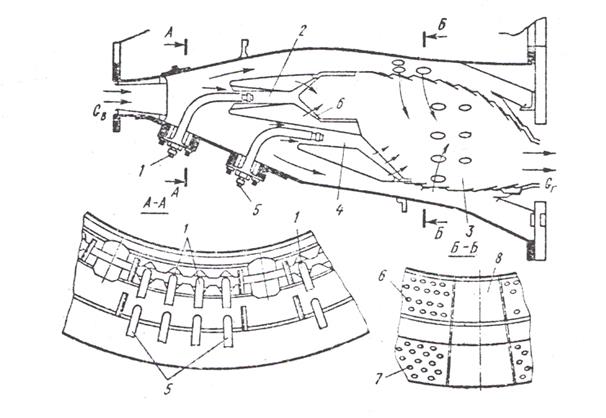
Рис.4 Схема малотоксичной камеры сгорания авиационного двигателя JT9D
Рассмотрим еще один возможный метод снижения выбросов NOx.
Влияние спирта и его добавок в реактивное топливо на выброс загрязняющих веществ авиационных ГТД.Несмотря на то, что спирты не удовлетворяют основным требованиям, предъявляемым к современным реактивным топливам, в основном из-за низкой энергоемкости, энергоплотности, плохой совместимости с материалами и смешиваемости с углеводородными топливами, гигроскопичности и т.д., они обладают положительными свойствами при сгорании: хорошей испаряемостью, невысокими вязкостью и поверхностным натяжением, низкой температурой пламени и отсутствием ароматических ядер в структуре химического соединения. Так, низкая температура пламени спиртов по сравнению с традиционными углеводородными топливами позволяет получить низкий уровень эмиссии NOx и снижение температуры стенки ЖТ, а низкие вязкость, поверхностное натяжение и температура кипения способствуют лучшему распылу и испарению топлива, что особенно важно на режимах запуска и малого газа, которые в основном определяют загрязнение атмосферы в зоне аэропорта оксидом углерода и несгоревшими углеводородами.
Обострение общей экологической ситуации и все возрастающие требования к ограничению выбросов загрязняющих веществ техническими устройствами вызывают определенный интерес к использованию спирта как топлива для ГТД. При этом полагается, что в будущем при использовании спирта, получаемого из угля, удастся добиться снижения его стоимости с существующим уровнем и что трудности, сопряженные с применением спиртов, не являются технически и экономически непреодолимыми.
В результате испытаний (проводившихся на малоразмерном газотурбинном стенде) этанола и реактивного топлива ТС-1 был подтвержден предполагаемый эффект спирта на понижение эмиссии оксидов азота NOx (см. табл.).
Эмиссии стендового малоразмерного ГТД и КС двигателя CF6-80A
| Двигатель | Режим работы | Топливо | EICO | EICxHy | EINOx | SN |
| CF6-80A | Малый газ Режим набора высоты | Jet-A Метанол Jet-A Метанол | 28,3 11,6 0,8 0,7 | 1,88 1,26 0,17 0,06 | 3,5 0,5 30,0 2,3 | 3,6 0,4 6,8 2,0 |
| Cтендовый малоразмерный ГТД | Имитация малого газа (Р*к..пр.=0,165) Имитация максимального режима (Р*к..пр.=0,25) | ТС-1 Этанол ТС-1 Этанол | 1,9 0,6 2,3 0,7 | 7,5 1,0 7,5 1,2 |
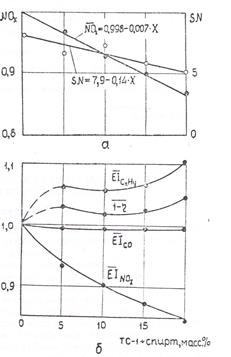
Рис.5 Изменение эмиссии ГТД при использовании спирта (этанола) в качестве добавки к основному топливу ТС-1: а – максимальный режим; б – малый газ
Следует заметить, что полученные результаты снижения эмиссии хорошо совпадают с результатами испытаний метанола в отсеке КС двигателя CF6-80А, несмотря на разный уровень термодинамических параметров этого двигателя и стендового ГТД.
В целом представленные результаты свидетельствуют о том, что при использовании спирта (метанола или этанола) в качестве топлива для ГТД можно уменьшить эмиссию оксидов азота в 3-5 раз при одновременном снижении числа дымности на 3-6 единиц.
Использование спирта в качестве добавки к реактивному топливу ТС-1 также уменьшает эмиссию NOx и дымность (рис.5), однако на режиме малого газа возможно и падение полноты сгорания топливной смеси за счет увеличения эмиссии несгоревших углеводородов. По всей вероятности, это связано с тем, что добавки спирта, понижая температуру пламени, замедляют испарение основных керосиновых фракций и кинетические процессы.
В заключении следует отметить, что при использовании спиртов в качестве основного топлива для ГТД и смесей спиртов с углеводородными топливами можно существенно снизить эмиссию оксидов азота и дымление двигателя при примерном сохранении уровня эмиссии оксида углерода и несгоревших углеводородов.
Выводы:
1. Основными факторами, влияющими на образование оксидов азота в реальных условиях горения, являются температура горения, концентрация свободного кислорода и время пребывания в зоне реагирования.
2. Уменьшение выше следующих факторов, ведущее к снижению выбросов NOx, можно добиться путем увеличения коэффициента избытка воздуха, улучшения качества распыливания, впрыском воды (пара),использования конструкционных материалов-катализаторов и введения специальных присадок в топливо.
3. Сегодня к современным камерам сгорания предъявляются следующие требования: это должны быть компактные конструкции топливосжигающих устройств с высокой эффективностью рабочих процессов, использование которых экономически оправдано с точки зрения создания и эксплуатации. С учетом вышесказанного предложены схемы наиболее перспективных малотоксичных камер: микрофакельной, модульной и двухзонной.
4. Рассмотрен также метод снижения эмиссии NOx, суть которого заключается в применении спирта в качестве основного топлива и его добавок.
Список литературы:
- Пчёлкин Ю.М. «Камеры сгорания газотурбинного двигателя», стр.182-192;
- «О снижении токсичности газотурбинных двигателей», Автомобильная промышленность, 1977/№4;
- «Влияние спирта и его добавок в реактивное топливо на выброс загрязняющих веществ авиационных ГТД», Авиационная техника, 1988/№2;
- Исаев В.В. «Сокращение выбросов оксидов азота в промышленной энергетике», стр. 5-10;
- «Влияние паров воды на образование окислов азота в диффузионном турбулентном пламени пропана», Физика горения и взрыва, 1981/№4;
- «Влияние влажности воздуха на горение однородных смесей керосина и воздуха», Авиационная техника, 1984/№3;
- Миркин Б.М., Наумова Л.Г. Популярный экологический словарь, 2003г.;
- Энциклопедический словарь-справочник «Окружающая среда», 1999г.
Похожие статьи:
poznayka.org
» ГОРЕНИЕ ВОЗДУХА БЕЗ ТОПЛИВА
В 2000 году была разработана теория бестопливного горения /Андреев Е.И. и др. Естественная энергетика. – СПб: Нестор, 2000./.
Согласно этой теории воздух мог гореть самостоятельно, автономно – без топлива.
Рассмотрим один из парадоксов традиционной теории горения. Известно, что кислородный баллон взрывается при наличии следов масла или любых углеводородов на его вентиле. Ясно, что в данном случае, теплота реакции следов масла никогда не соответствует энергии взрыва кислорода.
В этом и заключается парадокс: мизерное количество углеводородов, и в то же время – огромная энергия взрыва кислорода. Получается, что кислород взрывается как бы с самим собой.
Молекула кислорода состоит из двух атомов, соединенных одним электроном. В то же время в чистом кислороде вследствие всегда имеющего место фазового перехода «молекулы — атомы» в любой момент времени есть небольшое количество атомов (ионов) кислорода (плазма). А в углеводородах, содержащих большое количество электронов связи, всегда есть небольшое количество свободных электронов.
Наличие хотя бы одного электрона и противоположных по знаку избыточного электрического заряда атомов кислорода неизбежно приводит к их взаимодействию и последующему взрыву.
Только теперь, после знакомства с описанным выше процессом взрыва как быстрого горения, становится понятным его механизм. Свободные электроны, всегда присутствующие в углеводородном топливе, взаимодействуют как электроны – генераторы энергии с атомами кислорода, которые тоже всегда есть, хотя и в небольшом количестве, в чистом кислороде. Это вызывает разрушение молекул кислорода на атомы с одновременным освобождением их электронов связи, которые сразу становятся новыми генераторами энергии. Процесс, таким образом, идет ускоренно, лавиной, которой ничто не препятствует, и завершается взрывом, хотя органического топлива практически не было – только его следы. Но, как видно, именно они явились первопричиной начала реакции. Таков вкратце механизм взрыва чистого кислорода
При горении кислорода с органическим топливом, например углеродом, происходит соединение участников реакции – окисление топлива C+О2=СО2 . При этом продукт реакции СО2 потребляет два-три электрона для связи своих атомов: один электрон берется из молекулы кислорода, остальные электроны поставляет органическое топливо. То есть топливо в реакции горения является донором электронов.
В последние пять лет появились реально работающие энергоустановки, в которых происходит частичное расщепление воздуха или воды. Так в двигателях внутреннего сгорания (ДВС) был получен режим работы, при котором расход топлива (бензина) уменьшается до 5…6 раз, и соответственно возрастает мощность. В составе выхлопных газов ДВС обнаружено повышенное содержание водяного пара, кислород, и пониженное содержание азота и углекислого газа (1).
Поскольку в воздухе, идущем на горение в ДВС, кроме кислорода и азота ничего нет, то снижение расхода органического топлива происходит за счет вовлечения в горение азота, на что указывает снижение содержания азота в выхлопных газах.
Для этого необходимо каким-либо инициирующим воздействием разрушить молекулу азота хотя бы на атомы или более мелкие фрагменты. Это достигается магнитным потоком. Причем такой азотный режим работыи горения идет с окислением до h3O, а не до CO2, что энергетически и экологически более эффективно.
Отличие обычного и бестопливного горения.
Обычное горение
1. При обычном горении, например, углерода 12С, углеродные цепочки топлива разрушаются на отдельные элементы так, что на каждый атом углерода приходится по одному электрону их связи, который становится свободным С+е+С+е+… (1)
2. Молекулы кислорода воздуха, каждая из которых состоит из двух атомов и электрона их связи, разрушаются на положительно заряженный атом (ион) и отрицательно заряженный ион, состоящий из положительно заряженного атома кислорода и соединенного с ним электрона связи
O2=(OeO)—->O+ +(Oe)-=O++O- (2)
3. Свободный электрон, полученный в плазме горения от топлива (1), становится электроном – генератором энергии и взаимодействует с ионами О+, послойно, отбирая у них мелкие элементарные частицы, что создает малый дефект массы атома кислорода (порядка 10в -6 степени %). Такой ничтожный дефект массы позволяет сохранить химические свойства кислорода. По окончании процесса энерговыделения, продукты реакции объединяются в наиболее устойчивое соединение (СО2)
С + О2 = СО2 или с учетом электроновC+e+O+O++e=OeCeO=CO2 (3)
4. Как видно, при обычном горении идет атомная реакция расцепления кислорода. За счет энергии связи его элементарных частиц и выделяется тепловая энергия.Топливо является донором электронов.Реакция окисления (3) является следствием горения.Азот в обычном горении участия не принимает, являясь балластом в составе воздуха.
Необычное – «бестопливное» горение
1. Если разрушить молекулу кислорода с выделением свободного электрона связиO—>O+ +e+O+ (4)то этот свободный электрон станет электроном-генератором энергии точно так же, как электрон, полученный от топлива (1).2. Тогда исключается необходимость в топливе и горение становится бестопливным, но с тем же дефицитом массы кислорода как при обычном горенииO2 —>O2 — <>m (5)3. В чистом кислороде реакция энерговыделения по (4) идет со взрывом (быстрое горение). Для ее начала достаточно, как известно, следов углеводородов (смазочное масло, бензин, дизтопливо и т.п.).В воздухе взрыву препятствует азот. Молекулы азота, имея отрицательный избыточный заряд окружают каждую молекулу кислорода, имеющую положительный избыточный заряд, образуя агрегаты (кластеры) из кислорода, экранированного азотом от действия электронов.4. То есть для бестопливного горения необходимо не только разбить кислород по (4), но и предварительно разбить агрегаты кислорода с азотным экраном. Таким образом, азот не просто инертный балласт, а структурный конгломерат (кластер) мешающий доступу к кислороду и его взрыву.5. Если инициирующее воздействие достаточно для разрушения азота, молекула которого в два раза прочнее молекулы кислорода, так как имеет не один, а два электрона связи, то азот при этом разрушается не только на атомы, но и фрагменты, представляющие другие химические элементыN2 —>C,O,H. (6)6. Эти элементы, особенно, кислород и водород, вступают в реакцию энерговыделения с электронами – генераторами энергии.7. Участие азота увеличивает мощность реакции энерговыделения за счет дополнительной энергии связи элементарных частиц в атомах, указанных веществ. Такая реакция горения называется азотной реакцией.8. Продуктами азотной реакции являются, в основном, водяной пар (вода) Н2О, частично кислород О2, углерод С и в меньшей степени СО2, СО, NOХ и другие вещества.
Атомы азота в молекуле скреплены двумя электронами. Поэтому молекула азота является прочной и обладает относительно небольшим отрицательным зарядом, делающим азот химически менее активным, чем, например, кислород.
Два атома в молекуле кислорода скреплены только одним электроном. Поэтому молекула кислорода является менее прочной, чем молекула азота и более химически активной (если судить по заряду, то – в 15 раз).
В объеме воздуха при нормальных условиях находится 79% азота и 21% кислорода. Это значит, что на каждую молекулу кислорода приходится по 4 молекулы азота (по объему). Суммарный электрический заряд атмосферного воздуха, без учета других газов из-за их малого количества, составит:qатм ~4qN2 +qO2=11.4×10 в -20 степени Кл.
Как видно, заряд атмосферного воздуха является положительным. Именно поэтому воздушная атмосфера притягиватеся электростатически к Земле, имеющей противоположный по знаку, отрицательный избыточный электрический заряд. Поэтому и не улетает!В то же время, притягиваясь электростатически к Земле, воздушная атмосфера встречает поля положительных структурных зарядов Земли, которые как одноименные заряды отталкивают компоненты атмосферы, не давая им упасть на землю. Также ведет себя и геомагнитное поле Земли.
При наличии следов углеводородов (смазочное масло, топливо) взрывается чистый кислород. Взрыв – это быстрое горение, то есть при взрыве происходит фазовый переход высшего рода кислорода с выделением энергии, происходит почти мгновенно. А воздух не взрывается даже от сильных атмосферных электрических разрядов – молний. Ответ, как следует из предыдущего анализа, заключается в том, что в составе воздуха находится относительно инертный газ – азот, который при активном кислороде является балластом. Более того, будучи заряжены отрицательно, молекулы азота окружают каждую положительно заряженную молекулу кислорода своеобразной оболочкой, которая экранирует кислород и защищает его от взрыва. Обычный воздух при обычных воздействиях, включая молнии, не взрывается, если коротко сказать из-за наличия в нем азота.
Значит, для того чтобы добраться горению до кислорода, необходимо не только разрушить его молекулу на атомы, но и, в первую очередь разрушить структуру агрегатов воздуха из кислорода и окружающего его азота, то есть нарушить их электростатическую связь воздействием переменных магнитных полей.
Литература:
1. Андреев Е.И. и др. Естественная энергетика. – СПб: Нестор, 2000.2. Андреев Е.И. и др. Естественная энергетика-2. – СПб: Невская жемчужина, 2002.3. Андреев Е.И. Расчет тепло- и массообмена в контактных аппаратах. – Л.: Энергоатомиздат, 1985.4. Андреев Е.И. Механизм тепломассообмена газа с жидкостью. – Л.: Энергоатомиздат, 1990.5. Базиев Д.Х. Основы единой теории физики. – М.: Педагогика, 1994.6. Базиев Д.Х. Электричество Земли. – М.: Коммерческие технологии, 1997.7. Базиев Д.Х. Заряд и масса фотона. – М.: Педагогика, 20018. Журнал «Парадокс», № 9, 2002.

АКТИВАТОР
АКТИВАТОР АВТОТЕРМИИ
www.deg25.lv
Азота закись горение в ней
Для отличия от кислорода, который также поддерживает горение, смешивают равные объемы азота закиси с окисью азота, при этом не должно появляться красного дыма (ГФ X). Азота закись хорошо растворима в воде. [c.95]
Из газообразных веществ, кроме О2 и SO2, в качестве продуктов горения могут еще быть получены водород, галогены (в том числе и фтор), дициан, азот, закись азота N2O и др. [c.285]Закись азота. Из других окислов азота представляет интерес закись азота N26. Закись азота — бесцветный газ со слабым приятным запахом и сладковатым вкусом, довольно хорошо растворимый в воде. Растворяясь в воде, закись азота не образует с ней никакого соединения. Закись азота поддерживает горение, тлеющая лучина вспыхивает в ней, как в кислороде. Ее вдыхание вызывает состояние опьянения и судорожный смех, а затем бесчувствие поэтому она получила название веселящего газа . Получается закись азота нагреванием азотнокислого аммония (стр. 170). [c.164]
Закись азота поддерживает горение, так как при нагревании разлагается на азот и кислород. В атмосфере закиси азота фосфор горит ослепительно ярким пламенем сера сгорает ярки.м розовы.м пла.менем тлеющая лучина вспыхивает и ярко горит. [c.263]
Закись и окись азота, как показали опыты, будучи воспламеняемыми, не инициируют горение даже в случае образования суспензии каждой из этих окисей с жидким кислородом. [c.27]
При высоких температурах закись азота мало устойчива и разлагается на азот и оксид азота. Важно так вести сжигание, чтобы свести к минимуму образование оксидов азота. Предпочтительно проведение двухступенчатого сжигания при недостатке воздуха на первой ступени и избытке — на второй или сжигании в окислительной атмосфере, но при регулировании температуры пламени рециркуляцией продуктов горения при 1000—1100 °С. В этом случае содержание оксидов а юта в продуктах горения может быть менее 0,0005 % (объемн.). [c.192]
Исследовать с помощью горящей лучинки, горит ли закись азота и поддерживает ли она горение. [c.143]
В растворах закись азота имеет склонность к реакциям восстановления и окисления. Поэтому в смесях с огнеопасными веществами она может поддерживать горение [6]. В присутствии достаточно сильных окислителей она может разлагаться до азота и кислорода, а также окисляться до двуокиси азота. Поэтому в благоприятных условиях закись азота может участвовать в процессах коррозии металла, а также реагировать с компонентами содержимого аэрозольной упаковки. [c.121]
Закись азота не окисляется кислородом. Термическое разложение заметно при 500° С, а полный распад на азот и кислород происходит при 900° С. При высоких температурах проявляются сильные окислительные свойства, так как при температуре горения (свыше 450° С) начинается распад на азот и кислород. Поэтому газ способен поддерживать горение других веществ даже в бескислородной среде. Смесь закиси азота с диэтиловым эфиром взрывчата, а смеси ее с азотом. [c.121]
Положить небольшое количество сухого красного фосфора в ложечку для сжигания и зажженный на воздухе фосфор внести в верхнюю часть трубки. Поддерживает ли закись азота горение фосфора Написать уравнение. реакции. [c.127]
Пламя в атомной абсорбции выполняет роль температурной ячейки, применяемой для атомизации пробы. Возможность определения с достаточной чувствительностью того или иного элемента методом атомно-абсорбционной спектрофотометрии зависит от температуры пламени, а также от соотношения горючего газа и газа, поддерживающего горение. В основном при этом методе применяются пламена смесей пропан — воздух, ацетилен — воздух, ацетилен — закись азота. Низкотемпературное пламя (пропан — воздух, температура 1925° С) применяется с успехом для определения элементов, соединения которых легко диссоциируют при этой температуре. Сюда относятся цинк, медь, магний. [c.208]
Объемный состав окислов азота объясняет сущность различия закиси от окиси. Закись образована со сжатием, окись без него, ее объем равен сумме объемов азота и кислорода, в ней находящихся. При окислении, если бы таковое совершалось прямо, 2 объема закиси с 1 объемом кислорода дали бы не 3, а 4 объема окиси. Эти отношения необходимо принимать в расчет, сравнивая теплоту образования, способность поддерживать горение и другие свойства NO и N O. [c.526]
Разложение может быть вызвано электрической искрой. Подобно кислороду поддерживает горение, вызывает воспламенение тлеющей лучинки. Но в противоположность кислороду закись азота не реагирует с окисью азота. [c.23]
Это бесцветный газ, не имеющий запаха, поддерживающий горение при этом процессе закись азота отдает свой кислород, превращаясь в молекулярный азот. Даже при кратковременном вдыхании этого газа появляются признаки истерии в связи с таким действием (открытым в 1799 г. Гемфри Деви) это вещество получило название веселящего газа. Длительное вдыхание закиси азота вызывает потерю сознания, и на этом основано его использование (в смеси с воздухом или кислородом) в качестве анестезирующего средства при небольших операциях под общим наркозом. Этот газ находит также применение при изготовлении крема из сливок . газ под давлением растворяется в сливках, а когда давление снимают, он выделяется в виде множества мелких пузырьков образующаяся при этом масса напоминает обычные взбитые сливки. [c.256]
В практике атомно-абсорбционного анализа основным видом поглощающей ячейки являются различного рода газовые пламена. Для этого используются горючие газы светильный, пропан, бутан, ацетилен, водород и др. Окислители при горении — кислород, который поступает в чистом виде или как составная часть атмосферного воздуха, закись азота и некоторые другие газы. [c.244]
В приведенных реакциях горения окислителем является сухой воздух, состоящий примерно по объему из 21% кислорода и 79% азота,, и поэтому продукты сгорания балластируются азотом. При использовании в качестве окислителя чистого сухого кислорода балласт будет отсутствовать. В дальнейшем для простоты мы будем писать реакции горения без балластного азота, не забывая учитывать его при расчете горения. Азот только в условиях высоких температур (выше 2 000°С) начинает связываться с кислородом, образуя закись азота N0, и поэтому в расчетах горения азот рассматривается как инертный газ. [c.46]
Закись азота N 0 представляет собой бесцветный, почти без запаха, со сладковатым привкусом газ. Он хорошо растворим в воде и спирте. Закись азота сравнительно нереакционноспособна, хотя по термодинамическим данным она является более сильным окислителем, чем кислород. При комнатной температуре она инертна по отношению к галогенам, щелочным металлам и озону. При более высоких температурах разлагается на азот и кислород, реагирует со щелочными металлами и многими органическими соединениями и поддерживает горение. Закись азота в обычных условиях не окисляется кислородом до окисла азота. При вдыхании в незначительных количествах закись азота вызывает состояние легкого опьянения ( веселящий газ ). При вдыхании в больших количествах он действует как наркотическое средство. [c.25]
Бэйли и Ли [9] исследовали инфракрасные спектры испускания пламен различных газов, горящих в закиси азота. Спектры испускания окиси углерода и светильного газа не отличались сколько-нибудь существенно от спектров пламени тех же веществ в воздухе в них наблюдалась интенсивная полоса при 4,5 [х и более слабая при 2,88 х. При горении смеси водорода с закисью азота в воздухе наблюдается обычный водородно-воздушный спектр, но при горении водорода в закиси азота получается совершенно отличный спектр, который состоит из интенсивной полосы при 4,75 х, двух неско.лько менее интенсивных полос при 4 и 5,49 х, полосы воды при 2,7 х и других слабых полос этой же молекулы. Носителем полос при 4,75 и 4 [X является, по всей вероятности, закись азота, в спектре поглощения которой имеются полосы, расположенные при длинах волн, близких к этим значениям. Бэйли и Ли приписали полосу при 5,49 х молекуле воды, но полученное ими совпадение недостаточно хорошее. Возможно, что эта полоса обусловлена окисью азота, в спектре поглощения которой имеется полоса при 5,3 X. [c.168]
Смесь низкокипящих газов и окислов азота (окись и закись азота, азот, окись и двуокись углерода и водород), образующихся при разложении и горении порохов, разделялась на специально обработанном силикагеле нри температуре ниже 0°С [107]. Смесь окислов азота может быть разделена на угле СКТ (рис. 83) [108]. Компоненты этой смеси выходят в порядке возрастания температур кипения на пористом полимере [109[. На этом адсорбенте хорошо разделяются также смеси азота, кислорода и аргона [c.152]
При ускорении реакции необходимо нагрев ослабить и даже временно прекратить. Через две-три минуты, когда можно считать, что воздух из прибора вытеснен, соберите выделяющуюся закись азота в цилиндр. Всего наберите три цилиндра, причем при их смене газоотводную трубку выньте из воды и нагревание пробирки прекратите. Наполненный газом цилиндр под водой закройте стеклянной пластинкой и выньте из воды. Собранный газ испытайте на горение тлеющей лучиной, серой и фосфором. Серу и красный фосфор вносите в железных ложечках, предварительно подожженными. [c.102]
При сожжении азотсодержащих органических соединений происходят два процесса термическое разложение вещества и окисление как самого вещества, так и продуктов его распада. В том случае, когда сожжение прошло количественно, в газах горения в конечном итоге не должно присутствовать соединений, не окислившихся полностью. Поэтому, хотя при термическом разложении азотсодержащих веществ и могут, в зависимости от их свойств, образоваться такие продукты пиролиза, как аммиак, дициан, цианистый водород, закись, окись и двуокись азота, свободный азот, закись углерода и метан или другие летучие углеводороды, в действительности в газах горения присутствуют лишь азот, окись или двуокись азота. Значительно реже и лишь при сожжении некоторых азотсодержащих веществ появляется реальная возможность недоокисления углеводородов или нитрильной группы. Многие исследователи указывают также на возможность недогорания угля, содержащего азот В последнем случае получатся, конечно, пониженные результаты, так же как и при образовании N-гpyппы, которая [c.73]
Закись азота — соединение непрочное, легко разлагающееся при 170°С (443 К) на элемелтарные азот и кислород. Закись азота — хороший окислитель, поддерживающий горение с освобождением молекулярного азота, и хорошо растворяющийся в растворах серной кислоты (табл. 2.4). [c.58]
Веселящий газ , закись азота. Бесцветный газ, термически устойчивый. Плохо растворяется в воде. При сильном охлаждении из раствора кристаллизуется клатрат N2O 5,75Н20. Малореакционноспособный, не реагирует с разбавленными кислотами, щелочами, гидратом аммиака, кислородом. При нагревании реагирует с концентрированной серной кислотой, водородом, металлами, аммиаком. Поддерживает горение углерода и фосфора. Слабый окислитель, слабый восстановитель. Получение см. ЗИ, 52, 278, ЗОО. [c.151]
Исследования, относящиеся к химии, заложили основы науки о газах, или пневматической химии. Создал ряд приборов для изучения газов. Занимался изучением углекислого газа — воздуха, испорченного горением или дыханием и очищенного зелеными частями растений. Впервые получил солянокислый воздух — хлористый водород (1772), селитряный воздух — закись азота (1772), заметив, что он при соприкосновении с воздухом переходит в газ бурого цвета. Открыл (1772— 1774) щелочной воздух —аммиак. Открыл (1774) бесфлогнстонный воздух — кислород, получив его при нагревании оксида ртути. Изучил растворение углекислого газа и аммиака в воде. Получил продукт соединения серной и азотной кислот (названный позднее нитро-зилсерной кислотой) выделил (1775—1799) индивидуальные фтористый кремний, сернистый газ и окись углерода. Результаты своих химических исследований опубликовал в сочинении Опыты и наблюдения над различными видами воздуха (т. 1—3, 1774—1777). В теоретических воззрениях придерживался гипотезы флогистона. [c.409]
Закись азота N30 представляет собой бесцветный газ, растворимый в воде и имеющий склонность к реакциям восстановления и окисления. Поэтому в смесях с огнеопасными веществами закись азота может поддерживать горение. Чистая закись азота реагирует с металлами только нри температуре выше 100° С с освобождением азота. На резиновые и пластмассовые детали упаковки она не действует. Закись азота нетоксична и не вызывает раздражения кожи. Смесь N20 с воздухом (80 20) обладает анестезирующим действием. Закись азота составляет в США, например, /5 от общего потребления сжатых газов в аэрозольном производстве. Наиболее перспективное использование закись азота будет, по-видимому, иметь в аэрозолях на основе воды (крахмалы, полирующие составы, средства для чистки стекол). Например, состав для полировки автомобиля на основе эмульсии вода в масле содержит 90% фреона-12 и 10% закиси азота. Аэрозольная упаковка пищевых продуктов — второе направление использования этого пропеллента. Подсчитано, что из всего количества закиси азота, потребляемой в США для аэрозольных упаковок, 227 т в год расходуется для заполнения баллонов со сбитыми сливками [43]. Новый пропеллент для аэрозольной упа- [c.50]
Следует, однако, сказать, что представления Пристлея о кислороде в 1775 г. были весьма туманными. В то время как Лавуазье выступал с сообщением о кислороде в Парижской академии наук, Пристлей полагал, что для горения и дыхания лучше всего подходит естественный воздух и что наблюдавшееся им интенсивное горение свечи и лучинки во вновь открытом газе было лишь чисто случайным явлением. Только в дальнейшем он пришел к заключению, что кислород но отношению к горению и дыханию в 4 или 5 раз лучше обычного воздуха и потому назвал его дефлогистированным воздухом . В то же время он исправил свою прежнюю ошибку, указав, что газ, ранее полученный им при прокаливании селитры, не представляет собой дефлогистированного селитряного воздуха (закись азота), а является просто дефлогистированным воздухом (кислородом). [c.309]
Закись азота сравнительно нереакционноспособна, причем при комнатной температуре она инертна по отношению к галогенам, гцелочным металлам и озону. При более высоких температурах разлагается на азот и кислород, реагирует со щелочными металлами н лшогими органическими соединениями и поддерживает горение. Умеренно растворима в кремах и, если не учитывать важности в качестве анестезирующего вещества, находит промышленное при.ме-нение в качестве пропеллента в кремовых бомбах. [c.176]
Закись азота легко разлагается на азот и кислород при действии жара и ряда электрических искр, а это объясняет то, что множество тел, не могущих гореть в окиси азота, напротив того, весьма легко горят в закиси. Действительно, окись азота, если, разлагаясь, дает кислород, — тотчас же поглощает его, образуя прочную NO , а в закиси азота зовсе нет этой способности прямо далее соединяться с кислородом. Смесь закиси азота с водородом взрывает точно так, как гремучий газ, причем образуется, конечно, газообразный азот N -0- -H = = Н О -)- N . Объем остающегося азота равен первоначальному объему взятой закиси азота и равен объему водорода, входящего в соединение с кислородом значит, равные объемы азота и водорода в этой реакции замещают друг друга. Зажженные сера, фосфор, уголь горят, хотя и не столь ярко, как в кислороде. При горении в закиси азота развивается более тепла, чем при горении того же количества тел в кислороде, что и показывает ясным образом, что при соединении азота с кислородом для образования закиси азота произошло поглощение тепла (21000 кал. на 44 г №0). Если разлагают данный объем закиси азота металлом, напр., натрием, то по охлаждении остается совершенно такой же объем азота, какой имела закись следовательно, кислород, так сказать, располагается между атомами азота, не производя при этом увеличения в объеме азота. [c.209]
Закись азота хорошо поддерживает горение, так как при нагревании разлагается на а и кислород. Фосфор горит осиепи-тельно ярким пламенем. Сера сгорает ярким розовым пламенем. Тлеюшая лучина вспыхивает и ярко горит. [c.219]
Проводя один из своих опытов, Кавендиш заметил, что если пропустить воздух несколько раз над нагретым древесным углем, а затем через раствор гидроокиси калия, то остается газ, который похож па воздух, но легче его п не поддерживает горения. Кавендиш назвал этот воздух флогистированным . О своем открытии он написал только в письме к Пристли, так что Даппель Резерфорд [109] (выполнивший подобный эксперимент) первым объявил об открытии азота, а именно им и был флогистиро-ванный воздух . Кавендиш также открыл закись азота и обнаружил, что она реагирует с кислородом с образованием окпсп азота, которая при растворении в воде дает азотную кислоту. Эту реакцию он использовал для установления состава воздуха ц с этой целью сконструировал эвдиометр [110]. Выполнив более четырехсот опытов в различных местностях и при различных погодных условиях, Кавендиш сделал вывод, что в атмосфере содержится 20,84% дефлогистированного воздуха (кислорода). [c.58]
При продувке пылеуловителей и шлейфов на станциях подземного хранения газа (СПХГ) нередки случаи самовозгорания газа. При горении образуются закись, окись и двуокись азота, причем последняя наиболее токсичная. Двуокись азота может поглощать фиолетовые лучи и поэтому способствует фотохимическим реакциям в атмосфере. Кроме того, соединяясь с водой, она образует азотную кислоту. [c.20]
chem21.info
Окись азота реакция горения - Справочник химика 21
В качестве модельной цепной реакции с неразветвленными цепями используется реакция с хорошо изученной кинетикой взаимодействие хлора с водородом [34, 35]. Сложные реакции экзотермического распада озона [36] и ацетилена [37] имеют в определенном диапазоне условий формальную кинетику, близкую к бимолекулярной. Окись азота, как эндотермическое соединение, способна распадаться с выделением тепла, и этот процесс в определенных условиях может протекать по типу горения. При этом [c.274]
Давид Альбертович в составе большого коллектива принял участие в работе по проблеме окисления и фиксации атмосферного азота при горении и взрывах. Упоминания об этой проблеме, например у Кавендиша, появились сразу после открытия азота и вслед за тем, как был установлен состав воздуха. К исследованию этого процесса обращались такие крупные химики, как Ф. Габер, В. Нернст (Германия), Р. Бон (Англия). В связи с развитием теории цепных реакций вставал вопрос о возможности прямого использования энергии горения для превращения азота в окись азота. Исследования, проведенные при участии Давида Альбертовича, показали, что процесс связан с механизмом цепной реакции при участии атомов N и О, однако при этом выход окислов азота ограничен условиями термодинамического равновесия. Вполне естественно наметились направления последующей работы Давида Альбертовича с одной стороны — теория горения и взрыва, с другой — общие основы химической технологии. К этим вопросам Давид Альбертович был близок и по своему инженерному образованию и опыту. [c.496]Желтая дуга — это пламя азота, соединяющегося с кислородом в окись азота. Так как реакция сгорания азота происходит с поглощением тепла, горение азота происходит лишь в зоне электрической искры и мгновенно прекращается, как только выключается ток. [c.441]
Вследствие обратимости последних двух стадий содержащаяся в газе окись углерода (и углерод кокса) не может быть использована полностью, и поэтому выделяющийся из домны доменный (колошниковый) газ содержит, помимо азота воздуха и двуокиси углерода, 27—30% окиси углерода, а также небольшие количества водорода и метана. Повышение давления газов в печи, а вследствие этого и их концентраций ускоряет гетерогенные реакции, а увеличение концентрации кислорода в воздухе интенсифицирует реакции горения, уменьшает содержание азота в газе и, следовательно, количество теплоты, выносимое из печи газом. [c.180]
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры. Некоторые вещества, например, окись азота, гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствие дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре. Характерной особенностью многих реакций соединения с кислородом является выделение теплоты и света. Такой процесс называется горением. [c.373]
Так как двуокись азота окрашена в бурый цвет, то при удалении стеклянной пластинки с цилиндра, наполненного бесцветной окисью азота, газ немедленно окрашивается в бурый цвет. Окись азота не горит и не поддерживает горения лучины или свечи. Но такие вещества, которые весьма энергично соединяются с кислородом, горят в атмосфере окиси азота. Например, фосфор и уголь сгорают в ней очень энергично. При этих реакциях выделяется свободный азот [c.263]
Ценную информацию о характере химических процессов, протекающих во внутреннем и внешнем пламенах, дают исследования спектров этих пламен при добавке окиси азота в газовую смесь. Как уже указывалось выше, возникающее при этом желто-зеленое свечение, обусловленное процессом N0 - - О NOa -f- hv, является индикатором на атомарный кислород. Особенно велика яркость этого свечения в пламени оки ся углерода, что указывает на большую концентрацию атомов кислорода в зоне горения СО. В соответствии с этим находится тот факт, что при введении N0 в смеси СН4 и других углеводородов с воздухом свечение NO2 возникает практически лишь во внешнем пламени, откуда следует преобладание в этом пламени реакции окисления СО. На ранних стадиях окислительного процесса, во внутреннем пламени, атомы кислорода образуются лишь в незначительных концентрациях. [c.482]
Продукты реакции охлаждают и затем разделяют водород и газы реакции возвращаются в цикл, а жидкие продукты (бензин гидроформинга) подвергаются ректификации. Регенерация катализатора осуществляется так же, как и на установках каталитического крекинга [18, 78] выжигом отложенного кокса в струе воздуха остаточный воздух вместе с газообразными продуктами горения (двуокись углерода, окись углерода, азот и др.) нагретыми до 600° С и применяют для получения водяного пара. В качестве сырья используется фракция бензина прямой гонки. [c.131]
При соединении водорода с кислородом выделяется очень много тепла 60 ккал моль воды поэтому пламя водорода, сгорающего в чистом кислороде, развивает температуру до 2500°. Платина, золото, окись алюминия в нем плавятся, а серебро и окись кремния кипят, обращаясь в тяжелые пары. При горении водорода на воздухе тепла выделяется столько же, но оно не целиком переходит в продукт реакции — водяные пары, а распределяется между молекулами водяного пара и азотом температура пламени оказывается значительно меньше. [c.278]
Определение рациональных путей для совершенствования рабочего процесса ДВС в большой степени зависит от исследований, проводимых в направлении уменьшения токсических веществ в выпускных газах ДВС, анализа и обобщения полученных при исследованиях экспериментальных данных. Такие токсические вещества, как окись углерода СО, альдегиды, углеводороды СН, твердый углерод С (сажа), возникают в результате неполного сгорания топлива в предпламенных процессах и в процессе горения, а окислы азота образуются при соответствующих условиях за фронтом пламени — там, где реакции окисления топлива закончились (это говорит о термической природе реакций окисления азота в продуктах сгорания). Образование окислов азота зависит главным образом от температуры и времени пребывания газа в камере сгорания. При температуре ниже 1800 К образование окислов азота практически не происходит. [c.229]
Для анализа результатов, полученных в предположении о частичном равновесии в продуктах сгорания углеводородного горючего и других газах, содержащих окись углерода, необходимо рассмотреть равновесие реакции (XXI). В [12] при исследовании пламен смеси водород — окись углерода — воздух было обнаружено, что при смещении от стехиометрического состава в сторону обогащения смеси горючим равновесие по водяному пару в продуктах сгорания [посредством реакций (I) и (XXI)] не достигается, если температура пламени ниже 1500 К. На рис. 2.13 и 2.14 показаны профили мольных концентраций стабильных компонентов при горении смесей водород — окись углерода — воздух, в одной из которых конечная адиабатическая температура близка к 1650 К, а в другой — к 1350 К. Хорошо видно наличие максимумов концентрации водяного пара в обоих пламенах и недостижение равновесной концентрации Н2О во втором случае. В качестве еще одного примера использования подхода, связанного с предположением о частичном равновесии, интересно рассмотреть образование окиси азота путем связывания атмосферного азота в зоне горения в одномерном пла- [c.126]
Последние взаимодействуют между собой по так называемой реакции водяного газа (СО -f Н2О СО2 - - Н2), которая имеет большое значение во всех процессах неполного горения. Эта реакция при высоких температурах идет настолько быстро, что водород, окись углерода, водяной пар и углекислота в продуктах горения, покидающих реакционное пространство, находятся обычно в равновесии. Этому равновесию не мешает присутствие в продуктах горения не только инертного азота, но и продуктов, не находящихся в равновесии. К таким продуктам можно отнести метан (в небольшом количестве всегда присутствующий в продуктах неполного горения), ацетилен, этилен и твердый углерод в виде частичек сажи. [c.4]
Среди примеров катализаторов реакций горения укажем воду НдО, которая влияет на реакцию окисления окиси углерода СО + /2 2 СЮа ). Механизм реакции, но которому протекает катализ, таков СО + НдО СОз -Ь -Ь 2Н и 2Н -1- 72 2 НзО. Окись азота (N0) также служит ката.лизатором реакции окисления СО по механизму N0 Ч- Оз -> 2N02 и N 3 + СО N0 -1- СОз. В обоих этих примерах промежуточное соединение (например, Н или КОз) образуется, а затем разлагается. Добавление небольшого количества КОз к смеси Нд — Оз приводит к взрыву с разветвленной цепной реакцией. [c.497]
Было найдено, что при изменении температуры поверхности углерода от 1500 до 2000°К скорость горения углерода из нефтяного кокса увеличивается пропорционально корню квадратному из скорости потока газа. Было показано, что во всем исследованном диапазоне температур скорость горения углерода из нефтяного кокса прямо пропорциональна концентрации кислорода при изменении ее от 37 до 100%. По мере того как скорость потока газа увеличивалась от 25 до 305 м сек, кажущаяся энергия активации для горения углерода из нефтяного кокса уменьшалась от 5,3 до 2,3 ккал1моль. Было найдено, что азот, гелий, двуокись и окись углерода действовали на горение только как разбавители пары воды уменьшали отношение СО/СОг, а хлор сильно тормозил реакцию горения. [c.257]
Отсутствие замороженности этой адиабатической реакции резко отличает окись азота от СО, которая, несмотря на гораздо большую экзотермичность реакции горения [c.217]
Закись азота легко разлагается на азот и кислород при действии жара и ряда электрических искр, а это объясняет то, что множество тел, не могущих гореть в окиси азота, напротив того, весьма легко горят в закиси. Действительно, окись азота, если, разлагаясь, дает кислород, — тотчас же поглощает его, образуя прочную NO , а в закиси азота зовсе нет этой способности прямо далее соединяться с кислородом. Смесь закиси азота с водородом взрывает точно так, как гремучий газ, причем образуется, конечно, газообразный азот N -0- -H = = Н О -)- N . Объем остающегося азота равен первоначальному объему взятой закиси азота и равен объему водорода, входящего в соединение с кислородом значит, равные объемы азота и водорода в этой реакции замещают друг друга. Зажженные сера, фосфор, уголь горят, хотя и не столь ярко, как в кислороде. При горении в закиси азота развивается более тепла, чем при горении того же количества тел в кислороде, что и показывает ясным образом, что при соединении азота с кислородом для образования закиси азота произошло поглощение тепла (21000 кал. на 44 г №0). Если разлагают данный объем закиси азота металлом, напр., натрием, то по охлаждении остается совершенно такой же объем азота, какой имела закись следовательно, кислород, так сказать, располагается между атомами азота, не производя при этом увеличения в объеме азота. [c.209]
Для полного и быстрого горения газа необходимо создать хорошие условия перемещивания его с воздухом в соотнощени-ях, обеспечивающих протекание реакций взаимодействия между горючими компонентами и кислородом. Реакции полного сгорания комлонентав горючего газа и тепловой эффект горения представлены в табл. 27. Приведенные данные показывают, что при горении газов получаются продукты горения, состоящие из углекислоты и водяных паров. Если в газе содержатся сернистые соединения (например, сероводород), то в продуктах сгорания будет находиться сернистый газ. В дымовых газах также будут содержаться азот воздуха, поступивщего на сжигание таза, и избыточное (неизрасходованное) количество кислорода воздуха. При недостаточном поступлении воздуха в продуктах сгорания, как правило, содержится и окись углерода — продукт неполного горения углеводородных газов, а также несгоревшие компоненты газа. [c.115]
НОМ 3, И Нг К Н2О, превышающем 1,2, окалины на стали (не образуется. Поскольку от сжигания топлива до СО получается мало тепла, а несгоревший водород и вовсе не дает тепла, то невозможно при вышеуказанных соотношениях достичь температуры 1200°, если не принять каких-либо специальных мер для повышения температуры печи. Такими мерами могут быть сжигание топлива в кислороде или дожигание его в регенераторах или рекуператорах, которые служат для подогрева воздуха, расходуемого на горение или дожигание газов в особой камере, из которой тепло передается в нагревательное пространство через тонкую муфельную стенку. Номограмма на рис. 151 применима только для железа и стали. Разные металлы имеют различное химическое сродство с кислородом. Чтобы для других металлов получить номограмму, аналогичную изображенной на рис. 151, надо ее продлить в направлении обеих стрелок. Такое распространение номограммы на другие металлы было выполнено тем же Нейманном (рис. 152). Номограмма дана в логарифмических координатах со следующими делениями 1, 2, 5, 10, 20, 50, 100 и т. д. Более мелкие деления показаны на вспомогательных шкалах. iMeждy прочим, из рис. 152 видно, что никель в так называемой окислительной атмосфере печи не окисляется. Количество водорода может составлять нё более 1% от количества водяного пара, а окиси углерода — всего 1 % от количества углекислого газа, никель окисляться не будет. Кривая равновесия марганца располагается вблизи противоположного конца номограммы. При температурах, поддерживаемых в печи, марганец будет окисляться даже в том случае, если атмосфера печи будет состоять из чистого водорода, окиси углерода и инертного газа, например азота. Активность марганца при высоких температурах по отношению к кислороду используется для восстановления стали в мартеновских печах. В атмосфере, состоящей из окиси углерода и инертного газа, марганец при температурах печи окисляется благодаря реакции 2С0 = С -f СО2. Хотя окись углерода (СО) при повышенных температурах является весьма устойчивым соединением, указанное выше явление временной и исчезающей диссоциации обусловливает и эту быстг ро протекающую реакцию. Вновь возникающие молекулы углекислого газа диссоциируют таким же способом, и марганец окисляется временно освобождающимся кислородом. На рис. 152 приведены также кривые равновесия других используемых в промышленности металлов. [c.201]
В 1756 М. В. Ломоносов )та основе количественных опытов установил, что горение и окисление являются процессами соединения окисляемого вещества с частицами воздуха, а А. Лавуазье в 1774—77 доказал, что это соедипепие происходит о определенной составной частью во.здл ха — кислородом. В 1748 Ломоносов и независимо от него в 1774 Лавуазье открыли з а к о п сохранения массы веществ в химических реакциях. После открытия этого закона X. была превращена из качественно-описательной в количественную науку. Вторая половина и особенно последняя четверть 18 в. весьма богаты эксперимеитальнымн открытиями в области X. К началу 18 в. было известно только 1.Я хпмпч. элементов, а к концу 18 в.— 32, т. е. за одно столетие было открыто 19 элементов, в т. ч. кислород, водород, азот, хлор. Кроме того, в 18 в. установлен состав воздуха и воды, открыты окись и двуокись углерода, аммиак, сер]и1стыи ангидрид и др. газообразные соединения. Исследование газов приобрело широкий размах и составило направление пневматической X и м и и. [c.332]
Если малые навески нитроцеллюлозы нагреть до температуры выше 180° С, то после короткого периода индукции они воспламенятся. Воспламенению предшествует превращение в жидкое состояние и ускорение процесса разложения. В результате ускоренной реакции разложения образуется реагирующий газ, содержащий окислы азота, формальдегид, окись углерода и водород. В нрисутствии инертного газа эти продукты скопляются около поверхности нитроцеллюлозы, и может произо11ти воспламенение в газовой фазе, которое приведет к поверхностному горению навески. При очень низких давлениях этот реагирующий газ диффундирует так быстро, что восиламене-ния не происходит. В этих условиях ускоренное разложение в жидкой фазе может привести к тепловому взрыву. [c.435]
При продувке пылеуловителей и шлейфов на станциях подземного хранения газа (СПХГ) нередки случаи самовозгорания газа. При горении образуются закись, окись и двуокись азота, причем последняя наиболее токсичная. Двуокись азота может поглощать фиолетовые лучи и поэтому способствует фотохимическим реакциям в атмосфере. Кроме того, соединяясь с водой, она образует азотную кислоту. [c.20]
chem21.info
Азота окись горение в ней
Давид Альбертович в составе большого коллектива принял участие в работе по проблеме окисления и фиксации атмосферного азота при горении и взрывах. Упоминания об этой проблеме, например у Кавендиша, появились сразу после открытия азота и вслед за тем, как был установлен состав воздуха. К исследованию этого процесса обращались такие крупные химики, как Ф. Габер, В. Нернст (Германия), Р. Бон (Англия). В связи с развитием теории цепных реакций вставал вопрос о возможности прямого использования энергии горения для превращения азота в окись азота. Исследования, проведенные при участии Давида Альбертовича, показали, что процесс связан с механизмом цепной реакции при участии атомов N и О, однако при этом выход окислов азота ограничен условиями термодинамического равновесия. Вполне естественно наметились направления последующей работы Давида Альбертовича с одной стороны — теория горения и взрыва, с другой — общие основы химической технологии. К этим вопросам Давид Альбертович был близок и по своему инженерному образованию и опыту. [c.496]
Смесь низкокипящих газов и окислов азота (окись и закись азота, азот, окись и двуокись углерода и водород), образующихся при разложении и горении порохов, разделялась на специально обработанном силикагеле нри температуре ниже 0°С [107]. Смесь окислов азота может быть разделена на угле СКТ (рис. 83) [108]. Компоненты этой смеси выходят в порядке возрастания температур кипения на пористом полимере [109[. На этом адсорбенте хорошо разделяются также смеси азота, кислорода и аргона [c.152]При горении капролактам плавится и растекается с выделением дыма, в котором содержатся токсичные вещества (окислы азота, окись углерода, аммиак). Загоревшийся капролактам тушат тонкораспыленной водой, подаваемой с интенсивностью 0,26 л/(с-м2) и воздушно-механической пеной [6, с. 119]. [c.22]
Продукты полного горения топлива состоят из углекислого газа, сернистого газа, паров воды, избыточного кислорода и азота. При неполном горении в продуктах горения могут также присутствовать окись углерода, углеводороды, водород и элементарный углерод — сажа. [c.110]
Закись и окись азота, как показали опыты, будучи воспламеняемыми, не инициируют горение даже в случае образования суспензии каждой из этих окисей с жидким кислородом. [c.27]
Дым, образующийся при горении органических веществ, содержит твердые части цы сажи и газообразные продукты углекислый газ, окись углерода, азот, сернистый газ и другие. В зависимости от состава и условий горения веществ получается раз личный по составу дым. [c.28]
Основными вариантами газовой хроматографии являются га-зо-адсорбционная и газо-жидкостная. Выбор наиболее эффективного способа анализа определяется характером поставленной задачи. Смеси низкокипящих веществ, которые входят в состав продуктов горения (водород, окись углерода, метан, кислород, азот и др.), легче разделяются методом адсорбционной хроматографии. В связи с этим при анализе продуктов горения именно этот метод приобретает наибольшее практическое значение. [c.93]
Метод заключается в том, что находящаяся в продуктах горения окись азота окисляется и поглощается 3%-ным раствором перекиси водорода, налитым в специальные колбы. Количество полученной азотной кислоты определяют титрованием 0,05 N раствором едкого натра. Перед титрованием углекислый газ из колбы удалялся отдувкой сжатым азотом. Схема отбора проб позволяла в процессе опыта изменять скорость отбора. На линии подвода газа к колбе устанавливали конденсатоотводчик. Анализ конденсата показал, что содержание азотной кислоты в нем составляло около 1 %. [c.86]
Исследования режимов горения газа в топках котлов позволяют установить оптимальные условия, при которых может быть достигнута не только максимальная эффективность использования топлива, но и в значительной степени уменьшена возможность загрязнения атмосферы такими вредными веществами, как окись углерода, окислы азота, полициклические углеводороды и т. д. [c.4]
Окись азота появляется в коксовом газе на стадии коксования [7, 8]. Кроме того, источником попадания N0 в коксовый газ является подсос продуктов горения, содержащ их N0, и окисление аммиака, образующегося при сухой перегонке каменного угля, кислородом из коксового газа [9—И]. Если коксовый газ проходит стадию водной промывки, концентрация окиси азота в нем увеличивается. Это объясняется разложением нитритов аммония (4, 12], присутствующих в оборотной воде в результате жизнедеятельности нитробактерий. [c.432]
В работе Гордона [9] применена цилиндрическая горелка с кольцеобразным (так называемый открытый центр ) или сплошным ( закрытый центр ) несущим пламенем. В работе [10] автор заменил сплошное кольцевое пространство, через которое подается окислительный газ, на систему трубок, между ними поступает горючий газ. Газовые горелки различных конструкций были использованы для изучения горения одиночных металлических частиц и в ряде других работ [11—15]. Фотографирование велось на неподвижную или движущуюся пленку, окислительной средой служили смеси, содержащие кислород, углекислый газ, окись углерода, водяной пар, азот, аргон, гелий. Гуревич с сотр. применил для изучения горения металлических частиц аргоно-дуговую плазменную горелку, способную развивать температуру до 3000 К [16]1 [c.239]
В качестве модельной цепной реакции с неразветвленными цепями используется реакция с хорошо изученной кинетикой взаимодействие хлора с водородом [34, 35]. Сложные реакции экзотермического распада озона [36] и ацетилена [37] имеют в определенном диапазоне условий формальную кинетику, близкую к бимолекулярной. Окись азота, как эндотермическое соединение, способна распадаться с выделением тепла, и этот процесс в определенных условиях может протекать по типу горения. При этом [c.274]
Сильно нагретые газы — углекислота, водяной пар и азот (кислород воздуха израсходован на горение угля), проходя по каналу, образуют следующую зону — зону восстановления, где получаются основные горючие компоненты окись углерода и водород. К газу, кроме того, примешиваются продукты сухой перегонки — метан, сероводород и в небольших количествах непредельные углеводороды. [c.31]
Ценную информацию о характере химических процессов, протекающих во внутреннем и внешнем пламенах, дают исследования спектров этих пламен при добавке окиси азота в газовую смесь. Как уже указывалось выше, возникающее при этом желто-зеленое свечение, обусловленное процессом N0 - - О NOa -f- hv, является индикатором на атомарный кислород. Особенно велика яркость этого свечения в пламени оки ся углерода, что указывает на большую концентрацию атомов кислорода в зоне горения СО. В соответствии с этим находится тот факт, что при введении N0 в смеси СН4 и других углеводородов с воздухом свечение NO2 возникает практически лишь во внешнем пламени, откуда следует преобладание в этом пламени реакции окисления СО. На ранних стадиях окислительного процесса, во внутреннем пламени, атомы кислорода образуются лишь в незначительных концентрациях. [c.482]
Продукты реакции охлаждают и затем разделяют водород и газы реакции возвращаются в цикл, а жидкие продукты (бензин гидроформинга) подвергаются ректификации. Регенерация катализатора осуществляется так же, как и на установках каталитического крекинга [18, 78] выжигом отложенного кокса в струе воздуха остаточный воздух вместе с газообразными продуктами горения (двуокись углерода, окись углерода, азот и др.) нагретыми до 600° С и применяют для получения водяного пара. В качестве сырья используется фракция бензина прямой гонки. [c.131]
При полном горений большинства веществ образу ются двуокись углерода, пары воды, азот, сернистый и фосфорный ангидрид. При неполном горении обычно образуются токсичные, агрессивные, горючие и взрывоопасные продукты окись углерода, ширты, кетоны, альдегиды, кислоты и другие соединения. [c.314]
Была изучена зависимость количества энергии, излучаемой в сухих смесях окиси углерода с кислородом, от давления. Кривая давление — энергия излучения, по данным Гарнера и Холла, представляет собой приблизительно прямую линию, которая, однако, пересекает ось давления не в начале координат, а примерно при давлении, равном 120 мм Hg. Это обстоятельство рассматривается как указание на то, что инфракрасное излучение пламени окиси углерода имеет не только тепловую, но, по крайней мере частично, и химическую природу. Та-К011 вид этой зависимости может быть объяснен, если предположить, что среднее время жизни возбужденных молекул порядка 10 сек оно может быть даже значительно меньше, если только передача энергии между молекулами СОа происходит без затруднений. Эти заключения подтверждаются данными, полученными при изучении действия различных инертных примесей. Гелий, обладающий весьма высокой теплопроводностью, уменьшает инфракрасное излучение это указывает на то, что процесс излучения обусловлен, по крайней мере частично, тепловым делением в пламени. С другой стороны, кислород, азот, окись углерода и аргон несколько увеличивают количество испускаемой энергии, а это может быть объяснено, только если предположить, что большая часть энергии из л учае тс г впд е люмине сценции молекул СО2, образованных при горении. [c.176]
При сожжении азотсодержащих органических соединений происходят два процесса термическое разложение вещества и окисление как самого вещества, так и продуктов его распада. В том случае, когда сожжение прошло количественно, в газах горения в конечном итоге не должно присутствовать соединений, не окислившихся полностью. Поэтому, хотя при термическом разложении азотсодержащих веществ и могут, в зависимости от их свойств, образоваться такие продукты пиролиза, как аммиак, дициан, цианистый водород, закись, окись и двуокись азота, свободный азот, закись углерода и метан или другие летучие углеводороды, в действительности в газах горения присутствуют лишь азот, окись или двуокись азота. Значительно реже и лишь при сожжении некоторых азотсодержащих веществ появляется реальная возможность недоокисления углеводородов или нитрильной группы. Многие исследователи указывают также на возможность недогорания угля, содержащего азот В последнем случае получатся, конечно, пониженные результаты, так же как и при образовании N-гpyппы, которая [c.73]
При горении аммиака без катализатора получаются азот и водяной пар 4Nh4 + 302 = 2N2 + 6h30, а в присутствии катализатора — окись азота и водяной пар [c.58]
Для полного и быстрого горения газа необходимо создать хорошие условия перемещивания его с воздухом в соотнощени-ях, обеспечивающих протекание реакций взаимодействия между горючими компонентами и кислородом. Реакции полного сгорания комлонентав горючего газа и тепловой эффект горения представлены в табл. 27. Приведенные данные показывают, что при горении газов получаются продукты горения, состоящие из углекислоты и водяных паров. Если в газе содержатся сернистые соединения (например, сероводород), то в продуктах сгорания будет находиться сернистый газ. В дымовых газах также будут содержаться азот воздуха, поступивщего на сжигание таза, и избыточное (неизрасходованное) количество кислорода воздуха. При недостаточном поступлении воздуха в продуктах сгорания, как правило, содержится и окись углерода — продукт неполного горения углеводородных газов, а также несгоревшие компоненты газа. [c.115]
Среди примеров катализаторов реакций горения укажем воду НдО, которая влияет на реакцию окисления окиси углерода СО + /2 2 СЮа ). Механизм реакции, но которому протекает катализ, таков СО + НдО СОз -Ь -Ь 2Н и 2Н -1- 72 2 НзО. Окись азота (N0) также служит ката.лизатором реакции окисления СО по механизму N0 Ч- Оз -> 2N02 и N 3 + СО N0 -1- СОз. В обоих этих примерах промежуточное соединение (например, Н или КОз) образуется, а затем разлагается. Добавление небольшого количества КОз к смеси Нд — Оз приводит к взрыву с разветвленной цепной реакцией. [c.497]
Газы, которые состоят из атомов одного и того же рода, характеризуются тем, что атомы не обладают заряда.ми свободного электричества. Такие газы, как водород, кислород и азот, не излучают тепловой энергии и совершенно прозрачны для тепловых лучей, излучаемых каким-нибудь посторонни телом. Для технических расчетов большое значение имеет тепловое излучение углекислого газа и водяных паров, так как оба эти газа являются хорошими излучателями и присутствуют в больших количествах в газообразных продуктах горения. Окись углерода сернистый ангидрид и метан также хорошо излучают тепловую энергию, но присутствуют обычно в небольших концентрациях. На рис. 13-1 6 и 13-17 показаны спектры поглощения углекислоты и водяното пара. Из этих рисунков видно, что газы ведут себя не так, как твердые и жидкие тела, поскольку они излучают и поглощают лучистую энергию лишь определенных узких областей спектра. Для водяного пара эти области лежат сравнительно близко друг к другу. Излучение происходит главным образом в области с длиной волн более 1 мк, поэтому оно невидимо для глаза. Из ри-468 [c.468]
НОМ 3, И Нг К Н2О, превышающем 1,2, окалины на стали (не образуется. Поскольку от сжигания топлива до СО получается мало тепла, а несгоревший водород и вовсе не дает тепла, то невозможно при вышеуказанных соотношениях достичь температуры 1200°, если не принять каких-либо специальных мер для повышения температуры печи. Такими мерами могут быть сжигание топлива в кислороде или дожигание его в регенераторах или рекуператорах, которые служат для подогрева воздуха, расходуемого на горение или дожигание газов в особой камере, из которой тепло передается в нагревательное пространство через тонкую муфельную стенку. Номограмма на рис. 151 применима только для железа и стали. Разные металлы имеют различное химическое сродство с кислородом. Чтобы для других металлов получить номограмму, аналогичную изображенной на рис. 151, надо ее продлить в направлении обеих стрелок. Такое распространение номограммы на другие металлы было выполнено тем же Нейманном (рис. 152). Номограмма дана в логарифмических координатах со следующими делениями 1, 2, 5, 10, 20, 50, 100 и т. д. Более мелкие деления показаны на вспомогательных шкалах. iMeждy прочим, из рис. 152 видно, что никель в так называемой окислительной атмосфере печи не окисляется. Количество водорода может составлять нё более 1% от количества водяного пара, а окиси углерода — всего 1 % от количества углекислого газа, никель окисляться не будет. Кривая равновесия марганца располагается вблизи противоположного конца номограммы. При температурах, поддерживаемых в печи, марганец будет окисляться даже в том случае, если атмосфера печи будет состоять из чистого водорода, окиси углерода и инертного газа, например азота. Активность марганца при высоких температурах по отношению к кислороду используется для восстановления стали в мартеновских печах. В атмосфере, состоящей из окиси углерода и инертного газа, марганец при температурах печи окисляется благодаря реакции 2С0 = С -f СО2. Хотя окись углерода (СО) при повышенных температурах является весьма устойчивым соединением, указанное выше явление временной и исчезающей диссоциации обусловливает и эту быстг ро протекающую реакцию. Вновь возникающие молекулы углекислого газа диссоциируют таким же способом, и марганец окисляется временно освобождающимся кислородом. На рис. 152 приведены также кривые равновесия других используемых в промышленности металлов. [c.201]
Авторы изучили зависимость количества образующейся окиси азота от состава смеси при взрывах смесей, содержащих, кроме кислорода и азота, различные горючие компоненты (водород, окись углерода, этилен, метан). Оказалось, что выход окиси азота зависит от температуры горения, а не от химической спещ1фики горючего компонента, что свидетельствует в пользу предположения о термическом характере окисления азота. Это предположение было затем подтверждено другими специальными опытами. [c.105]
Капролактам, ластам е-аминокапроновой кислоты eHiiON, горючее бесцветное кристаллическое вещество. Мол. вес 113,16 плотн. 1023 кг/ж при 70° С т. пл. 69— 71° С т. кип. 262,5° С теплота сгорания 7100 ккал/кг-, очень гигроскопичен растворимость в воде 525% вес. в твердом виде хорошо смачивается водой. Т всп. 135° С т. самовоспл. 400° С нижн. предел воспл. около 1,3% объемн. нижн. темп, предел воспл. технического npd-дукта 123° С, скорость выгорания 1,53 кг м -мин)-, прп горении плавится и растекается, выделяет много дыма, в котором содержатся токсичные вещества (окислы азота, аммиак, окись углерода). Тушить тонкораспылеиной [c.119]
Сжигание высокосернистых мазутов сопровождается образованием окислов азота и серного ангидрида, обладающирс большой токсичностью. Наряду с этими токсичными окислами в продуктах сгорания топлив содержится некоторое количество окиси углерода. Однако, как показано Д. А. Франк-Каменецким, в процессе горения углеводородных топлив окись углерода образуется в начальной стадии и затем догорает в завершающей стадии горения. Поэтому основными загрязнителями воздуха вредными газами являются окислы азота и серы, а при сжигании природного газа — окислы азота. [c.217]
Исследования, относящиеся к химии, заложили основы науки о газах, или пневматической химии. Создал ряд приборов для изучения газов. Занимался изучением углекислого газа — воздуха, испорченного горением или дыханием и очищенного зелеными частями растений. Впервые получил солянокислый воздух — хлористый водород (1772), селитряный воздух — закись азота (1772), заметив, что он при соприкосновении с воздухом переходит в газ бурого цвета. Открыл (1772— 1774) щелочной воздух —аммиак. Открыл (1774) бесфлогнстонный воздух — кислород, получив его при нагревании оксида ртути. Изучил растворение углекислого газа и аммиака в воде. Получил продукт соединения серной и азотной кислот (названный позднее нитро-зилсерной кислотой) выделил (1775—1799) индивидуальные фтористый кремний, сернистый газ и окись углерода. Результаты своих химических исследований опубликовал в сочинении Опыты и наблюдения над различными видами воздуха (т. 1—3, 1774—1777). В теоретических воззрениях придерживался гипотезы флогистона. [c.409]
Сжатые и сжиженные газы также делятся на две подгруппы 1) горючие и поддерживающие горение водород, ацетилен, окись этилена, пропилен, дивинил, блаугаз, водяной газ, кислород сжатый и жидкий, воздух сжатый и жидкий, сероводород 2) инертные и негорючие газы аргон, гелий, неон, азот, углекислый газ, аммиак, сернистый ангидрид. [c.254]
В кадестве инертных, флегматизаторов обычно применяют дву-, окись, углерода, пары воды, азот, отработанные дымовые газы. Горение большинства реществ становится невозможным при сни жении содержания кислорода в смеси до 12—16% И[об.у. Для некоторых веществ с широкой областью воспламенения ир д ль [c.292]
Было найдено, что при изменении температуры поверхности углерода от 1500 до 2000°К скорость горения углерода из нефтяного кокса увеличивается пропорционально корню квадратному из скорости потока газа. Было показано, что во всем исследованном диапазоне температур скорость горения углерода из нефтяного кокса прямо пропорциональна концентрации кислорода при изменении ее от 37 до 100%. По мере того как скорость потока газа увеличивалась от 25 до 305 м сек, кажущаяся энергия активации для горения углерода из нефтяного кокса уменьшалась от 5,3 до 2,3 ккал1моль. Было найдено, что азот, гелий, двуокись и окись углерода действовали на горение только как разбавители пары воды уменьшали отношение СО/СОг, а хлор сильно тормозил реакцию горения. [c.257]
При выделении ацетилена из более сложных газовых смесей, например из продуктов неполного горения природного газа, хроматографическое разделение может сочетаться с дополнительным абсорбционным извлечением компонентов [И ]. В результате окисления природного газа получается газовая смесь, содержащая в основном водород и азот, а также двуокись углерода, окись углерода, метан, ацетилен, этан и этилен. При гиперсорбционном разделении этой смеси на два компонента с верха колонны выделяется смесь, [c.260]
Влияние весового отношения оки-горючеыу (топливо—азотная кисло-окислов азота + анилин) на удельную тягу и температуру горения по расчетным данным (при давлении ц камере 21 атм). [c.268]
В процессе горения образуются продукты сгорания, состоящие из двуокиси углерода, сернистого ангидрида, паров воды, избыточного кислорода и азота. В случае неполного сгорания могут присутствовать также окись углерода, несгоревшие углеводороды, водород, сажа. Общее количество продуктов сгорания (ЪМ, кмоль1кг) при полном сгорании топлива выражается уравнением [c.84]
chem21.info
Горение в окиси азота угля
Получение генераторного газа осуществляют в специальных печах— газогенераторах. Это высокие (около 5 м) цилиндрические печи, в которые сверху загружают топливо, например уголь, а снизу поступает воздух рис. 65). При горении топлива в нижней части генератора образуется углекислый газ, который, поднимаясь кверху, восстанавливается накаленным углем в окись углерода. Окись углерода вместе с азотом воздуха выходит из печи и собирается в приемник. Эта смесь содержит на один объем окиси углерода около двух объемов азота и называется воздушным газом. [c.203]
Закись азота легко разлагается на азот и кислород при действии жара и ряда электрических искр, а это объясняет то, что множество тел, не могущих гореть в окиси азота, напротив того, весьма легко горят в закиси. Действительно, окись азота, если, разлагаясь, дает кислород, — тотчас же поглощает его, образуя прочную NO , а в закиси азота зовсе нет этой способности прямо далее соединяться с кислородом. Смесь закиси азота с водородом взрывает точно так, как гремучий газ, причем образуется, конечно, газообразный азот N -0- -H = = Н О -)- N . Объем остающегося азота равен первоначальному объему взятой закиси азота и равен объему водорода, входящего в соединение с кислородом значит, равные объемы азота и водорода в этой реакции замещают друг друга. Зажженные сера, фосфор, уголь горят, хотя и не столь ярко, как в кислороде. При горении в закиси азота развивается более тепла, чем при горении того же количества тел в кислороде, что и показывает ясным образом, что при соединении азота с кислородом для образования закиси азота произошло поглощение тепла (21000 кал. на 44 г №0). Если разлагают данный объем закиси азота металлом, напр., натрием, то по охлаждении остается совершенно такой же объем азота, какой имела закись следовательно, кислород, так сказать, располагается между атомами азота, не производя при этом увеличения в объеме азота. [c.209]
Селитра представляет бесцветную соль, имеющую особый прохладительный вкус. Она легко кристаллизуется длинными, по бокам бороздчатыми, ромбическими шестигранными призмами, оканчивающимися такими же пирамидами. Ее кристаллы (уд- вес 1,93) не содержат воды. При слабом накаливании (339°) селитра плавится в совершенно бесцветную жидкость. При обыкновенной температуре в твердом виде КЫО малодеятельна и неизменна, но при возвышенной температуре она действует, как весьма сильное окисляющее средство, потому что может отдать смешанным с нею веществам значительное количество кислорода. Брошенная на раскаленный уголь, селитра производит быстрое его горение, а механическая смесь ее с измельченным углем загорается от прикосновения с накаленным телом и продолжает сама собою гореть. При этом выделяется азот, а кислород селитры идет на, окисление угля, вследствие чего и получаются углекалиевая соль и углекислый газ (или окись углерода) 4КЫО - С = = 2К СО ЗСО - -2№. Явление зависит от того, что при этом отделяется много тепла и раз начавшееся горение может само собою продолжаться, не требуя накаливания. Подобное же горение происходит и при нагревании селитры с серою и различными другими горючими телами. Напр. 2КЫО -(-25= = К ЗО О . В особенности замечательно окисление таких металлов, которые способны давать с избытком кислорода кислотные окислы, остающиеся при этом в соединении с окисью калия в виде калиевых солей. Таковы, напр., марганец, сурьма, мышьяк, железо, хром и др. Эти элементы, как С и 5, вытесняют свободный азот. Низшие степени окисления этих металлов, сплавленные с селитрою, переходят в самые высшие степени окисления. Понятно, после этого, что в химической практике и технике селитра употребляется во многих случаях как окислительное средство, действующее при высокой темпе[>атуре. На этом же основано применение ее для обыкновенного пороха, который есть механическая смесь мелко измельченных серы, селитры и угля. Относительное содержание этих веществ меняется, смотря по назначению пороха и по свойству угля, употребленного для состава (уголь берется рыхлый, не совершенно прокаленный и потому содержащий водород и кислород). При горении образуются газы, а именно — преимущественно азот, углекислый газ и окись углерода, которые и производят значительное давление, если свободный выход образующихся газов чем-либо прегражден. [c.29]
chem21.info