Валентность гелия. Гелий формула
Гелий и его характеристики
Общая характеристика гелия
Гелий встречается на Земле в основном в атмосфере, однако некоторые его количества выделяются в определенных местах из недр Земли вместе с природными газами. Воды многих минеральных источников тоже выделяют гелий.
Хотя содержание гелия в воздухе невелико, во Вселенной он занимает второе место по распространенности (после водорода). Спектральный анализ показывает присутствие этого элемента во всех звездах.
Гелий представляет собой бесцветный, трудносжижаемый газ (температура кипения -268,9oС), затвердевающий только под избыточным давлением (схема строения атома представлена на рис. 1). Обладает сильной способностью проникать через стекло и металлическую фольгу. Плохо растворяется в воде, лучше – в бензоле, этаноле, толуоле.
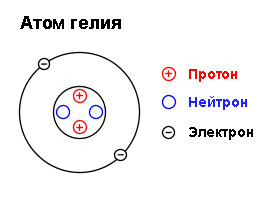
Рис. 1. Строение атома гелия.
Атомная и молекулярная масса гелия
Поскольку в свободном состоянии гелий существует в виде одноатомных молекул He, значения его атомной и молекулярной масс совпадают. Они равны 4,003.
Изотопы гелия
Гелий – наиболее распространенный после водорода элемент космоса – состоит из двух стабильных изотопов: 4He и 3He. Их массовые числа равны 4 и 3. Ядро атома гелия 4He содержит два протона и два нейтрона, а атома 3He – такое же число протонов и один нейтрон.
Спектральный анализ показывает присутствие его в атмосфере Солнца, звезд, в метеоритах. Накапливание ядер 4He во Вселенной обусловлено термоядерной реакцией, служащей источником солнечной и звездной энергии.
Ионы гелия
В обычных условиях гелий химически инертен, но при сильном возбуждении атомов он может образовывать молекулярные ионы He2+[ss2ss*1]. В обычных условиях эти ионы неустойчивы; захватывая недостающий электрон, они распадаются на два нейтральных атома.
Молекула и атом гелия
В свободном состоянии гелий существует в виде одноатомных молекул He.
Примеры решения задач
Плотность гелия (He), значение и примеры
Плотность гелия и другие его физические свойства
По физическим свойствам гелий наиболее близок к молекулярному водороду. Вследствие ничтожной поляризуемости атомов гелия у него самые низкие температуры кипения (-269oС) и плавления (-271oС при 2,5×106 Па).
Гелий по сравнению с другими элементами обладает наибольшей энергией ионизации атома (24,59 эВ). Особая устойчивость электронной структуры атома отличает гелий от остальных элементов Периодической системы Д.И. Менделеева.
Гелий хуже других газов растворяется в воде и других растворителях. В 1 л воды, например, растворяется при 0oС менее 10 мл гелия, т.е. в два с лишним раза меньше, чем молекул водорода (h3), и в 51000 раз меньше, чем молекул хлороводорода (HCl).
После водорода гелий – самый легкий из всех газов. Он более чем в 7 раз легче воздуха.
Плотность гелия равна 0,178кг/м3. Важнейшие константы гелия представлены в таблице ниже:
Таблица 1. Физические свойства гелия.
|
Плотность, кг/м3 |
0,178 |
|
Температура плавления, oС |
-271 |
|
Температура кипения, oС |
-269 |
Распространенность гелия в природе
Гелий относится к группе благородный газов. Он впервые был обнаружен на Солнце, а затем и на Земле. Спектральный анализ показывает присутствие гелия в атмосфере звезд и в метеоритах.
Краткое описание химических свойств и плотность гелия
Для инертных газов характерно полное или почти полное отсутствие химической активности. Так, в обычных условиях гелий химически инертен, но при сильном возбуждении атомов он может образовывать молекулярные ионы He2+[ss2ss*1]. В обычных условиях эти ионы неустойчивы; захватывая недостающий электрон, они распадаются на два нейтральных атома.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
Валентность гелия (He), формулы и примеры
Общие сведения о валентности гелия
По физическим свойствам гелий наиболее близок к молекулярному водороду. Вследствие ничтожной поляризуемости атомов гелия у него самые низкие температуры кипения (-269oС) и плавления (-271oС при 2,5×106 Па).
Гелий по сравнению с другими элементами обладает наибольшей энергией ионизации атома (24,59 эВ). Особая устойчивость электронной структуры атома отличает гелий от остальных элементов Периодической системы Д.И. Менделеева.
Гелий хуже других газов растворяется в воде и других растворителях. В 1 л воды, например, растворяется при 0oС менее 10 мл гелия, т.е. в два с лишним раза меньше, чем молекул водорода (h3), и в 51000 раз меньше, чем молекул хлороводорода (HCl).
После водорода гелий – самый легкий из всех газов. Он более чем в 7 раз легче воздуха.
Валентность гелия в соединениях
Ядро атома гелия содержит два протона и два нейтрона (массовое число гелия равно 4-м). Как и в атоме водорода, у гелия есть всего один энергетический уровень, на котором находятся два электрона (рис. 1).
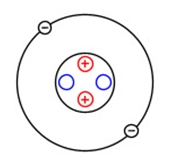
Рис. 1. Строение атома гелия.
Электронная формула атома гелия в основном состоянии выглядит следующим образом:
1s2.
А энергетическая диаграмма:

Поскольку на s-подуровне может содержаться не более 2-х электронов, то внешний энергетический уровень гелия является завершенным. В этой связи гелий является малоактивным химическим элементом и выделен в группу инертных газов. Т.е., можно сказать, что валентность гелия равна нулю.
Однако, при сильном возбуждении атомов он может образовывать молекулярные ионы He+2[σ2sσ*1s]. В обычных условиях эти ионы неустойчивы; захватывая недостающий электрон, они распадаются на два нейтральных атома. Возможно также образование ионизированных молекул HeH+[σ2s].
Примеры решения задач
ru.solverbook.com
История открытия:18 августа 1868 года французский учёный Пьер Жансен во время полного солнечного затмения в индийском городе Гунтур впервые исследовал хромосферу Солнца. Спектроскопия солнечных протуберанцев наряду с линиями водорода - синей, зелено-голубой и красной - выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Независимо от него английский астроном Норман Локьер обнаружил в спектре неизвестную жёлтую линию с длиной волны 587,56 нм, и обозначил её как D3. Спустя два года Локьер, совместно с английским химиком Эдвардом Франкландом, пришел к мнению, что эта ярко-жёлтая линия не принадлежит ни одному из ранее известных химических элементов и предложил дать новому элементу название "гелий" (от греч. hlioz - "солнце"). Нахождение в природе, получение:Гелий занимает второе место по распространённости во Вселенной после водорода - около 23% по массе. Однако на Земле гелий редок, образуясь в результате альфа-распада тяжёлых элементов. В рамках восьмой группы гелий по содержанию в земной коре занимает второе место (после аргона). Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5·1014 м3. Гелионосные природные газы содержат как правило до 2% гелия по объёму (редко 8-16%). Среднее содержание гелия в земном веществе - 3 г/т. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8-3,5 л/кг, а в торианите оно достигает 10,5 л/кг. Природный гелий состоит из двух стабильных изотопов: 4He и 3He. Известны ещё шесть искусственных радиоактивных изотопов гелия. В промышленности гелий получают из гелийсодержащих природных газов. Физические свойства:Простое вещество гелий - нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ, Tкип = 4,2K (наименьшая среди всех простых веществ). При атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. При нормальных условиях гелий ведёт себя практически как идеальный газ. Плотность 0,17847 кг/м3. Он обладает теплопроводностью (0,1437 Вт/(м·К) при н.у.) большей, чем у других газов, кроме водорода. Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Гелий менее растворим в воде, чем любой другой известный газ (при 20°C около 8,8 мл/л). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.При пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Химические свойства:Гелий - наименее химически активный элемент восьмой группы таблицы Менделеева. В газовой фазе он может образовывать (при действии электрического разряда или ультрафиолетового излучения) так называемые эксимерные молекулы, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние: двухатомные молекулы He2, фторид HeF, хлорид HeCl. Время жизни таких частиц очень мало, обычно составляет считанные наносекунды. В отличие от многих других газов гелий не образует клатратов, так как маленькие атомы гелия "ускользают" из слишком больших для них пустот в структуре воды. Применение:Уникальные свойства гелия широко используются: - в металлургии в качестве защитного инертного газа для выплавки чистых металлов; - в пищевой промышленности зарегистрирован в качестве пищевой добавки E939, в качестве пропеллента и упаковочного газа; - в качестве хладагента для получения сверхнизких температур; - для наполнения воздухоплавающих судов (дирижабли), воздушных шаров и оболочек метеорологических зондов; - в качестве теплоносителя в некоторых типах ядерных реакторов; - в качестве носителя в газовой хроматографии; - для поиска утечек в трубопроводах и котлах; - для заполнения газоразрядных трубок; - как компонент рабочего тела в гелий-неоновых лазерах; - в технике нейтронного рассеяния в качестве поляризатора и наполнителя для позиционно-чувствительных нейтронных детекторов; - в дыхательных смесях для глубоководного погружения; - для изменения тембра голосовых связок (эффект повышенной тональности голоса) за счет различия плотности обычной воздушной смеси и гелия, и т.д; - нуклид 3He является перспективным топливом для термоядерной энергетики. Барышева Д., Ильиных Н. ХФ ТюмГУ, 571 группа. Источники: Википедия: http://ru.wikipedia.org/wiki/Гелий,Онлайн Энциклопедия Кругосвет. Гелий | |
 | КонТрен – Химия для школьников, студентов, учителей ...подготовка к экзаменам и олимпиадам |
www.kontren.narod.ru
Гелий - это... Что такое Гелий?
| Ге́лий/Helium (He), 2 | |
| 4,002602 а. е. м. (г/моль) | |
| 1s2 | |
| ? (31)[1]пм | |
| 28[1]пм | |
| 93[1]пм | |
| 4,5 (шкала Полинга) | |
| 0 | |
| 0 | |
| 2361,3(24,47) кДж/моль (эВ) | |
| 0,147 (при −270 °C) 0,00017846 (при +20 °C) г/см³ | |
| 0,95 (при 2,5 МПа) | |
| 4,215 (для 4He)[2] | |
| 0,08 кДж/моль | |
| 20,79[2] Дж/(K·моль) | |
| 31,8 см³/моль | |
| гексагональная | |
| a=3,570; c=5,84 Å | |
| 1,633 | |
| (300 K) 0,152 Вт/(м·К) | |
Ге́лий — второй элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 2. Расположен в главной подгруппе восьмой группы, первом периоде периодической системы. Возглавляет группу инертных газов в периодической системе Менделеева. Обозначается символом He (лат. Helium). Простое вещество гелий (CAS-номер: 7440-59-7) — инертный одноатомный газ без цвета, вкуса и запаха.
Гелий — один из наиболее распространённых элементов во Вселенной, он занимает второе место после водорода. Также гелий является вторым по лёгкости (после водорода) химическим веществом.
Гелий добывается из природного газа процессом низкотемпературного разделения — так называемой фракционной перегонкой (см. Фракционная дистилляция в статье Дистилляция).
История
18 августа 1868 года французский учёный Пьер Жансен, находясь во время полного солнечного затмения в индийском городе Гунтур, впервые исследовал хромосферу Солнца. Жансену удалось настроить спектроскоп таким образом, чтобы спектр короны Солнца можно было наблюдать не только при затмении, но и в обычные дни. На следующий же день спектроскопия солнечных протуберанцев наряду с линиями водорода — синей, зелено-голубой и красной — выявила очень яркую жёлтую линию, первоначально принятую Жансеном и другими наблюдавшими её астрономами за линию D натрия. Жансен немедленно написал об этом во Французскую Академию наук. Впоследствии было установлено, что ярко-жёлтая линия в солнечном спектре не совпадает с линией натрия и не принадлежит ни одному из ранее известных химических элементов[3][4].
Спустя два месяца 20 октября английский астроном Норман Локьер, не зная о разработках французского коллеги, также провёл исследования солнечного спектра. Обнаружив неизвестную жёлтую линию с длиной волны 588 нм (более точно 587,56 нм), он обозначил её D3, так как она была очень близко расположена к Фраунгоферовым линиям D1 (589,59 нм) и D2 (588,99 нм) натрия. Спустя два года Локьер, совместно с английским химиком Эдвардом Франкландом, в сотрудничестве с которым он работал, предложил дать новому элементу название «гелий» (от др.-греч. ἥλιος — «солнце»)[4].
Интересно, что письма Жансена и Локьера пришли во Французскую Академию наук в один день — 24 октября 1868 года, однако письмо Локьера, написанное им четырьмя днями ранее, пришло на несколько часов раньше. На следующий день оба письма были зачитаны на заседании Академии. В честь нового метода исследования протуберанцев Французская академия решила отчеканить медаль. На одной стороне медали были выбиты портреты Жансена и Локьера над скрещенными ветвями лавра, а на другой — изображение мифического бога Солнца Аполлона, правящего в колеснице четверкой коней, скачущей во весь опор[4].
В 1881 году итальянец Луиджи Пальмиери опубликовал сообщение об открытии им гелия в вулканических газах (фумаролах). Он исследовал светло-желтое маслянистое вещество, оседавшее из газовых струй на краях кратера Везувия. Пальмиери прокаливал этот вулканический продукт в пламени бунзеновской горелки и наблюдал спектр выделявшихся при этом газов. Ученые круги встретили это сообщение с недоверием, так как свой опыт Пальмиери описал неясно. Спустя многие годы в составе фумарол действительно были найдены небольшие количества гелия и аргона[4].
Только через 27 лет после своего первоначального открытия гелий был обнаружен на Земле — в 1895 году шотландский химик Уильям Рамзай, исследуя образец газа, полученного при разложении минерала клевеита, обнаружил в его спектре ту же ярко-жёлтую линию, найденную ранее в солнечном спектре. Образец был направлен для дополнительного исследования известному английскому ученому-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия. 23 марта 1895 года Рамзай отправил сообщение об открытии им гелия на Земле в Лондонское королевское общество, а также во Французскую академию через известного химика Марселена Бертло[4].
Шведские химики П. Клеве и Н. Ленгле смогли выделить из клевеита достаточно газа, чтобы установить атомный вес нового элемента[источник не указан 1252 дня].
В 1896 году Генрих Кайзер, Зигберт Фридлендер, а еще через два года Эдвард Бэли окончательно доказали присутствие гелия в атмосфере[4][5][6].
Еще до Рамзая гелий выделил также американский химик Фрэнсис Хиллебранд, однако он ошибочно полагал, что получил азот[6] и в письме Рамзаю признал за ним приоритет открытия.
Исследуя различные вещества и минералы, Рамзай обнаружил, что гелий в них сопутствует урану и торию. Но только значительно позже, в 1906 году, Резерфорд и Ройдс установили, что альфа-частицы радиоактивных элементов представляют собой ядра гелия. Эти исследования положили начало современной теории строения атома[7].
График зависимости теплоёмкости жидкого гелия от температурыТолько в 1908 году нидерландскому физику Хейке Камерлинг-Оннесу удалось получить жидкий гелий дросселированием (см. Эффект Джоуля — Томсона), после того как газ был предварительно охлажден в кипевшем под вакуумом жидком водороде. Попытки получить твёрдый гелий еще долго оставались безуспешными даже при температуре в 0,71 K, которых достиг ученик Камерлинг-Оннеса — немецкий физик Виллем Хендрик Кеезом. Лишь в 1926 году, применив давление выше 35 атм и охладив сжатый гелий в кипящем под разрежением жидком гелии, ему удалось выделить кристаллы[8].
В 1932 году Кеезом исследовал характер изменения теплоёмкости жидкого гелия с температурой. Он обнаружил, что около 2,19 K медленный и плавный подъём теплоёмкости сменяется резким падением и кривая теплоёмкости приобретает форму греческой буквы λ (лямбда). Отсюда температуре, при которой происходит скачок теплоёмкости, присвоено условное название «λ-точка»[8]. Более точное значение температуры в этой точке, установленное позднее — 2,172 K. В λ-точке происходят глубокие и скачкообразные изменения фундаментальных свойств жидкого гелия — одна фаза жидкого гелия сменяется в этой точке на другую, причем без выделения скрытой теплоты; имеет место фазовый переход II рода. Выше температуры λ-точки существует так называемый гелий-I, а ниже её — гелий-II[8].
В 1938 году советский физик Пётр Леонидович Капица открыл явление сверхтекучести жидкого гелия-II, которое заключается в резком снижении коэффициента вязкости, вследствие чего гелий течёт практически без трения[8][9]. Вот что он писал в одном из своих докладов про открытие этого явления[10]:
… такое количество тепла, которое фактически переносилось, лежит за пределами физических возможностей, что тело ни по каким физическим законам не может переносить больше тепла, чем его тепловая энергия, помноженная на скорость звука. С помощью обычного механизма теплопроводности тепло не могло переноситься в таком масштабе, как это наблюдалось. Надо было искать другое объяснение.И вместо того, чтобы объяснить перенос тепла теплопроводностью, то есть передачей энергии от одного атома к другому, можно было объяснить его более тривиально — конвекцией, переносом тепла в самой материи. Не происходит ли дело так, что нагретый гелий движется вверх, а холодный опускается вниз, благодаря разности скоростей возникают конвекционные токи, и таким образом происходит перенос тепла. Но для этого надо было предположить, что гелий при своем движении течет без всякого сопротивления. У нас уже был случай, когда электричество двигалось без всякого сопротивления по проводнику. И я решил, что гелий так же движется без всякого сопротивления, что он является не сверхтеплопроводным веществом, а сверхтекучим. …… Если вязкость воды равняется 10−2 П, то это в миллиард раз более текучая жидкость, чем вода …
Происхождение названия
От греч. ἥλιος — «Солнце» (см. Гелиос). Любопытен тот факт, что в названии элемента было использовано характерное для металлов окончание «-ий» (по лат. «-um» — «Helium»), так как Локьер предполагал, что открытый им элемент является металлом. По аналогии с другими благородными газами логично было бы дать ему имя «гелион» («Helion»)[4]. В современной науке название «гелион» закрепилось за ядром лёгкого изотопа гелия — гелия-3.
Распространённость
Во Вселенной
Гелий занимает второе место по распространённости во Вселенной после водорода — около 23 % по массе[11]. Однако на Земле гелий редок. Практически весь гелий Вселенной образовался в первые несколько минут после Большого Взрыва[12][13], во время первичного нуклеосинтеза. В современной Вселенной почти весь новый гелий образуется в результате термоядерного синтеза из водорода в недрах звёзд (см. протон-протонный цикл, углеродно-азотный цикл). На Земле он образуется в результате альфа-распада тяжёлых элементов (альфа-частицы, излучаемые при альфа-распаде — это ядра гелия-4)[14]. Часть гелия, возникшего при альфа-распаде и просачивающегося сквозь породы земной коры, захватывается природным газом, концентрация гелия в котором может достигать 7 % от объёма и выше.
Земная кора
В рамках восьмой группы гелий по содержанию в земной коре занимает второе место (после аргона)[15].
Содержание гелия в атмосфере (образуется в результате распада Ac, Th, U) — 5,27·10−4 % по объёму, 7,24·10−5 % по массе[2][6][14]. Запасы гелия в атмосфере, литосфере и гидросфере оцениваются в 5·1014 м³[2]. Гелионосные природные газы содержат как правило до 2 % гелия по объёму. Исключительно редко встречаются скопления газов, гелиеносность которых достигает 8 — 16 %[14].
Среднее содержание гелия в земном веществе — 0,003 мг/кг или 0,003 г/т[14]. Наибольшая концентрация гелия наблюдается в минералах, содержащих уран, торий и самарий: клевеите, фергюсоните, самарските, гадолините, монаците (монацитовые пески в Индии и Бразилии), торианите. Содержание гелия в этих минералах составляет 0,8 — 3,5 л/кг, а в торианите оно достигает 10,5 л/кг[6][14]. Этот гелий является радиогенным и содержит лишь изотоп 4He, он образуется из альфа-частиц, излучаемых при альфа-распаде урана, тория и их дочерних радионуклидов.
Определение
Качественно гелий определяют с помощью анализа спектров испускания (характеристические линии 587,56 нм и 388,86 нм), количественно — масс-спектрометрическими и хроматографическими методами анализа, а также методами, основанными на измерении физических свойств (плотности, теплопроводности и др.)[2].
Физические свойства
Гелий — практически инертный химический элемент.
Простое вещество гелий — нетоксично, не имеет цвета, запаха и вкуса. При нормальных условиях представляет собой одноатомный газ. Его точка кипения (T = 4,215 K для 4He) наименьшая среди всех простых веществ; твёрдый гелий получен лишь при давлениях выше 25 атмосфер — при атмосферном давлении он не переходит в твёрдую фазу даже при крайне близких к абсолютному нулю температурах. Экстремальные условия также необходимы для создания немногочисленных химических соединений гелия, все они нестабильны при нормальных условиях.
Химические свойства
Гелий — наименее химически активный элемент восьмой группы таблицы Менделеева (инертные газы) [16]. Многие соединения гелия существуют только в газовой фазе в виде так называемых эксимерных молекул, у которых устойчивы возбуждённые электронные состояния и неустойчиво основное состояние. Гелий образует двухатомные молекулы He2+, фторид HeF, хлорид HeCl (эксимерные молекулы образуются при действии электрического разряда или ультрафиолетового излучения на смесь гелия с фтором или хлором).
Энергия связи молекулярного иона гелия He2+ составляет 58 ккал/моль, равновесное межъядерное расстояние 1,09 Å.[17]
Известно химическое соединение гелия LiHe (возможно, имелось в виду соединение LiHe7)[18][19].
Свойства в газовой фазе
Спектральные линии гелияПри нормальных условиях гелий ведёт себя практически как идеальный газ. При всех условиях гелий является моноатомным веществом. При нормальных условиях, плотность составляет 0,17847 кг/м³, обладает теплопроводностью 0,1437 Вт⁄(м·К) — бо́льшей, чем у всех других газов за исключением водорода, а его удельная теплоёмкость чрезвычайно высока (ср = 5,23 кДж⁄(кг·К), для сравнения — 14,23 кДж⁄(кг·К) для Н2).
Символ элемента, выполненный из газоразрядных трубок, наполненных гелиемПри пропускании тока через заполненную гелием трубку наблюдаются разряды различных цветов, зависящих главным образом от давления газа в трубке. Обычно видимый свет спектра гелия имеет жёлтую окраску. По мере уменьшения давления происходит смена цветов — розового, оранжевого, жёлтого, ярко-жёлтого, жёлто-зелёного и зелёного. Это связано с присутствием в спектре гелия нескольких серий линий, расположенных в диапазоне между инфракрасной и ультрафиолетовой частями спектра, важнейшие линии гелия в видимой части спектра лежат между 706,52 нм и 447,14 нм[8]. Уменьшение давления приводит к увеличению длины свободного пробега электрона, то есть к возрастанию его энергии при столкновении с атомами гелия. Это приводит к переводу атомов в возбуждённое состояние с бо́льшей энергией, в результате чего и происходит смещение спектральных линий от инфракрасного к ультрафиолетовому краю.
Хорошо изученный спектр гелия имеет два резко различных набора серий линий — единичных (1S0) и триплетных (3S1), поэтому в конце 19 века Локьер, Рунге и Пашен предположили, что гелий состоит из смеси двух газов; один из них имел в спектре жёлтую линию 587,56 нм, другой — зелёную 501,6 нм. Этот второй газ они предложили назвать астерием (Asterium) от греч. звёздный. Однако Рамзай и Траверс показали, что спектр гелия зависит от условий: при давлении газа 7—8 мм рт.ст. наиболее ярка жёлтая линия; при уменьшении давления увеличивается интенсивность зелёной линии. Спектры атома гелия были объяснены Гейзенбергом в 1926 г.[20] (см. Обменное взаимодействие). Спектр зависит от взаимного направления спинов электронов в атоме — атом с противоположно направленными спинами (дающий зелёную линию в оптических спектрах) получил название парагелия, с сонаправленными спинами (с жёлтой линией в спектре) назван ортогелием. Линия парагелия — одиночки, линии ортогелия — весьма узкие триплеты. Атом гелия в нормальных условиях находится в одиночном (синглетном) состоянии. Чтобы атом гелия перевести в триплетное состояние, нужно затратить работу в 19,77 эВ. Переход атома гелия из триплетного состояния в синглетное сам по себе осуществляется чрезвычайно редко. Такое состояние, из которого переход в более глубокое сам по себе маловероятен, носит название метастабильного. Вывести атом из метастабильного состояния в стабильное можно, подвергая атом внешнему воздействию, например, электронным ударом или при столкновении с другим атомом с передачей последнему непосредственно энергии возбуждения.[21] В атоме парагелия (синглетного состояния гелия) спины электронов направлены противоположно, и суммарный спиновый момент равен нулю. В триплетном состоянии (ортогелий) спины электронов сонаправлены, суммарный спиновый момент равен единице. Принцип Паули запрещает двум электронам находиться в состоянии с одинаковыми квантовыми числами, поэтому электроны в низшем энергетическом состоянии ортогелия, имея одинаковые спины, вынуждены иметь различные главные квантовые числа: один электрон находится на 1s-орбитали, а второй — на более удалённой от ядра 2s-орбитали (состояние оболочки 1s2s). У парагелия оба электрона находятся в 1s-состоянии (состояние оболочки 1s2).
Спонтанный интеркомбинационный (то есть сопровождающийся изменением суммарного спина) переход с излучением фотона между орто- и парагелием чрезвычайно сильно подавлен, однако возможны безызлучательные переходы при взаимодействии с налетающим электроном или другим атомом.
В бесстолкновительной среде (например, в межзвёздном газе) спонтанный переход из нижнего состояния ортогелия 23S1 в основное состояние парагелия 10S1 возможен путём излучения одновременно двух фотонов или в результате однофотонного магнитно-дипольного перехода (M1). В этих условиях расчётное время жизни атома ортогелия за счёт двухфотонного распада 23S1 → 10S1 + 2γ составляет 2,49·108 с, или 7,9 года[22]. Первые теоретические оценки[23] показывали[24], что время жизни за счёт магнитно-дипольного перехода на порядки больше, то есть что доминирует двухфотонный распад. Лишь через три десятилетия, после неожиданного открытия запрещённых триплетно-синглетных переходов некоторых гелиеподобных ионов в спектрах солнечной короны[25] было обнаружено[26], что однофотонный магнитно-дипольный распад 23S1-состояния значительно более вероятен; время жизни при распаде по этому каналу составляет «всего» 8·103 с[27].
Следует отметить, что время жизни первого возбуждённого состояния атома парагелия 20S1 также крайне велико по атомным масштабам. Правила отбора для этого состояния запрещают однофотонный переход 20S1 → 10S1 + γ[28], а для двухфотонного распада время жизни составляет 19,5 мс[22].
Гелий менее растворим в воде, чем любой другой известный газ. В 1 л воды при 20 °C растворяется около 8,8 мл (9,78 при 0 °C, 10,10 при 80 °C), в этаноле — 2,8 мл/л (15 °C), 3,2 мл/л (25 °C). Скорость его диффузии сквозь твёрдые материалы в три раза выше, чем у воздуха, и приблизительно на 65 % выше, чем у водорода.
Коэффициент преломления гелия ближе к единице, чем у любого другого газа. Этот газ имеет отрицательный коэффициент Джоуля — Томсона при нормальной температуре среды, то есть он нагревается, когда ему дают возможность свободно увеличиваться в объёме. Только ниже температуры инверсии Джоуля — Томсона (приблизительно 40 К при нормальном давлении) он остывает во время свободного расширения. После охлаждения ниже этой температуры гелий может быть превращён в жидкость при расширительном охлаждении. Такое охлаждение производится при помощи детандера.
Свойства конденсированных фаз
В 1908 году Х.Камерлинг-Оннес впервые смог получить жидкий гелий. Твёрдый гелий удалось получить лишь под давлением 25 атмосфер при температуре около 1 К (В. Кеезом, 1926). Кеезом также открыл наличие фазового перехода гелия-4 (4He) при температуре 2,17K; назвал фазы гелий-I и гелий-II (ниже 2,17 K). В 1938 году П. Л. Капица обнаружил, что у гелия-II отсутствует вязкость (явление сверхтекучести). В гелии-3 сверхтекучесть возникает лишь при температурах ниже 0,0026 К. Сверхтекучий гелий относится к классу так называемых квантовых жидкостей, макроскопическое поведение которых может быть описано только с помощью квантовой механики. В 2004 году появилось сообщение об открытии сверхтекучести твёрдого гелия (т. н. эффект суперсолид) при исследовании его в торсионном осцилляторе. Однако многие исследователи сходятся во мнении, что обнаруженный в 2004 году эффект не имеет ничего общего со сверхтекучестью кристалла. В настоящее время продолжаются многочисленные экспериментальные и теоретические исследования, целью которых является понимание истинной природы данного явления.
Изотопы
Природный гелий состоит из двух стабильных изотопов: 4He (изотопная распространённость — 99,99986 %) и гораздо более редкого 3He (0,00014 %; содержание гелия-3 в разных природных источниках может варьироваться в довольно широких пределах). Известны ещё шесть искусственных радиоактивных изотопов гелия.
Получение
В промышленности гелий получают из гелийсодержащих природных газов (в настоящее время эксплуатируются главным образом месторождения, содержащие > 0,1 % гелия). От других газов гелий отделяют методом глубокого охлаждения, используя то, что он сжижается труднее всех остальных газов. Охлаждение производят дросселированием в несколько стадий очищая его от CO2 и углеводородов. В результате получается смесь гелия, неона и водорода. Эту смесь, т. н. сырой гелий, (He — 70-90 % об.) очищают от водорода (4-5 %) с помощью CuO при 650—800 К. Окончательная очистка достигается охлаждением оставшейся смеси кипящим под вакуумом N2 и адсорбцией примесей на активном угле в адсорберах, также охлаждаемых жидким N2. Производят гелий технической чистоты (99,80 % по объёму гелий) и высокой чистоты (99,985 %).
В России газообразный гелий получают из природного и нефтяного газов. В настоящее время гелий извлекается на гелиевом заводе ООО «Газпром добыча Оренбург»[29] в Оренбурге из газа с низким содержанием гелия (до 0,055 % об.), поэтому российский гелий имеет высокую себестоимость. Актуальной проблемой является освоение и комплексная переработка природных газов крупных месторождений Восточной Сибири с высоким содержанием гелия (0,15-1 % об.), что позволит намного снизить его себестоимость.
По производству гелия лидируют США (140 млн м³ в год), затем — Алжир (16 млн м³). Россия занимает третье место в мире — 6 млн м³ в год. Мировые запасы гелия составляют 45,6 млрд м³.
В 2003 г. производство гелия в мире составило 110 млн м3, в том числе в США — 87 млн м3, Алжире — 16 млн м3, России — более 6 млн м3, Польше — около 1 млн м3.[30]
Транспортировка

Для транспортировки газообразного гелия используются стальные баллоны (ГОСТ 949-73) коричневого цвета, помещаемые в специализированные контейнеры. Для перевозки можно использовать все виды транспорта при соблюдении соответствующих правил перевозки газов.
Для перевозки жидкого гелия применяются специальные транспортные сосуды типа СТГ-10, СТГ-25 и т. п. светло-серого цвета объёмом 10, 25, 40, 250 и 500 литров, соответственно. При выполнении определённых правил транспортировки может использоваться железнодорожный, автомобильный и другие виды транспорта. Сосуды с жидким гелием обязательно должны храниться в вертикальном положении.
Применение
Уникальные свойства гелия широко используются в промышленности и народном хозяйстве:
В геологии
Гелий — удобный индикатор для геологов. При помощи гелиевой съёмки[31] можно определять на поверхности Земли расположение глубинных разломов. Гелий, как продукт распада радиоактивных элементов, насыщающих верхний слой земной коры, просачивается по трещинам, поднимается в атмосферу. Около таких трещин и особенно в местах их пересечения концентрация гелия более высокая. Это явление было впервые установлено советским геофизиком И. Н. Яницким во время поисков урановых руд. Эта закономерность используется для исследования глубинного строения Земли и поиска руд цветных и редких металлов[32].
В астрономии
В честь гелия назван астероид (895) Гелио (англ.)русск., открытый в 1918 году.
Биологическая роль
На данный момент биологическая роль не выяснена.
Физиологическое действие
- Хотя инертные газы обладают наркозным действием, это воздействие у гелия и неона при атмосферном давлении не проявляется, в то время как при повышении давления раньше возникают симптомы «нервного синдрома высокого давления» (НСВД)[33].
Стоимость
- В 2009 г. цены частных компаний на газообразный гелий находились в пределах 2,5—3 $/м³[34].
- В 2010 г. цена в Европе на сжиженный гелий была около 11 евро за литр. В 2012 году — 23 евро за литр
Интересные факты
- Гелий — вещество с самой низкой температурой кипения. Гелий кипит при температуре −269 °C[35].
См. также
Примечания
- ↑ 1 2 3 Size of helium in several environments (англ.). www.webelements.com. Проверено 10 июля 2009.
- ↑ 1 2 3 4 5 Соколов В. Б. Гелий // Химическая энциклопедия / гл. редактор Кнунянц И. Л.. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 513-514. — ISBN 5-85270-008-8.
- ↑ Kochhar, R. K. French astronomers in India during the 17th - 19th centuries (англ.) // Journal of the British Astronomical Association. — 1991. — Т. 101. — № 2. — С. 95-100.
- ↑ 1 2 3 4 5 6 7 Финкельштейн Д.Н. Глава II. Открытие инертных газов и периодический закон Менделеева // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 40-46. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Aaron John Ihde. Chapter 14. Inorganic chemistry I. Fundamental developments // The development of modern chemistry. — Изд. 2-е. — М.: Courier Dover Publications, 1984. — С. 373. — 851 с. — ISBN 0486642356
- ↑ 1 2 3 4 Фастовский В.Г., Ровинский А.Е., Петровский Ю.В. Глава первая. Открытие. Происхождение. Распространенность. Применение // Инертные газы. — Изд. 2-е. — М.: Атомиздат, 1972. — С. 3-13. — 352 с. — 2400 экз.
- ↑ Бронштейн М.П. Солнечное вещество // Солнечное вещество; Лучи икс; Изобретатели радиотелеграфа. — М.: ТЕРРА - Книжный клуб, 2002. — 224 с. — (Мир вокруг нас). — ISBN 5-275-00531-8
- ↑ 1 2 3 4 5 Финкельштейн Д.Н. Глава V. Гелий // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 111-128. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Капица, П.Л. Viscosity of Liquid Helium below the λ-Point (англ.) // Nature. — 1938. — Т. 141. — P. 74.
- ↑ «Свойства жидкого гелия» (П. Л. Капица)
- ↑ Helium: geological information (англ.). www.webelements.com. Проверено 11 июля 2009.
- ↑ Хокинг С., Млодинов Л. Глава восьмая. Большой взрыв, черные дыры и эволюция Вселенной // Кратчайшая история времени. — СПб: Амфора. ТИД Амфора, 2006. — С. 79-98. — 180 с. — 5000 экз. — ISBN 5-367-00164-5
- ↑ Вайнберг С. V. Первые три минуты // Первые три минуты: современный взгляд на происхождение Вселенной. — Изд. 2-е. — Ижевск: НИЦ "Регулярная и хаотическая динамика", 2000. — С. 105-122. — 272 с. — 1000 экз. — ISBN 5-93972-013-7
- ↑ 1 2 3 4 5 Финкельштейн Д.Н. Глава IV. Инертные газы на Земле и в космосе // Инертные газы. — Изд. 2-е. — М.: Наука, 1979. — С. 76-110. — 200 с. — («Наука и технический прогресс»). — 19 000 экз.
- ↑ Abundance in Earth's crust (англ.). www.webelements.com. Проверено 11 июля 2009.
- ↑ Фаустовский В. Г., Ровынский А. Е. Петровский Ю.В. Инертные газы. — Изд. 2. — М.: Атомиздат, 1972. — 352 с.
- ↑ Л.Паулинг Природа химической связи / перевод с англ. М.Е.Дяткиной, под ред. проф. Я.К.Сыркина. — М.-Л.: ГНТИ Химической литературы, 1947. — С. 262. — 440 с.
- ↑ Успехи физических наук
- ↑ Эксимерные лазеры
- ↑ W. Heisenberg, Z. Physik 39, 499 (1926).
- ↑ Фриш С.Э. Оптические спектры атомов. — М.-Л.: Издательство физико-математической литературы, 1963. — С. 69-71. — 640 с.
- ↑ 1 2 G. W. F. Drake, G. A. Victor, A. Dalgarno. Two-Photon Decay of the Singlet and Triplet Metastable States of Helium-like Ions. Phys. Rev. 180, 25-32 (1969).
- ↑ G. Breit and E. Teller, Astrophys. J. 91, 215 (1940).
- ↑ R.D.Knight. Lifetime of the Metastable 23S1 State in Stored Li+ Ions. — Ph.D.Thesis. Lawrence Berkeley Laboratory. — 1979. — 136 с.
- ↑ A.H. Gabriel and C. Jordan. Long Wavelength Satellites to the He-like Ion Resonance Lines in the Laboratory and in the Sun. Nature 221, 947 (1969).
- ↑ H.R. Griem, Spontaneous single-photon decay of 23S1 in Helium-like ions. Astrophys. J. 156, L103 (1969).
- ↑ G. Feinberg, J. Sucher. Calculation of the Decay Rate for 23S1 → 11S0 + One Photon in Helium. Phys. Rev. Lett. 26, 681—684 (1971).
- ↑ Это легко объяснимо из соображений симметрии. Как начальное, так и конечное состояние атома сферически симметричны и не имеют выделенного направления — оба электрона находятся в s-состоянии, и сумммарный спиновый момент также нулевой. Излучение фотона с определённым импульсом требует нарушения этой симметрии.
- ↑ Основным поставщиком гелия являлся ОГЗ
- ↑ Сырьевая база и перспективы развития гелиевой промышленности России и мира
- ↑ Helium studies confirm presence of oil on the Aysky block in Russia
- ↑ Государственный реестр открытий СССР. Яницкий И. Н. Научное открытие № 68 «Закономерность распределения концентрации гелия в земной коре»
- ↑ Павлов Б.Н. Проблема защиты человека в экстремальных условиях гипербарической среды обитания (рус.). www.argonavt.com (15 мая 2007). Архивировано из первоисточника 21 августа 2011. Проверено 6 июля 2009.
- ↑ http://www.ngtp.ru/rub/3/15_2009.pdf Нефтегазовая технология. Теория и практика. 2009 (4) ISSN 2070-5379.
- ↑ Книга рекордов Гиннесса для химических веществ
Ссылки
dic.academic.ru
Как гелий благородства лишился: получено кристаллическое соединение гелия. Химия и науки о материалах
Возможности гелия внутри звезд и планет-гигантов
По расчетам алгоритма, энтальпия (тепловыделение) получения такого кристалла при давлении 500 гигапаскалей становится равной –0,51 эВ, что означает, что реакция получения такого вещества — экзотермическая (то есть не требует нагревания для проведения, а приводит к выделению тепла). Эти характеристики были подтверждены экспериментально: соединение удалось синтезировать в ячейки с алмазными наковальнями группе профессора Александра Гончарова в Геофизической лаборатории в Вашингтоне. Полученное вещество по всем признакам не относится к так называемым включенным соединениям, когда один из атомов — случайный гость в кристаллической решетке, не меняющий ее свойства. Напротив, без гелия натрий образует металлическую структуру с одним электроном на ячейку — типичный металл, а внедрение в эту структуру гелия приводит к локализации в ней электронов и образованию неметаллического состояния. Полученное соединение имеет отрицательную энергию формирования: натрий и гелий при данных условиях гораздо охотнее образуют подобный кристалл, чем остаются в виде чистых элементов. Связи внутри кристалла становятся возможными благодаря sp3-гибридизации атомных орбиталей натрия.
Вторым предсказанным веществом, существование которого, однако, не проверили пока экспериментально, стало похожее соединение — Na2HeO. Оно тоже образует «трехмерную шахматную доску», только вместо электронных пар у нее в узлах стоят пары атомов кислорода, присоединившие к себе два электрона. Такой ион (О2-) тоже имеет заряд -2, как и два электрона в Na2He. Стабильно такое соединение должно быть при давлении 0,15 до 1,1 миллиона атмосфер.
Это новое открытие из области «запрещенной химии» (так ученый часто называет химию, которой при нормальных условиях «не должно быть») удивило Артема Оганова и его коллег: «Когда Сяо рассказал мне об этом, я был поражен результатом — один из самых электроположительных элементов, натрий, вступил в соединение с гелием. Это соединение устойчиво начиная с давлений примерно в 1 млн атмосфер и по крайней мере до 10 млн атмосфер. Тип кристаллической структуры во всем этом диапазоне не меняется. Структура очень простая и похожа на трехмерную шахматную доску. Дальнейшее изучение этого соединения показало его совершенно необычную химическую природу, а экспериментаторам удалось его синтезировать и подтвердить наше теоретическое предсказание». По словам ученого, влияние подобных веществ на процессы, происходящие внутри крупных астрономических объектов, еще только предстоит изучить.
Подписывайтесь на Indicator.Ru в соцсетях: Facebook, ВКонтакте, Twitter, Telegram.
indicator.ru
Гелий — Мегаэнциклопедия Кирилла и Мефодия — статья
Радиус нейтрального атома гелия 0, 122 нм. Электронная конфигурация нейтрального невозбужденного атома 1s2.Энергии последовательной ионизации нейтрального атома равны, соответственно, 24, 587 и 54, 416 эВ (у атома гелия самая высокая среди нейтральных атомов всех элементов энергия отрыва первого электрона). Простое вещество гелий — легкий одноатомный газ без цвета, вкуса, запаха.
Открытие гелия началось с 1868, когда при наблюдении солнечного затмения астрономы француз П.Ж. Жансен и англичанин Д.Н. Локьер независимо друг от друга обнаружили в спектре солнечной короны желтую линию (она получила название D3-линии), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 Локьер объяснил ее происхождение присутствием на Солнце нового элемента. В 1895 англичанин У. Рамзай выделил из природной радиоактивной руды клевеита газ, в спектре которого присутствовала та же D3-линия. Новому элементу Локьер дал имя, отражающее историю его открытия (греч. Helios—солнце). Поскольку Локьер полагал, что обнаруженный элемент — металл, он использовал в латинском названии элемента окончание «lim» (соответствует русскому окончанию «ий»), которое обычно употребляется в названии металлов. Таким образом, гелий задолго до своего открытия на Земле получил имя, которое окончанием отличает его от названий остальных инертных газов.В атмосферном воздухе содержание гелия очень мало и составляет около 5, 27·10-4% по объему. В земной коре его 0, 8·10-6%, в морской воде — 4·10-10 %. Источником гелия служат нефти и гелионосные природные газы, в которых содержание гелия достигает 2-3%, а в редких случаях и 8-10% по объему. Зато в космосе гелий — второй по распространенности элемент (после водорода): на его долю приходится 23% космической массы.
Технология получения гелия очень сложна: его выделяют из природных гелионосных газов, пользуясь методом глубокого охлаждения. Месторождения таких газов имеются в России, США, Канаде и ЮАР. Гелий содержится также в некоторых минералах (монаците, торианите и других), при этом из 1 кг минерала при нагревании можно выделить до 10 л гелия.
Гелий — легкий негорючий газ, плотность газообразного гелия при нормальных условиях 0, 178 кг/м3 (меньше только у газа водорода). Температура кипения гелия (при нормальном давлении) около 4, 2К (или –268, 93 °C, это — самая низкая температура кипения).
При нормальном давлении жидкий гелий не удается превратить в твердое вещество даже при температурах, близких к абсолютному нулю (0К). При давлении около 3, 76 МПа температура плавления гелия 2, 0К. Наименьшее давление, при котором наблюдается переход жидкого гелия в твердое состояние — 2, 5МПа (25 ат), температура плавления гелия при этом около 1, 1 К (–272, 1 °C).
В 100 мл воды при 20 °C растворяется 0, 86 мл гелия, в органических растворителях его растворимость еще меньше. Легкие молекулы гелия хорошо проходят (диффундируют) через различные материалы (пластмассы, стекло, некоторые металлы).
Для жидкого гелия-4, охлажденного ниже –270, 97 °C, наблюдается ряд необычных эффектов, что дает основание рассматривать эту жидкость как особую, так называемую квантовую, жидкость. Эту жидкость обычно обозначают как гелий-II в отличие от жидкого гелия-I — жидкости, существующей при чуть более высоких температурах. График изменения теплоемкости жидкого гелия с изменением температуры напоминает греческую букву лямбда (λ). Температура перехода гелия-I в гелий-II 2, 186 К. Эту температуру часто называют λ-точкой.
Жидкий гелий-II способен быстро проникать через мельчайшие отверстия и капилляры, не обнаруживая при этом вязкости (так называемая сверхтекучесть жидкого гелия-II). Кроме того, пленки гелия-II быстро перемещаются по поверхности твердых тел, в результате чего жидкость быстро покидает тот сосуд, в который она была помещена. Это свойство гелия-II называют сверхползучестью. Сверхтекучесть гелия-II открыта в 1938 советским физиком П. Л. Капицей (Нобелевская премия по физике, 1978). Объяснение уникальным свойствам гелия-II дано другим советским физиком Л. Д. Ландау в 1941-1944 (Нобелевская премия по физике, 1962).Никаких химических соединений гелий не образует. Правда, в разреженном ионизированном гелии удается обнаружить достаточно устойчивые двухатомные ионы Не2+.
Гелий используют для создания инертной и защитной атмосферы при сварке, резке и плавке металлов, при перекачивании ракетного топлива, для заполнения дирижаблей и аэростатов, как компонент среды гелиевых лазеров. Жидкий гелий, самая холодная жидкость на Земле, — уникальный хладагент в экспериментальной физике, позволяющий использовать сверхнизкие температуры в научных исследованиях (например, при изучении электрической сверхпроводимости). Благодаря тому, что гелий очень плохо растворим в крови, его используют как составную часть искусственного воздуха, подаваемого для дыхания водолазам. Замена азота на гелий предотвращает кессонную болезнь (при вдыхании обычного воздуха азот под повышенным давлением растворяется в крови, а затем выделяется из нее в виде пузырьков, закупоривающих мелкие сосуды).- Бердоносов С. С. Инертные газы вчера и сегодня. М.: Просвещение, 1966.110с.
- Фастовский В. Г. и др. Инертные газы. М., 1972.
- Фастовский В. Г., Ровинский А. Е., Петровский Ю. В. Инертные газы. М., 1972.
megabook.ru



















