способ получения фторида кальция. Формула фторид кальция
Фторид кальция — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
Физические свойства
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
Получение
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaCO_3+2HF \xrightarrow{} CaF_2\downarrow + CO_2\uparrow + H_2O}Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{Ca+F_2 \xrightarrow{} CaF_2}Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaO+2HF \xrightarrow{} CaF_2\downarrow + H_2O}Фторид кальция можно получить обменными реакциями, например:
Химические свойства
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaF_2+H_2O \xrightarrow{800^oC} CaO + 2HF} Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaF_2+H_2O + SiO_2 \xrightarrow{1450^oC} CaSiO_3 + 2HF}Разлагается концентрированной серной кислотой, что используется в промышлености для получения HF:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaF_2+H_2SO_4 \xrightarrow{130-200^oC} CaSO_4 + 2HF\uparrow}При избытке HF образует сложный кристаллогидрат:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{CaF_2+2HF+6H_2O \xrightarrow{} Ca(HF_2)_2\cdot 6H_2O\downarrow}При температуре в 600—700 °C фторид лития реагирует с оксидом кальция, давая на выходе оксид лития и фторид кальция:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{2LiF+CaO \xrightarrow{600-700^oC} CaF_2 + Li_2O}Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и фторид кальция:
Невозможно разобрать выражение (Выполняемый файл <code>texvc</code> не найден; См. math/README — справку по настройке.): \mathsf{2LiF+Ca(OH)_2 \xrightarrow{} CaF_2 + 2LiOH}Применение
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории, фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.[1]
Опасность применения
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
См. также
Напишите отзыв о статье "Фторид кальция"
Примечания
- ↑ [http://aecc.ru/caf_mor.php Информационный источник №1](недоступная ссылка — [//web.archive.org/web/*/http://aecc.ru/caf_mor.php история]). Проверено 28 марта 2010. [http://web.archive.org/20050302185300/aecc.ru/caf_mor.php Архивировано из первоисточника 2 марта 2005].
Отрывок, характеризующий Фторид кальция
– Наверняка, так же, как и вы... – был тихий ответ. – Мы гуляли по берегу озера, и не видели, что там был какой-то «провал»... Вот мы туда и провалились. А там ждал вот этот зверь... Что же будем делать? – Уходить. – Постаралась ответить как можно спокойнее я. – А остальных? Ты хочешь их всех оставить?!. – прошептала Стелла. – Нет, конечно же, не хочу! Но как ты собираешься их отсюда забирать?.. Тут открылся какой-то странный, круглый лаз и вязкий, красный свет ослепил глаза. Голову сдавило клещами и смертельно захотелось спать... – Держись! Только не спи! – крикнула Стелла. И я поняла, что это пошло на нас какое-то сильное действие, Видимо, этому жуткому существу мы нужны были совершенно безвольными, чтобы он свободно мог совершать какой то свой «ритуал». – Ничего мы не сможем... – сама себе бурчала Стелла. – Ну, почему же не получается?.. И я подумала, что она абсолютно права. Мы обе были всего лишь детьми, которые, не подумав, пустились в очень опасные для жизни путешествия, и теперь не знали, как из этого всего выбраться. Вдруг Стелла сняла наши наложенные «образы» и мы опять стали сами собой. – Ой, а где же мама? Ты кто?... Что ты сделала с мамой?! – возмущённо прошипел мальчик. – А ну немедленно верни её обратно! Мне очень понравился его бойцовский дух, имея в виду всю безнадёжность нашей ситуации. – Дело в том, что здесь не было твоей мамы, – тихо прошептала Стелла. – Мы встретили твою маму там, откуда вы «провалились» сюда. Они за вас очень переживают, потому что не могут вас найти, вот мы и предложили помочь. Но, как видишь, мы оказались недостаточно осторожными, и вляпались в ту же самую жуткую ситуацию... – А как давно вы здесь? Вы знаете, что с нами будут делать? – стараясь говорить уверенно, тихо спросила я. – Мы недавно... Он всё время приносит новых людей, а иногда и маленьких зверей, и потом они пропадают, а он приносит новых. Я с ужасом посмотрела на Стеллу: – Это самый настоящий, реальный мир, и совершенно реальная опасность!.. Это уже не та невинная красота, которую мы создавали!.. Что будем делать? – Уходить. – Опять упорно повторила малышка. – Мы ведь можем попробовать, правда? Да и бабушка нас не оставит, если уж будет по-настоящему опасно. Видимо пока мы ещё можем выбраться сами, если она не приходит. Ты не беспокойся, она нас не бросит. Мне бы её уверенность!.. Хотя обычно я была далеко не из пугливых, но эта ситуация заставляла меня очень сильно нервничать, так как здесь находились не только мы, но и те, за кем мы пришли в эту жуть. А как из данного кошмара выкарабкиваться – я, к сожалению, не знала. – Здесь нету времени, но он приходит обычно через одинаковый промежуток, примерно как были сутки на земле. – Вдруг ответил на мои мысли мальчик. – А сегодня уже был? – явно обрадованная, спросила Стелла. Мальчонка кивнул. – Ну что – пошли? – она внимательно смотрела на меня и я поняла, что она просит «надеть» на них мою «защиту». Стелла первая высунула свою рыжую головку наружу... – Никого! – обрадовалась она. – Ух ты, какой же это ужас!.. Я, конечно, не вытерпела и полезла за ней. Там и правда был настоящий «ночной кошмар»!.. Рядом с нашим странным «местом заточения», совершенно непонятным способом, повешенные «пучками» вниз головой, висели человеческие сущности... Они были подвешены за ноги, и создавали как бы перевёрнутый букет. Мы подошли ближе – ни один из людей не показывал признаков жизни... – Они же полностью «откачаны»! – ужаснулась Стелла. – У них не осталось даже капельки жизненной силы!.. Всё, давайте удирать!!! Мы понеслись, что было сил, куда-то в сторону, абсолютно не зная – куда бежим, просто подальше бы от всей этой, замораживающей кровь, жути... Даже не думая о том, что можем снова вляпаться в такую же, или же ещё худшую, жуть... Вдруг резко потемнело. Иссиня-чёрные тучи неслись по небу, будто гонимые сильным ветром, хотя никакого ветра пока что не было. В недрах чёрных облаков полыхали ослепительные молнии, красным заревом полыхали вершины гор... Иногда набухшие тучи распарывало о злые вершины и из них водопадом лилась тёмно-бурая вода. Вся эта страшная картинка напоминала, самый жуткий из жутких, ночной кошмар.... – Папочка, родимый, мне так страшно! – тоненько взвизгивал, позабыв свою былую воинственность, мальчонка. Вдруг одна из туч «порвалась», и из неё полыхнул ослепительно яркий свет. А в этом свете, в сверкающем коконе, приближалась фигурка очень худого юноши, с острым, как лезвие ножа, лицом. Вокруг него всё сияло и светилось, от этого света чёрные тучи «плавились», превращаясь в грязные, чёрные лоскутки. – Вот это да! – радостно закричала Стелла. – Как же у него это получается?!. – Ты его знаешь? – несказанно удивилась я, но Стелла отрицательно покачала головкой. Юноша опустился рядом с нами на землю и ласково улыбнувшись спросил: – Почему вы здесь? Это не ваше место. – Мы знаем, мы как раз пытались выбраться на верх! – уже во всю щебетала радостная Стелла. – А ты поможешь нам вернуться наверх?.. Нам обязательно надо быстрее вернуться домой! А то нас там бабушки ждут, и вот их тоже ждут, но другие. Юноша тем временем почему-то очень внимательно и серьёзно рассматривал меня. У него был странный, насквозь пронизывающий взгляд, от которого мне стало почему-то неловко. – Что ты здесь делаешь, девочка? – мягко спросил он. – Как ты сумела сюда попасть? – Мы просто гуляли. – Честно ответила я. – И вот их искали. – Улыбнувшись «найдёнышам», показала на них рукой. – Но ты ведь живая? – не мог успокоиться спаситель. – Да, но я уже не раз здесь была. – Спокойно ответила я. – Ой, только не здесь, а «наверху»! – смеясь, поправила меня моя подружка. – Сюда мы бы точно не возвращались, правда же? – Да уж, я думаю, этого хватит надолго... Во всяком случае – мне... – меня аж передёрнуло от недавних воспоминаний. – Вы должны отсюда уйти. – Опять мягко, но уже более настойчиво сказал юноша. – Сейчас. От него протянулась сверкающая «дорожка» и убежала прямо в светящийся туннель. Нас буквально втянуло, даже не успев сделать ни шагу, и через какое-то мгновение мы оказались в том же прозрачном мире, в котором мы нашли нашу кругленькую Лию и её маму. – Мама, мамочка, папа вернулся! И Велик тоже!.. – маленькая Лия кубарем выкатилась к нам навстречу, крепко прижимая к груди красного дракончика.. Её кругленькая мордашка сияла солнышком, а сама она, не в силах удержать своего бурного счастья, кинулась к папе и, повиснув у него на шее, пищала от восторга. Мне было радостно за эту, нашедшую друг друга, семью, и чуточку грустно за всех моих, приходящих на земле за помощью, умерших «гостей», которые уже не могли друг друга так же радостно обнять, так как не принадлежали тем же мирам... – Ой, папулечка, вот ты и нашёлся! А я думала, ты пропал! А ты взял и нашёлся! Вот хорошо-то как! – аж попискивала от счастья сияющая девчушка. Вдруг на её счастливое личико налетела тучка, и оно сильно погрустнело... И уже совсем другим голосом малышка обратилась к Стелле:o-ili-v.ru
Реферат Фторид кальция
Реферат на тему:
План:
- Введение
- 1 Физические свойства
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 5 Опасность применения Примечания
Введение
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
1. Физические свойства
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
2. Получение
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, желтый, оранжевый, красный, бурый, зеленый, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-черный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
Фторид кальция можно получить обменными реакциями, например:
3. Химические свойства
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
Разлагается концентрированной серной кислотой, что используется в промышлености для получения HF:
При избытке HF образует сложный кристаллогидрат:
При температуре в 600—700 °C фторид лития реагирует с оксидом кальция, давая на выходе оксид лития и фторид кальция:
Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и фторид кальция:
4. Применение
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории, фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторид кальция в:
- Микроскопии,
- Квантовой и силовой оптике,
- Инфракрасной технике,
- Спектрофотометрии,
- Фурье-спектроскопии,
- Рентгеновской технике,
- Космотехнике,
- Астрономии,
- Голографии.
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.[1]
5. Опасность применения
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
Примечания
- Информационный источник №1 - aecc.ru/caf_mor.php.
wreferat.baza-referat.ru
способ получения фторида кальция - патент РФ 2029731
 + 3CaSO4+8NaOH __
+ 3CaSO4+8NaOH __ 2CaF2+Na2SiO3+3Na2SO4+2Nh4+5h3O Полученное по примерам 1-7 и по прототипу вещество исследовалось на выход СаF2 (отношение в % к теоретическому выходу) наличие примесей, учитывалось наличие побочных летучих веществ в процессе получения и температуры, необходимые для реализации способа. Полученные данные позволили провести сопоставительный анализ известного и предлагаемого способа, количественно и качественно представленный в таблице ниже. Анализ полученных данных показывает в примерах 1-5, в которых соблюдается предлагаемое стехиометрическое соотношение между CaSO4 и SiF62- и предлагаемое значение рН, получают технически чистый продукт с высоким выходом СаF2, наличием только одного побочного летучего продукта и процесс проводится со снижением температуры на отдельных этапах. Пpи меньшем, чем стехиометрическое, соотношении (пример 2) снижается степень превращения CaSO4 и целевой продукт загрязняется. При большем, чем стехиометрическое соотношение (пример 3) фторсиликаты не полностью используются и загрязняют CaF2. Практически то же, а также снижение выхода СaF2 наблюдается при рН 10 (пример 7) нерационально расходуется щелочь, а образование в реакционной смеси кремнегеля затрудняет фильтрование и промывание осадка. Таким образом поставленная цель в заявляемом способе получения фторида кальция достигается при использовании отходов производства с уменьшением энергозатрат при соблюдении стехиометрического соотношения между СаSO4 и SiF62- и при нейтрализации реакционной смеси щелочью в пределах рН 9-10. Приведенные выше примеры и схема показывают, что во всех случаях возможно получение CaF2 с применением фторсиликатов, которые ранее не использовались для этой цели и тем более из отходов, которые еще недостаточно перерабатываются и требуют значительных затрат для утилизации. Реализация заявляемого способа позволяет использовать нетрадиционные виды сырья для синтеза СаF2, т.е. расширяет сырьевую базу для их получения. Из трудно- или неперерабатываемых отходов по заявляемому способу удается получить ценный продукт, который находит широкое применение в различных отраслях. Растворы, которые образуются при этом (Na2SiO3, Na2SO4) могут быть использованы в производстве порошкообразных моющих средств. Предлагаемый способ не требует специального оборудования.
2CaF2+Na2SiO3+3Na2SO4+2Nh4+5h3O Полученное по примерам 1-7 и по прототипу вещество исследовалось на выход СаF2 (отношение в % к теоретическому выходу) наличие примесей, учитывалось наличие побочных летучих веществ в процессе получения и температуры, необходимые для реализации способа. Полученные данные позволили провести сопоставительный анализ известного и предлагаемого способа, количественно и качественно представленный в таблице ниже. Анализ полученных данных показывает в примерах 1-5, в которых соблюдается предлагаемое стехиометрическое соотношение между CaSO4 и SiF62- и предлагаемое значение рН, получают технически чистый продукт с высоким выходом СаF2, наличием только одного побочного летучего продукта и процесс проводится со снижением температуры на отдельных этапах. Пpи меньшем, чем стехиометрическое, соотношении (пример 2) снижается степень превращения CaSO4 и целевой продукт загрязняется. При большем, чем стехиометрическое соотношение (пример 3) фторсиликаты не полностью используются и загрязняют CaF2. Практически то же, а также снижение выхода СaF2 наблюдается при рН 10 (пример 7) нерационально расходуется щелочь, а образование в реакционной смеси кремнегеля затрудняет фильтрование и промывание осадка. Таким образом поставленная цель в заявляемом способе получения фторида кальция достигается при использовании отходов производства с уменьшением энергозатрат при соблюдении стехиометрического соотношения между СаSO4 и SiF62- и при нейтрализации реакционной смеси щелочью в пределах рН 9-10. Приведенные выше примеры и схема показывают, что во всех случаях возможно получение CaF2 с применением фторсиликатов, которые ранее не использовались для этой цели и тем более из отходов, которые еще недостаточно перерабатываются и требуют значительных затрат для утилизации. Реализация заявляемого способа позволяет использовать нетрадиционные виды сырья для синтеза СаF2, т.е. расширяет сырьевую базу для их получения. Из трудно- или неперерабатываемых отходов по заявляемому способу удается получить ценный продукт, который находит широкое применение в различных отраслях. Растворы, которые образуются при этом (Na2SiO3, Na2SO4) могут быть использованы в производстве порошкообразных моющих средств. Предлагаемый способ не требует специального оборудования. ФОРМУЛА ИЗОБРЕТЕНИЯ
СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА КАЛЬЦИЯ, включающий взаимодействие при перемешивании в водной среде нерастворимой соли кальция и фторсодержащего соединения, отличающийся тем, что в качестве нерастворимой соли кальция и фторсодержащего соединения используют соответственно фосфогипс и фторсиликатные растворы, являющиеся отходами производства экстракционной фосфорной кислоты, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения рН 9 - 10.www.freepatent.ru
Фторид кальция - Википедия
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
Физические свойства[ | ]
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
Получение[ | ]
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
CaCO3+2HF→CaF2↓+CO2↑+h3O{\displaystyle {\mathsf {CaCO_{3}+2HF{\xrightarrow {}}CaF_{2}\downarrow +CO_{2}\uparrow +H_{2}O}}}Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
Ca+F2→CaF2{\displaystyle {\mathsf {Ca+F_{2}{\xrightarrow {}}CaF_{2}}}}Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
CaO+2HF→CaF2↓+h3O{\displaystyle {\mathsf {CaO+2HF{\xrightarrow {}}CaF_{2}\downarrow +H_{2}O}}}Фторид кальция можно получить обменными реакциями, например:
CaCl2+2Nh5F→CaF2↓+2Nh5Cl{\displaystyle {\mathsf {CaCl_{2}+2NH_{4}F{\xrightarrow {}}CaF_{2}\downarrow +2NH_{4}Cl}}}Химические свойства[ | ]
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
CaF2+h3O→800oCCaO+2HF{\displaystyle {\mathsf {CaF_{2}+H_{2}O{\xrightarrow {800^{o}C}}CaO+2HF}}} CaF2+h3O+SiO2→1450oCCaSiO3+2HF{\displaystyle {\mathsf {CaF_{2}+H_{2}O+SiO_{2}{\xrightarrow {1450^{o}C}}CaSiO_{3}+2HF}}}Разлагается концентрированной серной кислотой, что используется в промышлености для получения HF:
CaF2+h3SO4→130−200oCCaSO4+2HF↑{\displaystyle {\mathsf {CaF_{2}+H_{2}SO_{4}{\xrightarrow {130-200^{o}C}}CaSO_{4}+2HF\uparrow }}}При избытке HF образует сложный кристаллогидрат:
CaF2+2HF+6h3O→Ca(HF2)2⋅6h3O↓{\displaystyle {\mathsf {CaF_{2}+2HF+6H_{2}O{\xrightarrow {}}Ca(HF_{2})_{2}\cdot 6H_{2}O\downarrow }}}При температуре в 600—700 °C фторид лития реагирует с оксидом кальция, давая на выходе оксид лития и фторид кальция:
2LiF+CaO→600−700oCCaF2+Li2O{\displaystyle {\mathsf {2LiF+CaO{\xrightarrow {600-700^{o}C}}CaF_{2}+Li_{2}O}}}Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и фторид кальция:
2LiF+Ca(OH)2→CaF2+2LiOH{\displaystyle {\mathsf {2LiF+Ca(OH)_{2}{\xrightarrow {}}CaF_{2}+2LiOH}}}Применение[ | ]
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории, фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения от ультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.[1]
Опасность применения[ | ]
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
См. также[ | ]
Примечания[ | ]
encyclopaedia.bid
F*Ca - Бинарные химические соединения - Каталог статей - "МАТИ"
CaF
CaF2
Фторид кальция CaF2 – бесцветные кристаллы, т. пл. 14180С, ∆Нобр0 = - 1221 кДж/моль. Растворим в воде. Встречается в природе в виде минерала.
Выше 8000С CaF2 взаимодействует с парами воды с образованием HF. Обработка галидов MГ2 водяным паром вызывает их высокотемпературный гидролиз. Для CaCl2температура гидролиза около 4250С, а для бромида кальция - 3480С.
При нагревании CaF2 взаимодействует с неорганическими кислотами.
Кальций интенсивно реагирует с галогенами с образованием CaГ2.
Получают CaF2 обогащением флюоритовых руд, взаимодействием HF, Nh5F, Nh5HF2( или их водных растворов), h3SiF6с солями кальция или CaO.
Промышленное получение фтористого водорода основано на взаимодействии CaF2 с концентрированной h3SO4 по реакции
CaF2 + h3SO4 = 2HF↑ + CaSO4
Процесс проводят в стальных печах при 120-3000С.
CaF2 используют для промышленного получения HF. Фторид кальция-компонент металлургических флюсов, специальных стекол, эмалей, керамики, оптический и лазерный материал, флюоритовые концентраты-сырье для получения HF.
Фторид кальция — неорганическое бинарное ионное химическое соединение. Химическая формула CaF2.
Физические свойства
Бесцветные диамагнитные кристаллы (в измельчённом состоянии — белые). До температуры 1151 °C существует α-CaF2 с кубической решеткой (а = 0,54626 нм, z=4, пространственная группа Fm3m), выше 1151 °C — разупорядоченная модификация тетрагональной сингонии, температура плавления у этой модификации — 1418 °C.
Плохо растворим в воде (16 мг/л при 18 °C).
Получение
В природе CaF2 встречается в виде минерала флюорита (плавиковый шпат), который содержит до 90-95 % CaF2 и 3,5-8 % SiO2. Это хрупкий и мягкий минерал с большой вариацией в цвете: бесцветный, белый, жёлтый, оранжевый, красный, бурый, зелёный, зеленовато-голубой, фиолетово-синий, серый, пурпурный, синевато-чёрный, розовый и малиновый. Окраска связана с примесями хлора, железа, урана, дефектами кристаллической структуры, которая весьма тонко реагирует на нагревание. Является основным источником фтора в мире. Мировое производство ~4,5 млн т/год (1983 год).
В лабораторных условиях фторид кальция обычно получают из карбоната кальция и плавиковой кислоты:
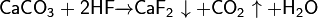
Чисто теоретический интерес представляет способ получения непосредственно из простых веществ:
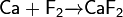
Разбавленная плавиковая кислота взаимодействует с оксидом кальция:
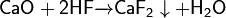
Фторид кальция можно получить обменными реакциями, например:
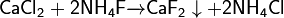
Химические свойства
Фторид кальция химически относительно пассивен. При высокой температуре подвергается гидролизу:
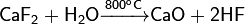
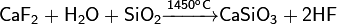
Разлагается концентрированной серной кислотой, что используется в промышлености для получения HF:
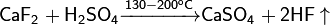
При избытке HF образует сложный кристаллогидрат:
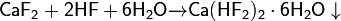
При температуре в 600—700 °C фторид лития реагирует с оксидом кальция, давая на выходе оксид лития и фторид кальция:
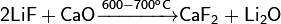
Фторид лития с насыщенным раствором гидроксида кальция реагирует образовывая гидроксид лития и фторид кальция:
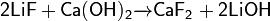
Применение
Фторид кальция является основным источником фтора и его соединений. Начиная с конца 1990-х добывалось ~5 млн тонн данного вещества в год.
Фторид кальция является компонентом металлургических флюсов, специальных стекол, эмалей, керамики, оптических и лазерных материалов. Он также используется в качестве флюса при плавке и переработке жидких чугуна и стали.
В лаборатории, фторид кальция широко применяется в качестве оптического материала для инфракрасного и ультрафиолетового излучений, а также как материал с чрезвычайно низким показателем преломления. В первые годы 21-го века цена на рынке фторида кальция упала, и многие крупные заводы были закрыты. Canon и другие производители используют синтетически выращенные кристаллы фторида кальция в качестве компонентов в объективах, уменьшающих рассеивание света.
Отличные механические, технические и эксплуатационные характеристики в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, высокой радиационной устойчивостью позволяют использовать оптические монокристаллы фторида кальция в:
Монокристаллы используются для изготовления окон, призм, линз и других оптических деталей, работающих в диапазоне излучения отультрафиолетового до инфракрасного. Оптические детали из фторида кальция используются без защитных покрытий.[1]
Опасность применения
Фторид кальция считается относительно безвредным в силу его малой растворимости в воде. Ситуация схожа и с BaSO4, где токсичность, обычно связанная с Ba2+, компенсируется очень низкой растворимостью сульфата.
Результаты поиска:
Результаты поиска:
mati-himia.3dn.ru
Способ получения фторида кальция
Изобретение относится к способам переработки отходов производства и может быть использовано для получения фторида кальция из отходов производства экстракционной фосфорной кислоты: фосфогипса и фторсиликатных растворов. Фторид кальция получают путем взаимодействия при перемешивании в водной среде нерастворимой соли кальция и фторосодержащего соединения, в качестве взаимодействующих компонентов используют такие отходы экстракционной фосфорной кислоты, как фосфогипс и фторсиликатные растворы, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения pH 9 - 10. Выход продукта 98% . Продукт получают технически чистый. Рееализация способа позволит использовать нетрадиционные виды сырья, получить ценный продукт с низкой себестоимостью из отходов и сократить расход энергии. 1 табл.
Изобретение относится к способам переработки отходов производства и может быть использовано для получения фторида кальция из отходов производства экстракционной фосфорной кислоты: фосфогипса и фторсиликатных растворов.
Известные способы переработки и использования фосфогипса который является многотоннажным отходом производства экстракционной фосфорной кислоты, как правило, предусматривают получение в качестве целевых продуктов нерастворимых солей кальция, сульфатов натрия или аммония и сернистого газа. Способы комплексной переработки включают извлечение из фосфогипса лантаноидов, фосфатов и некоторых других продуктов [1]. Реже в литературе рассматривается получение фторида кальция. По способу [2] фторсодержащие компоненты испаряются в процессе сушки фосфогипса при 400-600оС и при взаимодействии с известью образуется СаF2. Сухой продукт в дальнейшем прокаливается при 1200-1250оС в восстановительной атмосфере с получением извести и SO2. В известном способе СаF2 получают из фторсодержащих компонентов, которые являются примесью фосфогипса, т.е. источником фтора является сам фосфогипс, а кальция - специально добавляемая известь. Недостатком известного способа переработки фосфогипса с целью получения СаF2 является только частичное использование отходов производства фосфорной кислоты, необходимость использования дополнительных компонентов и как следствие - высокая стоимость целевого продукта. Наиболее близким способом получения СаF2 по химической сущности является способ получения фторидов щелечноземельных металлов, который выбран в качестве прототипа [3]. Если опустить отдельные операции в этом способе, которые необходимы при получении препаративно чистого, а не технического продукта, то схему получения можно представить уравнением реакции нерастворенной соли кальция с фтористоводородной кислотой в стехиометрическом соотношении: CaCO3 + 2HF = CaF2 + CO2 + h3O Практически способ осуществляется следующим образом. Рассчитанное количество СаСО3 растворяют в платиновой чашке при добавлении разбавленной горячей уксусной кислоты и добавляют эквимолярное количество 40%-ной плавиковой кислоты. Раствор упаривают досуха и получают белый мелкокристаллический порошок СаF2. Недостаком известного способа является использование сырья и высокие энергетические затраты в связи с необходимостью упаривания растворов. Целью заявляемого технического решения является расширение сырьевой базы и уменьшение энергозатрат при получении фторида кальция. Цель достигается тем, что при получении фторида кальция путем перемешивания в водной среде нерастворимой соли кальция и фторсодержащего соединения в качестве нерастворимой соли кальция и фторсодержащего соединения, используют отходы производства экстракционной фосфорной кислоты: фосфогипс и фторсиликатные растворы, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения рН 9-10. Преимущества заявляемого способа получения СаF2 иллюстрируются примерами конкретного выполнения, для которых использованы отходы производства экстракционной фосфорной кислоты на Винницком ПО "Химпром". Исходный фосфогипс в качестве основного вещества содержал 94,5-95,0% СаSO4 и примеси (% мас. ): общее Р2О5 - 0,34-0,35, растворимое Р2О5 - 0,1-0,14, общее F - 0,08-0,15 и влаги 4,5-5,5. Кислые фторсиликатные растворы образуются после получения бифторида аммония и белой сажи и содержат переменные количества (Nh5)2 SiF6 (8-10)% и h3SiF6 (5-6)%. Общее содержание фторсиликатов обычно близкое к 15%. рН кислых растворов около 1. П р и м е р 1. В химический стакан емкостью 1 дм3 вносят 143,2 г фосфогипса, содержащего 136 г СаSO4 и приливают 360 г, 15%-го раствора h3SiF6 + (N2h5)2 SiF6 (стехиометрическое соотношение CaSO4 и SiF6). При включенной мешалке порциями прибавляют 3%-ный раствор NaOH в течение, 0,5 ч до получения рН нейтрализованной смеси равной 9,5. Расход раствора в пересчете на NaOH составляет 76 г. Нейтрализованную смесь продолжают перемешивать до ее остывания (комнатная температура). Полученный мелкокристаллический белый осадок фторида кальция переносят на воронку Бюхнера, фильтруют и промывают водой до исчезновения запаха аммиака. Отмытый осадок высушивают при температуре около 100оС до постоянной массы. П р и м е р 2. Как пример 1, но приливают 308,6 г 15%-ного раствора h3SiF6 + (Nh5)2 SiF6 (соотношение CaSO4 и SiF62- меньше стехиометрического. П р и м е р 3. Как пример 1, но приливают 411,4 г 15%-ного раствора h3SiF6 + (Nh5)2SiF6 (соотношение CaSО4 и SiF62- больше стехиометрического). П р и м е р 4. Как пример 1, но нейтрализацию щелочью ведут до рН 9 (заявляемое нижнее значение). П р и м е р 5. Как пример 1, но нейтрализацию щелочью ведут до рН 10 (заявляемое верхнее значение). П р и м е р 6. Как пример 1, но нейтрализацию щелочью ведут до рН 8,7 (меньше нижнего значения). П р и м е р 7. Как пример 1, но нейтрализацию щелочью ведут до рН 10,3 (больше верхнего значения). П р и м е р по прототипу. К 10 г СаСО3 при перемешивании и нагревании приливают разбавленную уксусную кислоту до растворения навески. К полученному раствору прибавляют 10 г 40%-ной HF и упаривают досуха. Полученный мелкокристаллический порошок перемешивают с 4 г Nh5F и нагревают до постоянной массы сначала при 100, а затем при 400оС. Выход CaF2 составил 7,3 г. Синтез СаF2 по указанному способу ведут в платиновой посуде. Получение СаF2 по примерам 1-7 основано на взаимодействии исходных компонентов, которое можно представить следующим уравнением: + 3CaSO4+8NaOH __
+ 3CaSO4+8NaOH __ 2CaF2+Na2SiO3+3Na2SO4+2Nh4+5h3O Полученное по примерам 1-7 и по прототипу вещество исследовалось на выход СаF2 (отношение в % к теоретическому выходу) наличие примесей, учитывалось наличие побочных летучих веществ в процессе получения и температуры, необходимые для реализации способа. Полученные данные позволили провести сопоставительный анализ известного и предлагаемого способа, количественно и качественно представленный в таблице ниже. Анализ полученных данных показывает в примерах 1-5, в которых соблюдается предлагаемое стехиометрическое соотношение между CaSO4 и SiF62- и предлагаемое значение рН, получают технически чистый продукт с высоким выходом СаF2, наличием только одного побочного летучего продукта и процесс проводится со снижением температуры на отдельных этапах. Пpи меньшем, чем стехиометрическое, соотношении (пример 2) снижается степень превращения CaSO4 и целевой продукт загрязняется. При большем, чем стехиометрическое соотношение (пример 3) фторсиликаты не полностью используются и загрязняют CaF2. Практически то же, а также снижение выхода СaF2 наблюдается при рН 10 (пример 7) нерационально расходуется щелочь, а образование в реакционной смеси кремнегеля затрудняет фильтрование и промывание осадка. Таким образом поставленная цель в заявляемом способе получения фторида кальция достигается при использовании отходов производства с уменьшением энергозатрат при соблюдении стехиометрического соотношения между СаSO4 и SiF62- и при нейтрализации реакционной смеси щелочью в пределах рН 9-10. Приведенные выше примеры и схема показывают, что во всех случаях возможно получение CaF2 с применением фторсиликатов, которые ранее не использовались для этой цели и тем более из отходов, которые еще недостаточно перерабатываются и требуют значительных затрат для утилизации. Реализация заявляемого способа позволяет использовать нетрадиционные виды сырья для синтеза СаF2, т.е. расширяет сырьевую базу для их получения. Из трудно- или неперерабатываемых отходов по заявляемому способу удается получить ценный продукт, который находит широкое применение в различных отраслях. Растворы, которые образуются при этом (Na2SiO3, Na2SO4) могут быть использованы в производстве порошкообразных моющих средств. Предлагаемый способ не требует специального оборудования.
2CaF2+Na2SiO3+3Na2SO4+2Nh4+5h3O Полученное по примерам 1-7 и по прототипу вещество исследовалось на выход СаF2 (отношение в % к теоретическому выходу) наличие примесей, учитывалось наличие побочных летучих веществ в процессе получения и температуры, необходимые для реализации способа. Полученные данные позволили провести сопоставительный анализ известного и предлагаемого способа, количественно и качественно представленный в таблице ниже. Анализ полученных данных показывает в примерах 1-5, в которых соблюдается предлагаемое стехиометрическое соотношение между CaSO4 и SiF62- и предлагаемое значение рН, получают технически чистый продукт с высоким выходом СаF2, наличием только одного побочного летучего продукта и процесс проводится со снижением температуры на отдельных этапах. Пpи меньшем, чем стехиометрическое, соотношении (пример 2) снижается степень превращения CaSO4 и целевой продукт загрязняется. При большем, чем стехиометрическое соотношение (пример 3) фторсиликаты не полностью используются и загрязняют CaF2. Практически то же, а также снижение выхода СaF2 наблюдается при рН 10 (пример 7) нерационально расходуется щелочь, а образование в реакционной смеси кремнегеля затрудняет фильтрование и промывание осадка. Таким образом поставленная цель в заявляемом способе получения фторида кальция достигается при использовании отходов производства с уменьшением энергозатрат при соблюдении стехиометрического соотношения между СаSO4 и SiF62- и при нейтрализации реакционной смеси щелочью в пределах рН 9-10. Приведенные выше примеры и схема показывают, что во всех случаях возможно получение CaF2 с применением фторсиликатов, которые ранее не использовались для этой цели и тем более из отходов, которые еще недостаточно перерабатываются и требуют значительных затрат для утилизации. Реализация заявляемого способа позволяет использовать нетрадиционные виды сырья для синтеза СаF2, т.е. расширяет сырьевую базу для их получения. Из трудно- или неперерабатываемых отходов по заявляемому способу удается получить ценный продукт, который находит широкое применение в различных отраслях. Растворы, которые образуются при этом (Na2SiO3, Na2SO4) могут быть использованы в производстве порошкообразных моющих средств. Предлагаемый способ не требует специального оборудования.Формула изобретения
СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА КАЛЬЦИЯ, включающий взаимодействие при перемешивании в водной среде нерастворимой соли кальция и фторсодержащего соединения, отличающийся тем, что в качестве нерастворимой соли кальция и фторсодержащего соединения используют соответственно фосфогипс и фторсиликатные растворы, являющиеся отходами производства экстракционной фосфорной кислоты, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения рН 9 - 10.РИСУНКИ
Рисунок 1www.findpatent.ru
«Химзавод фторсолей» - Кальция фторид (Кальций фтористый) "Ч", "Технический"
Calcium fluoride
CAS №: 7789-75-5
ТУ 2621-007-69886968-2015 с изм.1
Формула: CaF2
Описание
Белый кристаллический порошок с серым оттенком. Нерастворим в воде. Токсичен. Пожаровзрывобезопасен.
Характеристики
|
Показатели |
Ч |
Технический |
|
Массовая доля фторида кальция (CaF2), %, не менее |
98,0 |
92,0 |
|
Массовая доля общего азота (N), из нитратов, нитритов и др., %, не более |
0,02 |
- |
|
Массовая доля сульфатов (SO4), %, не более |
0,02 |
0,02 |
|
Массовая доля хлоридов (Cl), %, не более |
0,02 |
0,02 |
|
Массовая доля железа (Fe), %, не более |
0,015 |
- |
|
Массовая доля кремния, (Si), %, не более |
0,02 |
- |
|
Массовая доля тяжелых металлов (Cu+Pb+Mn), %, не более |
0,002 |
- |
Упаковка
Полиэтиленовый мешок, вложенный в картонный барабан, 30 кг.
Возможна упаковка в ведрах по 5, 10 кг
Условия хранения
Хранить в сухом, хорошо проветриваемом помещении.
Гарантийный срок хранения:
- Квалификация «Ч» – 3 года;
- Квалификация «Технический» – 1 год.
ftorsoli.ru
- Какое масло заливать в бензогенератор

- Вольт амперная характеристика это
- Стабилизатор 15 квт

- Стабилизатор 15 квт

- Плоский солнечный коллектор

- Плоский солнечный коллектор

- Генератор huter dy4000l

- Генератор huter dy4000l

- Сварочный фен для полипропилена

- Сварочный фен для полипропилена

- Сварочная маска ресанта хамелеон









