Азотная кислота: формула химическая, свойства, получение и применение. Формула азот
АЗОТ | Энциклопедия Кругосвет
АЗОТ, N (nitrogenium), химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом), и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого, известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3–), нитриты (NO2–), цианиды (CN–), нитриды (N3–) и азиды (N3–).
Историческая справка.
Опыты А.Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни и процессов горения, подтвердили существование относительно инертного вещества в атмосфере. Не установив элементную природу остающегося после сгорания газа, Лавуазье назвал его azote, что на древнегреческом означает «безжизненный». В 1772 Д.Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух». Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру».
Фиксация азота и азотный цикл.
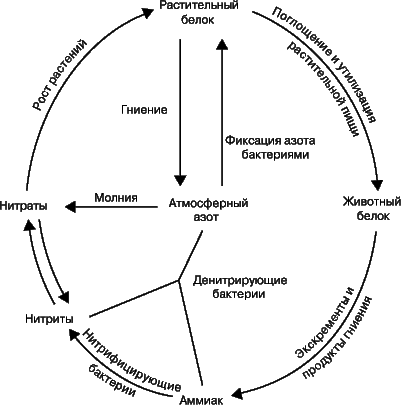
Термин «фиксация азота» означает процесс связывания атмосферного азота N2. В природе это может происходить двумя путями: либо бобовые растения, например горох, клевер и соя, накапливают на своих корнях клубеньки, в которых бактерии, фиксирующие азот, превращают его в нитраты, либо происходит окисление атмосферного азота кислородом в условиях разряда молнии. С.Аррениус установил, что таким способом фиксируется до 400 млн. т азота ежегодно. В атмосфере оксиды азота соединяются с дождевой водой, образуя азотную и азотистую кислоты. Кроме того, установлено, что с дождем и снегом на каждый гектар земли попадает ок. 6700 г азота; достигая почвы, они превращаются в нитриты и нитраты. Растения используют нитраты для образования растительных белковых веществ. Животные, питаясь этими растениями, усваивают белковые вещества растений и превращают их в животные белки. После смерти животных и растений происходит их разложение, азотные соединения превращаются в аммиак. Аммиак используется двумя путями: бактерии, не образующие нитратов, разрушают его до элементов, выделяя азот и водород, а другие бактерии образуют из него нитриты, которые другими бактериями окисляются до нитратов. Таким образом происходит круговорот азота в природе, или азотный цикл.
Строение ядра и электронных оболочек.
В природе существуют два стабильных изотопа азота: с массовым числом 14 ( содержит 7 протонов и 7 нейтронов) и с массовым числом 15 (
содержит 7 протонов и 7 нейтронов) и с массовым числом 15 (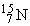
 таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ.
таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ. Молекулярный азот.
Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2p-электрона каждого атома образуют тройную связь:N:::N:, формируя электронные пары. Измеренное межатомное расстояние N–N равно 1,095 Å. Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1).
Энергия диссоциации моля (28,016 г или 6,023Ч1023 молекул) молекулярного азота на атомы (N2 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Получение и применение.
Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы.
Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы.
Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:
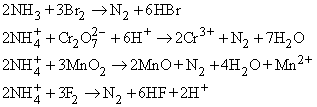
Очень удобен процесс окисления иона аммония нитрит-ионом:
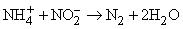
Известны и другие способы – разложение азидов при нагревании, разложение аммиака оксидом меди(II), взаимодействие нитритов с сульфаминовой кислотой или мочевиной:
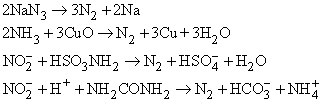
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:
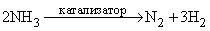
Физические свойства.
Некоторые физические свойства азота приведены в табл. 1.
| Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА | |
| Плотность, г/см3 | 0,808 (жидк.) |
| Температура плавления, °С | –209,96 |
| Температура кипения, °С | –195,8 |
| Критическая температура, °С | –147,1 |
| Критическое давление, атма | 33,5 |
| Критическая плотность, г/см3а | 0,311 |
| Удельная теплоемкость, Дж/(мольЧК) | 14,56 (15° С) |
| Электроотрицательность по Полингу | 3 |
| Ковалентный радиус, | 0,74 |
| Кристаллический радиус, | 1,4 (M3–) |
| Потенциал ионизации, Вб | |
| первый | 14,54 |
| второй | 29,60 |
| а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы.б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота. | |
Химические свойства.
Как уже было отмечено, преобладающим свойством азота при обычных условиях температуры и давления является его инертность, или малая химическая активность. Электронная структура азота содержит электронную пару на 2s-уровне и три наполовину заполненные 2р-орбитали, поэтому один атом азота может связывать не более четырех других атомов, т.е. его координационное число равно четырем. Небольшой размер атома также ограничивает количество атомов или групп атомов, которые могут быть связаны с ним. Поэтому многие соединения других членов подгруппы VA либо вовсе не имеют аналогов среди соединений азота, либо аналогичные соединения азота оказываются нестабильными. Так, PCl5 – стабильное соединение, а NCl5 не существует. Атом азота способен связываться с другим атомом азота, образуя несколько достаточно стабильных соединений, такие, как гидразин N2h5 и азиды металлов MN3. Такой тип связи необычен для химических элементов (за исключением углерода и кремния). При повышенных температурах азот реагирует со многими металлами, образуя частично ионные нитриды MxNy. В этих соединениях азот заряжен отрицательно. В табл. 2 приведены степени окисления и примеры соответствующих соединений.
| Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ | |
| Степень окисления | Примеры соединений |
| –III | Аммиак Nh4, ион аммония Nh5+, нитриды M3N2 |
| –II | Гидразин N2h5 |
| –I | Гидроксиламин Nh3OH |
| I | Гипонитрит натрия Na2N2O2, оксид азота(I) N2O |
| II | Оксид азота(II) NO |
| III | Оксид азота(III) N2O3, нитрит натрия NaNO2 |
| IV | Оксид азота(IV) NO2, димер N2O4 |
| V | Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) |
Нитриды.
Соединения азота с более электроположительными элементами, металлами и неметаллами – нитриды – похожи на карбиды и гидриды. Их можно разделить в зависимости от характера связи M–N на ионные, ковалентные и с промежуточным типом связи. Как правило, это кристаллические вещества.
Ионные нитриды.
Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3–. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя Nh4 и гидроксиды металлов.
Ковалентные нитриды.
Когда электроны азота участвуют в образовании связи совместно с электронами другого элемента без перехода их от азота к другому атому, образуются нитриды с ковалентной связью. Нитриды водорода (например, аммиак и гидразин) полностью ковалентны, как и галогениды азота (NF3 и NCl3). К ковалентным нитридам относятся, например, Si3N4, P3N5 и BN – высокостабильные белые вещества, причем BN имеет две аллотропные модификации: гексагональную и алмазоподобную. Последняя образуется при высоких давлениях и температурах и имеет твердость, близкую к твердости алмаза.
Нитриды с промежуточным типом связи.
Переходные элементы в реакции с Nh4 при высокой температуре образуют необычный класс соединений, в которых атомы азота распределены между регулярно расположенными атомами металла. В этих соединениях нет четкого смещения электронов. Примеры таких нитридов – Fe4N, W2N, Mo2N, Mn3N2. Эти соединения, как правило, совершенно инертны и обладают хорошей электрической проводимостью.
Водородные соединения азота.
Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода – аммиак Nh4 и гидразин N2h5. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак Nh4.
Аммиак – один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
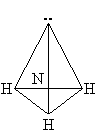
Строение молекулы.
Молекула Nh4 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
Cвойства аммиака.
Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
| Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ | ||
| Свойство | Аммиак | Вода |
| Плотность, г/см3 | 0,65 (–10° С) | 1,00 (4,0° С) |
| Температура плавления, °С | –77,7 | 0 |
| Температура кипения, °С | –33,35 | 100 |
| Критическая температура, °С | 132 | 374 |
| Критическое давление, атм | 112 | 218 |
| Энтальпия испарения, Дж/г | 1368 (–33° С) | 2264 (100° С) |
| Энтальпия плавления, Дж/г | 351 (–77° С) | 334 (0° С) |
| Удельная электропроводность | 5Ч10–11 (–33° С) | 4Ч10–8 (18° С) |
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель.
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
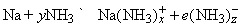
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
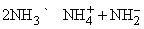
аналогично процессу, протекающему в воде:
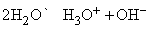
Некоторые химические свойства обеих систем сопоставлены в табл. 4.
Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой.
Получение аммиака.
Газообразный Nh4 выделяется из солей аммония при действии сильного основания, например, NaOH:
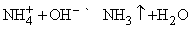
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
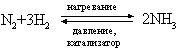
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака.
Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение Nh4Чh3O, которое часто ошибочно считают гидроксидом аммония Nh5OH; в действительности существование Nh5OH в растворе не доказано. Водный раствор аммиака («нашатырный спирт») состоит преимущественно из Nh4, h3O и и малых концентраций ионов Nh5+ и OH–, образующихся при диссоциации
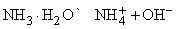
Основной характер аммиака объясняется наличием неподеленной электронной пары азота:Nh4. Поэтому Nh4 – это основание Льюиса, которое имеет высшую нуклеофильную активность, проявляемую в форме ассоциации с протоном, или ядром атома водорода:
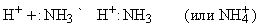
Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с Nh4 с образованием координационного соединения. Например:
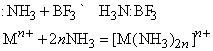
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония Nh5NO3, хлорид аммония Nh5Cl, сульфат аммония (Nh5)2SO4, фосфат аммония (Nh5)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина Nh3CONh3, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
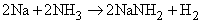
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
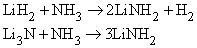
Амиды щелочных металлов (например, NaNh3) реагируют с N2O при нагревании, образуя азиды:
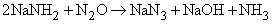
Газообразный Nh4 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и h3:
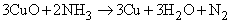
Атомы водорода в молекуле Nh4 могут замещаться на галоген. Иод реагирует с концентрированным раствором Nh4, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции Nh4 c Cl2 образуются хлорамины NCl3, NHCl2 и Nh3Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
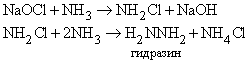
Гидразин.
Приведенные выше реакции представляют собой способ получения моногидрата гидразина состава N2h5Чh3O. Безводный гидразин образуется при специальной перегонке моногидрата с BaO или другими водоотнимающими веществами. По свойствам гидразин слегка напоминает пероксид водорода h3O2. Чистый безводный гидразин – бесцветная гигроскопичная жидкость, кипящая при 113,5° C; хорошо растворяется в воде, образуя слабое основание
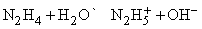
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [Nh3Nh3H]+X–. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты.
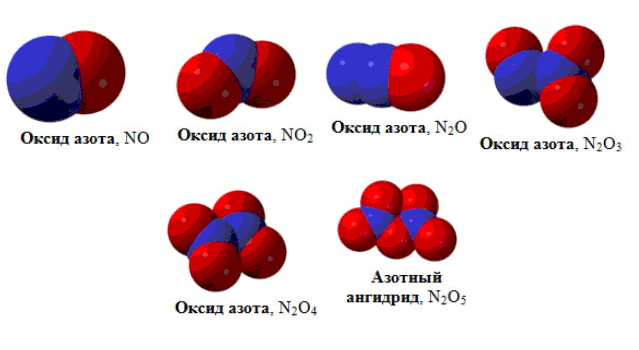
Оксиды азота.
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I)
N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
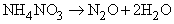
Молекула имеет линейное строение
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине.
Оксид азота(II)
NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
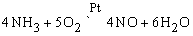
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
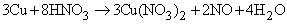
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO  N2O2.
N2O2.
Оксид азота(III)
N2O3 (триоксид азота) – ангидрид азотистой кислоты: N2O3 + h3O  2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV)
NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
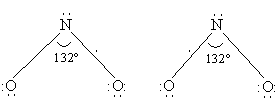
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:

а также по реакциям:
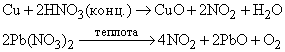
При комнатной температуре NO2 – газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при –9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + h3O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта – азотной кислоты.
Оксид азота(V)
N2O5 (устар. ангидрид азотной кислоты) – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
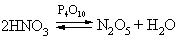
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
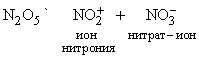
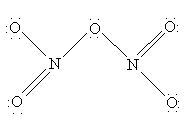
N2O5 – хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
Оксокислоты азота.
Для азота известны три оксокислоты: гипоазотистая h3N2O2, азотистая HNO2 и азотная HNO3.
Гипоазотистая кислота
h3N2O2 – очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла – гипонитрита при действии другой кислоты: M2N2O2 + 2HX  2MX + h3N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
2MX + h3N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
Азотистая кислота
HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
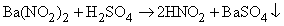
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H–O–N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты.
Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты – нитриты – хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей.
Азотная кислота
HNO3 – один из наиболее важных неорганических продуктов основной химической промышленности. Она используется в технологиях множества других неорганических и органических веществ, например, взрывчатых веществ, удобрений, полимеров и волокон, красителей, фармацевтических препаратов и др. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
www.krugosvet.ru
Формула оксида азота в химии
Определение и формула оксида азота
Известно несколько оксидов азота, в которых азот имеет разные степени окисления.
Оксид диазота
Химическая формула – 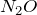
Молярная масса равна 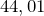 г/моль.
г/моль.
Другие названия — «Веселящий газ», закись азота.
Физические свойства – в обычных условиях бесцветный термически устойчивый газ.
Несолеобразующий оксид, слабый окислитель и слабый восстановитель.
Химические свойства оксида диазота
Получение
Один из способов получения закиси азота основан на разложении нитрата аммония при 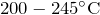 :
:
![Rendered by QuickLaTeX.com \[ NH_4NO_3 \rightarrow N_2O+2H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-63a55873bb3112a8e56eabaa8e4c045a_l3.png)
Монооксид азота
Формула – 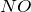
Молярная масса равна 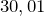 г/моль.
г/моль.
Физические свойства – бесцветный газ, голубая жидкость.
В твердом состоянии полностью димеризован, термически устойчивый.
Несолеобразующий оксид, слабый окислитель и слабый восстановитель, плохо растворяется в воде.
Химические свойства монооксида азота
Получение
Один из способов получения закиси азота основан на взаимодействии аммиака с кислородом при 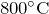 в присутствии катализатора:
в присутствии катализатора:
![Rendered by QuickLaTeX.com \[ 4NH_3+5O_2=4NO+6H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-931fc8c6688553ace097138aab9474c9_l3.png)
Триоксид азота
Формула – 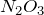
Молярная масса равна 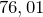 г/моль.
г/моль.
Физические свойства – синяя жидкость, термически неустойчивая.
В твердом состоянии имеет голубоватый цвет.
Солеобразующий оксид.
Химические свойства триоксида азота
Получение
Один из способов получения триоксида азота основан на взаимодействии диоксида азота с водой:
![Rendered by QuickLaTeX.com \[ 4NO_2 + H_2O = 2HNO_3 + N_2O_3 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-959480ad1004f2d4ce577d79dde56482_l3.png)
Диоксид азота
Формула – 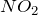
Молярная масса равна 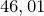 г/моль.
г/моль.
Физические свойства – бурый газ, в жидком состоянии димер бесцветен, в твердом состоянии белый.
Хорошо растворяется в холодной воде и реагирует с ней.
Сильный окислитель.
Химические свойства диоксида азота
Получение
Один из способов получения триоксида азота основан на взаимодействии диоксида азота с водой:
![Rendered by QuickLaTeX.com \[ 2NO+O_2=2NO_2 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6ec5ccb385eb2e45d82373461e8ae9a6_l3.png)
Пентаоксид азота
Формула – 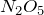
Молярная масса равна 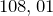 г/моль.
г/моль.
Физические свойства – белое твердое вещество, бесцветный газ и бесцветная жидкость.
При нагревании возгоняется и плавится.
Солеобразующий оксид, ангидрид азотной кислоты.
Химические свойства пентаоксида азота
Получение
Один из способов получения пентаоксида азота основан на взаимодействии реакции:
![Rendered by QuickLaTeX.com \[ 4HNO_3+P_4O_{10}=2N_2O_5 + 4HPO_3 \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e1082901cc55055b1081913b65331eb4_l3.png)
Примеры решения задач
ru.solverbook.com
Азот — характеристика элемента, физические и химические свойства простого вещества. Аммиак, соли аммония.
 Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Азот (N) находится во втором периоде, пятой группе главной подгруппы. Порядковый номер – 7, Ar – 14,008.
Молекула N2 – самая прочная из всех двухатомных за счет наличия тройной связи малой длины (энергия связи – 946 кДж). Связь в молекуле ковалентная неполярная.
Физические свойства: бесцветный газ, без запаха и вкуса; малорастворим в воде: в 1 л h3O растворяется 15,4 мл N2 при t° = 20 °C и p = 1 атм; t кипения =-196 °C; t плавления =-210 °C. Природный азот состоит из двух изотопов с атомными массами: 14 и 15.
Химические свойства азота: Атом азота имеет 7 электронов, из них 5 на внешнем уровне (5 валентных электронов). Он является одним из самых электроотрицательных элементов (3,04 по шкале Полинга), уступая лишь хлору (3.16), кислороду (3,44) и фтору (3,98).
Характерная валентность – 3 и 4.
Наиболее характерные степени окисления: -3, -2, -1, +2, +3, +4, +5, 0. В обычных условиях азот подобен инертному газу.
В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li3N. При нагревании (то есть активации молекул N2) или воздействии электрического разряда вступает в реакцию со многими веществами, обычно выступает как окислитель (азот по электроотрицательности на 3 месте после кислорода и фтора) и лишь при взаимодействии со фтором и кислородом – как восстановитель.
N2 + 3h3 ↔ 2Nh4N2 + 2B → 2BN3Si + 2N2 → Si3N43Ca + N2 → Ca3N2N2 + O2 → 2NO.
Получение азота. В промышленности азот получают путем сжижения воздуха с последующим испарением и отделением азота от других газовых фракций воздуха (перегонка). Полученный азот содержит примеси благородных газов (аргона).
В лабораториях обычно используется азот, доставляемый с производства в стальных баллонах под повышенным давлением или жидкий азот в сосудах Дьюара. Можно получать азот разложением некоторых его соединений:
Nh5NO2 → N2 + 2h3O (при to)
(Nh5)2Cr2O7 → N2 + Cr2O3 + 4h3O (при to)
2N2O → 2N2 + O2 (при to)
Особо чистый азот получают термическим разложением азида натрия:
2NaN3 → 2Na + 3N2 (при to)
Нахождение в природе: в природе азот встречается в основном в свободном состоянии. Содержание азота в воздухе — его объемная доля 78,09 %. В небольшом количество соединения азота находится в почве; азот входит в состав аминокислот, образующих через посредство пептидных связей белки; содержится в молекулах нуклеиновых кислот – ДНК и РНК – в составе азотистых оснований (нуклеотидов): гуанина, аденила, тимидила, цитизила и уридила. Общее содержание азота в земной коре – 0,01 %. Из минералов промышленное значение имеют чилийская селитра NaNO3 и индийская селитра KNO3.
himege.ru
Азот, свойства азота | Формулы и расчеты онлайн

Азот — бесцветный газ, который составляет 78% атмосферы нашей планеты.
Фермеры во всем мире используют в качестве удобрения аммиак, содержащий азот.
\[NH_3\]
Аммиак имеет резкий неприятный запах, и является одним из опасных химических веществ, но растворенный в небольшом количестве воды после орошения этим раствором почвы, он становится пищей для разных сель хоз-культур. Огромное количество азота ежегодно используется для орошения почв. К сожалению, большая его часть убегает с подземными водами в океан, где азот вызывает бурное цветение водорослей, потому, что в морской воде, так же как и в почве, азот часто является фактором, влияющим на рост растений. Положительной стороной, этого является возможность накормить миллиарды людей, которые в противном случае могли бы умереть с голоду. Жизнь полна компромиссов.
Азот, Свойства и параметры азота
Азот, Вступление | |
| Символ | N |
| Латинское название | Nitrogen |
| Тип вещества | простой химический элемент |
| Первооткрыватель | Д. Резерфорд |
| Год открытия | 1772 |
Основные параметры азота по таблице Менделеева | |
| Атомный номер Z | 7 |
| Атомная масса | 14.0067 |
| Группа | 15 |
| Период | 2 |
| Принадлежность к группе | неметаллы |
Механические свойства азота | |
| Плотность газообразных веществ (при 0°C и 760мм.рт.ст) | 1.250 (Килограмм / Метр3) |
| Скорость звука | 333.6 (Метр / Секунда) |
Термодинамические свойства азота | |
| Агрегатное состояние при нормальных условиях | газ |
| Точка плавления по Кельвину | 63.05 (Кельвин) |
| Точка плавления по Цельсию | -210.1 (°C) |
| Точка кипения по Кельвину | 77.36 (Кельвин) |
| Точка кипения по Цельсию | -195.79 (°C) |
| Показатель адиабаты | 1.40 |
| Газовая постоянная | 297 (Джоуль / (Килограмм · Кельвин)) |
| Коэффициент объемного расширения газов в интервале температур (0..100°C) при давлении 101.3 кПа | 3.372 · 10 − 3 (1 / Кельвин) |
Магнитные свойства азота | |
| Тип магнитной проницаемости | диамагнетик |
Свойства атома азота | |
| Конфигурация электронного облака | 1s22s22p3 |
| Радиус атома | 56 · 10 − 12 (Метр) |
| Число протонов p | 7 |
| Число нейтронов n | 7 |
| Число электронов e | 7 |
| Массовое число A | 14 |
| Атомная структура азота | 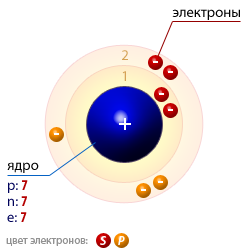 |
Химические свойства азота | |
| Валентность | 3 |
Распространенность азота | |
| Вселенная состоит из азота на | 0.1% |
| Солнце состоит из азота на | 0.1% |
| Мировой океан состоит из азота на | 0.00005% |
| Человеческое тело состоит из азота на | 2.6% |
Вселенная | |
| Вселенная состоит из азота на | 0.1% |
В помощь студенту
| стр. 782 |
www.fxyz.ru
Азот — Циклопедия
Азот
Химический элемент
| Символ, номер | N, 7 |
| Атомная масса | 14,00643 а.е.м. |
| Электронная конфигурация | [He] 2s2 2p3 |
| Электроотрицательность | 3,04 по шкале Поллинга |
| Степени окисления | 5; 4; 3; 2; 1; 0; −1; −2; −3 |
| Плотность | 0,001251 г/см³ (при н.у.) |
| Температура плавления | -209,86 °C |
| Температура кипения | -195,75 °C |
| Структура кристаллической решетки | кубическая |
| Теплопроводность | (300 K) 0,026 Вт/(м·К) |
Азот — весьма инертный химический элемент.
[править] История открытия
В работе «Химический трактат о воздухе и огне» шведский химик К. Шееле описал получение и свойства «огненного воздуха» и отметил, что атмосферный воздух состоит из двух «видов воздуха»: «огненного» — кислорода и «флогистованого» — азота. Однако приоритет открытия кислорода принадлежит Джозефу Пристли, потому что труд Шееле был опубликован только в 1777 году.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота.
[править] Происхождение названия
Название «азот» (от греч. ἀζωτος — безжизненный, (на других языках: лат. Nitrogenium — то, что порождает селитру) предложено в 1787 Антуан Лавуазье, который в то время в составе группы других французских ученых разрабатывал принципы химической номенклатуры.
[править] Распространение в природе
Круговорот азота в природеОбщее содержание азота в земной коре составляет 1 · 10−2 % по массе. Основная его масса находится в воздухе. Сухой воздух содержит в среднем 78,09 % по объему (или 75,6 % по массе) свободного азота, соответствует общей массе 4 • 1015 т.[1] В отношении малых количествах свободный азот находится в растворенном состоянии в водах океанов. В виде соединений с другими элементами (связанный азот) входит в состав всех растительных и животных организмов. Мощные месторождения азота в виде так называемой чилийской селитры известны лишь в Чили (Южная Америка). Кроме того, небольшие количества азота содержатся в почве, главным образом в виде органических соединений и солей азотной кислоты.
Азот имеет два стабильных изотопа: 14N (99,63 %) и 15N (0,37 %). Искусственно получено 4 радиоактивных изотопа азота с массовыми числами 12, 13, 16, 17.
[править] Химические свойства
Азот входит в главной подгруппы пятой группы периодической системы Менделеева. Порядковый номер его 7. Атомы азота имеют во внешней электронной оболочке пять электронов. Поэтому они могут присоединять три электрона, которых им не хватает для образования полностью заполненной восемью электронами оболочки, и восстанавливаться до ионов N 3 или терять пять валентных электронов, превращаясь в положительно заряженные ионы и проявляя при этом свою максимальную положительную валентность. Атомы азота также могут терять и меньшее количество электронов, проявляя при этом положительную валентность 1+, 2+, 3+ и 4+.
Молекулы азота двухатомные, оба атома прочно связаны между собой тремя общими электронными парами.
Чтобы разложить молекулу азота на атомы, надо потратить значительное количество энергии. Поэтому азот при обычных условиях химически довольно пассивный.
При высоких температурах, когда молекулы азота разлагаются и он переходит в атомарное состояние, он сравнительно легко вступает в реакции с металлами (особенно с активными), образуя так называемые нитриды. При высокой температуре, высоком давлении и наличии катализатора оксид соединяется с водородом с образованием аммиака. При температуре электрической искры (свыше 3000 °C) азот реагирует с кислородом, образуя неустойчивый при высокой температуре монооксид азота NO по реакции:
В природе эта реакция происходит при грозовых разрядах.
[править] Другие свойства
В обычных условиях азот физиологически инертен, но при вдыхании сжатого воздуха наступает состояние, называемое азотным наркозом, подобное алкогольному опьянению. Эти случаи могут быть при условии водолазных работ на глубине нескольких десятков метров. Для предупреждения возникновения данного состояния порой пользуются искусственными газовыми смесями, в которых азот заменен гелием или иным инертным газом. При резком и значительном снижении парциального давления азота, растворимость его в крови и тканях настолько уменьшается, что часть его выделяется в виде пузырьков, является одной из причин возникновения кессонной болезни, которая наблюдается у водолазов при быстром их поднятии на поверхность и у пилотов при больших скоростях взлета самолета, а также при входе в верхние слои атмосферы.
В смеси с кислородом азот используется как слабый наркотик, вызывающий состояние опьянения, эйфории, притупление болевой чувствительности. Используется для ингаляционного наркоза.
Получение азота разложением нитрита аммонияВ лабораторных условиях чистый азот обычно получают путем разложения при нагревании раствора нитрита аммония по реакции:
Еще один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре 700 °C:
- 2Nh4 + 3CuO → N2↑ + 3h3O + 3Cu.
Аммиак берут из насыщенного раствора при нагревании, количество CuO в 2 раза больше расчетного. Непосредственно перед применением азот очищают от примесей кислорода и аммиака пропусканием над медью и ее оксидом (II), затем сушат концентрированной серной кислотой и сухой щелочью. Процесс достаточно медленный, но газ получается довольно чистый.
В промышленности азот в больших количествах добывают из воздуха с помощью азотных станций.
Жидкий азотЖидкий азот применяется как хладагент и для криотерапии.
Промышленное применение газообразного азота обусловлены его инертными свойствами. Газообразный азот пожаро- и взрывобезопасный, препятствует окислению, гниению. В нефтехимии азот применяется для продувки резервуаров и трубопроводов, проверки работы трубопроводов под давлением, увеличение выработки месторождений. В горном деле азот может использоваться для создания в шахтах взрывобезопасной среды, для распирания пластов породы. В производстве электроники азот применяется для продувки областей, не допускающих наличия кислорода. Если в процессе, традиционно проходит с использованием воздуха, окисления или гниения являются негативными факторами — азот может успешно заменить воздух.
Большая часть получаемого в технике азота используется для производства аммиака.
В последнее время значительное распространение получило использование азота для создания инертной среды при проведении некоторых химических реакций, при перекачке горючих жидкостей и т. д.
Поскольку азот имеет низкую температуру кипения (77,4 К), то сжиженный азот является одним из главных криогенных жидостей.
Азот присутствует во многих взрывчатых веществах. Их свойства объясняются тем, что образование молекулы азота приводит к установлению очень прочной тройной связи, при этом высвобождается большое количество энергии.
- ↑ Кравчук П. А. Рекорды природы. — Любешов: Эрудит, 1993, 216 с.
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Украинская советская энциклопедия. В 12-ти томах / Под ред. М. Желаемая. — 2-е изд. — К. : Гол. редакция УРЕ, 1974—1985.
- Ф. А. Деркач «Химия» Л. 1968
- Малая горная энциклопедия . В 3-х т. / Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004.
cyclowiki.org
Степень окисления азота (N), формула и примеры
Общие сведения о степени окисления азота
Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14N (99,635%) и 15N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот – газ. Температуры плавления (-210oС) и кипения (-195,8oС) азота очень низкие; он плоха растворяется в воде и других растворителях.
Степень окисления азота в соединениях
Азот образует двухатомные молекулы состава N2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю.
Для азота характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-3) азот проявляет в соединениях под названием нитриды (Mg+23N-32, B+3N-3), самым известным из которых является аммиак (N-3H+13).
Степень окисления (-2) азот проявляет в соединениях перикисного типа – пернитридах, простейшим представителем которых является гидразин (диамид/ пернитрид водорода) – N-22h3.
В соединении под названием гидроксиламин – N-1h3OH–азот проявляет степень окисления (-1).
Наиболее устойчивые положительные степени окисления азота – это (+3) и (+5). Первую из них он проявляет во фториде (N+3F-13), оксиде (N+32O-23), оксогалогенидах (N+3OCl, N+3OBr и т.д.), а также производных аниона NO2— (KN+3O2, NaN+3O2 и др.). Степень окисления (+5) азот проявляет в оксиде N+52O5, оксонитриде N+5ON, диоксофториде N+5O2F, а также в триоксонитрат (V) –ионе NO3— и динитридонитрат (V) –ионе Nh3—.
Азот также проявляет степени окисления (+1) – N+12O, (+2) – N+2O и (+4)N+4O2 в своих соединениях, но значительно реже.
Примеры решения задач
ru.solverbook.com
формула химическая, свойства, получение и применение
Один из наиболее важных продуктов, используемых человеком, – это нитратная кислота. Формула вещества – HNO3, оно же обладает и разнообразными физическими и химическими характеристиками, отличающими его от других неорганических кислот. В нашей статье мы изучим свойства азотной кислоты, ознакомимся с методами ее получения, а также рассмотрим сферы применения вещества в различных отраслях промышленности, медицины и сельского хозяйства.
Особенности физических свойств
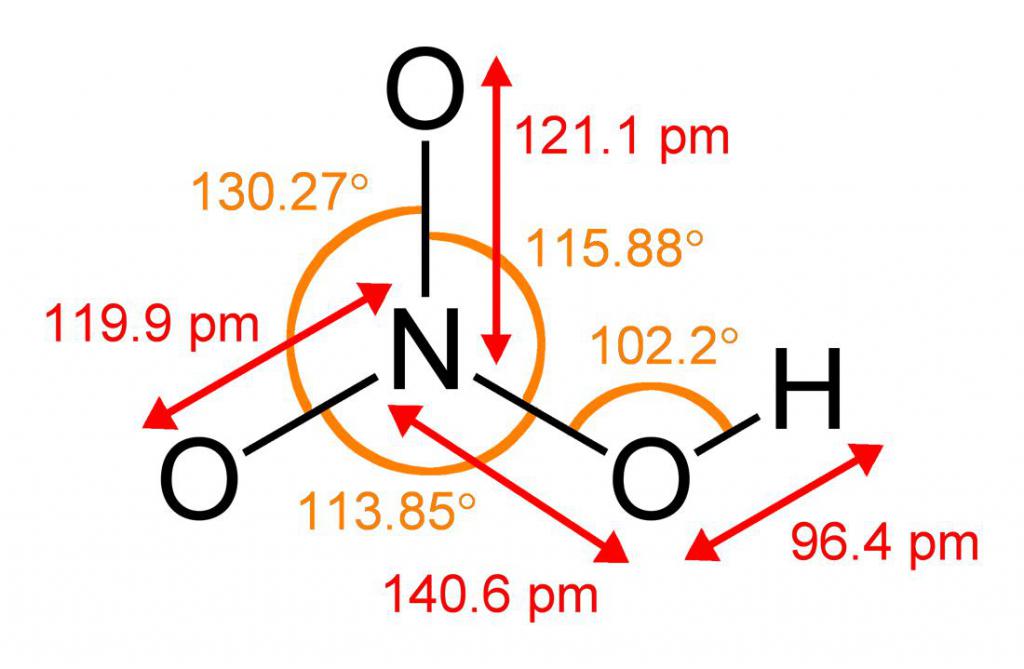
Полученная в лаборатории азотная кислота, структурная формула которой приведена ниже, представляет собой бесцветную жидкость с неприятным запахом, более тяжелую, чем вода. Она быстро испаряется и имеет невысокую температуру кипения, равную +83 °С. Соединение легко смешивается с водой в любых пропорциях, образуя растворы различной концентрации. Более того, нитратная кислота может поглощать влагу из воздуха, то есть является гигроскопическим веществом. Структурная формула азотной кислоты неоднозначна, и может иметь две формы.
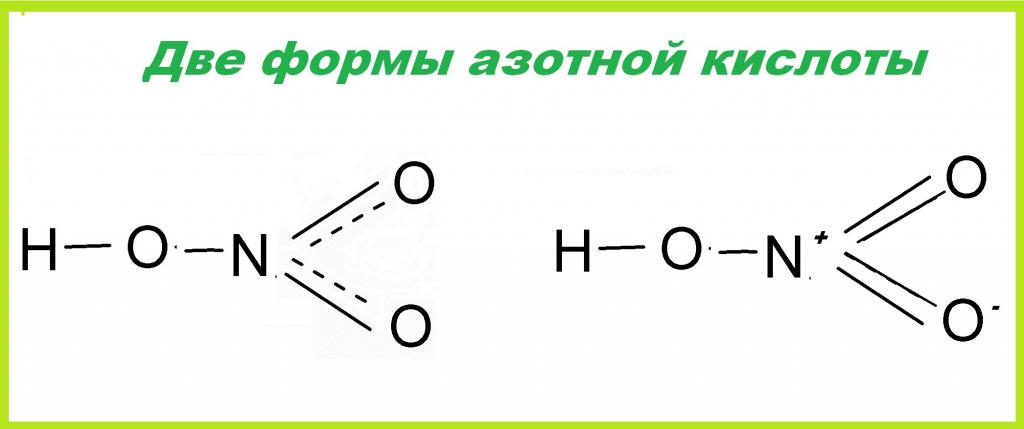
В молекулярном виде нитратная кислота не существует. В водных растворах различной концентрации вещество имеет вид следующих частиц: h4O+ - ионов гидроксония и анионов кислотного остатка - NO3-.
Кислотно-основное взаимодействие
Азотная кислота, являющаяся одной из самых сильных кислот, вступает в реакции замещения, обмена, нейтрализации. Так, с основными оксидами соединение участвует в обменных процессах, в результате которых получается соль и вода. Реакция нейтрализации – основное химическое свойство всех кислот. Продуктами взаимодействия оснований и кислот всегда будут соответствующие соли и вода:
NaOH + HNO3→ NaNO3 + h3O
Реакции с металлами
В молекуле азотной кислоты, формула которой HNO3, азот проявляет самую высокую степень окисления, равную +5, поэтому вещество обладает ярко выраженными окислительными свойствами. Как сильная кислота оно способно взаимодействовать с металлами, стоящими в ряду активности металлов до водорода. Однако она, в отличие от других кислот, может реагировать и с пассивными металлическими элементами, например, с медью или серебром. Реагенты и продукты взаимодействия определяются, как концентрацией самой кислоты, так и активностью металла.

Разбавленная азотная кислота и ее свойства
Если массовая доля HNO3 составляет 0,4-0,6, то соединение проявляет все свойства сильной кислоты. Например, диссоциирует на катионы водорода и анионы кислотного остатка. Индикаторы в кислой среде, например, фиолетовый лакмус, в присутствии избытка ионов H+ меняет свою окраску на красную. Важнейшая особенность реакций нитратной кислоты с металлами – это невозможность выделения водорода, который окисляется до воды. Вместо него образуются различные соединения – оксиды азота. Например, в процессе взаимодействия серебра с молекулами азотной кислоты, формула которой HNO3, обнаруживается монооксид азота, вода и соль – нитрат серебра. Степень окисления азота в сложном анионе снижается, так как происходит присоединение трех электронов.

С активными металлическими элементами, такими, как магний, цинк, кальций, нитратная кислота реагирует с образованием окиси азота, валентность которого наименьшая, она равна 1. Также образуются соль и вода:
4Mg + 10HNO3 = Nh5NO3 + 4Mg(NO3)2 + 3h3O
Если же азотная кислота, химическая формула которой HNO3, очень разбавлена, в этом случае, продукты ее взаимодействия с активными металлами будут различными. Это может быть аммиак, свободный азот или оксид азота (І). Все зависит от внешних факторов, к которым можно отнести степень измельчения металла и температуру реакционной смеси. Например, уравнение ее взаимодействия с цинком будет иметь следующий вид:
Zn + 4HNO3= Zn(NO3)2+ 2NO2+ 2h3O
Концентрированная HNO3 (96-98%) кислота в реакциях с металлами восстанавливается до диоксида азота, причем, это обычно не зависит от положения металла в ряду Н. Бекетова. Так происходит в большинстве случаев, например, при взаимодействии с серебром.
Запомним исключение из правила: концентрированная азотная кислота в обычных условиях не реагирует с железом, алюминием и хромом, а пассивирует их. Это значит, что на поверхности металлов образуется защитная оксидная пленка, препятствующая дальнейшему их контакту с молекулами кислоты. Смесь вещества с концентрированной хлоридной кислотой в соотношении 3:1 называется царской водкой. Она имеет способность растворять золото.
Как нитратная кислота реагирует с неметаллами
Сильные окислительные свойства вещества приводят к тому, что в его реакциях с неметаллическими элементами, последние переходят в форму соответствующих кислот. Например, сера окисляется до сульфатной, бор – до борной, а фосфор – до фосфатных кислот. Приведенные ниже уравнения реакций подтверждают это:
S0 + 2HNVO3 → h3SVIO4 + 2NIIO
Получение азотной кислоты
Наиболее удобный лабораторный способ получения вещества – взаимодействие нитратов с концентрированной сульфатной кислотой. Ее проводят при слабом нагревании, не допуская повышения температуры, так как в этом случае получившийся продукт разлагается.
В промышленности азотную кислоту можно добыть несколькими способами. Например, окислением аммиака, полученным из азота воздуха и водорода. Производство кислоты проходит в несколько стадий. Промежуточными продуктами будут оксиды азота. Вначале образуется монооксид азота NO, затем кислородом воздуха его окисляют до двуокиси азота. Наконец, в реакции с водой и избытком кислорода из NO2 добывают разбавленную (40-60%) нитратную кислоту. Если ее перегонять с концентрированной сульфатной кислотой, можно повысить массовую долю HNO3 в растворе до 98.
Вышеописанный метод производства нитратной кислоты, впервые был предложен основателем азотной промышленности в России И. Андреевым еще в начале 20 века.
Применение
Как мы помним, химическая формула азотной кислоты HNO3. Какая особенность химических свойств обуславливает ее применение, если нитратная кислота является многотоннажным продуктом химического производства? Это высокая окислительная способность вещества. Его применяют в фармацевтической промышленности для получения лекарственных препаратов. Вещество служит исходным сырьем для синтеза взрывчатых соединений, пластических масс, красителей. Нитратная кислота применяется в военной технике в качестве окислителя для ракетного топлива. Большой ее объем применяют в производстве важнейших видов азотных удобрений – селитр. Они способствуют повышению урожайности важнейших сельскохозяйственных культур и повышают содержание в плодах и зеленой массе белка.
Области применения нитратов
Рассмотрев основные свойства, получение и применение азотной кислоты, остановимся на использовании важнейших ее соединений – солей. Они являются не только минеральными удобрениями, некоторые из них имеют большое значение в военной промышленности. Например, смесь, состоящая из 75% нитрата калия, 15% мелкодисперсного угля и 5% серы называется черным порохом. Из нитрата аммония, а также порошка угля и алюминия получают аммонал – взрывчатое вещество. Интересное свойство солей нитратной кислоты – это их способность разлагаться при нагревании.

Причем, продукты реакции будут зависеть от того, ион какого металла входит в состав соли. Если металлический элемент находится в ряду активности левее магния, от в продуктах обнаруживаются нитриты и свободный кислород. Если металл, входящий в состав нитрата, расположен от магния до меди включительно, то при нагревании соли происходит образование диоксида азота, кислорода и оксида металлического элемента. Соли серебра, золота или платины при высокой температуре образуют свободный металл, кислород и двуокись азота.
В нашей статье мы выяснили, какая химическая формула азотной кислоты в химии, и какие особенности ее окислительных свойств имеют наиболее важное значение.
fb.ru















.jpg)