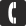Диоксид углерода. Co2 что это
Все о CO2 в аквариуме.
Многие, наверное, хотели иметь дома аквариум с растениями или рыбами, но не все понимают, что к его выбору нужно подходить с особой тщательностью. Одна из самых главных проблем — это подача CO2 (углекислый газ). Ведь растения на 40−50% состоят из него.
Краткое резюме о CO2:
Подача CO2 сильно усиливает рост растений. Оптимальная концентрация CO2 должна составлять 15−30 мг\л для аквариума с растениями и не более 30 мг\л с рыбами.Кислород не вытесняется из воды углекислым газом. Среднее значение подачи CO2 рассчитывается по формуле: при kHmin=4 градуса подача должна быть один пузырек в минуту на десять литров живого объема аквариума.Уровень кислотности (pH) должен быть 6,8−7,2 и за этим нужно внимательно следить, т.к. нитраты и CO2 понижает уровень pH, плюс он может изменятся сам в течении дня. Утром понижается и вечером повышается.
Для получения оптимального уровня pH нужно, чтобы мера щелочности (kH) воды не превышала 6 ед. Чтобы избежать критического падения pH, минимальный безопасный уровень kHmin.=4.
Концентрацию CO2 можно вычислить с фомощью формулы, но для начала нужно измерить pH и kH. CO2=3,0хkHх10^(7,00-pH). Получить CO2 можно из баллона или методом брожения.
Растениям также нужен свет, но не забывайте, что интенсивность освещения и подача CO2 должны быть прямопропорциональными.Основным строительным для клеток растений выступает углерод (СO2), поэтому подача СО2 просто необходима для эффективного и быстрого роста растений. В обычных условиях растения будут расти очень медленно или даже погибать, но подача СО2 ускорит темпы роста в 4−6 раз! Вы приятно удивлены результатами при подаче СО2 (углекислого газа) в аквариум, только не забывайте о правильном балансе со светом и жидкими удобрениями. Без углекислого газа вам останется только наблюдать за тем, как ваши растения будут гибнуть. Но все же СО2 это не единственное, что нужно растениям для роста, поэтому сразу после неожиданного быстрого роста, растения почувствуют нехватку в питательных веществах. Железо, магний, калий и другие микроэлементы очень быстро усваиваются растениями и в очень больших количествах, поэтому подачу углекислого газа (СО2) стоит в обязательном порядке скоординировать с подачей жидких удобрений.
Что нужно растениям для хорошего роста.Во-первых, хороший грунт с нужными для растения свойствами.Во-вторых, постоянная подача углекислого газа (CO2).В-третьих, у растения должна быть постоянная подача питательных веществ.В-четвертых, достаточное количество света и правильный состав спектра.
Для чего растениям CO2?
Все кто хочет иметь аквариум должны уяснить — все растения состоят из С (углерод) и без него они не выживут. Растения питаются, осуществляя фотосинтез. Этот процесс не возможен без кислорода, углерода, света и тд… Каждый из ингредиентов должен поступать в определенном количестве и продолжительности иначе фотосинтез не будет происходить.
Было проведено много исследований, которые показали, что при определенном количестве света, CO2 и питательных веществ, они являются основным фактором роста. Одно из таких исследований было проведено в компании Tropica, где выращивали риччию в течении двух недель. Исследование показало следующие результаты:Если подавать мало CO2 и света, то в 4 раза увеличивается рост растения.Без подачи CO2 и малом количестве света рост падает до нуля.Мало CO2 и большое количество света в 6 раз увеличивает рост растения.Много CO2 и много света из 1 грамма вырастает 6,9 грамм.
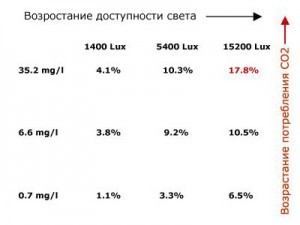
Вывод: Если мы хотим хороший результат, то не стоит увеличивать количество, лишь одного «ингредиента » (CO@ или свет) — это особого эффекта не даст, но при равном увеличении результат поразит вас! Если же вы будите делать как многие неопытные аквариумисты, например, держать аквариум в темноте без подачи CO2? То энергии у растения хватит только на временное поддержание жизни.
Для чего нужно соблюдать правила?
Вам не придется долго ждать. Чтобы композиция приобрела нужный вид. Всего 1,5−3 месяца.Вы можете чаще подрезать растения, детальнее редактировать композицию, делать её такой как вы захотите.Молодые листья выглядят лучше, а значит и композиция будет лучше.Если вы хотите стремиться к работам Takashi Amano, то быстрый рост растений просто необходим.
К 4-х кратному ускорению роста растения может привести даже небольшие дозы углекислого газа, и даже в малоосвещенных помещениях. Это происходит потому, что без каких либо вредоносных последствий, растение начинает производить на порядок больше хлорофилла, но при этом не рушит энергетический баланс. Таким образом, для извлечения углекислого газа (СО2) из воды, растение начинает тратить меньше энергии, собственно больше энергии растение затрачивает на оптимальную переработку данной ему малой доле световой энергии. Вот таким вот путем мы может очень эффективно увеличить рост растения, не перенасыщая его светом, так как оно может полностью использовать даваемый ему свет. Потому, что избыток света может неблагоприятно сказать на здоровом росте растения. Но в любом случае, если правильно увеличить и подачу углекислого газа и света, это произведет гораздо лучший эффект чем улучшение чего-то одного. То как каждый фотон используется в фотосинтезе, независимо от того, под каким углом он падает на лист, вы можете посмотреть на приведенном графике. Этот график явно показывает зависимость данного процесса в использовании молекул углекислого газа от света. Итак, из всего вышеописанного мы можем сделать два вывода. Первое: очень важно балансировать подачу углекислого газа (СО2) под интенсивность освещения и наоборот. Второе: даже если вы подаете малое освещение, уровень подачи углекислого газа (СО2) рекомендуется поддерживать не менее 15мг/л. Хотя лучше всегда поддерживать уровень подачи в районе 30мг/л. Ошибка многих любителей аквариумных растений — неопытность и незнание методики обогащения растений светом и углекислым газом. Обычно в таких случаях, темпы роста растений, у таких людей, стоят на уровне желтой линии, в редких случая — на зеленой. Достигнуть синей линии, можно просто усилив интенсивность подаваемого света. Но тут есть большая опасность водорослей. Только если вы согласуете подачу углекислого газа (СО2) с интенсивностью подаваемого света, вы сможете увеличить темпы роста в разы, то есть достигнуть красной линии. Вы будете удивлены, как быстро вырастут ваши растения!
Почему CO2?
Растения могут употреблять углерод в двух видах: газообразной (CO2) и растворенный в воде — бикарбонат (HCO3-). Растения отдают своё предпочтение чистому CO2 — это связано с тем, что для фотосинтеза придется утилизировать бикарбонат, а растения это делать затруднительно. Поэтому растворенный CO2 более выгодный способ для его получения.
Какая должна быть концентрация CO2?
Думаю, все знают, что CO2 отлично растворим, будь то воздух или вода. В воде CO2 растворяется намного медленнее, чем в воздухе, но водные растения все предусмотрели! У них есть специальный слой, который ускоряет этот процесс, у наземных растений он тоже есть, но он намного тоньше чем у водных. У водных растений такой слой составляет где-то 0.5мм. Чтобы обеспечить водным растениям оптимальный фотосинтез, концентрация CO2 должна составлять 15−30 мг\л, не превышая при этом концентрацию для рыб 30мг\л. Все это нужно для создания естественной окружающей среды, создающая главные сдерживающие факторы фотосинтеза.
CO2 и Кислород.
Многие очень сильно заблуждаются, когда думают, что кислород не вытесняется из воды углекислым газом, и что кислород в больших количествах необходим для дыхания рыб. Нет! Это не так! На самом деле уровень кислорода днем поднимается до 11 мг\л, что превышает 100%. Это происходит из-за активного роста растений. Уровень падает у утру до 8,0 мг\л при условиях, что температура воды 24С. Для нормальной жизни, рыбами необходимо 5мг\л (60%) кислорода растворенного в воде.
Включать или Отключать на ночь CO2?
На этот вопрос существует два мнения. В первом случае считают, что можно обойтись без CO2. Так как к утру уровень кислорода остается высоким, а уровень кислорода остается высоким, а уровень кислотности нормальным, если аквариум не более 1200 литров и в нем не проживает много рыб, то можно обойтись без начального поступления CO2. Вторая сторона считает, что CO2 нужно начинать подавать за 1−2 часа ДО включения света. Так как утром больше всего активен процесс фотосинтез, уровень O2 намного ниже, чем обычно.
Баланс CO2 и света.
Как мы уже говорили, интенсивность света должна соответствовать интенсивности подаваемому CO2. Даже исследования Tropica подтвердили слова Takashi Amano о том если концентрация подаваемого света и CO2 не равномерна, то это принесет только вред и не капли пользы. Все говорят об этом, но не всегда нужно большое количество CO2, это мы можем увидеть из формулы фотосинтеза: 6CO2+12h3O-> C6h22 O6+ 6h3O. В этот момент растения активно выделяют кислород, но, не смотря на это, растения становятся все более слабыми. Таким образом, потребление растениями азота и фосфата уменьшается. Если в аквариуме недостаточно CO2, а света больше чем в достатке, то начнут появляться водоросли. Не стоит добавлять никаких удобрений. Это принесет ещё больше вреда. Но слишком большое количество CO2 может стать токсичным для рыб и других обитателей аквариума. Для каждого растения нужно определенное количество света, а значит и определенное количество CO2. Некоторым нужно больше света, значит больше CO2. Takashi Amano считает, что не существует простых или сложных растений, просто есть растения любящие свет и любящие тень. Подаваемое количество света и CO2 единственное их различие. Если вы хотите завести аквариум то вам стоит с самого начала рассчитать. Какое количество света и CO2 будите подавать своим растениям, чтобы в дальнейшем это не вызвало неудобств.
Сколько нужно CO2
Не думайте, что на этом все, нужно также отслеживать равновесие pH и CO2. Чтобы это все отрегулировать, нужно чтобы kH, pH и CO2 были следующих параметров: kHmin=4 градусов, pH вечером = 7,2, а утром = 6,8, при таких условиях CO2 приобретет параметры от 15−30 мг\л. Это нужно понимать всем кто хочет иметь или же имеет аквариум, и понять, что все это взаимосвязано.Чем больше в воде гидроксидных ионов, тем меньше pH. Реакция воды может быть щелочной (pH>7.0), нейтральной(pH=7.0) и кислой(pH Концентрация растворенного в воде CO2 в природе бывает намного ниже, чем этого нужно для подводного царства, но в пресных водоемах на оборот, по отношению к её обитателям уровень слишком высокий и постоянно возобновляется благодаря течению и выделениям отложений на дне. Если искусственно не обогащать воду CO2, то собственных запасов хватит растениям, только на поддержание жизни и естественно не о каком росте и речи быть не может. Можно вычислить темп подачи с помощью следующей формулы, главное чтобы kH=2-4 при 1 пузырьку в минуту на 10 литров воды: CO2=7-19 мг\л при pH=6,8-7,2. Если kH окажется выше нормы, то вычислять нужно по формуле: kHx V(воды) \ 30. Выше мы уже говорили о том, как правильно использовать большие концентрации. Но они рассчитаны только на подачу CO2. Не забывайте отслеживать рост растения, не совершайте глупых ошибок, и самое главное не забывайте, что растением нужно одинаковое количество света и CO2.
Как влияет CO2 на уровень кислотности(pH).
Как упомянуто выше, для роста растений нужен углерод. Также рекомендуется держать низкий уровень водородного показателя (рН). Подавая СО2 в аквариумную воду мы выполняем обе задачи. Это происходит за счет того, что при попадании СО2 в воду, начинает образовываться угольная кислота. Вода соединяется с СО2 (Н2О+СО2=Н2СО3). Получившаяся кислота диссоциирует на ионы (Н+) и бикарбонат (НСО3-) (основа КН). А при повышении концентрации катионов водорода (Н+), водородный показатель (рН) уменьшается. Таким образом, мы одновременно даем нужный для роста растений углерод, и понижаем водородный показатель на более благоприятный уровень. Но тем не менее мы повышаем уровень углекислого газа (СО2), из-за понижения водородного показателя (рН). (см. ниже в разделе «рН»).Концентрация в воде углекислого газа, а также карбонатный буфер КН, сильно влияют на значение водородного показателя (рН). Из-за этого, связь (рНKH растворенный СО2) будет жесткой. Теперь нам нужно скоординировать подачу углекислого газа вместе с тем, какой уровень водородного показателя в аквариуме нам нужен. А водородный показатель, как раз таки определяется наличием карбонатного буфера КН. То есть единственное, что мы можем контролировать из наших 3-х показателей (рН, КН и СО2), это углекислый газ СО2, так как остальное является заданными величинами оптимальными для нормального роста растений. Таким образом, теперь мы должны подстроить подачу СО2 еще и под оптимальный уровень водородного показателя, которой должен быть равен рН=6.8−7.2, а не только под нужный уровень концентрации углекислого газа в воде. Для всего этого нам понадобится вода с жесткостью dGH=4−10, и собственно с исходным КН=2−8. Тогда оптимальная концентрация должна составлять СО2=15−30мг/л и рН=6.8−7.2.
Растениям необходимо лишь pH=6,8−7,2.
Растения хотят больше CO2.
Как уже говорилось растениям нужно очень много CO2, ведь они сами на 40−50% состоят из углерода и логично, что самым лучшим источником энергии для них будет углекислый газ. В воде он может находиться в двух видах: в виде бикарбоната (HCO3-) и углекислого газа. Диффузным путем они поглощают CO2через стенки клеток, тем самым насыщая свой растительный организм питательными веществами. Многие растения выбрали этот путь поглощения энергии, ведь так им на много проще. Так как, поглощая бикарбонат, они должны сначала поглотить HCO3− и уже только потом извлечь из него CO2 и насытиться им. Это происходит потому, что бикарбонат содержит связанный CO2. Теперь вы понимаете, почему не многие растения не выбирают второй способ поглощения CO2. Многие из них просто не способны на это и это понятно, ведь это очень сложный химический процесс.
В мягкой воде с pH меньше 7, 70% CO2 будет в доступном и усвояемом для растений виде и только 30% будет в бикарбонате. Это значит, что ниже будет показатель кислотности воды, тем больше кислорода смогут усвоить растения, так как он будет легко усвояемом растениями виде (газообразном). Поясню, это значит, что в мягкой воде с показателем kH=2−6 растения получат намного больше углерода, чем в жесткой воде.
Будет ли pH сохранять стабильность с одновременной деятельностью биологических веществ.
Поддерживание стабильного уровня водородного показателя (рН) в аквариуме.Слабые кислоты могут обладать особыми химическими свойствами, результат действий этих свойств и называется — буферизация. Диссоциирование слабых кислот в воде, формирует пары кислота-основание, которые имеют логарифмическое отношение друг к другу. При добавлении кислот и оснований в воду, водородный показатель сильно не измениться, то есть на графике отношения щелочность/кислота относительно водородного показателя, мы могли бы увидеть, что линия зависимости ниже или выше определенного значения водородного показателя (рН) будет плоской. Такое состояние водородного показателя (рН) называется «точкой равновесия», когда линия практически плоская, то есть сколько бы мы не добавляли оснований или кислот, это не будет сильно влиять на уровень водородного показателя (рН). Причем, что еще важно, точка равновесия не одна, и может варьироваться в зависимости от кислот.К примеру, точка равновесия угольной кислоты (Н2СО3), которую мы получаем при добавлении углекислого газа в воду (см. выше), составляет рН=6.37. Из-за того, что в аквариуме естественным биологическим путем производятся нитраты (NO3), которые являются кислотами, водородный уровень может понизиться, если до этого был чуть выше точки равновесия угольной кислоты. А данный уровень водородного показателя (рН=6.37) практически идеален для аквариумных растений, поэтому нам нужно стремиться сохранять именно этот уровень водородного показателя. Буферизации кислоты будет идти долго, перед тем как уровень водородного показателя приобретет желаемый результат, это происходит из-за того что начальный уровень водородного показателя будет выше точки равновесия, и нам нужно сместить его в сторону точки равновесия угольной кислоты. Это и будет для вас секретом стабильности уровня водородного показателя, (рН=6.8−7.2), как наилучший для Nature Aquarium.
Аммоний и токсичный аммиак, какое должно быть соотношение между ними.
Все мы знаем, что аммиак(Nh4) один из форм аммония (Nh5+) и к тому же он очень вреден для жизни, даже в малых количествах (0,06 мг\л). Соотношение аммоний \ аммиак зависит от количества pH. Если pH ниже, то соответственно в аквариуме меньше вредного аммиака. Он будет составлять около 0,5% при условии, что уровень кислотности будет равен 7, но если pH будет больше, например 7,5, то аммиак составит 4%. Что совсем не допустимо! Итак, нужно запомнить одно простое правило: если pH(уровень кислотности воды) более 7,0 , то количество аммиака увеличивается и вредит вашим растениям, рыбам. Можно гарантировать отсутствие аммиака в одном случает, если при pH= 6,8 — 7,2 в NA, тогдаДоля Nh4= 0,4−0,8%. Это потому что NA поддерживает низкий уровень Nh5+\ Nh4(аммоний \ аммиак).
Нитрифицирующие бактерии и их активность.
Бактерии активны на 85% от максимума при уровне кислотности 6,6 . Бактерии никогда не работали, и не будут работать на максимум. При малейших изменениях они могут повысить или понизить свою деятельность. Даже если состояние воды ухудшится, они справятся с нагрузкой, немного увеличив активность своей деятельности, сохранят стабильное положение аквариума. Будет создаваться такой же запас стабильности как с точкой pH. (pH=7,5−7,8 при этом параметре наблюдается максимальная активность нитрофикации, замедляется при pH= 7,5).
И так теперь все поняли, какой должен быть показатель pH (6,8−7,2) для хорошего роста долгой жизни растений. Теперь же давайте определимся, какой должен быть показатель kH.
1. Нужно учесть, что вода при kH=2−5 уже кислая, поэтому автоматически буферизируется на pH= 6,0−7,3. Так как содержится не угольная кислота (h3CO3), а углекислый газ причем в больших количествах. Чтобы избежать падение pH ниже чем вообще возможно, нужно чтобы минимальный уровень жесткости составлял минимум=4,0 при одновременной подаче CO2.
Почему нужно именно этот уровень и почему нельзя больше? Да потому что, если вода будет слишком жесткая, то есть kH>7,0 то и pH будет равняться = 7,8 и тогда придется превысить допустимую для рыб норму подачи CO2. А она должна составлять не более 30 мг\л. И тогда уже не будет никаких и способов и возможностей снизить хоть немного уровень кислотности в воде. Но и занижать уровень жесткости тоже нельзя, я напоминаю, что не ниже двух. Тогда придется увеличить подачу CO2 или придется повысить количество нитратов и при всех этих условиям может возникнуть угроза падения, причем резкого уровня кислотности- это меньше 6,8. Это будет просто ужасно для рыб и растений.
2. Чтобы поддержать стабильность кислотности в воде, нужно чтобы уровень жесткости имел минимум 4, ДО подачи CO2, чтобы в любую минуту не исчез карбонатный буфер, что может привести к снижению кислотности.
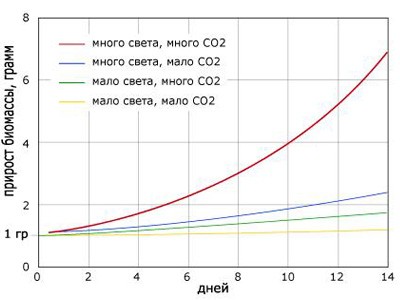
Также надеюсь, вы помните, что pH-kH-CO2 зависят друг от друга. Поэтому по таблице 1 зависимости, зная kH, взяв требуемую величину pH, мы сможем найти углекислый газ. То есть, какая получиться концентрация углекислого газа, если мы возьмем определенные параметры pH и kH.
Например: мы наблюдаем, что с pH=6,8−7,2; kH= 4−5, тогда концентрация углекислого газа (CO2) составит 7,6− 23,8 мг\л. Используя для воды такие параметры, получим нормальное количество pH и CO2. Причем CO2 не будет слишком много, он будет оптимально насыщать воду, что поможет ускорению роста растений.
3. Чтобы растения свободно в большом количестве потребляли углекислый газ нужно, чтобы жесткость воды была равная 3,5−4 и мера кислотности воды была всегда меньше 7. Исходя из этого (уровень карбонатной жесткости) kH играет главную роль в увеличении роста ваших растений. В отличии от общей жесткости (gH), он не сильно влияет на рост растений, поэтому он является второстепенным, не важным фактором в аквариуме, но все же чтобы не навредить рыбам этот показатель не должен быть слишком высоким или слишком низким.
aquahome.info
Диоксид углерода - это... Что такое Диоксид углерода?
| Другие названия | углекислый газ, углекислота,сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.;771 кг/м³, жидкий;1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | 0 0 0
(жидкость) |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Оксиды | COC3O2C2OCO3 |
| Если не указано иное, данные даны дляматериалов при стандартных условиях (25 °C, 100 кПа)Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин.Свойства
Физические
Плотность при нормальных условиях 1,98 г/л. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом — реакция Кольбе) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Диоксид углерода не токсичен, но не поддерживает дыхание. Большая концентрация в воздухе вызывает удушье (см. Гиперкапния). Недостаток углекислого газа тоже опасен (см. Гипокапния)
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленности получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). Смесь газов промывают раствором карбоната калия, который поглощает углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании разлагается, высвобождая углекислоту. При промышленном производстве закачивается в баллоны.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора с соляной кислотой.
Применение
В пищевой промышленности диоксид углерода используется как консервант и обозначается на упаковке под кодом Е290, а также в качестве разрыхлителя теста.
Жидкая углекислота (жидкая пищевая углекислота) — сжиженный углекислый газ, хранящийся под высоким давлением (~ 65-70 Атм). Бесцветная жидкость. При выпуске жидкой углекислоты из баллона в атмосферу часть её испаряется, а другая часть образует хлопья сухого льда.
Баллоны с жидкой углекислотой широко применяются в качестве огнетушителей и для производства газированной воды и лимонада. Углекислый газ используется в качестве активной среды при сварке проволокой так как при температуре дуги углекислота разлагается на угарный газ СО и кислород который в свою очередь и входит в заимодействие с жидким металом окисляя его. Углекислота в баллончиках применяется в пневматическом оружии и в качестве источника энергии для двигателей в авиамоделировании.
Твёрдая углекислота — сухой лёд — используется в качестве хладагента в ледниках и морозильных установках.
Методы регистрации
Измерение парциального давления углекислого газа требуется в технологических процессах, в медицинских применениях — анализ дыхательных смесей при искусственной вентиляции лёгких и в замкнутых системах жизнеобеспечения. Анализ концентрации CO2 в атмосфере используется для экологических и научных исследований, для изучения парникового эффекта.
Углекислый газ регистрируют с помощью газоанализаторов основанных на принципе инфракрасной спектроскопии и других газоизмерительных систем. Медицинский газоанализатор для регистрации содержания углекислоты в выдыхаемом воздухе называется капнограф.
Концентрация
- Подземное животное голый землекоп отличается терпимостью к большим (смертельным для других животных) концентрациям углекислого газа.[1]
Примечания
См. также
Ссылки
Wikimedia Foundation. 2010.
biograf.academic.ru
Измеритель CO2 с даталогером: ammo1
За последние 50 лет концентрация углекислого газа а атмосфере земли повысилась с 0,0315% или 315 ppm до 400 ppm и растёт на 2.2 ppm в год. Концентрация CO2 почти не зависит от места на земле - воздух хорошо перемешивается. Как это не удивительно, содержание CO2 в городском воздухе и в лесу отличается всего на 10 ppm. Считается, что концентрация до 700 ppm для человека не заметна и никак не влияет на его здоровье и самочувствие.
Человек при дыхании выделяет много углекислого газа, поэтому в закрытом помещении концентрация CO2 очень быстро вырастает до 2000 ppm и выше.
Существует два метода определения концентрации углекислого газа в воздухе - электрохимический (solid electrolyte) и метод недисперсионной инфракрасной спектрометрии (Non-dispersive infrared (NDIR) technology). Электрохимический метод менее точен и датчики, работающие на его основе, недолговечны.
Производителей датчиков NDIR похоже всего два. Более известный - шведский SenseAir http://senseair.com. Сейчас SenseAir выпускает датчики K30. Датчики предыдущего поколения SensAir K22 сняты с производства, однако их сделали много и теперь продают относительно дёшево, что позволяет производить измерители CO2 по цене от $100.
Именно таким датчиком, SensAir K22 и оснащён прибор AZ Instruments 7798 CO2 datalogger. По неизвестным причинам когда этот прибор продают под оригинальным называнием он стоит аж $390, однако хитрый продавец GainExpress на Aliexpress и Ebay продаёт этот же прибор под названием «CO98 3-in1 CO2 Carbon Dioxide Desktop Datalogger Monitor Indoor Air Quality Temperature Relative Humidity RH 0~9999ppm Clock» за $139. Там-то я его и купил.
Аналогичный прибор без даталогера и с менее точным датчиком влажности у того же продавца стоит $119.
В комплекте - прибор, блок питания, кабель USB, диск с программой, инструкция, сертификат калибровки.
Прибор показывает уровень CO2 в ppm, температуру и влажность с высокой точностью, время и дату. Кроме того показывается оценочное состояние уровня углекислого газа - Good, Normal или Poor. При желании по достижении уровня Poor прибор может начать пищать и показывать значок вентилятора - пора проветривать.
В этом приборе используется точный ёмкостной датчик влажности (±3%RH at 25°C, 10~90% RH, ±5%RH at 25°C, <10% & >90% RH). В более дешёвых измерителях CO2 стоят датчики попроще, дающие большую ошибку на низких уровнях влажности.
Прибор умеет показывать минимальные и максимальные значения всех трёх измеряемых параметров. В режиме даталогинга задаётся частота измерений (от 1 секунды до 5 часов). При долгом нажатии кнопки Log начинается запись значений в память. Во время записи мигает светодиод и основной дисплей (значение ppm постоянно сменяется надписью rec). Из-за этого мигания неудобно постоянно оставлять прибор в режиме логинга. заканчивается запись по долгому нажатию Esc. Каждая новая запись стирает предыдущую.
После окончания записи данные можно передать в компьютер. Для этого сзади у прибора есть маленький круглый разъём, а в комплекте идёт кабель USB.
Программа считывает данные с прибора и рисует вот такие графики.
Можно включить отображение температуры и влажности, но тогда на экране будет вот такая мешанина.
Датчик NDIR требует периодической калибровки, поэтому прибор автоматически калибруется раз в 7 дней. Минимальное значение CO2 принимается за 400 ppm (при этом за один раз калибровка может сдвигать показания не более, чем на 50 ppm). Для правильной работы прибора необходимо как минимум раз в неделю хорошо проветривать помещение (3-4 часа с открытым окном без людей в помещении). Этого достаточно, чтобы уровень CO2 в помещении стал таким же, как на улице и прибор правильно откалибровался.
Прибор питается только от сети. Это связано с тем, что датчик NDIR потребляет довольно много. Прибор постоянно потребляет 30 mA, раз в секунду происходит импульс потребления 200 mA. Напряжение питания - 5 вольт. Я воспользовался повербанком для того, чтобы временно использовать прибор в качестве портативного, измеряя уровни CO2 в разных помещениях.
Наличие этого прибора не только позволяет оценивать уровень CO2, но и очень стимулирует правильное и частое проветривание - смотришь на "страшные" показания прибора и тут же бежишь открывать окно.
Несмотря на то, что прибор недёшев я заказал второй другой модели, чтобы в каждой комнате было по CO2-метру. Когда придёт, расскажу и о нём.
ammo1.livejournal.com
Оксид углерода(II) - это... Что такое Оксид углерода(II)?
Оксид углерода (II) (угарный газ, окись углерода, монооксид углерода) — бесцветный ядовитый газ (при нормальных условиях) без вкуса и запаха. Химическая формула — CO. Нижний и верхний концентрационные пределы распространения пламени: от 12,5 до 74 % (по объёму)[1].
Строение молекулы
Молекула CO имеет тройную связь, как и молекула азота N2. Так как эти молекулы сходны по строению (изоэлектронны, двухатомны, имеют близкую молярную массу), то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
В рамках метода валентных связей строение молекулы CO можно описать формулой :C=O:.
Согласно методу молекулярных орбиталей электронная конфигурация невозбуждённой молекулы CO σ²Oσ²zπ4x, yσ²C. Тройная связь образована σ—связью, образованной за счёт σz электронной пары, а электроны дважды вырожденного уровня πx, y соответствуют двум π—связям. Электроны на несвязывающих σC—орбитали и σO—орбитали соответствуют двум электронным парам, одна из которых локализована у атома углерода, другая — у атома кислорода.
Благодаря наличию тройной связи молекула CO весьма прочна (энергия диссоциации 1069 кДж/моль, или 256 ккал/моль, что больше, чем у любых других двухатомных молекул) и имеет малое межъядерное расстояние (dC≡O=0,1128 нм или 1,13Å).
Молекула слабо поляризована, электрический момент её диполя μ = 0,04·10−29Кл·м. Многочисленные исследования показали, что отрицательный заряд в молекуле CO сосредоточен на атоме углерода C−←O+ (направление дипольного момента в молекуле противоположно предполагавшемуся ранее). Ионизационный потенциал 14,0 в, силовая константа связи k = 18,6.
Свойства
Оксид углерода (II) представляет собой бесцветный газ без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей.
Основными типами химических реакций, в которых участвует оксид углерода (II), являются реакции присоединения и окислительно-восстановительные реакции, в которых он проявляет восстановительные свойства.
При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑. Это широко используется в пирометаллургии. На реакции CO в растворе с хлоридом палладия основан способ качественного обнаружения CO, см. ниже).
Окисление СО в растворе часто идёт с заметной скоростью лишь в присутствии катализатора. При подборе последнего основную роль играет природа окислителя. Так, KMnO4 быстрее всего окисляет СО в присутствии мелкораздробленного серебра, K2Cr2O7 — в присутствии солей ртути, KClO3 — в присутствии OsO4. В общем, по своим восстановительным свойствам СО похож на молекулярный водород.
Ниже 830 °C более сильным восстановителем является CO, — выше — водород. Поэтому равновесие реакции:
до 830 °C смещено вправо, выше 830 °C влево.
Интересно, что существуют бактерии, способные за счёт окисления СО получать необходимую им для жизни энергию.
Оксид углерода (II) горит пламенем синего цвета[2] (температура начала реакции 700 °C) на воздухе:
ΔG°298 = −257 кДж, ΔS°298 = −86 Дж/KТемпература горения CO может достигать 2100 °C, она является цепной, причём инициаторами служат небольшие количества водородсодержащих соединений (вода, аммиак, сероводород и др.)
Благодаря такой хорошей теплотворной способности, CO является компонентом разных технических газовых смесей (см., например генераторный газ), используемых, в том числе, для отопления.
Оксид углерода (II) реагирует с галогенами. Наибольшее практическое применение получила реакция с хлором:
Реакция экзотермическая, её тепловой эффект 113 кДж, в присутствии катализатора (активированный уголь) она идёт уже при комнатной температуре. В результате реакции образуется фосген — вещество, получившее широкое распространение в разных отраслях химии (а также как боевое отравляющее вещество). По аналогичным реакцииям могут быть получены COF2 (карбонилфторид) и COBr2 (карбонилбромид). Карбонилиодид не получен. Экзотермичность реакций быстро снижается от F к I (для реакций с F2 тепловой эффект 481 кДж, с Br2 — 4 кДж). Можно также получать и смешанные производные, например COFCl (подробнее см. галогенпроизводные угольной кислоты).
Реакцией CO с F2, кроме карбонилфторида можно получить перекисное соединение (FCO)2O2. Его характеристики: температура плавления −42 °C, кипения +16 °C, обладает характерным запахом (похожим на запах озона), при нагревании выше 200 °C разлагается со взрывом (продукты реакции CO2, O2 и COF2), в кислой среде реагирует с иодидом калия по уравнению:
Оксид углерода (II) реагирует с халькогенами. С серой образует сероксид углерода COS, реакция идёт при нагревании, по уравнению:
ΔG°298 = −229 кДж, ΔS°298 = −134 Дж/KПолучены также аналогичные селеноксид углерода COSe и теллуроксид углерода COTe.
Восстанавливает SO2:
C переходными металлами образует очень летучие, горючие и ядовитые соединения — Карбонилы, такие как Cr(CO)6, Ni(CO)4, Mn2CO10, Co2(CO)9 и др.
Оксид углерода (II) незначительно растворяется в воде, однако не реагирует с ней. Также он не вступает в реакции с растворами щелочей и кислот. Однако реагирует с расплавами щелочей с образованием соответствующих формиатов:
Интересна реакция оксида углерода (II) с металлическим калием в аммиачном растворе. При этом образуется взрывчатое соединение диоксодикарбонат калия:
Реакцией с аммиаком при высоких температурах можно получить важное для промышленности соединение — циановодород HCN. Реакция идёт в присутствии катализатора (диоксид тория ThO2) по уравнению:
Важнейшим свойством оксида углерода (II) является его реакции с водородом (процесс синтеза Фишера-Тропша):
спирты + линейные алканыЭтот процесс является источником производства таких важнейших промышленных продуктов как метанол, синтетическое дизельное топливо, многоатомные спирты, масла и смазки.
С d-металлами образует карбонильные соединения:
Физиологическое действие, токсичность
TLV (предельная пороговая концентрация, США): 25 ppm; 29 мг/м³ (как TWA — среднесменная концентрация, США) (ACGIH 1994—1995). MAC (максимальная допустимая концентрация, США): 30 ppm; 33 мг/м³; Беременность: B (вредный эффект вероятен даже на уровне MAK) (1993). ПДКр.з. по Гигиеническим нормативам ГН 2.2.5.1313—03 составляет 20 мг/м³ (около 0,0017%).
В выхлопе бензинового автомобиля допускается до 1,5-3 %.
По классификации ООН оксид углерода (II) относится к классу опасности 2,3, вторичная опасность по классификации ООН: 2,1.
Угарный газ очень опасен, так как не имеет запаха и вызывает отравление и даже смерть. Признаки отравления: головная боль и головокружение; отмечается шум в ушах, одышка, сердцебиение, мерцание перед глазами, покраснение лица, общая слабость, тошнота, иногда рвота; в тяжёлых случаях судороги, потеря сознания, кома[3][2].
Токсическое действие оксида углерода (II) обусловлено образованием карбоксигемоглобина - значительно более прочного карбонильного комплекса с гемоглобином, в сравнении с комплексом гемоглобина с кислородом (оксигемоглобином)[3], блокируя, таким образом, процессы транспортировки кислорода и клеточного дыхания. Концентрация в воздухе более 0,1 % приводит к смерти в течение одного часа[3].
Опытами на молодых крысах выяснено, что 0,02 % (возможно — 0,02 г/м³, то есть ПДК?) концентрация CO в воздухе замедляет их рост и снижает активность по сравнению с контрольной группой. Интересно то, что крысы, живущие в атмосфере с повышенным содержанием CO, предпочитали воде и раствору глюкозы спиртовой раствор в качестве питья (в отличие от контрольной группы, особи в которой предпочитали воду).
Помощь при отравлении оксидом углерода (II)[3]
Соединение окиси углерода с гемоглобином обратимо.
- Пострадавшего следует вынести на свежий воздух. При отравлении лёгкой степени достаточно гипервентиляции лёгких кислородом.
- Искусственная вентиляция лёгких.
- Лобелин или кофеин под кожу.
- Карбоксилаза внутривенно.
- Ацизол внутримышечно.
Защита от оксида углерода (II)
CO очень слабо поглощается активированным углём обычных фильтрующих противогазов, поэтому для защиты от него применяется специальный фильтрующий элемент (он может также подключаться дополнительно к основному) — гопкалитовый патрон. Гопкалит представляет собой катализатор, способствующий окислению CO в CO2 при нормальных температурах. Недостатком использования гопкалита является то, что при его применении приходится вдыхать нагретый в результате реакции воздух. Обычный способ защиты — использование изолирующего дыхательного аппарата[2].
История открытия
Оксид углерода (II) был впервые получен французским химиком Жаком де Лассоном в 1776 при нагревании оксида цинка с углём, но первоначально его ошибочно приняли за водород, так как он сгорал синим пламенем.
То, что в состав этого газа входит углерод и кислород, выяснил в 1800 английский химик Вильям Крукшэнк. оксид углерода (II) вне атмосферы Земли впервые был обнаружен бельгийским ученым М. Мижотом (M. Migeotte) в 1949 году по наличию основной колебательно-вращательной полосы в ИК спектре Солнца.
Получение
Промышленный способ
Влияние температуры на равновесие реакции :: (тепловой эффект этой реакции 220 кДж), (ΔH=172 кДж, ΔS=176 Дж/К)Эта реакция происходит при печной топке, когда слишком рано закрывают печную заслонку (пока окончательно не прогорели угли). Образующийся при этом оксид углерода (II), вследствие своей ядовитости, вызывает физиологические расстройства («угар») и даже смерть (см. ниже), отсюда и одно из тривиальных названий — «угарный газ»[2].
Реакция восстановления диоксида углерода обратимая, влияние температуры на состояние равновесия этой реакции приведено на графике. Протекание реакции вправо обеспечивает энтропийный фактор, а влево — энтальпийный. При температуре ниже 400 °C равновесие практически полностью сдвинуто влево, а при температуре выше 1000 °C вправо (в сторону образования CO). При низких температурах скорость этой реакции очень мала, поэтому оксид углерода (II) при нормальных условиях вполне устойчив. Это равновесие носит специальное название равновесие Будуара.
Лабораторный способ
Можно также обработать муравьиную кислоту хлорсульфоновой. Эта реакция идёт уже при обычной температуре по схеме:- Нагревание смеси щавелевой и концентрированной серной кислот. Реакция идёт по уравнению:
Определение оксида углерода (II)
Качественно можно определить наличие CO по потемнению растворов хлорида палладия (или пропитанной этим раствором бумаги). Потеменение связано с выделением мелкодисперсного металлического палладия по схеме:
Эта реакция очень чувствительная. Стандартный раствор: 1 грамма хлорида палладия на литр воды.
Количественное определение оксида углерода (II) основано на иодометрической реакции:
Применение
- Оксид углерода (II) является промежуточным реагентом, используемым в реакциях с водородом в важнейших промышленных процессах для получения органических спиртов и неразветвлённых углеводородов.
- Оксид углерода (II) применяется для обработки мяса животных и рыбы, придает им ярко красный цвет и вид свежести, не изменяя вкуса (en:Clear smoke или en:Tasteless smoke технология). Допустимая концентрация CO равна 200 мг/кг мяса.
- Угарный газ от выхлопа двигателей применялся нацистами в годы Второй мировой войны для массового умерщвления людей путём отравления.
Оксид углерода (II) в атмосфере Земли
Содержание CO в атмосфере Земли по данным MOPITTРазличают природные и антропогенные источники поступления в атмосферу Земли. В естественных условиях, на поверхности Земли, CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров. Оксид углерода (II) образуется в почве как биологическим путём (выделение живыми организмами), так и небиологическим. Экспериментально доказано выделение оксида углерода (II) за счёт обычных в почвах фенольных соединений, содержащих группы OCh4 или OH в орто- или пара-положениях по отношению к первой гидроксильной группе.
Общий баланс продуцирования небиологического CO и его окисления микроорганизмами зависит от конкретных экологических условий, в первую очередь от влажности и значения pH. Например, из аридных почв оксид углерода (II) выделяется непосредственно в атмосферу, создавая таким образом локальные максимумы концентрации этого газа.
В атмосфере СО является продуктом цепочек реакций с участием метана и других углеводородов (в первую очередь, изопрена).
Основным антропогенным источником CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Оксид углерода образуется при сгорании углеводородного топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления CO в CO2). В прошлом значительную долю антропогенного поступления CO в атмосферу обеспечивал светильный газ, использовавшийся для освещения помещений в XIX веке. По составу он примерно соответствовал водяному газу, то есть содержал до 45 % оксида углерода (II). В коммунальной сфере не применяется в виду наличия значительно более дешёвого и энергоэффективного аналога - природного газа.
Поступление CO от природных и антропогенных источников примерно одинаково.
Оксид углерода (II) в атмосфере находится в быстром круговороте: среднее время его пребывания составляет около 0,1 года. Основной канал потери CO — окисление гидроксилом до диоксида углерода.
См. также
Примечания
- ↑ Баратов А. Н. Пожаровзрывоопасность веществ и материалов и средства их тушения: Справочное издание: в 2-х книгах. — М.: Химия, 1990. — Т. Книга 2. — С. 384.
- ↑ 1 2 3 4 Оксид углерода. // Российская энциклопедия по охране труда: В 3 т. — 2-е изд., перераб. и доп. — М.: Изд-во НЦ ЭНАС,2007. Архивировано из первоисточника 22 июня 2012. Проверено 5 июня 2012.
- ↑ 1 2 3 4 Справочник фельдшера, под ред. А. Н. Шабанова М.: «Медицина», 1984.
Литература
- Ахметов Н. С. Общая и неорганическая химия. 5-е изд., испр. — М.: Высш. шк.; 2003 ISBN 5-06-003363-5
- Некрасов Б. В. Основы общей химии. Т. I, изд. 3-е, испр. и доп. Изд-во «Химия», 1973 г. Стр. 495—497, 511—513
- Химия: Справ. из./В. Шретер, К.-Х. Лаутеншлегер, Х. Бибрак и др.: Перс. с нем. 2-е изд., стереотип. — М.:Химия, 2000 ISBN 5-7245-0360-3 (рус.)
- Баратов А. Н. Пожаровзрывоопасность веществ и материалов и средства их тушения: Справочное издание: в 2-х книгах; Книга 2. - М.: Химия, 1990 - 384с.
Ссылки
dic.academic.ru