Оксид азота: формула, свойства, применение. Азот формула
формула, свойства, применение :: SYL.ru
Оксидами называют бинарные соединения химических элементов с кислородным атомом, у которого окислительная степень равна 2-. Азот, обладающий меньшим электроотрицательным значением, образует различные комбинации с кислородом. Эти соединения относятся к разным классам веществ. Оксид азота кислород содержит в количестве, которое устанавливает валентность элемента N. Она колеблется от 1 до 5.
Какие бывают оксиды
Существует около десятка азотистых соединений, содержащих O-элемент. Из них пять наиболее часто встречаемых: оксид одновалентного, оксид двухвалентного, оксид трехвалентного, оксид четырехвалентного и оксид пятивалентного азота.
Остальные соединения считаются менее распространенными. К ним относят оксид азота четырехвалентного в форме димера, нестабильные молекулы нитрилазида, нитрозилазида, тринитрамида и нитратный радикал.
Формулы оксидов азота
Ниже приведены обозначения наиболее значимых соединений элемента N.
Это прежде всего оксид азота, формула которого состоит из двух химических знаков - N и O. За ними ставятся индексы, в зависимости от степени окисления атомов.
- Азота одновалентного оксид имеет формулу N2O. В нем атом N заряжен +1.
- Азота двухвалентного оксид имеет формулу NO. В нем атом N заряжен +2.
- Азота трехвалентного оксид имеет формулу N2O3. В нем атом N заряжен +3.
- Четырехвалентный оксид азота, формула которого NO2, имеет заряд атома N +4.
- Пятивалентное кислородное соединение обозначается как N2O5. В нем атом N заряжен +5.
Описание одновалентного оксида азота
Он еще именуется диазотом, закисью и газом веселящим. Последнее название произошло от действия, связанного с опьянением.
Оксид азота с валентностью I в условиях нормальной температуры существует в форме негорючего газа, без цвета, который проявляет приятный сладковатый привкус и запах. Воздух легче данного соединения. Оксид растворяется в водной среде, этаноле, эфирах и кислоте серной.
Вода, щелочные и кислотные растворы не способны с ним вступать в реакцию, он не образует соли. Не подвергается воспламенению, зато способен поддержать процесс горения.
Аммиак оксид азота переводит в азид (N3Nh5).
При соединении с молекулами эфиров, хлорэтана и циклопропана образуется взрывоопасная смесь.
Обычные условия способствуют его инертности. Под действием нагревания вещество восстанавливается.
Описание оксида двухвалентного азота
Его еще называют моноокисью, окисью или нитрозил-радикалом. В условиях нормальной температуры является бесцветным негорючим газом, слаборастворимым в водной среде. Воздухом окисляется, получается NO2. Жидкая и твёрдая его форма становятся голубого цвета.
Оксид азота может быть восстановителем в реакциях взаимодействия с галогенами. Продуктом их присоединения является нитрозилгалогенид, который имеет формулу NOBr.
Диоксид серы и другие сильные восстановители окисляют NO с получением молекул N2.
Описание оксида трехвалентного азота
Они именуется ангидридом азотистым. В нормальном состоянии может быть жидкостью, с синей окраской, а стандартные параметры среды переводят оксид в форму газа, не имеющего цвета. Обладает устойчивостью только при низких температурах.
Молекулы N2O3 диссоциируют во время нагревания с выделением одно- и двухвалентного оксида.
В качестве ангидрида присоединяет воду с получением кислоты азотистой, а со щелочами формирует соли в виде нитритов.
Описание оксида четырехвалентного азота
По-другому его называют диоксидом. Существует в форме буро-красного газа, у которого имеется острый запах, а также может быть желтоватой жидкостью.
Относится к кислотным оксидам, у которых развита хорошо химическая активность.
Его молекулы окисляют неметаллы с образованием кислородсодержащих соединений и свободного азота.
Диоксид взаимодействует с оксидом четырехвалентной и шестивалентной серы. Получается кислота серная. Метод ее синтеза называют нитрозным.
В водной среде можно растворить оксид азота. Азотная кислота является результатом данной реакции. Такой процесс называют диспропорционированием. Промежуточным компонентом считается кислота азотистая, которая быстро распадается.
Если растворить азота четырехвалентного оксид в щелочи, то происходит образование растворов нитратов и нитритов. Можно использовать его жидкую форму для взаимодействия с металлом, тогда получится безводная соль.
Описание оксида пятивалентного азота
Его также называют диазотным пентаоксидом, нитратом нитрония, нитриловым нитратом или азотным ангидридом.
Существует в форме бесцветных кристаллов, которые обладают летучестью и неустойчивостью. Их стабильность наблюдается при низкой температуре. Такую структуру образуют нитрат- и нитрит-ионы.
В газообразном виде вещество имеет форму ангидрида NO2−O−NO2.
Оксид азота пятивалентный обладает свойствами кислотными. Он легко разлагается с выделением кислорода.
Вещество реагирует с водой, в результате получается азотная кислота.
Щелочи растворяют ангидрид с выделением солей нитратов.
Как получают оксиды азота
Закись N2O образуется при острожном нагревании аммония нитрата в сухом виде, однако такой способ может сопровождаться взрывом.
Предпочтительным методом получения оксида одновалентного является воздействие кислотой азотной в концентрированном виде на кислоту сульфаминовую. Главным условием считается нагревание.
Нитрозил, или NO, – это особый оксид азота, получение которого осуществляется при взаимодействии молекул N2 иO2. Важным условием такого процесса является сильное нагревание свыше 1000 °C.
Природный способ получения связан с грозовыми разрядами в атмосферном воздухе. Такой оксид быстро соединяется с кислородными молекулами и формируется диоксид.
Лабораторный метод синтеза NO связан с реакцией металлов и неконцентрированной кислоты азотной. Примером такой реакции может быть взаимодействие меди с HNO3.
Другой способ образования моноокиси азота - реакция хлорида железа двухвалентного с натрия нитритом и кислотой соляной. Результатом процесса являются железа трехвалентного и натрия хлориды, вода и сама окись.
В промышленных масштабах его добывают за счет окисления аммиачных молекул во время нагревания и под высоким давлением. Ускорителем процесса является платина или хрома трехвалентного оксид.
Диоксид, или NO2, получается при взаимодействии мышьяка трехвалентного оксида с 50 % кислотой азотной, которую наносят по каплям на поверхность твердого реагента. Образуется смесь из оксидов двухвалентного и четырехвалентного азота.
Если ее охладить до температуры -30 °С, то синтезируется ангидрид азотистый, или N2O3.
В порошкообразном виде он получается в случае пропускания тока электрического сквозь газообразную его форму.
Если на крахмальный порошок подействовать кислотой азотной с концентрацией 50 %, то выделяется оксид двухвалентного и четырехвалентного азота, газ углекислый и вода. В дальнейшем из полученных первых двух соединений формируется молекула N2O3.
В результате теплового расщепления свинцового нитросоединения выделяется диоксид азота, свободный кислород и оксид свинца.
Ангидрид, или N2O5, образуется благодаря отщеплению молекулы воды от кислоты азотной действием фосфора оксида пятивалентного.
Другой способ его синтеза является пропускание сухого хлора сквозь безводный серебряный нитрат.
Если на диоксид азотный подействовать молекулами озона, то формируется N2O5.
www.syl.ru
Азот | Химия свойства элементов
Общие сведения и методы получения
Азот (N) — при обычных условиях бесцветный газ, не имеющий запаха. Основная составляющая атмосферного воздуха (78,2 % по объему), открыт во второй половине XVIII в., по предложению Лавуазье назван азотом.
Азот —неотъемлемая часть живых организмов. Неорганических соединений, содержащих азот, в природе встречается мало, за исключением так называемой чилийской селитры NaN03. Общее содержание аю-та в земной коре, атмосфере и гидросфере составляет 0,04 %.
Чистый азот в лабораторных условиях обычно получают или термическим разложением его соединений, например нитрата аммония, или пропуская воздух в замкнутом пространстве над раскаленной медью. При этом медь, окисляясь, поглощает весь кислород. Наряду с азотом в газовой фазе остается около 1 % аргона.
Для технических целей азот получают сжижением и фракционированной перегонкой жидкого воздуха, которая основана на разнице температур кипения кислорода (—182,972 °С) и азота (—195,812 °С). При перегонке из жидкого воздуха преимущественно испаряется азот, а оставшийся воздух становится все более насыщенным кислородом. Жидкий азот поставляют потребителю в сосудах Дюара, газообразный — в баллонах.
Физические свойства
Атомные характеристики. Атомный номер 7, атомная масса 14,0067 а. е.м., атомный объем 13,70-10_3 м3/моль. Атомный радиус азота (ковалеит-ный) 0,062 нм. Конфигурация внешних электронных оболочек атома 2s22p3. Азот состоит из двух стабильных изотопов 14 N и 15 N, процентное содержание которых соответственно 99,635 и 0,365 %- Кроме того, известны четыре искусственных радиоактивных изотопа 12 N, l3N, ieN, 17N, период полураспада которых 0,0125; 606; 7,4; 4,14 с соответственно.
При атмосферном давлении и температуре ниже —237,4 °С стабильна а-фаза N2, имеющая кубическую решетку; при 21 К период решетки а = 0,5667 нм. При —237,4 "С происходит полиморфное превращение а=г±В с ДЯ=8,2 кДж/кг. Фаза й обладает гексагональной кристаллической решеткой; при 50 К периоды решетки a = 0,4036 нм, с — 0,6630 нм.
Химические свойства
Высшая степень окисления азота +5, низшая —3. Известна степень окисления азота, равная +2, +4.
В нормальных условиях азот очень инертен, так как состоит из двухатомных молекул N2, между атомами которых существует тройная электронная связь; межатомное расстояние 0,10945 нм. Тройная связь обеспечивает большую устойчивость молекулы азота. Даже при нагреве газа до 2700—3000 °С диссоциация молекул весьма незначительна. Заметное расщепление молекулы азота на атомы происходит под воздействием тлеющего электрического разряда. Атомарный азот химически очень активен. Так, прн комнатной температуре он взаимодействует со ртутью, а также с серой и фосфором. Молекулярный азот практи»
чески не взаимодействует ни с металлами, ни с металлоидами. Исключение составляет только литий. Образование соединения L'i3N медленно протекает в атмосфере азота уже при комнатной температуре.
Имеется несколько соединений азота с водородом. Одно из наиболее практически важных — аммиак. В настоящее время аммиак синтезируют непосредственным переводом свободного азота воздуха в связанное состояние по реакции: N2+3h3**2Nh4. Большую роль в процессе синтеза аммиака играют катализаторы — чистое железо, оксид алюминия, оксид калия. Аммиак представляет собой бесцветный газ с очень характерным запахом, хорошо растворимый в воде. При О "С в одном объеме воды растворяется до 1200 объемов газа.
Из других соединений азота с водородом следует отметить гидра-зин N2h5 —бесцветную жидкость с температурой кипения 113,34 °С. Гидразин является хорошим восстановителем. При его горении в атмосфере воздуха или кислорода выделяется большое количество тепла. Гидразин и все его производные сильно ядовиты.
Азидоводород, или азидоводородная кислота, HN3 — бесцветная жидкость с температурой кипения 36 "С. Азидоводород и его соли — азиды — взрывоопасны.
С кислородом азот образует ряд оксидов. Оксид с участием одновалентного азота N20 представляет собой бесцветный газ со слабым запахом, малорастворимый в воде, не реагирующий ии с водой, ни с кислотами, ни со щелочами.
Оксид NO с участием двухвалентного азота представляет собой бесцветный газ с температурой кипения —151,72 °С и затвердевания —163,62 "С.
Диоксид N02 —бурый ядовитый газ, легко сгущается в красноватую жидкость с температурой кипения 20,8 °С и затвердевания — 11 °С. N02 является очень энергичным окислителем, многие вещества могут гореть в атмосфере N02. Оксид, образованный трехвалентным азотом, N2O3, иначе азотистый ангидрид, представляет собой темно-сииюю жидкость, уже при низких температурах разлагающуюся на смесь N0 и N02.
Оксид, образованный пятивалентным азотом, N205, называемый азотным ангидридом, в обычных условиях представляет собой белые кристаллы, постепенно разлагающиеся на N02 и 02. Это очень сильный окислитель, при взаимодействии с которым воспламеняются многие органические вещества. Раствор N2O5 в воде дает азотную кислоту HN03, принадлежащую к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на иоиы Н+ и N0^".
Соединения азота с электроположительными элементами, главным образом металлами, называются нитридами. Те нитриды, которые по составу можно рассматривать как продукты замещения водорода в аммиаке, например Li3N, Zn3N2 и др., в большинстве случаев разлагаются при воздействии воды с выделением аммиака. Переходные металлы IV— VIA подгрупп образуют с азотом тугоплавкие нитриды, очень стойкие к термическому и другим видам воздействия, находящие широкое применение в технике.
Области применения
Азот, добываемый в промышленности, широко используется в сельском хозяйстве в виде азотсодержащих удобрений, в химической промышленности для синтеза соединений с широким спектром физико-химических свойств.
Чистый азот используют также в качестве нейтральной атмосферы при обработке металлов, а также для упрочнения поверхности изделий
из стали, сплавов титана и т. д. путем диффузионного насыщения, в результате которого образуются нитридные фазы (азотирование). Соединения азота широко применяются в технике в качестве различных тра-вителей иа базе азотной кислоты, а также горючих смесей на базе различных азотводородных соединений. Аммиак является исходным сырьем для производства различных видов азотсодержащих удобрений, азотной кислоты, карбанида и других веществ.
Ряд соединений азота — нитридов тугоплавких металлов — находят применение* технике при создании твердых и упрочнении жаропрочных сплавов.
Азот широко используется в сельском хозяйстве. 5.2.
ibrain.kz
Азот — Мегаэнциклопедия Кирилла и Мефодия — статья
Азо́т (лат. Nitrogenium — рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14, 0067. В свободном виде — газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам.
Природный азот состоит из стабильных нуклидов14N (содержание в смеси 99, 635% по массе) и 15N. Конфигурация внешнего электронного слоя 2s22р3. Радиус нейтрального атома азота 0, 074 нм, радиус ионов: N3- — 0, 132, N3+ — 0, 030 и N5+ — 0, 027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14, 53, 29, 60, 47, 45, 77, 47 и 97, 89 эВ. По шкале Полинга электроотрицательность азота 3, 05.Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух») и в отличие от CO2 не поглощаемый раствором щелочи. Вскоре французский химик А. Л. Лавуазье пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный). В 1784 английский физик и химик Г. Кавендиш установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем).В природе свободный (молекулярный) азот входит в состав атмосферного воздуха (в воздухе 78, 09% по объему и 75, 6% по массе азота), а в связанном виде — в состав двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) — и ряда других соединений. По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0, 0019% земной коры по массе. Несмотря на свое название, азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом. Он входит в состав молекул белков, нуклеиновых кислот, коферментов, гемоглобина, хлорофилла и многих других биологически активных веществ. Некоторые, так называемые азотфиксирующие, микроорганизмы способны усваивать молекулярный азот воздуха, переводя его в соединения, доступные для использования другими организмами (см. Азотфиксация). Превращения соединений азота в живых клетках — важнейшая часть обмена веществ у всех организмов.В промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (−195, 8 °C), чем у другого компонента воздуха — кислорода (−182, 9 °C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара.В лаборатории чистый («химический») азот получают, добавляя при нагревании насыщенный раствор хлорида аммония Nh5Cl к твердому нитриту натрия NaNO2:
NaNO2 + Nh5Cl = NaCl + N2 + 2h3O.
Можно также нагревать твердый нитрит аммония:
Nh5NO2 = N2 + 2h3O.
Плотность газообразного азота при 0 °C 1, 25046 г/дм3, жидкого азота (при температуре кипения) — 0, 808 кг/дм3. Газообразный азот при нормальном давлении при температуре –195, 8 °C переходит в бесцветную жидкость, а при температуре –210, 0 °C — в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже –237, 54 °C устойчива форма с кубической решеткой, выше — с гексагональной.
Критическая температура азота –146, 95 °C, критическое давление 3, 9МПа, тройная точка лежит при температуре –210, 0 °C и давлении 125, 03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость.
Теплота испарения жидкого азота 199, 3 кДж/кг (при температуре кипения), теплота плавления азота 25, 5 кДж/кг (при температуре –210 °C).
Энергия связи атомов в молекуле N2 очень велика и составляет 941, 6 кДж/моль. Расстояние между центрами атомов в молекуле 0, 110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие σ- и π-орбитали. Молекула азота немагнитна (диамагнитна).
Из-за высокой прочности молекулы N2процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв.Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от –3 до +5). С водородом образует аммиак Nh4. Косвенным путем (не из простых веществ) получают гидразин N2h5 и азотистоводородную кислоту HN3. Соли этой кислоты — азиды. Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов.Известно несколько оксидов азота. С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3 = N2 + 3I2.
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6h3O = 3Ca(OH)2 + 2Nh4.
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2h3 может быть получен цианистый водород HCN.
В промышленности газ азот используют главным образом для получения аммиака. Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент, его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.- Справочник азотчика. М., 1969.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. М., 1988. Т. 1.
- Некрасов Б. В. Основы общей химии. М., 1973.
- Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982.
megabook.ru
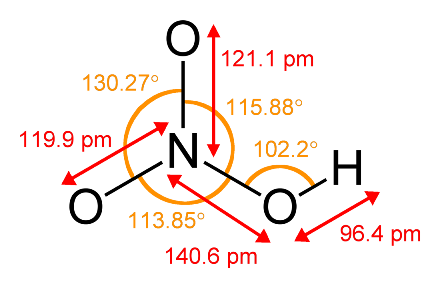
Формула Азотной кислоты структурная химическая
Структурная формула
 |
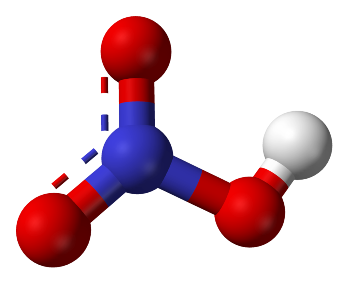 |
Истинная, эмпирическая, или брутто-формула: HNO3
Химический состав Азотной кислоты
| O | Кислород | 15.999 | 3 | 76,2% |
| H | Водород | 1.008 | 1 | 1,6% |
| N | Азот | 14.007 | 1 | 22,2% |
Молекулярная масса: 63,012
Азо́тная кислота́ (HNO3) — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы. Образует с водой азеотропную смесь с концентрацией 68,4 % и tкип120 °C при нормальном атмосферном давлении. Известны два твёрдых гидрата: моногидрат (HNO3·h3O) и тригидрат (HNO3·3h3O).
Азот в азотной кислоте четырёхвалентен, степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C ( при нормальном атмосферном давлении) с частичным разложением. Азотная кислота смешивается с водой во всех соотношениях. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения. ри нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять без разложения только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +5 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты.
Смесь азотной и серной кислот носит название «меланж».
Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила.
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется. Нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно.
Азотная кислота по степени воздействия на организм относится к веществам 3-го класса опасности. Её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное жёлтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета). ПДК для азотной кислоты в воздухе рабочей зоны по NO2 2 мг/м3.
formula-info.ru
Азотная кислота структурная формула - Справочник химика 21
Азотная кислота. Молекулярная формула азотной кислоты НМОд структурная [c.117]
Н-С Ы н-С=С-Н Структурную формулу азотной кислоты изображают так [c.54]
Структурную формулу азотной кислоты изображают так [c.78]
Поскольку у атомов любых элементов в молекуле не может быть более четырех электронных пар (октет электронов), то и их валентность не может превышать четырех. Поэтому приведенные ниже структурные формулы азотной и серной кислот, изображаемые символами, не соответствуют действительности [c.43]
Напишите структурные формулы а) пропилового эфира азотной кислоты, б) среднего этилового эфира серной кислоты. [c.146]Химическое строение азотной кислоты. Структурные формулы азотного ангидрида и азотной кислоты [c.445]
Валентность азота в молекуле азотной кислоты также равна четырем. В настоящее время структурную формулу азотной кислоты изображают так [c.59]
Большую наглядность рассуждениям придает использование структурных формул, в которых связи между атомами обозначаются черточками (причем одна черточка соответствует единице валентности каждого из соединенных этой связью атомов). Последовательные стадии построения формулы азотной кислоты могут быть схематически изображены следующим образом [c.27]
Химические свойства. Структурные формулы азотной кислоты и их объяснение см. 3.10. [c.196]
Объясните валентность азота в азотной кислоте. Изобразите ее структурную формулу. [c.115]
В молекуле азотной кислоты атомы кислорода, связанные только с азотом, равноценны, поэтому и возможность перехода электронов к каждому из них одинакова. Поэтому более точно строе -ние НЫОз выражает следующая структурная формула [c.54]
Альдопентоза (А) в D-конфигурации при окислении концентрированной азотной кислотой дает 2,3,4-триоксипентандиоловую кислоту (триоксиглутаровую кислоту. В), не обладающую оптической активностью. При добавлении к А H N с последующим гидролизом, лак-тонизацией и восстановлением образуются две стереоизомерные альдогексозы (С и D). Окисление D дает оптически неактивную 2,3,4,5-тетраоксигександиоловую кислоту (сахариновая кислота, E). Напишите структурные формулы соединений А—Е. [c.193]
Признание полярного в общем случае характера валентных связей приводит к важному следствию описание химической молекулы вещества (I 6 доп. 3) схематической структурной формулой должно производиться с обозначением любых валентных связей (а не только ковалентных, как это иногда принимается). Например, если можно написать структурную формулу молекулы азотной кислоты, то можно написать и структурную формулу молекулы азотнокислого натрия хотя связь Ка—О гораздо более полярна, чем связь Н—О, но принципиально они не отличаются друг от друга (ср. ХП1 1 доп. 104). [c.92]
Составьте структурные формулы азотной н азотистой кислот, соблюдая правило атом водорода свя зывается с атомом азота через атом кислорода (см, структурные формулы серной и сернистой кислот, стр. 97). Какова валентность азота в этих кислотах [c.143]
Азотная кислота. Состав азотной кислоты выражают формулой ИНОз структурная ее формула [c.163]
Рассмотрим это положение на примере азота N2, гидразина аммиака N1-13, аммоний-иона НН и азотной кислоты ННОз. Схема распределения электронов по квантовым ячейкам атома азота представлена на рис. 6. Из него легко сделать вывод, что, поскольку азот имеет три неспаренных электрона, он может образовывать три химические связи. Обозначая каждую электронную пару ковалентной связи черточкой, получим структурные формулы для N2, N21 4 и N1 3 [c.108]
Ковалентная связь может также образовываться по донорно-акцепторному механизму, например в аммоний-ионе (с. 78), в котором валентность атома азота равна четырем (четыре связи), а степень окисления азота —3. При присоединении протона к молекуле N1 3 валентность азота увеличилась с 3 до 4, но степень окисления не изменилась. Валентность азота в молекуле азотной кислоты также равна четырем. В настоящее время структурную формулу азотной кислоты изображают так [c.108]
Таким образом, понятие валентности в рамках метода ВС приобрело четкий физический смысл. Однако не все трудности были преодолены. Например, как записать структурную формулу молекулы газообразной азотной кислоты или нитрат-иона, учитывая, что валентности кислорода и азота равны соответственно двум и трем По Бутлерову, их структурные формулы имеют вид [c.235]
Химические свойства. Структурные формулы азотной кислоты и их объяснение даны в 1.17. В HNOз валентность азота равна 4, степень окисления+ 5, координационное число азота 3. [c.115]
Однако эти формулы не могут объяснить существующей фундаментальной разницы между электролитами и неэлектролитами и, следовательно, между водным раствором азотной кислоты и крепкой кислотой, а также между солями и эфирами азотной кислоты. Это удалось только помощью координационной теории Вернера и его теории комплексных соединений и ионогенной связи. Согласно этой теории только эфиры отвечают обычной структурной формуле. Соли же напротив — комплексной формуле с комплексным анионом. [c.81]
При действии смеси концентрированных азотной и серной кислот на салициловый (2-гидроксибензойный) альдегид получена смесь моно- и динитропроизводных. Напишите структурные формулы каждого из полученных изомеров. [c.329]
Запись данных опыта. Описать проделанную работу и наблюдаемые явления. Написать уравнение реакции взаимодействия сурика с азотной кислотой и структурные формулы ортосвинцовой кислоты и сурика, как соли этой кислоты. [c.223]
Соединение состава 2H5NO2 образует соли как с азотной кислотой, так и с гидроксидом бария. Напишите структурную формулу этого вещества и его изомера из другого класса. Приведите уравнения реакций солеобразования и назовите полученные продукты. [c.230]
Структурные формулы дают гораздо более полное представление о рассматриваемых веществах, чем обычные, так как показывают не только число атомов каждого элемента в молекуле, но и как эти атомы друг с другом соединены. В связи с этим установление структурных формул нередко требует больших исследований. Такого рода исследованиями занимались и занимаются многие ученые, что объясняется впервые выявленной А. М. Бутлеровым громадной ролью структурных формул в химии, особенно — органической. Относительно простые фор-,мулы неорганической химии обычно не пищутся в явно выраженной структурной форме, но часто содержат ее в скрытом виде. Например, азотная кислота обозначается НЫОз (а не ЫНОз или ЫОзН), что указывает на центральное положение в ее молекуле атома азота. [c.30]
К первой же группе относятся и кислородные производные графита ( окислы графита , графитовые кислоты ), образующиеся при длительном действии на него сильных окислителей (например, КСЮз со смесью концентрированных серной и азотной кислот). После отмывки водой получаются вещества коричневого, желтого или белого цвета. При сушке окисленного продукта над Р2О5 расстояние между слоями углеродных атомов в нем равно 6,4 А, при сушке на воздухе — 9 А, в воде оно увеличивается до И А, а в разбавленном растворе щелочи возрастает еще более резко. Сами слои углеродных атомов исходного графита претерпевают сильное искажение, предположительно за счет возникновения связей С—О—С, С = 0 и С—ОН. Предложенные для них структурные схемы показаны на рис. Х-11. Вытекающий из этих схем идеальный состав кислородного производногр графита отвечает формуле СвО Нг, но практически такой состав не достигается. [c.503]
При сожжении 1,960 мг вещества образовалось 1,743 мг СО2 и 0,712 мг Н2О. При обработке 0,06 г этого вещества дымящей азотной кислотой и AgNOa образовалось 0,173 г Ag l. Молекулярная масса вещества 99. Найдите его простейшую и молекулярную формулы, напишите структурные формулы изомеров. [c.51]
Находим Валентности элементов, образующих кислоты, и надписываем их над символами. Затем намечаем порядок расположения символов элементов в структурной формуле. Если имеется всего один атом элемента, дающего название кислоте, то сначала выписывают его, а затем постепенно насыщают все его валентности, сначала соединяя его с атомами водорода через кислородные атомы, а затем насыщают оставшиеся валентности кислородными атомами (см. формулы хлорноватистой, фосфористой, азотной, хромовой и ениевой кислот). [c.43]
В 1888 г. выдающемуся русскому химику И. Коновалову впервые удалось успещно осуществить нитрование предельных углеводородов разбавленной азотной кислотой на примере нонанафтена — одного из, циклических углеводородов, входящих в состав кавказской нефти. Нонавафтен имеет следующую -структурную формулу [c.232]
Карбоновые кислоты сходны по строению, а следовательно и по свойствам, с минеральными кислотами, у которых гидроксильная группа тоже находится при окисленном атоме неметалла. Например, азотная кислота НЫОз имеет структурную формулу НО—ЫОг серная кислота Н2504 имеет структурную формулу НО [c.97]
Контрольные вопросы. 1. В какой группе периодической системы находится железо Указать строение его атома, валентность в соединениях. 2. Привести формулы важнейших промышленных руд железа. 3. Написать уравнения реакций, протекающих при растворении железа а) в соляной кислоте б) в разбавленной серной кислоте в) в разбавленной азотной кислоте г) в концентрированной серной кислоте при нагревании. 4. Написать структурную формулу т1ирита. 5. Как окрашены ионы железа (П) и (П1) в водных растворах их солей 6. Какими характерными реакциями можно установить наличие ионов двух- и трехвалентного железа [c.229]
chem21.info
азот - это... Что такое азот?
АЗО́Т -а; м. [франц. azote от греч. an- - не-, без- и zōtikos - дающий жизнь]. Химический элемент (N), газ без цвета и запаха, не поддерживающий дыхания и горения (составляет основную по объёму и массе часть воздуха, является одним из главных элементов питания растений).
◁ Азо́тный, -ая, -ое. А-ая кислота. А-ые удобрения. Азо́тистый, -ая, -ое. А-ая кислота.
АЗО́Т (лат. Nitrogenium — рождающий селитры), N (читается «эн»), химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде — газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам. Природный азот состоит из стабильных нуклидов (см. НУКЛИД) 14N (содержание в смеси 99,635% по массе) и 15N. Конфигурация внешнего электронного слоя 2s22р3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3- — 0,132 , N3+ — 0,030 и N5+ — 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,05. История открытия Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух») и в отличие от CO2 не поглощаемый раствором щелочи. Вскоре французский химик А. Л. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран) пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный). В 1784 английский физик и химик Г. Кавендиш (см. КАВЕНДИШ Генри) установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем). Нахождение в природе В природе свободный (молекулярный) азот входит в состав атмосферного воздуха (в воздухе 78,09% по объему и 75,6% по массе азота), а в связанном виде — в состав двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра (см. ЧИЛИЙСКАЯ СЕЛИТРА)) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) — и ряда других соединений. По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0,0019% земной коры по массе. Несмотря на свое название, азот присутствует во всех живых организмах (1—3% на сухую массу), являясь важнейшим биогенным элементом (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ). Он входит в состав молекул белков, нуклеиновых кислот, коферментов, гемоглобина, хлорофилла и многих других биологически активных веществ. Некоторые, так называемые азотфиксирующие, микроорганизмы способны усваивать молекулярный азот воздуха, переводя его в соединения, доступные для использования другими организмами (см. Азотфиксация (см. АЗОТФИКСАЦИЯ)). Превращения соединений азота в живых клетках — важнейшая часть обмена веществ у всех организмов. Получение В промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (-195,8 °C), чем другого компонента воздуха — кислорода (-182,9 °C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара (см. ДЬЮАРА СОСУД). В лаборатории чистый («химический») азот получают, добавляя при нагревании насыщенный раствор хлорида аммония Nh5Cl к твердому нитриту натрия NaNO2: NaNO2 + Nh5Cl = NaCl + N2 + 2h3O. Можно также нагревать твердый нитрит аммония: Nh5NO2 = N2 + 2h3O. Физические и химические свойства Плотность газообразного азота при 0 °C 1,25046 г/дм3, жидкого азота (при температуре кипения) — 0,808 кг/дм3. Газообразный азот при нормальном давлении при температуре –195,8 °C переходит в бесцветную жидкость, а при температуре –210,0 °C — в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже –237,54 °C устойчива форма с кубической решеткой, выше — с гексагональной. Критическая температура азота –146,95 °C, критическое давление 3,9МПа, тройная точка лежит при температуре –210,0 °C и давлении 125,03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость. Теплота испарения жидкого азота 199,3 кДж/кг (при температуре кипения), теплота плавления азота 25,5 кДж/кг (при температуре –210 °C). Энергия связи атомов в молекуле N2 очень велика и составляет 941,6 кДж/моль. Расстояние между центрами атомов в молекуле 0,110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие s- и p-орбитали. Молекула азота немагнитна (диамагнитна). Из-за высокой прочности молекулы N2процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена (см. ГЕКСОГЕН)) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв. Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием (см. ЛИТИЙ) с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от –3 до +5). С водородом образует аммиак (см. АММИАК) Nh4. Косвенным путем (не из простых веществ) получают гидразин (см. ГИДРАЗИН) N2h5 и азотистоводородную кислоту HN3. Соли этой кислоты — азиды (см. АЗИДЫ). Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов. Известно несколько оксидов азота (см. АЗОТА ОКСИДЫ). С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3). Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается: 2NI3 = N2 + 3I2. Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами. При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например: Са3N2 + 6h3O = 3Ca(OH)2 + 2Nh4. Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2h3 может быть получен цианистый водород HCN. Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота (см. АЗОТНАЯ КИСЛОТА) HNO3, ее соли нитраты (см. НИТРАТЫ), а также азотистая кислота HNO2 и ее соли нитриты (см. НИТРИТЫ). Применение В промышленности газ азот используют главным образом для получения аммиака (см. АММИАК). Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент (см. ХЛАДАГЕНТ), его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения (см. МИНЕРАЛЬНЫЕ УДОБРЕНИЯ).dic.academic.ru
Что такое азот? Масса азота. Молекула азота
Неметаллический элемент 15-й группы [Va] периодической таблицы – азот, 2 атома которого, соединяясь, образуют молекулу, – бесцветный, без запаха и вкуса газ, составляющий большую часть атмосферы Земли и являющийся составной частью всего живого.
История обнаружения
Газ азот составляет около 4/5 земной атмосферы. Он был выделен в ходе ранних исследований воздуха. В 1772 году шведский химик Карл-Вильгельм Шееле первым продемонстрировал, что такое азот. По его мнению, воздух представляет собой смесь двух газов, один из которых он назвал «огненным воздухом», т. к. тот поддерживал горение, а другой – «нечистым воздухом», потому что он оставался после того, как первый расходовался. Это были кислород и азот. Примерно в то же время азот был выделен шотландским ботаником Даниэлем Резерфордом, который первым опубликовал свои выводы, а также британским химиком Генри Кавендишем и британским священнослужителем и ученым Джозефом Пристли, который разделил с Шееле первенство открытия кислорода. Дальнейшие исследования показали, что новый газ входит в состав селитры, или нитрата калия (KNO3), и, соответственно, он был назван нитрогеном ("рождающим селитру") французским химиком Шапталем в 1790 г. Азот был впервые отнесен к химическим элементам Лавуазье, чье объяснение роли кислорода в горении опровергло теорию флогистона – популярное в XVIII в. ошибочное представление о горении. Неспособность этого химического элемента поддерживать жизнь (по-гречески ζωή) стала причиной того, что Лавуазье назвал газ азотом.

Возникновение и распространение
Что такое азот? По распространенности химических элементов он занимает шестое место. Атмосфера Земли на 75,51 % по весу и на 78,09 % по объему состоит из этого элемента и является основным его источником для промышленности. В атмосфере также содержится небольшое количество аммиака и солей аммония, а также оксиды азота и азотная кислота, образующиеся во время гроз, а также в двигателях внутреннего сгорания. Свободный азот найден во многих метеоритах, вулканических и шахтных газах и некоторых минеральных источниках, на солнце, в звездах и туманностях.
Азот также встречается в минеральных отложениях нитрата калия и натрия, но для удовлетворения потребностей человека их недостаточно. Другим материалом, богатым этим элементом, является гуано, которое можно найти в пещерах, где много летучих мышей, или в сухих местах, посещаемых птицами. Также азот содержится в дожде и почве в виде аммиака и солей аммония, а в морской воде в виде ионов аммония (Nh5+), нитритов (NO2-) и нитратов (NO3-). В среднем он составляет около 16 % сложных органических соединений, таких как белки, присутствующих во всех живых организмах. Естественное его содержание в земной коре составляет 0,3 части на 1000. Распространенность в космосе – от 3 до 7 атомов на атом кремния.
Крупнейшими странами-производителями азота (в виде аммиака) в начале XXI века были Индия, Россия, США, Тринидад и Тобаго, Украина.

Коммерческое производство и использование
Промышленное производство азота основано на фракционной перегонке сжиженного воздуха. Температура его кипения равна -195,8 °С, что на 13 °С ниже, чем у кислорода, который таким образом отделяется. Азот также может быть получен в больших масштабах путем сжигания углерода или углеводородов в воздухе и отделения полученного диоксида углерода и воды из остаточного азота. В малых масштабах чистый азот производится путем нагревания азида бария Ba(N3)2. Лабораторные реакции включают нагрев раствора нитрита аммония (Nh5NO2), окисление аммиака водным раствором брома или нагретым оксидом меди:
- Nh5++NO2-→N2+2h3O.
- 8Nh4+3Br2→N2+6Nh5++6Br-.
- 2Nh4+3CuO→N2+3h3O+3Cu.
Элементарный азот может быть использован в качестве инертной атмосферы для реакций, требующих исключения кислорода и влаги. Находит применение и жидкий азот. Водород, метан, окись углерода, фтор и кислород – единственные вещества, которые при температуре кипения азота не переходят в твердое кристаллическое состояние.
В химической промышленности этот химический элемент используется для предотвращения окисления или другой порчи продукта, как инертный разбавитель химически активного газа, для удаления тепла или химических веществ, а также в качестве ингибитора пожара или взрыва. В пищевой промышленности газ азот применяется для предотвращения порчи продуктов, а жидкий – для сушки замораживанием и в системах охлаждения. В электротехнической промышленности газ предотвращает окисление и другие химические реакции, создает давление в оболочке кабеля и защищает электродвигатели. В металлургии азот используется при сварке и пайке, предотвращая окисление, обуглероживание и обезуглероживание. Как неактивный газ его применяют в производстве пористой резины, пластмассы и эластомеров, он служит в качестве пропеллента в аэрозольных баллончиках, а также создает давление жидкого топлива в реактивных самолетах. В медицине быстрое замораживание жидким азотом используется для сохранения крови, костного мозга, тканей, бактерий и спермы. Он нашел применение и в криогенных исследованиях.

Соединения
Большая часть азота используется в производстве химических соединений. Тройная связь между атомами элемента настолько сильна (226 ккал на моль, вдвое больше, чем у молекулярного водорода), что молекула азота с трудом вступает в другие соединения.
Основным промышленным методом фиксации элемента является процесс Хабера-Боша для синтеза аммиака, разработанный во время Первой мировой войны, чтобы уменьшить зависимость Германии от чилийской селитры. Он включает прямой синтез Nh4 – бесцветного газа с резким, раздражающим запахом – непосредственно из его элементов.
Большая часть аммиака превращается в азотную кислоту (HNO3) и нитраты – соли и сложные эфиры азотной кислоты, кальцинированную соду (Na2CO3), гидразин (N2h5) – бесцветную жидкость, используемую в качестве ракетного топлива и во многих промышленных процессах.
Азотная кислота является другим основным коммерческим соединением данного химического элемента. Бесцветная, высококоррозионная жидкость используется в производстве удобрений, красителей, лекарственных средств и взрывчатых веществ. Нитрат аммония (Nh5NO3) – соль аммиака и азотной кислоты – является наиболее распространенным компонентом азотных удобрений.

Азот + кислород
С кислородом азот образует ряд оксидов, в т. ч. закись азота (N2O), в которой его валентность равна +1, окись (NO) (+2) и двуокись (NO2) (+4). Многие оксиды азота чрезвычайно летучи; они являются главными источниками загрязнения в атмосфере. Закись азота, также известная как веселящий газ, иногда используется в качестве анестезирующего средства. При вдыхании она вызывает мягкую истерию. Оксид азота быстро реагирует с кислородом с образованием коричневого диоксида, промежуточного продукта в производстве азотной кислоты и мощного окислителя в химических процессах и ракетном топливе.
Также используются некоторые нитриды, образованные соединением металлов с азотом при повышенных температурах. Нитриды бора, титана, циркония и тантала имеют специальные применение. Одна кристаллическая форма нитрида бора (BN), например, по твердости не уступает алмазу и плохо окисляется, поэтому используется в качестве высокотемпературного абразива.
Неорганические цианиды содержат группу CN-. Цианистый водород, или синильная кислота HCN, является крайне неустойчивым и чрезвычайно токсичным газом, который применяется для фумигации, концентрации руды, в других промышленных процессах. Дициан (CN)2 используется в качестве промежуточного химического вещества и для фумигации.
Азиды представляют собой соединения, которые содержат группу из трех атомов азота -N3. Большинство их неустойчиво и очень чувствительно к ударам. Некоторые из них, такие как азид свинца Pb(N3)2, используются в детонаторах и капсюлях. Азиды, подобно галогенам, охотно взаимодействуют с другими веществами и образуют множество соединений.
Азот входит в состав нескольких тысяч органических соединений. Большинство из них являются производными от аммиака, цианистого водорода, циана, закиси или азотной кислоты. Амины, аминокислоты, амиды, например, получены из аммиака или тесно связаны с ним. Нитроглицерин и нитроцеллюлоза – сложные эфиры азотной кислоты. Нитриты получают из азотистой кислоты (HNO2). Пурины и алкалоиды являются гетероциклическими соединениями, в которых азот замещает один или несколько атомов углерода.

Свойства и реакции
Что такое азот? Это бесцветный газ без запаха, который конденсируется при -195,8 °С в бесцветную, маловязкую жидкость. Элемент существует в виде молекул N2, представляемых в виде :N:::N:, у которых энергия связи, равная 226 ккал на моль, уступает только окиси углерода (256 ккал на моль). По этой причине энергия активации молекулярного азота очень высока, поэтому в обычных условиях элемент относительно инертен. Кроме того, высокостабильная молекула азота в значительной степени способствует термодинамической неустойчивости многих азотсодержащих соединений, в которых связи, пусть и достаточно сильные, но уступают связям молекулярного азота.
Относительно недавно и неожиданно была открыта способность молекул азота служить в качестве лигандов в комплексных соединениях. Наблюдение того, что некоторые растворы комплексов рутения могут поглощать атмосферный азот, привело к тому, что вскоре может быть найден более простой и лучший способ фиксации этого элемента.
Активный азот можно получить путем пропускания газа низкого давления через высоковольтный электрический разряд. Продукт светится желтым светом и гораздо охотнее вступает в реакции, чем молекулярный, с атомарным водородом, серой, фосфором и различными металлами, а также способен разлагать NO до N2 и O2.
Более ясное представление о том, что такое азот, можно получить благодаря его электронной структуре, которая имеет вид 1s22s22p3. Пять электронов внешних оболочек слабо экранируют заряд, в результате чего эффективный ядерный заряд ощущается на расстоянии ковалентного радиуса. Атомы азота относительно невелики и обладают высокой электроотрицательностью, располагаясь между углеродом и кислородом. Электронная конфигурация включает три полузаполненные внешние орбитали, позволяющие образовывать три ковалентные связи. Поэтому атом азота должен обладать чрезвычайно высокой реакционной способностью, образуя с большинством других элементов стабильные бинарные соединения, особенно когда другой элемент существенно отличается электроотрицательностью, придающей значительную полярность связям. Когда электроотрицательность другого элемента ниже, полярность придает атому азота частичный отрицательный заряд, что освобождает его неразделенные электроны для участия в координационных связях. Когда другой элемент более электроотрицателен, частично положительный заряд азота существенно ограничивает донорные свойства молекулы. При малой полярности связи, вследствие равной электроотрицательности другого элемента, множественные связи превалируют над одиночными. Если несоответствие атомных размеров препятствует образованию множественных связей, то образованная простая связь, вероятно, будет относительно слабой, и соединение будет неустойчивым.
Аналитическая химия
Часто процент азота в газовой смеси может быть определен путем измерения ее объема после поглощения других компонентов химическими реагентами. Разложение нитратов серной кислотой в присутствии ртути высвобождает окись азота, которая может быть измерена в виде газа. Азот высвобождается из органических соединений, когда они сгорают над окисью меди, а свободный азот может быть измерен в виде газа после поглощения других продуктов сгорания. Хорошо известный метод Кьельдаля по определению содержания рассматриваемого нами вещества в органических соединениях заключается в разложении соединения концентрированной серной кислотой (в случае необходимости содержащей ртуть, или ее оксид, а также различные соли). Таким образом азот преобразуется в сульфат аммония. Добавление гидроксида натрия высвобождает аммиак, который собирают обычной кислотой; остаточное количество непрореагировавшей кислоты затем определяется титрованием.

Биологическое и физиологическое значение
Роль азота в живой материи подтверждает физиологическую активность его органических соединений. Большинство живых организмов не может использовать этот химический элемент непосредственно и должно иметь доступ к его соединениям. Поэтому фиксация азота имеет огромное значение. В природе это происходит в результате двух основных процессов. Одним из них является действие электрической энергии на атмосферу, благодаря чему молекула азота и кислорода диссоциируют, что позволяет свободным атомам образовать NO и NO2. Двуокись затем вступает в реакцию с водой: 3NO2+h3O→2HNO3+NO.
HNO3 растворяется и приходит на Землю с дождем в виде слабого раствора. Со временем кислота становится частью комбинированного азота почвы, где нейтрализуется, образуя нитриты и нитраты. Содержание N в культивируемых почвах, как правило, восстанавливается благодаря внесению удобрений, содержащих нитраты и аммонийные соли. Выделения животных и растений и их разложение возвращает соединения азота в почву и воздух.
Другим основным процессом естественной фиксации является жизнедеятельность бобовых. Благодаря симбиозу с бактериями эти культуры способны превращать атмосферный азот непосредственно в его соединения. Некоторые микроорганизмы, такие как Azotobacter Chroococcum и Clostridium pasteurianum, способны фиксировать N самостоятельно.
Сам газ, будучи инертным, безвреден, за исключением случая, когда им дышат под давлением, и он растворяется в крови и других жидкостях тела в более высоких концентрациях. Это вызывает наркотический эффект, а если давление снижается слишком быстро, избыток азота выделяется в виде пузырьков газа в различных местах организма. Это может вызвать боль в мышцах и суставах, обмороки, частичный паралич и даже смерть. Эти симптомы называются декомпрессионной болезнью. Поэтому те, кто вынужден дышать воздухом в таких условиях, должны очень медленно снижать давление до нормального, чтобы избыток азота выходил через легкие без образования пузырьков. Лучшей альтернативой является использование для дыхания смеси кислорода и гелия. Гелий гораздо менее растворим в жидкостях организма, и опасность уменьшается.
Изотопы
Азот существует в виде двух стабильных изотопов: 14N (99,63 %) и 15N (0,37 %). Они могут быть разделены с помощью химического обмена или путем термической диффузии. Масса азота в виде искусственных радиоактивных изотопов находится в пределах 10-13 и 16-24. Наиболее стабильный период полураспада, равный 10 минутам. Первая искусственно индуцированная ядерная трансмутация была произведена в 1919 г. британским физиком Эрнестом Резерфордом, который, бомбардируя азот-14 альфа-частицами, получил ядра кислорода-17 и протоны.
Свойства
Напоследок перечислим основные свойства азота:
- Атомный номер: 7.
- Атомная масса азота: 14,0067.
- Температура плавления: -209,86 °C.
- Точка кипения: -195,8 °C.
- Плотность (1 атм, 0 °С): 1,2506 г азота на литр.
- Обычные состояния окисления: -3, +3, +5.
- Конфигурация электронов: 1s22s22p3.
fb.ru